降尿酸方对高尿酸血症肾病大鼠内皮功能的影响
2022-06-02郭亚芳丁铃乔春萍周嘉宝李东东甘静张长明高建东
郭亚芳 丁铃 乔春萍 周嘉宝 李东东 甘静 张长明 高建东





摘要 目的:探究降尿酸方对氧嗪酸钾联合腺嘌呤造模高尿酸血症肾病大鼠内皮型一氧化氮合酶(eNOS),内皮素(ET)的影响。方法:将40只8周龄无特定病原(SPF)级雄性SD大鼠随机分为正常组、模型组、别嘌醇组和降尿酸方组。正常组灌胃2 mL/d灭菌蒸馏水,2次/d,模型组采用上午氧嗪酸钾1 500 mg/(kg·d)联合腺嘌呤100 mg/(kg·d)灌胃,下午2 mL/d灭菌蒸馏水4周诱导高尿酸血症肾病模型。别嘌醇组,降尿酸方组,上午与模型组相同。下午别嘌醇组给予大鼠灌胃2.5 mg/100 g剂量别嘌醇灌胃,降尿酸方组给予大鼠灌胃1.6 g/(100 g·mL)劑量灌胃。治疗4周后处死,检测血肌酐(Scr)、血尿酸(SUA)、尿素氮(BUN)。观察肾功能,电镜观察肾脏内皮病变,实时聚合酶链式反应技术(Real-time PCR)检测eNOS mRNA,ET mRNA表达水平。免疫组织化学检测eNOS、ET的表达。结果:与正常组比较,模型组Scr、SUA、BUN显著升高(P<0.05),电镜显示肾脏内皮细胞损伤严重。肾组织eNOS mRNA的表达降低(P<0.05)。肾组织ET mRNA的表达升高(P<0.05)。免疫组织化学显示eNOS表达下降,ET-1表达升高。与模型组比较,别嘌醇组和降尿酸方组Scr、SUA、BUN降低(P<0.05),电镜显示大鼠肾脏内皮损伤改善,肾组织eNOS mRNA的表达升高(P<0.05)。肾组织ET mRNA的表达降低(P<0.05)。免疫组织化学显示eNOS表达升高,ET-1表达下降。结论:降尿酸方通过促进eNOS基因的表达,抑制ET基因的表达改善高尿酸血症肾病大鼠内皮功能,达到保护肾脏的目的。
关键词 降尿酸方;内皮功能;高尿酸血症;高尿酸血症肾病;大鼠;内皮型一氧化氮合酶;内皮素;中药
Effect of Jiangniaosuan Prescription on the Endothelial Function of Rats with Uric Acid Nephropathy
GUO Yafang1,2,DING Ling2,QIAO Chunping2,ZHOU Jiabao1,LI Dongdong1,GAN Jing1,ZHANG Changming2,GAO Jiandong1
(1 Department of Nephrology,Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine,Institute of Kidney Disease,Shanghai University of Traditional Chinese Medicine,Shanghai Key Laboratory of Traditional Chinese Clinical Medicine,Shanghai 201203,China; 2 Shanghai Pudong Hospital Affiliated to Fudan University,Shanghai 201399,China)
Abstract Objective:To study the effects of Jiangniaosuan prescription on endothelial nitric oxide synthase(eNOS) and endothelin(ET) in rats with hypoxanthine and adenine-induced uric acid(UA) nephropathy.Methods:Forty 8-week-old male SD rats of SPF grade were randomly divided into a normal group,a model group,an allopurinol group,and a Jiangniaosuan prescription group,with 10 rats in each group.The normal group was given 2 ml/d acidified water by gavage twice a day.All groups were given hypoxanthine 1 500 mg/(kg·d) and adenine 100 mg/(kg·d) in the morning for 4 weeks except the normal group.The model group was given 2 mL/d acidified water by gavage in the afternoon for 4 weeks.The allopurinol group was given allopurinol(2.5 mg/100 g) by gavage in the afternoon.The Jiangniaosuan prescription group was given Jiangniaosuan prescription 1.6 g/(100 g·mL) by gavage in the afternoon.The rats were sacrificed after 4-week treatment,and the serum creatinine(Scr),blood urea nitrogen(BUN),and UA were detected.The renal function of rats was observed,and the renal endothelial lesion was measured by electron microscopy.Real-time quantitative polymerase chain reaction(real-time PCR) was used to determine the expression levels of messenger ribonucleic acid(mRNA) of eNOS and ET.The expressions of eNOS and ET were detected by immunocytochemistry.Results:Compared with the normal group,the Scr,serum uric acid(SUA),BUN,and UA of rats in the model group were significantly increased(P<0.05),and the cells of renal endothelium were severely damaged.The mRNA expression of eNOS in the kidney tissue was decreased(P<0.05),and the mRNA expression of ET in the kidney tissue was increased(P<0.05).The results of immunocytochemistry showed that eNOS expression decreased,whereas ET-1 expression increased.Compared with the model group,the Scr,BUN,and UA of rats in the allopurinol group and the Jiangniaosuan prescription group were decreased(P<0.05),and the renal endothelial function was improved.The mRNA expression of eNOS in the kidney tissue was increased(P<0.05),and the mRNA expression of ET in the kidney tissue was decreased(P<0.05).The results of immunocytochemistry showed that eNOS expression increased,whereas ET-1 expression decreased.Conclusion:Jiangniaosuan prescription improved the endothelial function of rats with UA nephropathy by promoting the expression of eNOS gene and inhibiting the expression of ET gene,thus protecting the kidney.
Keywords Jiangniaosuan prescription; Endothelial function; Hyperuricemia; Uric acid nephropathy; Rats; Endothelial nitric oxide synthase; Endothelin; Chinese medicine
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.07.012
1990—2017年,全球慢性肾脏病患者病死率增加了41.5%,2017年记录的全球慢性肾脏病患者达到6.97亿,全球患病率达9.1%[1]。越来越多的研究发现,内皮功能障碍,不仅是慢性肾脏病的一个早期预测因子,还是慢性肾脏病的发病机制中的重要因素,更是慢性肾脏病病情进展的预测因子。临床研究发现,患者血尿酸水平的升高与内皮功能障碍相关[2]。长期的高尿酸血症导致尿酸钠结晶沉积在肾髓质、肾间质组织,激活肾脏局部肾素-血管紧张素-醛固酮系统,进一步损伤内皮细胞。导致肾小球处于高压力、慢性炎症反应、间质纤维化等病理学改变是慢性尿酸盐肾病发病机制。尿酸通过诱导血管内皮细胞表型转变,诱导氧化应激和糖被脱落导致内皮功能障碍[3]。而一些针对尿酸治疗临床研究发现患者尿酸改善的同时,内皮功能也得到恢复,指导一些血管性疾病的预后[4]。当今动物实验及临床试验均已经发现高尿酸血症患者伴有不同程度的内皮功能障碍[5]。內皮功能改善被认为是慢性肾脏病预后的一个关键指标[6-7]。随着人们经济水平的改善,高尿酸血症已成为我国仅次于糖尿病的第二大代谢性疾病,高尿酸血症肾病也逐渐出现,给慢性肾脏病诊治带来了新的挑战[8]。
前期临床研究发现降尿酸方对高尿酸血症肾病患者可以降低其肌酐及尿酸[9]。本文在前期研究的基础上进一步观察其对高尿酸血症肾病大鼠组织内皮型一氧化氮合酶(Endothelial Nitric Oxide Synthase,eNOS)、内皮素(Endothelin,ET)的作用,探讨其对肾脏内皮功能的保护作用,了解其保护肾脏的机制。
1 材料与方法
1.1 材料
1.1.1 动物 选用8周龄无特定病原体(Specific Pathogen Free,SPF)级雄性SD大鼠40只,体质量200~220 g,购自北京维通利华实验动物有限公司,实验动物许可证证号:SYXK(沪)2014~0006,动物实验伦理许可号:PZSHUTCM190315030。饲养于上海中医药大学实验动物中心3楼,恒温(25 ℃)、12 h光照(12 h光/暗循环)、恒湿(45%左右相对湿度)的环境中,自由饮水(蒸馏水),饮食。代谢笼每周清理2次。适应性喂养7 d。如未见发病及发育异常,符合条件,可以实验。
1.1.2 药物 降尿酸方药物组成:王不留行10 g、白芥子10 g、车前子15 g(包)、粉萆薢10 g、生山楂10 g、威灵仙15 g、制大黄10 g。中药饮片由上海康桥中药饮片有限公司提供。水煎浓缩,药物配制好后置于-20 ℃冰箱中分装保存,临用前恢复至室温备用。别嘌醇胶囊(黑龙江澳利达奈德制药有限公司,批号:H20041338)250 mg/粒。
1.1.3 试剂与仪器 肌酐测定试剂盒(货号:1845)、尿酸测定试剂盒(货号:1885),均购于世诺临床诊断制品(上海)贸易有限公司;RIPA裂解液(碧云天生物技术有限公司,货号:P0013B);ChamQTM SYBR qPCR Master Mix(通用型高灵敏度染料法定量PCR检测试剂盒,南京诺唯赞生物科技有限公司,货号:Q341-02)。ET-1抗体(货号:ab2786)、eNOS抗体(货号:ab76198),均购于英国Abcam公司。透射电子显微镜(FEI公司,德国,型号:Tecna G2BioTWIN),台式离心机(上海安亭科学仪器厂,型号:TDL-5),多用途高效离心机(Beckman公司,美国,型号:Avanti J-E)。全自动生化分析仪(Beckman公司,美国,型号:AU5800),海尔冰箱(海尔公司,型号:BCD-215KA),-80 ℃超低温冰箱(SANYO公司,日本,型号:MDF-U53V),荧光定量PCR仪(ABI公司,美国,型号:SteP One Plus),组织匀浆器(上海净信科技发展有限公司,型号:JX-FSTPRP-24),普通药物天平(上海医疗器械八厂,型号:JPT-5)。
1.2 方法
1.2.1 分组与模型制备 40只8周龄雄性SPF级SD大鼠随机分为正常组(A)、模型组(B)、别嘌醇组(C)、降尿酸方组(D),每组10只。除正常组上午以灭菌蒸馏水1 mL/(100 g·d)灌胃,其余3组以氧嗪酸钾150 mg/(100 g·d)联合腺嘌呤10 mg/(100 g·d)灌胃4周诱导高尿酸血症肾病模型。
1.2.2 给药方法 正常组:灭菌蒸馏水灌胃2 mL/次,2次/d。模型组:上午氧嗪酸钾1 500 mg/(kg·d)联合腺嘌呤100 mg/(kg·d)灌胃,1次/d,下午灭菌蒸馏水灌胃2 mL/次,1次/d,灌胃时间间隔4 h以上。喂养4周诱导高尿酸血症肾病模型。别嘌醇组和降尿酸方组,上午与模型组灌胃相同。下午别嘌醇组给予大鼠灌胃2.5 mg/100 g剂量别嘌醇灌胃,降尿酸方组给予大鼠1.6 g/(100 g·mL)剂量灌胃。
1.2.3 检测指标与方法 治疗4周后处死。处死大鼠当天腹主动脉抽取大鼠动脉血,将动脉血注入促凝管中,计时静置2 h后,离心(3 000 r/min,有效离心半径10 cm)15 min,分离血清,保存,测血肌酐(Serum Creatinine,Scr)、血尿酸(Serum Uric Acid,SUA)、血尿素氮(Blood Urea Nitrogen,BUN)。处死后立即在肾动脉和肾静脉出入处摘取肾脏,取1/2左肾1 mm×1 mm×1 mm的肾间质组织,每个肾组织取3~4块1 mm3标本放于盛有固定液小瓶中,4 ℃避光保存行电镜观察肾脏内皮病变。每组随机选取3只大鼠摘取肾组织,每个肾组织分为4片,将肾组织置于去酶EP管,实验室放-80 ℃冰箱储存,实时聚合酶链式反应法检测eNOS mRNA,ET mRNA表达水平,免疫组织化学法检测eNOS和ET的表达。基因及引物序列见表1。
1.3 统计学方法 采用SPSS 23.0统计软件对数据进行处理,计量资料用均数±标准差(±s)表示,两独立样本采用独立样本t检验(Independentsample t-test),多样本使用单因素方差分析(One-way ANOVA)。以P<0.05为差异有统计学意义。
2 结果
2.1 肾功能的改变 肾功能结果提示:模型组Scr、SUA、BUN与正常组比较均明显增高(P<0.05),与模型大鼠比较,降尿酸方和别嘌醇能降低大鼠Scr、SUA和BUN水平(P<0.05)。见表2。
2.2 肾脏电镜的变化 肾脏电镜显示正常组:内皮细胞于血管内膜下排列较紧密,形态较一致。模型组:内皮细胞水肿,呈现泡沫样改变,部分内皮细胞脱落,且基底膜厚度增厚。中药组及别嘌醇组内皮细胞肿胀改善,排列整齐,形态规则,血管壁厚度等较模型组有不同程度的改善。各组大鼠肾脏电镜表现见图1。
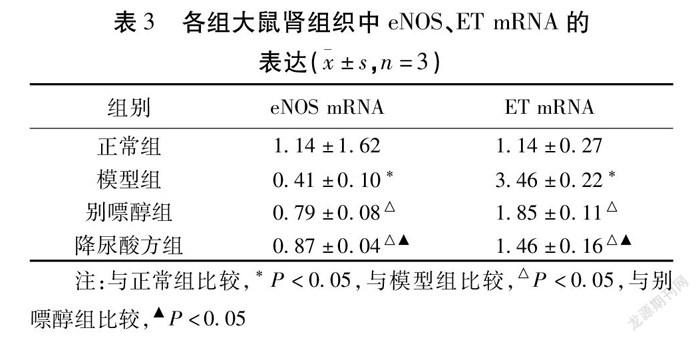
2.3 各组大鼠肾组织中eNOS,ET mRNA的表达 与正常组比较,模型组eNOS mRNA表达量减少(P<0.05);与模型组比较,别嘌醇组和降尿酸方组eNOS mRNA表达量增多(P<0.05);与正常组比较,模型组ET mRNA表达量增多(P<0.05);与模型组比较,别嘌醇组和降尿酸方组ET mRNA表达量减少(P<0.05)。见表3。
2.4 免疫组织化学法检测肾脏eNOS、ET-1的定位和表达 免疫组织化学发现正常组中见肾小管上皮、肾小球中有棕黄色沉积,以胞质中为主,肾间质未见表达。与正常组比较,模型组的eNOS表达在肾小管上皮细胞,肾小球表达减少,胞质中呈棕黄色染色颗粒明显减少,模型组肾小管管腔变大,不规则。与模型组比较,降尿酸方组和别嘌醇组细胞质中呈棕黄色染色颗粒明显升高。见图2。
免疫组织化学法发现正常组肾小管基底膜区、肾小管腔内、胞质有均有表达,与正常组比较,模型组在肾小管基底膜区、肾小管腔内、细胞质有大面积棕黄色染色,肾小管间质亦有少量染色,间质模糊不清。模型组肾小管管腔变大,不规则。与模型组比较,别嘌醇组和降尿酸方组肾脏沉积较模型组弱,模型组,别嘌醇组和降尿酸方组均可见肾小管基底膜区、肾小管腔内、细胞质均有明显的ET-1沉积,肾间质亦有少量沉积。与正常组比较,模型组表达强于正常组、别嘌醇组和降尿酸组;与模型组比较,别嘌醇组和降尿酸组表达较模型组减弱。见图3。
3 讨论
不同类型的肾损害发展成为进展型肾衰竭显著的病理学变化除了肾脏血管的改变就是伴随的内皮功能障碍。说明在慢性肾脏病的治疗环节中我们应重视患者内皮功能障碍的治疗[10]。有研究对我国大陆2000—2014年的流行病学调查研究发现,高尿酸血症的总体患病率达到13.3%[11]。而持续的高尿酸血症导致尿酸盐结晶沉积在肾髓质和肾间质组织,通过激活局部肾素-血管紧张素-醛固酮系统,氧化应激,损伤内皮细胞,引起肾脏等一系列的炎症及肾脏纤维化等病理学变化,最终形成高尿酸血症肾病[12-16]。作为肾脏滤过屏障之一的内皮细胞,最先感受尿酸带来的肾损害。导致肾脏屏障功能受损,炎症等进一步肾损伤。故肾脏内皮细胞功能的完善和健全对肾脏,乃至全身的血管系统都有很大影响[17]。
当今的临床和实验研究均证明尿酸可以引起内皮细胞损伤,引起内皮功能紊乱。具体机制有以下几种:1)嘌呤代谢为尿酸时同时生成了大量的活性氧(ROS),ROS通过氧化应激的方式对内皮功能损伤。2)高浓度的尿酸(HUA)会减弱eNOS與钙调蛋白(CaM)之间的结合,从而降低eNOS活性和NO的产生。3)尿酸还可以起内皮细胞表型转换,上皮-间充质转化(EMT)或内皮-间充质转化(EndoMT)直接作用于肾间质,导致纤维化,引起肾损伤等一系列反应最终导致内皮细胞功能紊乱。4)尿酸通过氧化应激导致内皮细胞糖被的脱落,损伤内皮细胞[18],引起血管内皮细胞凋亡[19]。5)尿酸诱导炎症反应激活血小板或炎症介质等使抗凝及纤溶失衡促使内皮细胞功能紊乱[20]。
血管内皮是机体重要的内分泌器官,可分泌多种血管活性物,如NO、ET-1等,NO是血管内皮细胞释放的主要血管舒张物质,ET是内皮细胞释放的主要血管收缩物质,也可以介导炎症反应,促进其他炎症介质的释放。二者共同介导体内血管的收缩和舒张功能。NO在体内的主要代谢产物为硝酸盐和亚硝酸盐。NO在体内主要由一氧化氮合酶(NOS)合成。由于NO半衰期很短,故针对NO的研究,主要集中在NOS上。目前发现的NOS主要有3类,神经型、内皮型和诱导型。在肾脏结构中,以eNOS为主要表达。eNOS主要分布于肾脏的肾内小动脉、肾小球毛细血管、近端小管、髓袢升支粗段和集合管中。故eNOS的水平变化可以来间接反映肾脏系统内皮功能变化。我们的实验发现与正常组比较,模型组eNOS mRNA表达水平降低,与模型组比较,降尿酸方组eNOS mRNA表达水平较模型组升高。即经过降尿酸方治疗后患者eNOS mRNA表达水平升高。进一步说明尿酸通过抑制eNOS的活性,影响NO的生成,进一步影响内皮功能。降尿酸方通过提高eNOS的水平,改善高尿酸血症肾病大鼠内皮功能达到保护肾脏的目的。
ET主要存在于血管内皮,是1988年由Yanagisana等[21]首先从猪主动脉内皮细胞中分离出来的。它是内皮细胞合成的最强的缩血管物质。由于缺氧等因素刺激内皮细胞后生成ET-1。血管的ET系统以内皮细胞产生ET-1为主。故血管内皮功能损伤可出现二者分泌失调。综上可知,别嘌醇和降尿酸方能够保护高尿酸血症肾病大鼠肾功能,保护高尿酸血症肾病大鼠的内皮功能。机制是通过增加高尿酸血症肾病大鼠肾脏eNOS的表达和降低ET的表达,保护高尿酸血症肾病大鼠肾脏的内皮功能,达到保护肾脏的目的。
降尿酸方由七味药物组成:王不留行10 g、白芥子10 g、车前子15 g、威灵仙15 g、粉萆薢15 g、生山楂10 g、制大黄10 g(便秘者改为用生大黄5 g后下)。本方君药为三子:王不留行、白芥子、车前子。王不留行:性苦,平。功效:活血通经消肿,本方即取其祛痰行血通络之功;白芥子:性辛,温。入肺、肝、脾、胃、心包经。功效:利气豁痰,温中散寒,通络止痛。本方取其去皮里膜外之痰,活血通络之功。车前子:性甘,微寒。入肾、膀胱经。功效:清热利尿,渗湿通淋,祛痰。本方取其利小便,通肾气。粉萆薢:性苦,平。入肝、胃、膀胱经。功效:祛风,利湿。本方取其利肾、膀胱之水之功,分清泌浊以清源。威灵仙:性辛、咸,温。归膀胱经。功效:祛风除湿,通络止痛。本方取其除湿通络止痛之效。生山楂:性酸、甘、微温。归脾、胃、肝经。功效:消食健胃,行气散瘀。本方取其“化血块,气块,活血”。大黄:性苦,寒。归脾、胃、大肠、肝、心包经。功效:泻热通肠,凉血解毒,逐瘀通经。本方取其通二便直达下焦,深入血分,无坚不破,荡涤积垢。若大便溏薄改为制大黄。诸药合用,达到活血通络、化痰降浊之功效。
我们认为高尿酸血症肾病病因病机为脾肾不足,痰瘀阻络的本虚标实之症。治疗以利湿泄浊、健脾补肾、活血化瘀之法治疗,方药以降尿酸方加减治疗高尿酸血症肾病,疗效好。前期临床发现其不仅能减轻高尿酸血症肾病患者腰酸乏力等不适,更能很好地减少患者血肌酐、血尿酸,有很好的肾脏保护作用。本研究发现降尿酸方能够减少高尿酸血症肾病大鼠血肌酐、血尿酸。其保护肾脏的机制是通过增加肾脏eNOS的表达,降低肾脏ET的表达来实现的。
本实验通过电镜观察到正常大鼠,肾小球,肾小管,肾间质结构正常,高尿酸血症肾病大鼠模型组内皮细胞受到明显损伤,呈现泡沫样改变,部分内皮细胞脱落,且基底膜增厚。而尿酸性大鼠经过降尿酸方和别嘌呤醇治疗后较模型组比较肾脏内皮细胞明显好转,排列整齐,窗孔减少,基底膜增厚减轻。进一步PCR基因检测及免疫组织化学发现降尿酸方能促进eNOS mRNA的表达,抑制ET mRNA的表达。因此我们可以认为,降尿酸方是通过增加促进eNOS mRNA的表达,抑制ET mRNA的表达来改善高尿酸血症肾病大鼠的内皮功能,达到保护肾脏的目的。
参考文献
[1]Global,regional,and national burden of chronic kidney disease,1990-2017:a systematic analysis for the Global Burden of Disease Study 2017[J].Lancet,2020,395(10225):709-733.
[2]Taher R,Sara JD,Prasad M,et al.Elevated serum uric acid is associated with peripheral endothelial dysfunction in women[J].Atherosclerosis,2019,290:37-43.
[3]Ko J,Kang HJ,Kim DA,et al.Uric acid induced the phenotype transition of vascular endothelial cells via induction of oxidative stress and glycocalyx shedding[J].FASEB J,2019,33(12):13334-13345.
[4]Vila E,Solé M,Masip N,et al.Uric acid treatment after stroke modulates the Krüppel-like factor 2-VEGF-A axis to protect brain endothelial cell functions:Impact of hypertension[J].Biochem Pharmacol,2019,164:115-128.
[5]孟晶,田婧卓,王连嵋,等.适宜中药筛选的高尿酸血症动物模型初探[J].中国实验方剂学杂志,2021,27(17):46-56.
[6]Erturk I,Yesildal F,Acar R,et al.Vascular endothelial growth factor and soluble vascular endothelial growth factor receptor-1 in patients with end-stage renal disease.Associations with laboratory findings,comorbidities,and medications[J].Saudi Med J,2018,39(6):586-591.
[7]Dubin RF,Guajardo I,Ayer A,et al.Associations of Macro-and Microvascular Endothelial Dysfunction With Subclinical Ventricular Dysfunction in End-Stage Renal Disease[J].Hypertension,2016,68(4):913-920.
[8]高尿酸血癥相关疾病诊疗多学科共识专家组.中国高尿酸血症相关疾病诊疗多学科专家共识[J].中华内科杂志,2017,56(3):235-248.
[9]郑平东,邹士林,黄璐.中西医结合治疗慢性尿酸性肾病的临床研究[J].中国中西医结合肾病杂志,2003,4(11):644-646.
[10]Radenkovic M,Stojanovic M,Prostran M.Endothelial Dysfunction in Renal Failure:Current Update[J].Curr Med Chem,2016,23(19):2047-2054.
[11]Liu R,Han C,Wu D,et al.Prevalence of Hyperuricemia and Gout in Mainland China from 2000 to 2014:A Systematic Review and Meta-Analysis[J].Biomed Res Int,2015,2015:762820.
[12]Pilemann-Lyberg S,Hansen TW,Tofte N,et al.Uric Acid Is an Independent Risk Factor for Decline in Kidney Function,Cardiovascular Events,and Mortality in Patients With Type 1 Diabetes[J].Diabetes Care,2019,42(6):1088-1094.
[13]Ko J,Kang HJ,Kim DA,et al.Uric acid induced the phenotype transition of vascular endothelial cells via induction of oxidative stress and glycocalyx shedding[J].FASEB J,2019,33(12):13334-13345.
[14]Yang L,Chang B,Guo Y,et al.The role of oxidative stress-mediated apoptosis in the pathogenesis of uric acid nephropathy[J].Ren Fail,2019,41(1):616-622.
[15]Yang X,Gu J,Lv H,et al.Uric acid induced inflammatory responses in endothelial cells via up-regulating(pro)renin receptor[J].Biomed Pharmacother,2019,109:1163-1170.
[16]Milanesi S,Verzola D,Cappadona F,et al.Uric acid and angiotensin Ⅱ additively promote inflammation and oxidative stress in human proximal tubule cells by activation of toll-like receptor 4[J].J Cell Physiol,2019,234(7):10868-10876.
[17]Huang G,Qin J,Deng X,et al.Prognostic value of serum uric acid in patients with acute heart failure.A meta-analysis[J].Medicine,2019,98(8):e14525.
[18]Kang DH.Hyperuricemia and Progression of Chronic Kidney Disease:Role of Phenotype Transition of Renal Tubular and Endothelial Cells[J].Contrib Nephrol,2018,192:48-55.
[19]Song C,Zhao X.Uric acid promotes oxidative stress and enhances vascular endothelial cell apoptosis in rats with middle cerebral artery occlusion[J].Biosci Rep,2018,38(3):BSR20170939.
[20]van der Poll T,Parker RI.Platelet Activation and Endothelial Cell Dysfunction[J].Crit Care Clin,2020,36(2):233-253.
[21]Yanagisawa M,Kurihara H,Kimura S,et al.A novel potent vasoconstrictor peptide produced by vascular endothelial cells[J].Nature,1988,332(6163):411-415.
(2020-05-12收稿 本文編辑:王明)
