当归水提取物补血、调节肠道菌群作用研究
2022-06-02郝莉雨李宗源孙建辉单中超于泽玥陈红映霍海如李绮婧张宏萌李洪梅
郝莉雨 李宗源 孙建辉 单中超 于泽玥 陈红映 霍海如 李绮婧 张宏萌 李洪梅


摘要 目的:探究當归水提取物的补血作用,以及对血虚证模型小鼠肠道菌群结构的影响。方法:采用单纯放血法制备血虚证小鼠模型,通过测定小鼠外周血象、胸腺指数、红细胞膜Na+-K+-ATP酶活性评价当归水提取物的补血作用,并利用MiSeq平台对小鼠盲肠内容物进行16S rDNA测序,探究当归水提取物对小鼠肠道菌群结构的影响。结果:与模型组比较,当归组雌性小鼠外周血红细胞数量、白细胞数量显著升高(P<0.05),胸腺指数有上升趋势,红细胞膜Na+-K+-ATP酶活性显著升高(P<0.01);当归水提取物显著提高血虚证小鼠肠道菌群中的益生菌属如Lactobacillus(乳杆菌属)、Muribaculaceae(Muri菌)、Alloprevotella(普雷沃菌属)的丰度,且相关性分析表明,血虚证小鼠外周血红细胞数量、白细胞数量、血红蛋白量、血细胞比容与肠道多种微生物群落丰度具有显著相关性。结论:当归水提取物具有补血作用,且对小鼠肠道菌群具有调节作用。
关键词 血虚证;当归;肠道菌群;外周血象;补血
Effect of Angelica sinensis Water Extract on Tonifying Blood and Regulating Intestinal Flora
HAO Liyu1,LI Zongyuan1,2,SUN Jianhui1,SHAN Zhongchao1,YU Zeyue1,CHEN Hongying1,3,HUO Hairu1,LI Qijing4,ZHANG Hongmeng4,LI Hongmei1
(1 Institute of Chinese Materia Medica,China Academy of Chinese Medical Sciences,Beijing 100700,China; 2 Jiangsu University,Zhenjiang 212013,China; 3 Qionghai Hospital of Traditional Chinese Medicine,Qionghai 571400,China; 4 Shandong University of Traditional Chinese Medicine, Ji′nan 250355,China)
Abstract Objective:To explore the blood-tonifying effect of Angelica sinensis water extract and the influence on intestinal flora in mice with blood deficiency syndrome.Methods:The model of blood deficiency syndrome in mice was induced by simple bloodletting method.The blood-tonifying effect of A.sinensis water extract was evaluated by measuring the peripheral blood,thymus index,and erythrocyte membrane Na+-K+-ATPase activity of the mice.The content of cecum in mice was subjected to 16S ribosomal ribonucleic acid(16S rDNA) sequencing by MiSeq to explore the effect of A.sinensis water extract on the structure of intestinal flora.Results:Compared with the model group,the number of peripheral blood red blood cells(RBC) and the number of white blood cells(WBC) from the female mice in the A.sinensis water extract group were significantly increased(P<0.05),the thymus index had an upward trend,and Na+-K+-ATPase activity was significantly increased(P<0.01).A.sinensis water extract significantly increased the abundance of probiotics in the intestinal flora of mice,such as Lactobacillus,Muribaculaceae,and Alloprevotella.The correlation analysis showed that the number of RBC,WBC,hemoglobin(HGB),and hematocrit(HCT) was significantly correlated with the abundance of various intestinal microbial communities.Conclusion:A.sinensis water extract has the blood-tonifying effect and regulates the intestinal flora of mice.
Keywords Blood deficiency syndrome; Angelica sinensis; Intestinal flora; Peripheral blood; Blood tonification
中图分类号:R256.3文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.07.002
在中醫基础理论中,血液运行周身濡养脏腑、形体与经络,支持人体的正常生命活动,是人体的重要组成成分[1]。血虚证是临床常见证候,主要是指人体血液绝对或相对不足,不能濡养滋润脏腑经脉、四肢百骸,而出现一系列虚弱性表现的证候总称[2],存在于多种疾病中[3]。血虚证形成原因多数为失血过多、脾胃虚弱,或者血液生化之源不足以及瘀血阻滞等[4],目前对于血虚证的治疗,以补血为主,兼以补气[5]。当归为伞形科植物当归Angelica sinensis(Oliv.)Diels的干燥根。根据2020版《中华人民共和国药典》记载[6],当归具有补血活血,调经止痛,润肠通便的功效,尤擅于妇科血虚血瘀证候诸疾的治疗和调养,为“补血之圣药”[7]。当归始载于《神农本草经》,列为中品[8-9]。肠道菌群是人体中的一个复杂而动态的微生物群落,其在维持免疫代谢动态平衡和抵御病原体方面起到至关重要的作用[10]。
本研究采用单纯放血法制备小鼠血虚证模型,在评价当归水提取物对血虚证小鼠治疗效果的同时,探究其对血虚证模型小鼠肠道微生物结构的影响,为传统中医气血理论与肠道内环境的相关性研究提供实验基础。
1 材料与方法
1.1 材料
1.1.1 动物 美国癌症研究所(Institute of Cancer Research,ICR)小鼠,40只,无特定病原体(Specific Pathogen Free,SPF)级,雌雄各半,6~8周龄,体质量18~22 g,由北京维通利华实验动物技术有限公司提供,动物生产许可证号:SCXK(京)2016-0006。小鼠饲育于屏障环境,保持饲养环境22~27 ℃,相对湿度40%~70%,明暗交替12 h。试验所用的饲料由北京科奥协力饲料有限公司提供,饮用水由中国中医科学院中药研究所提供。实验动物使用许可证号:SYXK(京)2019-0003。本研究所涉及动物实验经中国中医科学院中药研究所动物福利伦理委员会批准通过(伦理审批号:2020B174)。
1.1.2 药物 当归(安国市昌达中药材饮片有限公司,批号:2102003)。
1.1.3 试剂与仪器 小鼠Na+-K+-ATP酶酶联免疫吸附试验(Enzyme Linked Immunosorbent Assay,ELISA)试剂盒(凡科维公司,批号:202111);DNA抽提试剂盒(Omega Bio-tek公司,美国,货号:E.Z.N.A. soil DNA kit M9636-02);琼脂糖(biowest公司,西班牙,货号:111860);FastPfu Polymerase[北京全式金生物技术(TransGen Biotech)股份有限公司,货号:AP211];AxyPrep DNA Gel Extraction Kit(Axygen,美国,货号:AP-GX-250);测序试剂盒(Illumina公司,美国,货号:20028313);电子天平(赛多利斯科学仪器有限公司,型号:Sartorius BSA323S-CW);电子天平[梅特勒-托利多仪器(上海)有限公司,型号:PL203 METTLER TOLEDO];冷冻离心机(KUBOTA公司,日本,型号:5922);电子调温电热套(天津市泰斯特仪器有限公司,型号:98-I-B);全自动流式血细胞计数仪(Sysmex公司,日本,型号:XN-1000V);小型离心机(合肥艾本森科学仪器有限公司,型号:ABSON MiFly-6);高速台式冷冻离心机(Eppendorf公司,德国,型号:5424R);超微量分光光度计(Thermo Fisher Scientific公司,美国,型号:NanoDrop2000);酶标仪(Biotek公司,美国,型号:ELx800);旋涡混合器(海门其林贝尔仪器制造有限公司,型号:QL-901);粉碎研磨仪(上海万柏生物科技有限公司,型号:TL-48R);研磨仪(MP公司,美国,型号:FastPrep-24 5G);微型荧光计(Promega公司,美国,型号:QuantusTM);电泳仪(北京市六一仪器厂,型号:DYY-6C);测序仪(Illumina公司,美国,型号:Illumina Miseq);超声波破碎仪(Gene Company Limited公司,型号:Covaris M220);超低温冰箱(Thermo Fisher公司,美国,型号:Forma-86C)。PCR扩增仪(ABI公司,美国,型号:GeneAmp 9700)。
1.2 方法
1.2.1 受试物制备 当归水提液的制备:称取当归饮片200 g,放入圆底烧瓶,加入10倍量纯净水,置电热套中加热,保持微沸120 min,回流提取2次,过滤后合并滤液,取滤液置水浴锅浓缩(80 ℃),得生药质量浓度为0.2 g/mL的水提液,4 ℃保存[11]。
1.2.2 分组与模型制备 适应期1~2 d,适应期期间自由饮水、采食,给予小鼠维持饲料,适应性饲养结束后,按体质量分层随机分组,分别为正常组(12只)、模型组(16只)、当归组(12只,剂量为4 g/kg),雌雄各半。除正常组外,其余各组给药2周后采用单纯放血法进行造模,隔日经小鼠眼眶静脉丛放血1次,约0.3 mL/次,持续3周,不限饮食,自由饮水。
1.2.3 给药方法 除正常组、模型组外,其他各组灌胃给予相应浓度的药物,1次/d,连续35 d,正常组与模型组灌胃给予等体积的纯净水(20 mL/kg)。当归剂量设计:当归成人每天推荐用量按12 g(2020版《中华人民共和国药典》推荐用量为6~12 g)计算,成人体质量按60 kg计算,以成人剂量的20倍作为小鼠的剂量,即为4 g/kg体质量。
1.2.4 检测指标与方法
1.2.4.1 当归水提取物對血虚证小鼠体质量的影响 每天观察动物一般状况,每周称体质量,根据体质量调整给药量。
1.2.4.2 当归水提取物对血虚证小鼠外周血象的影响 末次给药1 h后,小鼠摘眼球取血,取0.3 mL全血于EDTA-K2抗凝管内,采用全自动流式血细胞计数仪,检测小鼠抗凝全血中红细胞数量(Red Blood Cell,RBC)、白细胞数量(White Blood Cell,WBC)、血红蛋白量(Hemoglobin,HGB)、血细胞比容(Hematocrit,HCT)、红细胞平均体积(Mean Corpuscular Volume,MCV)、红细胞平均血红蛋白(Mean Corpuscular Hemoglobin,MCH)、红细胞平均血红蛋白浓度(Mean Corpuscular Hemoglobin Concentration,MCHC)、红细胞体积分布宽度(Red Blood Distribution Width,RDW)、血小板数量(Platelet,PLT)。
1.2.4.3 当归水提取物对血虚证小鼠胸腺指数的影响 取血后,将小鼠脱颈椎处死,摘取胸腺,称重,计算脏器指数:胸腺指数=胸腺质量(g)/小鼠体质量(g)×100。
1.2.4.4 当归水提取物对血虚证小鼠红细胞膜能量代谢酶活性的影响 将小鼠抗凝全血离心,吸取上层血浆,加入3倍体积的生理盐水,轻轻颠倒混匀,(50~190)×g,离心5 min,弃上清留沉淀红细胞,重复2~3次,直至上清液无色为止(洗涤红细胞),应用Elisa试剂盒测定Na+-K+-ATP酶活性。
1.2.4.5 肠道内容物DNA提取、PCR扩增及测序 实验结束时,取小鼠回盲部容物于无菌无RNA酶离心管中,迅速置于液氮中,于-80 ℃保存。肠道内容物DNA提取按DNA提取试剂盒说明书进行,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop 2000测定DNA浓度和纯度;使用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对V3~V4可变区进行PCR扩增,扩增程序如下:95 ℃预变性3 min,27个循环(95 ℃,变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后在4 ℃进行保存。PCR体系为:5×TransStart FastPfu缓冲液4 μL,2.5 mmol/L,脱氧核苷三磷酸(Deoxyribonucleoside-triphosphates ,dNTPs)2 μL,上游引物(5 μmol/L)0.8 μL,下游引物(5 μmol/L)0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 10 ng,双蒸水(Double-distilled Water,ddH2O)补足至20 μL。每个样本3个重复。
1.2.4.6 Illumina Miseq测序 将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用QuantusTM Fluorometer对回收产物进行检测定量。使用NEXTflexTM Rapid DNA-Seq Kit进行建库:1)接头链接;2)使用磁珠筛选去除接头自连片段;3)利用PCR扩增进行文库模板的富集;4)磁珠回收PCR产物得到最终的文库。利用测序仪进行测序。
1.2.4.7 生物信息分析 使用Fastp[12](https://github.com/OpenGene/fastp,version 0.20.0)软件对原始测序序列进行质控,使用FLASH[13](http://www.cbcb.umd.edu/software/flash,version 1.2.7)软件进行拼接,使用UPARSE[14]软件(http://drive5.com/uparse/,version 7.1),根据97%的相似度对序列进行运算分类单元(Operational Taxonomic Unit,OTU)聚类并剔除嵌合体[15],利用RDP classifier[16](http://rdp.cme.msu.edu/,version 2.2)对每条序列进行物种分类注释。其中群落结构多样性基于α多样性及β多样性(主成分分析及PcoA分析)进行;丰度显著差异分类单元筛选使用LEfSe[17]方法在属水平进行,判别标准为:Kruskal-Wallis检验筛选值α<0.05,配对Wilcoxon检验筛选值α<0.05,显著判别值线性判别分析(LDA)>2;小鼠肠道微生物群落与环境因子之间的相关性利用Heatmap图来分析,以WBC、RBC、HGB、HCT作为环境因子进行分析。
1.3 统计学方法 肠道微生物多样性采用生物信息学分析,其余药效学指标采用SPSS 20.0统计软件进行数据分析,以均数±标准差(±s)表示,采用t检验,以P<0.05为差异有统计学意义。
2 结果
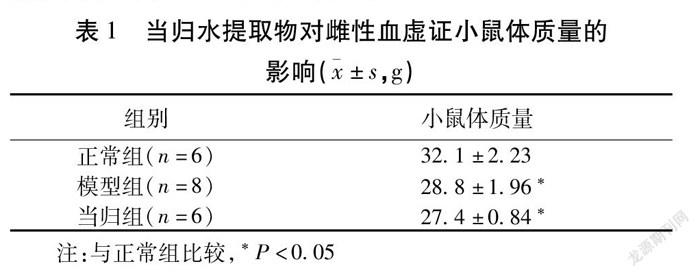
2.1 当归水提取物对血虚证小鼠体质量的影响 与正常组比较,造模后雌性模型组体质量明显下降,差异有统计学意义(P<0.05)。雄性小鼠体质量未见明显影响。见表1。
2.2 当归水提取物对血虚证小鼠外周血象的影响 在雌性小鼠中,与正常组比较,模型组小鼠外周血RBC、HGB、HCT、RDW明显下降,差异有统计学意义(P<0.01);与模型组比较,当归组小鼠外周血RBC、WBC明显上升,差异有统计学意义(P<0.05)。雄性小鼠外周血象未见明显影响。见表2。
2.3 当归水提取物对血虚证小鼠胸腺的影响 在雌性小鼠中,与正常组比较,模型组小鼠胸腺指数明显下降,差异有统计学意义(P<0.05);与模型组比较,当归组小鼠胸腺指数有上升趋势。雄性小鼠胸腺指数未见明显影响。见表3。
2.4 当归水提取物对血虚证小鼠红细胞膜能量代谢酶活性的影响 在雌性小鼠中,与正常组比较,模型组小鼠的红细胞膜Na+-K+-ATP酶活性明显降低,差异有统计学意义(P<0.05);与模型组比较,当归组小鼠的红细胞膜Na+-K+-ATP酶活性明显上升,差异有统计学意义(P<0.01)。见表4。
2.5 当归水提取物对血虚证小鼠肠道菌群结构的影响
2.5.1 当归水提取物对血虚证小鼠肠道菌群多样性的影响 通过α多样性分析显示,模型组小鼠肠道微生物丰富度指数(Chao、ACE、Sobs指数)均明显降低,与正常组比较,差异有统计学意义(P<0.05)。见表5。小鼠肠道菌群β多样性分析显示,在雌性小鼠中,可以观察到正常对照组与模型组之间菌群轮廓可在一定程度上分离,群落结构差异有统计学意义(P<0.05),给予当归水提取物后对雌性小鼠肠道菌群结构产生一定程度上的影响。见图1。在雄性小鼠中,可以观察到正常对照组与模型组之间菌群轮廓可在一定程度上分离,群落结构差异有统计学意义(P<0.05)。见图2。可以观察到正常组与模型组之间菌群轮廓差异有统计学意义(P<0.05)。
2.5.2 当归水提取物对血虚证小鼠肠道微生物群落组成的影响 在雌性小鼠肠道菌群中丰度较高的菌群依次为Firmicutes(厚壁菌门)、Bacteroidetes(杆菌门)、Actinobacteria(放线菌门)、Desulfobacterota(脱硫菌门)以及Patescibacteria(巴氏杆菌门),其中厚壁菌门具有绝对优势。在属水平上,Lactobacillus(乳杆菌属)丰度占绝对优势,其他丰度较高的菌群依次为Muribaculaceae(Muri菌)、Enterorhabdus(肠杆菌属)、Lachnospiraceae(毛螺菌科)以及Alistipes(另枝菌属)。见图3。在雄性小鼠肠道菌群中丰度较高的菌群依次为Firmicutes、Bacteroidota、Actinobacteriota、Patescibacteria以及Desulfobacterota,其中厚壁菌门具有绝对优势。在属水平上,丰度较高的菌群依次为Lachnospiraceae_NK4A136(毛螺菌科_NK4A136)、Muribaculaceae、unclassified_f__Lachnospiraceae(毛螺菌科)、Lactobacillus(乳杆菌属)、Alistipes等。见图4。
2.5.3 丰度显著差异分类单元筛选 雌性小鼠在门水平上,与正常组比较,模型组的Firmicutes、Bacteroidota、Actinobactota丰度下降;与模型组比较,当归组Bacteroidota丰度上升。在属水平上,与正常组比较,模型组Lactobacillus、Muribaculaceae、Clostridia(梭状芽孢杆菌属)丰度有所下降,Alistipes丰度有所上升;与模型组比较,当归组Lactobacillus、Muribaculaceae、Alloprevotella(普雷沃菌属)丰度有所上升。雄性小鼠在门水平上,与正常组比较,模型组小鼠Firmicutes、Bacteroidota、Desulfobacterota丰度上升,Actinobacteriota、Patescibacteria丰度下降;与模型组比较,当归组的Bacteroidota、Desulfobacterota、Actinobacteriota、Patescibacteria丰度上升,Firmicutes丰度下降。在属水平上,与正常组比较,模型组中Muribaculaceae、Lachnospiraceae_NK4A136、unclassified_f__Lachnospiraceae丰度上升,Lactobacillus、Desulfovibrio(脱硫弧菌属)丰度下降;与模型组比较,当归组Muribaculaceae、Lactobacillus、Desulfovibrio丰度上升,Lachnospiraceae、unclassified_f__Lachnospiraceae丰度下降。见图5。
2.5.4 血虚证小鼠肠道微生物与外周血象相关性分析 鼠肠道微生物与外周血象相关性分析显示,在雌性小鼠中RBC、HGB、HCT 3个指标与小鼠肠道微生物群落之间相关性显著,其中Dubosiella(杜氏乳杆菌属)、Turicibacter与RBC、HGB、HCT显著正相关(P<0.05或P<0.01),Lachnoclostridium(蓝绿藻菌属)丰度与RBC、HCT正相关(P<0.05或P<0.01),Gemella(孪生球菌属)丰度与RBC、HGB、HCT负相关(P<0.05)。在雄性小鼠中,Clostridium innocuum(无害梭菌)、Bacteroides(杆菌属)与RBC、HGB、HCT 3个指标正相关(P<0.05或P<0.01),与WBC负相关(P<0.05);Erysipelato-clostridium菌属与HGB、HCT正相关(P<0.05),与WBC负相关;Lachnospiraceae_NK4A136、Desulfovibrio与HGB、HCT负相关(P<0.05),与WBC正相關(P<0.05)。见图6。
3 讨论
血虚证是指血液亏虚不能濡养脏腑、经络、形体器官,以面、睑、唇、舌色淡白,毛发不泽、头昏、脉细、乏力等为特征的综合性证候。血液亏虚的主要原因,一是血液生化或来源不足,如相关脏腑(脾胃、肾等)功能减退所致;二是血液耗损过多,可见于出血之后或因大病、久病而劳神太过暗耗阴血等[18-19]。血虚证的造模方法包括失血法[20]、溶血法[21]、辐射损伤法[22]、化学损伤法[23]等,本研究采取单纯放血法制备血虚证小鼠模型,旨在更好地模血液耗损这一病因,使得模型与临床症候更为相似。从实验结果中可以看出,造模后模型组小鼠体质量、外周血RBC、HGB、MCV、RDW含量、胸腺指数以及红细胞膜Na+-K+-ATP酶活性明显下降,说明本实验所采用的单纯放血法成功地模出了血虚证血液亏损、免疫力低下、血液缺乏濡养且来源不足的临床症状[24]。在连续给药35 d后,与模型组比较,当归组雌性小鼠外周血RBC、WBC及红细胞膜Na+-K+-ATP酶活性显著升高(P<0.05),胸腺指数也有上升趋势,说明当归水提取物具有补血作用,可在一定程度上改善血虚证小鼠的血虚症状。
在肠道菌群的研究中,血虚证小鼠长期服用当归水提取物后,小鼠门水平肠道菌群结构发生改变,其中Bacteroidota丰度上升,Firmicutes丰度明显下降,有研究表明Bacteroidota丰度下降,Firmicutes上升是肥胖发生的标志之一[25],说明当归水提取物可能通过调节血虚证小鼠肠道微生物结构对机体代谢产生影响。在属水平上,以Lactobacillus、Muribaculaceae为代表的有益菌丰度显著升高[26],其中Muribaculaceae被认为在机体能量代谢中发挥重要作用[27]。此外,通过小鼠外周血象指标与肠道菌群的相关性分析可以得出,小鼠外周血象与肠道微生物结构有着非常密切的联系,中医气血理论与肠道微生物结构之间的关系仍需要深入研究。
综上所述,当归水提取物具有补血作用,且对小鼠肠道菌群具有一定的调节作用。
参考文献
[1]印会河.中医基础理论[M].上海:上海科学技术出版社,1984:59.
[2]刘先利,刘宝利.基于中医古籍文献探讨血虚证病因、症候及治则治法[J].北京中医药,2020,39(3):262-265.
[3]刘竞男,张会永,于莉,等.血虚证中医疗效评价量表条目筛选[J].中华中医药杂志,2021,36(8):4583-4586.
[4]胡柳,韩铨,吴妍,等.综合放血法所致血虚证小鼠模型的比较研究[J].中国当代医药,2020,27(26):35-38.
[5]莫国艳,韩祥志,穆丹丹,等.石榴补血糖浆对血虚小鼠造血功能的影响[J].世界科学技术-中医药现代化,2021,23(5):1636-1642.
[6]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2020:133.
[7]高学敏.中药学[M].北京:中国中医药出版社,2007:460-462.
[8]Han Y,Chen Y,Zhang Q,et al.Overview of therapeutic potentiality of Angelica sinensis for ischemic stroke[J].Phytomedicine,2021,90:153652.
[9]Wei WL,Zeng R,Gu CM,et al.Angelica sinensis in China-A review of botanical profile,ethnopharmacology,phytochemistry and chemical analysis[J].J Ethnopharmacol,2016,190:116-141.
[10]Luckey TD.Intestinal microecology.Introduction:the villus in chemostat man[J].Am J Clin Nutr,1974,27(11):1266-1276.
[11]韩莹,张岩,杨德芳,等.基于当归/白芍提取物调节原发性痛经大鼠子宫供血的机制研究[J].中南药学,2018,16(5):625-628.
[12]Chen S,Zhou Y,Chen Y,et al.fastp:an ultra-fast all-in-one FASTQ preprocessor[J].Bioinformatics,2018,34(17):i884-i890.
[13]Mago T,Salzberg SL.FLASH:fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics,2011,27(21):2957-2963.
[14]Edgar RC.UPARSE:highly accurate OTU sequences from microbial amplicon reads[J].Nat Methods,2013,10(10):996-998.
[15]Stackebrandt E,Goebel B M.Taxonomic Note:A Place for DNA-DNA Reassociation and 16S rRNA Sequence Analysis in the Present Species Definition in Bacteriology[J].Int J Syst Bacteriol,1994,44(4):846-849.
[16]Wang Q,Garrity GM,Tiedje JM,et al.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Appl Environ Microbiol,2007,73(16):5261-7.
[17]Segata N,Izard J,Waldron L,et al.Metagenomic biomarker discovery and explanation[J].Genome Biol,2011,12(6):R60.
[18]秦甜,劉建新,周小青,等.从血虚证探讨证的认识论特征[J].环球中医药,2014,7(8):612-614.
[19]吴江,郭平.血虚证的现代研究进展[J].山东中医杂志,2018,37(9):780-782.
[20]田昌平,赵瑞,邵将,等.一种血虚证小鼠模型的制备方法及评价[J].辽宁中医药大学学报,2015,17(5):169-171.
[21]任德旺,叶渟渟,倪必辉,等.盐酸苯肼致小鼠化学损伤性血虚证模型的改良[J].辽宁中医药大学学报,2015,17(8):108-110.
[22]王成龙,王林元,朱映黎,等.芍药内酯苷对放射线辐照法致血虚免疫抑制小鼠的补血作用及机制研究[J].环球中医药,2017,10(7):782-787.
[23]邱云,戎宽,杨惠,等.生血增白汤对环磷酰胺致血虚小鼠RBC、Hb、WBC、Plt含量的影响[J].湖南中医药大学学报,2017,37(12):1323-1325.
[24]杨岚,陈为.四物汤对血虚小鼠红细胞膜Na+-K+-ATP酶的影响[J].海南医学院学报,2003,9(1):10-12.
[25]Turnbaugh PJ,Ley RE,Mahowald MA,et al.An obesity-associated gut microbiome with increased capacity for energy harvest[J].Nature,2006,444(7122):1027-1031.
[26]Zhou D,Pan Q,Xin FZ,et al.Sodium butyrate attenuates high-fat diet-induced steatohepatitis in mice by improving gut microbiota and gastrointestinal barrier[J].World J Gastroenterol,2017,23(1):60-75.
[27]王伯韬.青春双歧杆菌对高脂饮食引发肥胖症的缓解作用与机制研究[D].无锡:江南大学,2021.
(2022-03-10收稿 本文编辑:王明)
