miR-103靶向USP10对胰腺癌细胞YAP/TAZ表达及化疗耐药性的影响*
2022-06-01闫红印杨柳张克正
闫红印, 杨柳, 张克正
平煤神马医疗集团总医院普外一区(河南平顶山 461700)
胰腺癌是常见的消化系统恶性肿瘤,临床上主要采用化疗来控制病情,然而胰腺癌细胞对化疗药物耐药则是影响患者预后不良的主要原因之一[1-2]。因此,探究胰腺癌的耐药机制,有助于提高癌细胞对药物的敏感性,对改善患者预后具有重要意义。微小RNA-103(microRNA-103,miR-103)在多种肿瘤中均有表达,不仅参与肿瘤细胞的增殖、分化与凋亡,也与肿瘤细胞的耐药性有关[3-4]。研究表明[5],miR-103可靶向负调控caveolin-1表达,增加SGC7901/ADR细胞对多柔比星敏感性,从而逆转胃癌多药耐药。泛素特异性蛋白酶10(ubiquitin-specific protease 10,USP10)参与细胞中多种生命活动的调节,与肿瘤的发生和耐药性有关。研究表明,降低USP10的表达可能通过下调P21蛋白的表达从而促进G1/S期转变参与胰腺癌细胞的吉西他滨耐药[6-7]。但miR-103、USP10对胰腺癌顺铂(DDP)的耐药性尚未可知,因此,我们于2020年3月至2021年3月开展实验,探索miR-103对人胰腺癌细胞(PANC-1)DDP耐药作用及机制,以期为临床探索克服胰腺癌对DDP耐药性的有效途径提供依据。本研究经我院伦理委员会审核批准(202012-05)。
1 材料与方法
1.1 主要材料与仪器 人胰腺癌细胞(PANC-1)、人正常胰腺上皮细胞株hTERT-HPNE购于中国科学院细胞库;DDP购自山东齐鲁制药有限公司;si-miR-103和si-NC由广州市锐博生物科技有限公司设计与合成;miR-103、USP10、U6、GAPDH引物序列由上海生工生物工程有限公司设计合成;Lipofectamine 2000试剂盒购自大连Takara公司;双荧光素酶检测试剂盒购自美国Promega公司;CCK-8试剂盒、Annexin V/PI细胞凋亡试剂盒购自北京索莱宝科技有限公司;兔抗人MRP、Yes相关蛋白(YAP)、包含WW结构域的转录调节蛋白1(TAZ)、β-actin单克隆抗体购自美国CST公司。
1.2 方法
1.2.1 胰腺癌DDP耐药细胞株PANC-1/DDP的建立 采用高浓度间歇诱导法建立PANC-1/DDP,采用5 μg/mL DDP与PANC-1细胞连续培养48 h后,换成不含药物的培养液继续培养,待细胞对数生长期后,进行2次传代培养,再采用5 μg/mL DDP培养,直至PANC-1细胞可以在5 μg/mL DDP药物浓度中稳定生长并传代。
1.2.2 细胞转染 实验分为3组,将耐药细胞PANC-1/DDP分别转染miR-103干扰RNA(si-miR-103)和阴性对照(negative control,si-NC),按照Lipofectamine 2000试剂盒说明书将si-miR-103和si-NC转染PANC-1/DDP细胞,转染48 h后,进行阳性克隆筛选。
1.2.3 si-miR-103转染后PANC-1/DDP细胞对DDP的半抑制浓度 收集对照组、si-miR-103组和si-NC组对数生长期PANC-1/DDP细胞,调整细胞浓度为5×106·mL-1,按照每孔200 μL接种至96孔板中,每孔加入DDP,使其终浓度为0.5、1、2、4、8、16、32、64 μg/mL,同时设置DMSO对照孔,37℃、5% CO2培养48 h,CCK-8法测定450 nm处吸光度值,根据A值计算各药物的半数抑制浓度(50% inhibiting concentration,IC50)。
1.2.4 实时荧光定量PCR(real-time quantification PCR,RT-qPCR)实验检测miR-103、USP10相对表达量 采用RT-qPCR检测各组细胞中miR-103、USP10、MDR1相对表达量,根据RNA提取试剂盒说明书,提取1.2.2各组细胞提取总RNA,反转录合成cDNA后,进行PCR扩增。分别以U6、GAPDH为内参,采用2-ΔΔCt法分别计算各RNA相对表达量。miR-103、USP10、U6、GADPH引物序列见表1。
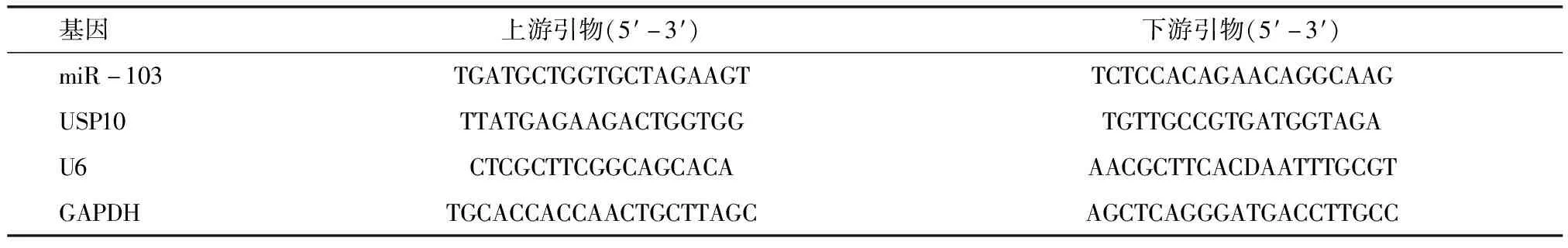
表1 miR-103、USP10、MDR1、U6、GAPDH各引物序列
1.2.5 细胞增殖实验 转染si-NC、si-miR-103后的PANC-1/DDP细胞培养48 h后,经胰酶消化制成单细胞悬液,以每孔1×106·mL-1浓度接种于96孔板,每孔加入10 μL的CCK-8溶液,培养2.5 h后,计算细胞存活率(%)=(OD实验组/OD空白对照组)×100%。
1.2.6 细胞凋亡实验 将转染si-NC、si-miR-103后的PANC-1/DDP细胞,调整细胞浓度,加入 5 μL Annexin V-FITC 混匀,4℃避光孵育10 min,再加 5 μL PI 染液,室温避光孵育 10 min,流式细胞仪进行检测细胞凋亡率。
1.2.7 免疫印迹法(Western blot,WB)检测多药耐药相关蛋白(multidrug resistance-related proteins,MRP)、YAP、TAZ水平蛋白表达 转染后的各组细胞提取总蛋白,经SDS-PAGE电泳后转膜,10%脱脂奶粉封闭2 h,加入一抗MRP、YAP、TAZ和β-actin(1∶1 000),4℃孵化过夜,TBST洗涤3次,再加入HRP标记二抗(1∶5 000),室温孵育1.5 h,使用ECL试剂显色,以β-actin为内参,各条带进行灰度分析。
1.2.8 双荧光素酶报告基因检测实验 根据MiRcode数据库预测,miR-103与USP10有靶标位点,根据miR-103结合USP10 3′UTR序列区域,构建野生型USP10-3′UTR-WT和突变型USP10-3′UTR-MUT质粒,PANC-1细胞培养24 h后,均与si-miR-103、si-NC共转染PANC-1细胞24 h,分为USP10-3′UTR-WT+si-NC组、USP10-3′UTR-WT+si-miR-103组、USP10-3′UTR-MUT+si-miR-103组和USP10-3′UTR-MUT+si-NC组,根据说明书制备细胞提取物,测量各组荧光素酶活性。
2 结果
2.1 PANC-1、PANC-1/DDP细胞miR-103、USP10表达水平 与hTERT-HPNE细胞比较,PANC-1与耐药细胞PANC-1/DDP中miR-103表达水平显著升高,USP10表达显著降低,差异有统计学意义(P<0.05);与PANC-1比较,耐药细胞PANC-1/DDP中miR-103表达水平显著升高,USP10表达显著降低,差异有统计学意义(P<0.05)。见表2。
表2 PANC-1、PANC-1/DDP细胞miR-103、USP10表达情况
2.2 si-miR-103转染后PANC-1/DDP细胞对DDP的IC50与对照组和si-NC组比较,si-miR-103组PANC-1/DDP细胞IC50值显著降低(P<0.05)。见表3。
表3 si-miR-103转染后各组细胞IC50比较
2.3 转染后各组细胞miR-103、USP10表达水平情况 与对照组和si-NC组比较,si-miR-103组miR-103表达水平显著降低(P<0.05),USP10表达显著升高,差异有统计学意义(P<0.05)。见表4。
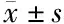
表4 各组细胞miR-103、USP10表达情况
2.4 si-miR-103转染对PANC-1/DDP细胞增殖、凋亡的影响 与对照组和si-NC组比较,si-miR-103组PANC-1/DDP细胞增殖活性下降、凋亡率显著升高(P<0.05)。见表5、图1。
图1 si-miR-103转染后PANC-1/DDP细胞凋亡
表5 si-miR-103转染对PANC-1/DDP细胞凋亡的影响
2.5 双荧光素酶报告基因检测系统验证miR-103与USP10靶向关系 经MiRcode数据库预测显示,miR-103与USP10 3′UTR区有结合位点,见图2。双荧光素酶报告基因检测结果显示,与USP10-3′UTR-WT+si-NC组比较,USP10-3′UTR-WT+si-miR-103组荧光素酶活性降低(P<0.05)。见表6、图2。
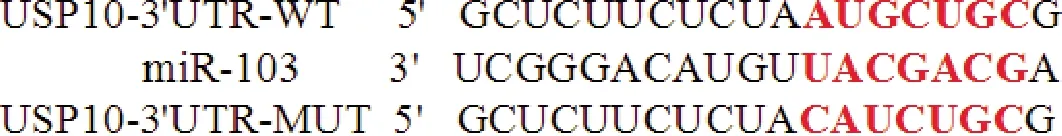
图2 miR-103与USP10结合位点预测结合
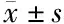
表6 各组PANC-1细胞双荧光素酶报告基因检测结果
2.6 si-miR-103转染对PANC-1/DDP细胞MRP、YAP、TAZ蛋白表达的影响 与对照组和si-NC组比较,si-miR-103组MRP、YAP、TAZ蛋白表达显著降低(P<0.05)。见图3、表7。

注:A:对照组;B:si-NC组;C:si-miR-103组
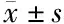
表7 各组细胞YAP、TAZ蛋白表达情况
2.7 敲减USP10对PANC-1/DDP细胞增殖及YAP、TAZ蛋白表达的影响 与si-NC组比较,敲减USP10后,si-USP10组细胞增殖活性显著增高,YAP、TAZ蛋白表达显著降低(P<0.05),同时敲减USP10与抑制miR-103表达后,si-USP10组与si-NC组细胞增殖活性与YAP、TAZ蛋白表达差异无统计学意义,见表8、图4。

表8 各组细胞增殖活性及YAP、TAZ蛋白表达情况
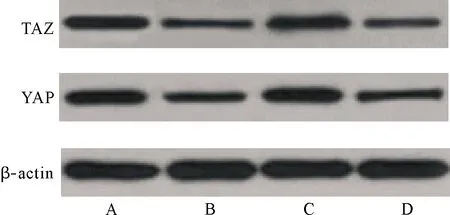
注:A:si-NC组;B:si-USP10组;C:si-USP10+miR-103抑制组;D:miR-103抑制组
3 讨论
胰腺癌是诊断和治疗都很困难的恶性肿瘤,胰腺癌治疗主要以化疗为主,目前胰腺癌的化疗药物主要有DDP、吉西他滨、卡培他滨、5-氟尿嘧啶、紫杉醇类等。DDP是治疗胰腺癌的一线药物,然而对DDP耐药是导致胰腺癌化疗失败的主要原因[8-9]。
多项研究表明[10-11],有多种miRNA在胰腺癌的发生发展与耐药中发挥调控作用。何平等[12]研究表明,miR-429在胰腺癌卡培他滨耐药细胞株中高表达,敲低miR-429可通过靶向上调PTEN并阻断PI3K/AKT信号通路,进而显著抑制PANC-1/CAP细胞增殖活力,从而下调PANC-1/CAP细胞对卡培他滨的耐药性。本研究结果显示,在PANC-1及耐药细胞PANC-1/DDP中miR-103表达水平显著升高,且PANC-1/DDP细胞中表达水平高于PANC-1细胞,提示miR-103与PANC-1细胞耐药有关。然而其具体耐药机制尚不清楚,本研究发现敲低miR-103表达,PANC-1/DDP 细胞IC50与MDR1显著低于si-NC组,且细胞增殖活性降低,凋亡率增加,表明干扰miR-103表达后,PANC-1细胞对DDP的敏感性增加。有研究表明[13],miR-103可通过调控下游基因的表达,可增加胃癌多药耐药细胞SGC7901/ADR对阿霉素的敏感性。孙红文等[14]研究表明,miR-103在肺癌达沙替尼(DASA)耐药组织和A549/DASA耐药细胞中均高表达,敲低miR-103表达,可通过影响其靶向位点PTEN表达并激活PI3K/AKT信号通路逆转肺癌细胞对DASA的耐药。
研究表明USP10在结肠癌、胃癌中均呈低表达,与肿瘤耐药有一定相关性,USP10 可以通过稳定p53来抑制癌细胞的增殖,在缺乏野生型p53的非小细胞肺癌中USP10增加提细胞对DDP的耐药性[15]。研究表明[16],USP10可能通过p53依赖途径参与P21聚集,从而诱发胰腺癌细胞对吉西他滨耐药。有研究表明[17],miR-103与USP10存在靶向关系,本研究经MiRcode数据库预测,miR-103与USP10 3′UTR区存在结合位点,且双荧光素酶基因检测报告显示,证实miR-103与USP10存在靶向关系,与Xu等[17]的研究结果一致,表明miR-103通过靶向调控USP10表达,参与PANC-1/DDP的耐药性。
YAP、TAZ为Hippo 信号通路的关键下游分子,Hippo通路在调控肿瘤发生中起着重要作用,YAP、TAZ为同源蛋白质,在乳腺癌、结肠癌、非小细胞肺癌等肿瘤中表达上调,下调YAP可抑制喉癌细胞Warburg效应及上皮间质转化进展,可以减弱喉癌细胞迁移、侵袭能力[18]。YAP、TAZ也与肿瘤耐药性相关[19],占婷等[20]研究表明胰腺癌细胞中YAP、TAZ蛋白表达升高,且与胰腺癌细胞吉西他滨耐药有关,干扰YAP、TAZ表达后,癌细胞对吉西他滨的IC50明显降低。本研究结果显示,si-miR-103转染后PANC-1/DDP 细胞YAP、TAZ表达水平降低,提示敲除miR-103表达,可抑制细胞YAP、TAZ表达及减少细胞耐药性。
另外,本研究试图进一步明确miR-103通过靶向调控USP10对胰腺癌PANC-1/DDP细胞DDP耐药性的作用机制。本研究敲低USP10后,PANC-1/DDP细胞YAP、TAZ蛋白表达显著降低,表明USP10可影响YAP、TAZ蛋白表达水平,细胞增殖活性显著增高,表明敲低USP10可促进细胞增殖,同时敲低USP10与抑制miR-103表达后,si-USP10组与si-NC组细胞增殖活性与YAP、TAZ蛋白表达差异不显著,证实沉默miR-10通过靶向上调USP10表达抑制YAP/TAZ表达,逆转PANC-1/DDP细胞对DDP的耐药性。
综上所述,干扰miR-103表达,miR-103可通过靶向上调USP10并抑制YAP/TAZ表达,进而抑制PANC-1/DDP 细胞增殖、促进凋亡,从而逆转PANC-1/DDP细胞对DDP的耐药性。
利益相关声明:所有作者均声明不存在任何利益冲突。
作者贡献说明:闫红印负责设计实验、数据采集、分析、论文撰写;杨柳负责数据分析、对论文的知识性内容做审阅;张克正负责课题设计、统计分析。
