间充质干细胞诱导的神经干细胞条件培养基对原代培养海马神经干细胞缺氧损伤的保护作用
2022-06-01杨建成金毅然马晓娜李家辉郭松林刘佳鑫梁雪云
王 燕, 杨建成, 金毅然, 马晓娜, 李家辉, 郭松林, 刘佳鑫, 梁雪云
(1.宁夏医科大学临床医学院,银川 750004; 2.宁夏医科大学总医院宁夏干细胞与再生医学重点实验室,银川 750004)
缺血性脑卒中的致死率和致残率极高[1],患者因脑缺血造成不可逆的功能神经元丧失和神经受损[2],目前临床上仍缺乏有效的治愈方法。神经干细胞主要存在于大脑海马区,可自我更新并增殖分化为神经细胞[3]。海马区神经干细胞的增殖分化能力被脑缺血影响[4],移植的神经干细胞可替代丢失的神经元和重建脑缺血后受损的神经回路[5]。因此,脑缺血后及时保护海马区神经干细胞有利于促进神经功能的修复[6]。干细胞移植成为最有希望治疗脑卒中的方法之一[7]。间充质干细胞可诱导分化成衍生神经干细胞样细胞[8],但是目前相关研究较少。本课题组前期采用不同诱导培养基均可将人胎盘间充质干细胞(human placental mesenchymal stem cells,hPMSCs)诱导成神经细胞,且诱导的细胞具有神经干细胞的特性[9]。因此,本文旨在探究用hPMSCs 诱导成神经干细胞(hPMSCs induced neural stem cells,hPMSCsiNSCs)的条件培养基对经氧-糖剥夺(oxygen and glucose deprivation,OGD)损伤后的小鼠海马神经干细胞的治疗效果。
1 材料与方法
1.1 主要材料与试剂
P3 至P6 代hPMSCs 由宁夏医科大学总医院宁夏干细胞与再生医学重点实验室提供,细胞的采集及获取均获得宁夏医科大学总医院伦理委员会批准(伦理号:2020-289)。SPF 级雄性ICR小鼠,3 周龄,平均体质量18~20 g,由宁夏医科大学实验动物中心提供,所有的实验动物均符合动物伦理委员会的要求(伦理号:2020-725),所有的实验过程均按照宁夏医科大学实验动物相关伦理规定操作。Ultraculture Serum Free Medium购自瑞士Lonza 公司;Pall Ultroser G Serum substitute 购自美国Pall 公司;Neurobasal A Medium、B27 Supplement、N2 Supplement、胰蛋白酶、胎牛血清购自美国Gibco 公司;bFGF、EGF 购自美国PeproTech 公司;EdU 检测试剂盒、ROS 活性氧检测试剂盒购自苏州宇恒生物科技有限公司;层粘连蛋白包被液购自瑞典BioLamina 公司;兔抗NF、NSE、GAP43、Cleaved-Caspase-3、SOD 抗体均购自英国Abcam 公司;兔抗Nestin 抗体购自美国Invitrogen 公司;鼠抗β-actin 抗体购自美国Proteintech 公司;Cy3 标记的山羊抗兔IgG 购自美国Jackson Immuno Research 公司;IRDye 680RD 山羊抗兔IgG、IRDye 800CW 山羊抗小鼠IgG 购自美国LI-COR 公司;SDS-PAGE 凝胶配制试剂盒购自上海雅酶生物医药科技有限公司;BCA 蛋白含量检测试剂盒购自江苏凯基生物技术股份有限公司;封闭羊血清、DAPI 购自北京索莱宝科技有限公司;蛋白酶和磷酸酶抑制剂混合物、CO2恒温培养箱、PRIMO 台式高速离心机购自美国Thermo Fisher 公司;倒置显微镜购自日本Olympus公司;Odyssey CLx 双色红外激光成像仪购自美国LI-COR 公司;流式细胞仪购自美国BD 公司;6 孔板、12 孔板、培养皿及离心管等耗材均购自美国康宁公司。
1.2 方法
1.2.1 hPMSCs 的培养与诱导 hPMSCs 复苏后接种于Lonza+UG 无血清培养基的培养皿中,放入37 ℃、5%CO2培养箱内培养。待细胞生长融合至90%时,胰蛋白酶消化、离心,调整细胞密度为1.0×104个/mL,接种于添加2%B27、1%N2、10 mg·L-1bFGF、20 mg·L-1EGF 的Neurobasal 诱导培养基的培养皿内,诱导成悬浮的细胞球(直径约100 μm)。
1.2.2 免疫荧光染色法鉴定hPMSCs-iNSCs 将hPMSCs-iNSCs 吹打成单个细胞后贴壁培养于层粘连蛋白包被过的12 孔板中,贴壁过夜,预热的PBS 洗2 次,4%多聚甲醛室温固定10 min 后洗3 次,0.5% TritonX-100 透化1 h,5%山羊血清室温封闭1 h,分别滴加一抗Nestin(1∶200)、GAP43(1∶500),4 ℃孵育过夜。滴加Cy3 标记的山羊抗兔IgG(1∶800)室温避光孵育3 h 后洗3 次,DAPI避光染色5 min 后洗3 次,荧光显微镜下观察并采集图像。
1.2.3 hPMSCs-iNSCs 条件培养基收集 选择直径约100 μm 的hPMSCs-iNSCs 置于新鲜的添加2%B27、10 mg·L-1bFGF、20 mg·L-1EGF、2 μg·mL-1肝素的Neurobasal 神经干细胞培养基内继续培养24 h 后收集上清液作为条件培养基(conditioned medium,CM),0.22 μm 滤器过滤后用于后续实验。
1.2.4 小鼠海马神经干细胞的原代培养 ICR小鼠处死后用75%乙醇浸泡消毒,剪下头部,剥离皮肤组织,沿颅骨中线剪开,将脑组织与颅骨分离,完全暴露大脑组织,用弯镊轻轻将大脑取出置于无菌培养皿中,在解剖显微镜下小心剥离出海马组织,用剪刀将海马组织剪碎成1 mm3的组织碎块,胰酶消化7 min,PBS 洗2 次,接种于添加2%B27、10 mg·L-1bFGF、20 mg·L-1EGF、2 μg·mL-1肝素的Neurobasal 神经干细胞培养基的培养皿内,放入37 ℃、5%CO2培养箱内培养。待培养至1 周左右时,显微镜下可以看到折光性较强的细胞球,移液器轻轻吹散并接种于新的培养皿内继续培养至2 周左右,悬浮细胞球的数量明显增多,体积明显增大,培养至P3 代(直径约100 μm)后用于后续实验。
1.2.5 免疫荧光染色法鉴定海马神经干细胞 将原代培养的海马神经干细胞吹打成单个细胞后按照1.2.2 步骤对海马神经干细胞进行鉴定,免疫荧光染色法检测Nestin(1∶200)、GAP43(1∶500)、NSE(1∶300)、NF(1∶1 000)的蛋白表达。
1.2.6 实验分组 将小鼠海马神经干细胞吹打成单个细胞后接种于层粘连蛋白包被过的6 孔板内,待生长融合至70%左右。正常组(Normal 组):用神经干细胞培养基培养,放入95%O2、5%CO2培养箱;氧-糖剥夺组(OGD 组):更换为无糖神经干细胞培养基(添加物不变),放入1%O2、5%CO2、94%N2低氧培养箱,24 h 后显微镜下观察细胞形态,并更换为神经干细胞培养基,放入95%O2、5%CO2培养箱培养48 h;氧-糖剥夺+条件培养基组(OGD+CM 组):与OGD 组处理一样,低氧24 h 后更换hPMSCs-iNSCs 条件培养基,放入95%O2、5%CO2培养箱培养48 h 后进行后续实验。
1.2.7 EdU 染色法检测神经干细胞的增殖能力 各组细胞用终浓度为10 μmol·L-1的EdU 工作液(组分A)孵育24 h,4%多聚甲醛室温固定20 min,2 mg·mL-1的甘氨酸溶液室温孵育5 min,3%BSA洗2 次,加入0.5%TritonX-100 室温孵育20 min,3%BSA 洗2 次,加入Click-iT 反应混合物(组分C、D、E)室温避光孵育30 min,PBS 洗2 次,DAPI避光染色5 min 后洗3 次。荧光显微镜下观察并采集图像。
1.2.8 免疫荧光染色法检测神经干细胞的凋亡水平 待1.2.6 结束后,按照1.2.2 的方法检测Cleaved-Caspase-3(1∶1 000)的水平来评估海马神经干细胞的凋亡情况。
1.2.9 Western blot 法检测神经干细胞抗氧化蛋白SOD 的表达水平 各组细胞用预冷的PBS 洗2 次,加入含有蛋白酶和磷酸酶抑制剂的细胞裂解液冰上裂解30 min,4 ℃离心12 000 r·min-1,10 min 后得到细胞总蛋白上清液,BCA 试剂盒检测浓度。适量蛋白样品用SDS-PAGE 凝胶电泳,湿转法转至PVDF 膜上,5%脱脂牛奶封闭1.5 h,加入一抗SOD(1∶1 000)、β-actin(1∶10 000),4 ℃孵育过夜;TBST 洗3 次,加入680RD 山羊抗兔IgG(1∶10 000)、800CW 山羊抗小鼠IgG(1∶10 000),室温避光孵育1 h,TBST 洗3 次。Odyssey CLx 双色红外激光成像仪扫描读膜,Image J 软件分析灰度值。
1.2.10 流式细胞术检测神经干细胞内ROS 水平 采用DCFH-DA 荧光探针法结合流式细胞术检测细胞内ROS 水平。各组细胞用胰酶消化得到细胞悬液,加入终浓度为10 μmol·L-1的DCFHDA 工作液,37 ℃避光孵育30 min,无血清培养基洗2 次,PBS 重悬为细胞悬液(细胞数至少3×104个),488 nm 激发,530 nm 测定,流式细胞仪检测神经干细胞内ROS 水平变化。
1.3 统计学分析
采用GraphPad Prism 7.04 软件进行统计学分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析。所有实验至少重复3 次。P≤0.05 为差异有统计学意义。
2 结果
2.1 hPMSCs-iNSCs 的形态学观察
将hPMSCs 接种于含有诱导培养基的培养皿中,24~48 h 后,培养皿中逐渐出现悬浮生长的细胞球。随着天数的增加,悬浮生长的细胞球的数量和直径均增加(P 均<0.05),见图1。

图1 hPMSCs-iNSCs 的形态学变化
2.2 hPMSCs-iNSCs 的生物学特性检测
免疫荧光染色结果显示,未诱导hPMSCs 仅有少量细胞为Nestin 或GAP43 阳性细胞,荧光信号较弱。诱导后hPMSCs-iNSCs,60%以上的细胞为Nestin 阳性细胞,90%以上的细胞为GAP43阳性细胞,并且荧光信号较强,见图2。

图2 hPMSCs 与hPMSCs-iNSCs 中Nestin 和GAP43 免疫荧光染色(↙:Nestin 与GAP43 阳性细胞;bar=20 μm)
2.3 原代培养的小鼠海马神经干细胞的生物学特性鉴定
免疫荧光染色法检测直径约为100 μm 的细胞球的神经干细胞标志蛋白Nestin、NF、GAP43和NSE 的表达。结果显示,几乎所有细胞均表达Nestin、NF、GAP43 和NSE 蛋白,见图3。

图3 小鼠海马神经干细胞的Nestin、NF、GAP43 和NSE 免疫荧光染色(↙:Nestin、NF、GAP43 和NSE 阳性细胞;bar=20 μm)
2.4 hPMSCs-iNSCs 条件培养基对OGD 损伤的海马神经干细胞形态的影响
贴壁培养的原代海马神经干细胞在OGD 24 h后,贴壁生长的细胞仅有30%左右,大多数细胞漂浮在培养液中;细胞形态改变,表现为细胞轮廓模糊,细胞胞体变圆,细胞突起缩短,贴壁能力差,见图4B。OGD 组和OGD+CM 组培养48 h后,两组细胞数量均有所增加,细胞形态与OGD前后的神经干细胞明显不同,主要表现为胞体变大,突起变长变粗。OGD 组与OGD+CM 组相比,细胞形态无明显差异,见图4C、D。

图4 不同培养条件下海马神经干细胞的形态
2.5 hPMSCs-iNSCs 条件培养基对OGD 损伤后海马神经干细胞增殖能力的影响
EdU 染色结果显示,与Normal 组比较,OGD 组海马神经干细胞EdU 阳性细胞数减少(P<0.05);与OGD 组比较,OGD+CM 组海马神经干细胞EdU 阳性细胞数增多(P<0.05),见图5。
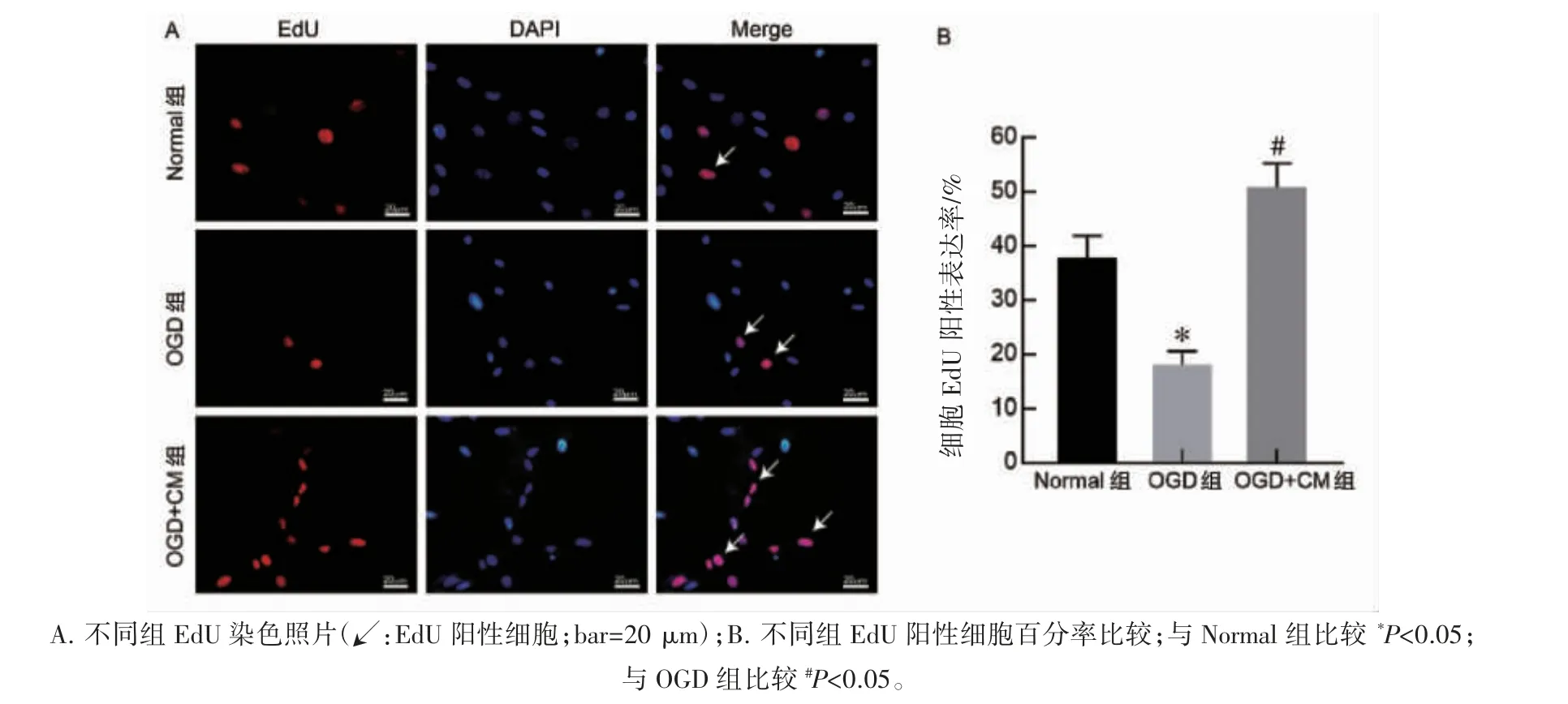
图5 不同培养条件下海马神经干细胞EdU 染色
2.6 hPMSCs-iNSCs 条件培养基对OGD 损伤后海马神经干细胞凋亡的影响
免疫荧光染色结果显示,与Normal 组比较,OGD 组海马神经干细胞Cleaved-Caspase-3 阳性细胞数增加(P<0.05);与OGD 组比较,OGD+CM组海马神经干细胞Cleaved-Caspase-3 阳性细胞数减少(P<0.05),见图6。

图6 不同培养条件下海马神经干细胞Cleaved-Caspase-3 免疫荧光染色
2.7 hPMSCs-iNSCs 条件培养基对OGD 损伤后海马神经干细胞抗氧化能力的影响
Western blot 结果显示,与Normal 组比较,OGD 组海马神经干细胞SOD 蛋白的表达下降(P<0.05);与OGD 组比较,OGD+CM 组海马神经干细胞SOD 蛋白的表达升高(P<0.05),见图7A。流式细胞术结果显示,与Normal 组比较,OGD 组海马神经干细胞内ROS 水平上升(P<0.05);与OGD 组比较,OGD+CM 组海马神经干细胞内ROS水平下降(P<0.05),见图7B。

图7 不同培养条件下海马神经干细胞抗氧化能力变化
3 讨论
海马区对缺血缺氧极为敏感[10],脑缺血损伤时,海马区神经干细胞可迁移至受损区域,替代受损神经细胞发挥功能[11],同时脑缺血会使海马区的神经干细胞功能受损[12-13]。有研究[14-15]发现,移植的神经干细胞可迁移至受损部位,促进内源性神经干细胞的增殖、分化及迁移,然而,神经干细胞的来源十分有限。
本研究将人胎盘来源的间充质干细胞诱导为hPMSCs-iNSCs,其表达神经干细胞的标志蛋白Nestin 和GAP43,表明hPMSCs-iNSCs 具有部分神经干细胞的生物学特性,可以作为外源性的神经干细胞的来源。本研究利用小鼠海马神经干细胞建立体外OGD 模型来模拟脑缺血的内环境[16-17],探讨hPMSCs-iNSCs 条件培养基对OGD损伤的海马神经干细胞的保护作用。EdU 染色和Cleaved-Caspase-3 免疫荧光染色结果表明,OGD 后海马神经干细胞的增殖能力下降,且Cleaved-Caspase-3 阳性细胞数增加;用hPMSCsiNSCs 条件培养基处理后,受损海马神经干细胞的增殖能力升高,Cleaved-Caspase-3 阳性细胞数下降。间充质干细胞可清除自由基,促进内源性抗氧化防御系统的修复,对受损神经细胞起到保护作用[18-19]。脑缺血后神经细胞内的活性氧(reactive oxygen species,ROS)水平上升[20],ROS 的过度产生破坏细胞的结构与功能[21-22]。为了进一步探讨hPMSCs-iNSCs 条件培养基对OGD 损伤的海马神经干细胞的保护机制,检测细胞内ROS水平变化和抗氧化蛋白SOD 的表达,评价hPMSCs-iNSCs 条件培养基的治疗效果。Western blot和流式细胞术结果表明,hPMSCs-iNSCs 条件培养基不仅可以清除OGD 损伤的海马神经干细胞过度产生的ROS,还可以修复OGD 损伤后的内源性抗氧化系统中抗氧化蛋白SOD 的表达。hPMSCs-iNSCs 条件培养基可能通过其抗氧化物质成分对受损的海马神经干细胞发挥保护作用。在后续的研究中我们将检测hPMSCs-iNSCs条件培养基中的抗氧化物质成分,进一步明晰hPMSCs-iNSCs 条件培养基对OGD 损伤的海马神经干细胞的保护作用。
综上所述,本研究利用hPMSCs 诱导的细胞具有神经干细胞的特性,采用hPMSCs-iNSCs 条件培养基处理OGD 损伤的海马神经干细胞,能够使受损神经干细胞的增殖能力和抗氧化能力升高,进而降低神经干细胞的凋亡,促进神经干细胞的修复。本研究结果为临床利用神经干细胞移植治疗缺血性脑卒中提供了理论依据。
