胰腺胃肠间质瘤3例临床分析并文献复习
2022-06-01韦猛白涛陈洁王小波符洪源莫运海黎乐群吴飞翔
韦猛 白涛 陈洁 王小波 符洪源 莫运海 黎乐群 吴飞翔
广西医科大学附属肿瘤医院肝胆外科,区域性高发肿瘤早期防治研究教育部重点实验室,南宁 530021
胃肠间质瘤(gastrointestinal stromal tumors, GISTs)起源于胃肠道肌间神经丛的Cajal间质细胞(interstitial cells of Cajal, ICCs)或向ICCs分化的多能干细胞,占消化道肿瘤的1%~4%,胃部为好发部位,占所有GISTs的60%~70%[1]。发生在消化道外的胰腺、肝脏、腹膜和腹膜后等部位的GISTs称为胃肠外间质瘤(extra-gastrointestinal stromal tumors,eGISTs),占GISTs的比例低于5%,而胰腺胃肠间质瘤(pancreatic gastrointestinal stromal tumors,pGISTs)占eGISTs的比例更低[2]。目前对pGISTs的认识仍然很少,需要进一步的总结和研究。本研究报道广西医科大学附属肿瘤医院收治的3例pGISTs,并系统回顾国内外相关文献,总结和分析该病的临床病理特征和预后,旨在帮助临床医师提高疾病诊断率并指导选择治疗方案。
资料与方法
一、一般资料
回顾性分析2015年8月至2019年10月间广西医科大学附属肿瘤医院病理科诊断明确的3例pGISTs。记录患者的一般情况,症状和体征,实验室检查指标,影像学检查结果,治疗方式(手术方式或姑息治疗方法),病理学资料,肿瘤大小,肿瘤部位,肿瘤囊实性,组织学类型,核分裂象,免疫组织化学染色指标CD117、CD34、Dog-1、SMA、S-100、Desmin,Ki-67增殖指数,基因突变状态,改良美国国立卫生研究院(modification National Institutes of Health,mNIH)风险度分级,术后辅助治疗手段,肿瘤复发时间以及患者死亡时间。本研究经广西医科大学附属肿瘤医院伦理委员会批准。
使用英文检索词“pancreas”,“extra-gastrointestinal tumor”,“gastrointestinal stromal tumors”,“stromal tumor”在PubMed检索2004年1月至2020年12月相关英文文献;使用中文检索词“胰腺间质瘤”、“间质瘤”、“胃肠间质瘤”、“胃肠外间质瘤”在中国知网、万方及维普数据库检索同期相关中文文献。检索到有较全面患者信息的国内外个案报道共 71例,合并本次报道的3例共74例。
二、方法
1.免疫组织化学检测:3例手术标本均使用10%甲醛溶液固定,石蜡包埋,组织连续切片,厚度4 μm,分别行苏木精-伊红染色和免疫组织化学染色。选择细胞生长最活跃区,连续50个高倍镜视野(high power field, HPF,×400)观察进行核分裂象计数。免疫组织化学染色采用 EnVision两步法,一抗为CD117、CD34、Dog-1、SMA、S-100、Desmin(福建迈新生物技术有限公司)。在Ki-67核阳性最强的区域计数500~2 000个肿瘤细胞,计算阳性细胞百分比作为Ki-67增殖指数,操作按说明书进行。
2.基因突变检测:准备8张厚度为4 μm的未染色切片,手工刮下切片上的肿瘤组织区域。用试剂盒QIAamp DNA Mini Kit(德国Qiagen公司)提取DNA并行PCR扩增。通过双向Sanger测序检测c-kit和PDGFRα突变,使用Chromas1.45版本(澳大利亚Technelysium公司)解读测序结果并与NCBI基因库c-kit和PDGFRα基因外显子序列进行比对分析。
3.风险度分级:使用mNIH风险度分级系统[3]进行评估,分为极低度、低度、中度和高度风险4级。
三、随访
术后利用电话进行随访,生存时间从患者手术日开始,以患者复发或死亡为终点事件,随访截止时间为2021年1月。
四、统计学处理
结 果
一、3例pGISTs的临床及病理学特征
病例1 男性,71岁。因“上腹部胀痛半月余”入院。无上腹部撞击伤等病史。增强CT示胰头部4.3 cm×3.7 cm实性占位,动脉期呈轻度增强(图1A)。三维可视化技术显示,肿瘤主要由胰十二指肠上前动脉和胰十二指肠下总动脉供血(图2B)。腹腔及腹膜后多发小淋巴结影。血、尿淀粉酶及胆红素、肿瘤标志物值均在正常范围内。超声胃镜下行针刺活检,病理提示:镜下见少量梭形细胞,无癌细胞,免疫组织化学染色示CD117、CD34和S100蛋白均阴性,无法确诊。征得患者意见择期行剖腹探查。术中见胰头部大小约4 cm×3.5 cm×3 cm的肿瘤,遂行胰十二指肠切除术(whipple)+区域淋巴结清扫术。术后病理提示,肿块无确切包膜,边界不规则,镜下见肿块由轻度异型细胞组成。苏木精-伊红染色可见核分裂象为6个/50HPF。其余免疫组织化学染色结果为CD117+++、Dog-1+、SMA+,而CD34-、Desmin-、S100-,Ki-67指数>10%。15个肿大的淋巴结均为反应性增生。基因检测示c-kit基因第11外显子存在非移位缺失突变。患者确诊为pGISTs,mNIH风险度分级评估为低风险。术后未行伊马替尼辅助治疗,随访14个月无复发或转移。
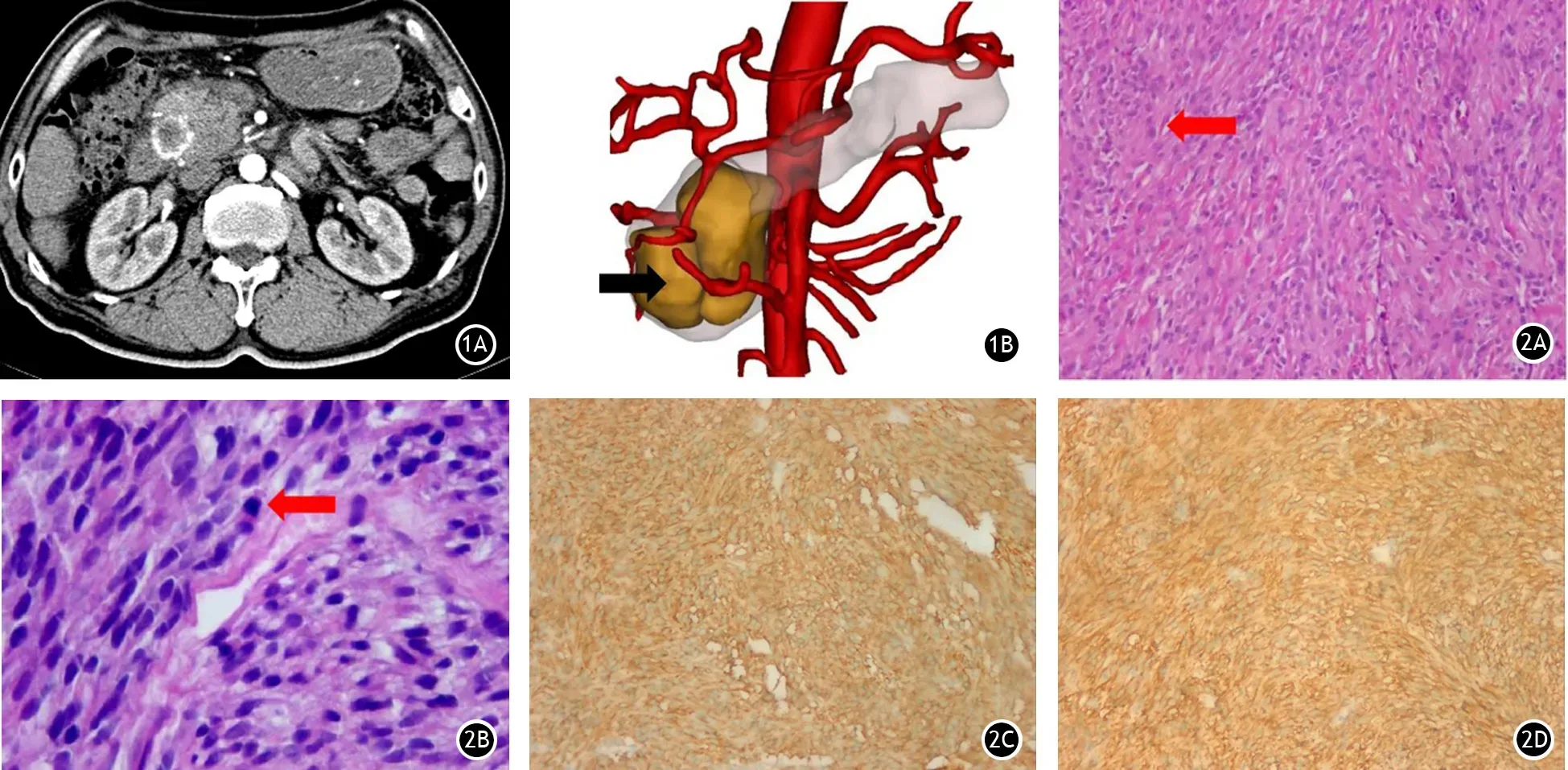
图1 病例1,CT提示胰头部实性占位,动脉期实性部分可见部分强化,肿瘤大小4.3 cm×3.7 cm(1A),三维可视化示胰头肿瘤(↑)和腹腔动脉的关系(1B) 图2 病例2,肿瘤细胞排列呈漩涡状或栅栏状排列,可见梭形细胞(2A,↑,苏木精-伊红染色 ×100),镜下见核分裂像(2B,↑,苏木精-伊红染色 ×400)。免疫组织化学染色示CD117(2C)和Dog-1(2D)呈弥漫强阳性(EnVision染色 ×100)
病例2 女性,73岁。因“体检发现胰尾部占位1月余,腹痛腹胀7 d”入院。CT增强扫描提示胰腺体尾部10.1 cm×4.8 cm×4.6 cm囊实性肿瘤,实质部分明显强化。CA125为38.09 U/ml,血红蛋白为90 g/L。择期行剖腹探查。术中见肿块位于胰体部,快速冷冻切片见梭形细胞(图2A),考虑为间质瘤,遂行胰体尾部切除术。术后病理提示:腺体尾部肿物,大小约为6.5 cm×4.0 cm×2.2 cm,可能来源于间叶组织。苏木精-伊红染色可见核分裂象<5个/50 HPF(图2B),其余免疫组织化学染色结果为CD117+(图2C)、Dog-1+(图2D)、CD34-、S-100-、Desmin-、SMA-,Ki-67指数>10%。诊断为pGISTs,mNIH分级评估为高风险。患者因经济原因,术后未能予伊马替尼辅助治疗。随访61个月患者无复发或转移。
病例3 女性,67岁。因“腰背部胀痛1月余,检查发现腹腔肿物20余天”入院。MRI提示腹膜后实性占位性病变,增强后肿块不均匀强化,考虑良性或低度恶性肿瘤(以副神经节瘤可能性大)。血、尿淀粉酶及胆红素、肿瘤标志物的值均在正常范围内。择期剖腹探查,术中见胰头部5.0 cm×6.3 cm×6.7 cm实性肿块,快速冷冻切片见梭形细胞,考虑为间质瘤。拟行胰十二指肠切除术,但患者及家属要求仅行胃空肠造口术,取肿物组织活检。术后病理切片未找到确切核分裂象。免疫组织化学染色显示CD117+++、Dog-1+++、SMA+,CD34-、S-100-,Ki-67指数约5%,诊断为低风险pGISTs。术后随访55个月,患者健在。
二、pGISTs的一般资料分析
本组3例加上文献报道的71例,总共纳入74例pGISTs。其中中国报道36例(48.6%),美国报道8例(10.8%),印度、意大利各4例(5.4%),巴西、土耳其、捷克共和国各3例(4.1%),朝鲜2例(2.7%),埃及、波兰、德国、俄罗斯、韩国、罗马尼亚、摩洛哥、日本、突尼斯、新加坡、英国各1例(1.3%)。
74例患者中男性36例,女性38例,年龄55(19~84)岁,其中17例(22.9%)无症状,41例(55.4%)有上腹痛、腹胀和不适等局部症状,16例(21.6%)出现体重减轻、虚弱和贫血等全身症状;71例患者记录了肿瘤部位,其中位于胰头部30例(42.3%)、胰头和钩突1例(1.4%)、钩突6例(8.5%)、胰体6例(8.5%)、胰体尾15例(21.1%)、胰尾13例(18.3%);72例患者记录了肿瘤的影像学长径,中位数为8 cm(2~35 cm),其中≤2 cm 2例(2.7%),2 cm<~≤5 cm 18例(25.0%),5 cm<~≤10 cm 25例(34.7%),>10 cm 27例(37.5%);63例患者记录了肿瘤的囊实性资料,其中实性33例(52.4%),囊性8例(12.7%),囊实性22例(34.9%);7例患者初次诊断时发现有转移灶,其中同时发生肝脏及腹膜转移2例(28.6%),肝脏转移2例(28.6%),肺、胃窦和大网膜转移各1例(14.3%);26例(35.1%)患者行胰十二指肠切除术,20例(27.1%)患者行胰体尾或胰尾部切除联合脾脏术,14例(18.9%)患者行局部切除术,14例(18.9%)未治疗或姑息手术治疗。手术切除率达81.1%。
三、pGISTs的病理学资料及基因突变情况
58例患者记录了肿瘤的组织学类型,其中48例(82.7%)为梭形,2例(3.4%)为上皮型,8例(13.7%)为混合型;59例患者记录了肿瘤组织核分裂象,其中33例(55.9%)<5个/50HPF,15例(25.4%)5<~≤10个/50HPF,11例(18.7%)>10个/50HPF。26例记录了Ki-67指数,其中17例(65.4%)≤10%,9例(34.6%)>10%。免疫组织化学染色:CD117+97.3%(71/73),Dog-1+81.5%(22/27),CD34+71.0%(49/69),SMA+39.2%(20/51),S-100+11.5%(6/52)。根据mNIH风险分类,2.8%(2/69)的患者为极低风险,17.3%(7/69)患者为低风险,79.7%(55/69)的患者为高风险,无中风险患者。
14例患者行基因突变检测,3例(21.4%)为野生型,11例(78.6%)发生了基因突变,其中6例(54.5%)携带c-kit第11外显子突变,4例(36.4%)携带c-kit第9外显子突变,1例(9.1%)携带c-kit第18外显子DNA多态性突变。11例突变的患者中,7例(63.6%)为缺失突变,2例(18.2%)为重复突变,1例(9.1%)为多态性变异,1例未记录突变类型(表1)。
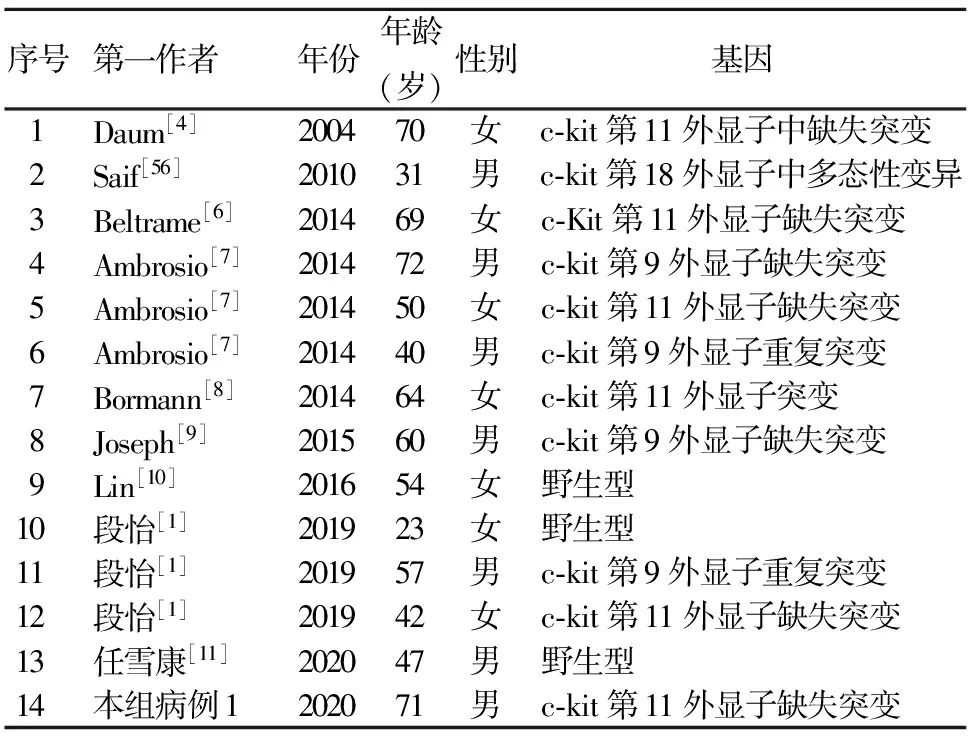
表1 14例胰腺胃肠间质瘤患者的基因突变特征
四、pGISTs肿瘤囊实性特征与临床病理参数的相关性
对有完整资料的pGISTs患者进行肿瘤囊实性特征和临床病理参数相关性分析发现,肿瘤的囊实性特征与肿瘤部位、肿瘤长径和核分裂象有显著相关性,而与患者年龄、性别、肿瘤组织学类型、Ki-67指数和mNIH分类无显著相关性(表2)。胰头部的肿瘤多为实性,长径>10 cm的肿瘤多为囊实性,肿瘤核分裂象≤5个/50 HPF多为实性。
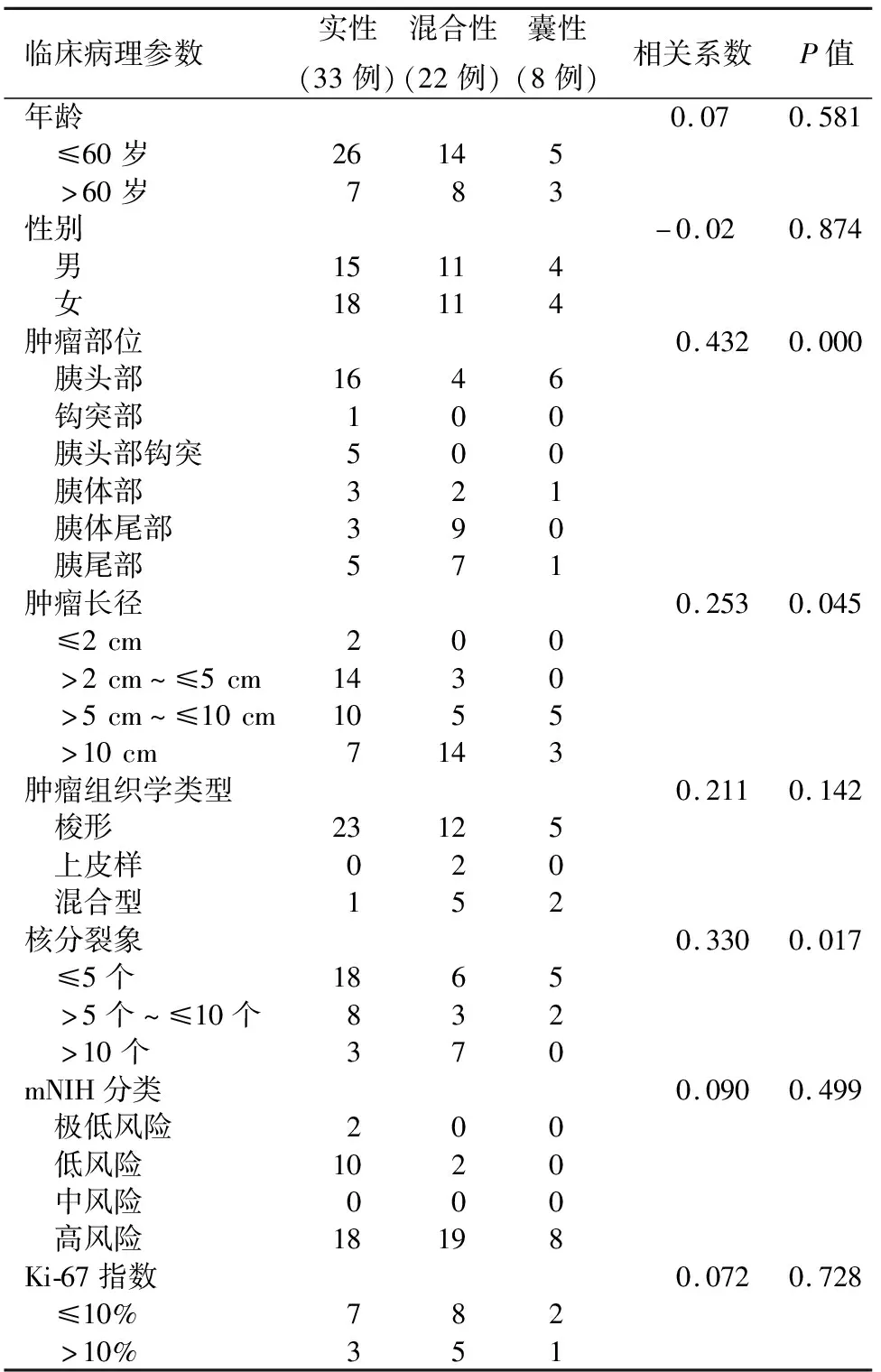
表2 63例胰腺胃肠间质瘤患者肿瘤囊实性特征与临床病理参数的相关性(例)
五、患者生存时间及预后分析
60例患者有生存率数据,其中51例患者接受了根治性手术治疗,其余9例接受非根治性治疗。随访时间为5 d~83个月。60例患者的5年总生存率为82.8%(图3A);51例根治术后患者5年总生存率为88.8%,5年无病生存率为60.3%(图3B);接受姑息治疗或未治疗患者1年总生存率为51.9%,姑息治疗1年病死率为33.3%(3/9),死因为肿瘤进展。
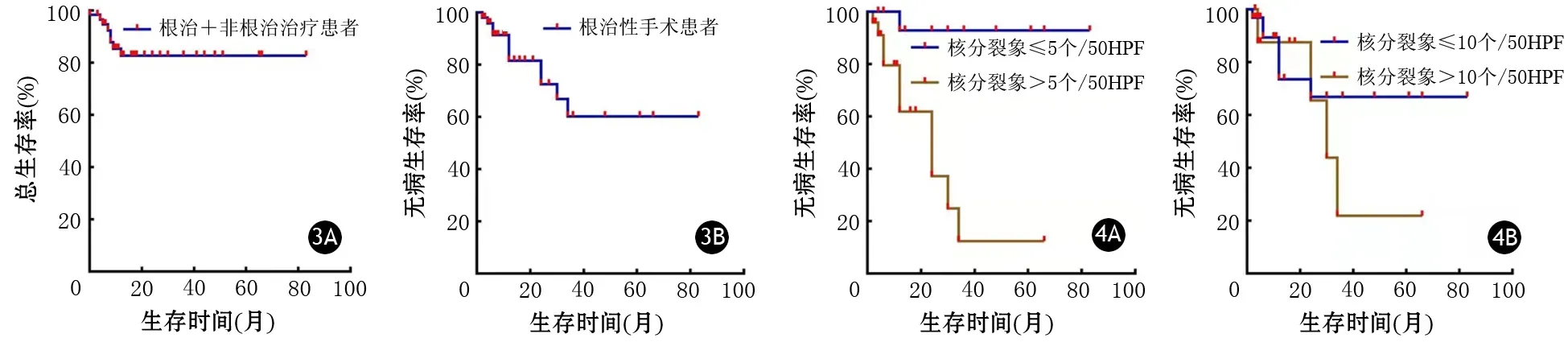
图3 60例行根治+非根治性治疗的胰腺胃肠间质瘤患者5年总生存曲线(3A)及51例行根治性手术治疗患者的5年无病生存曲线(3B)图4 胰腺胃肠间质瘤核分裂象≤5个/50HPF、>5/50HPF(P=0.0003,4A),≤10个/50HPF、>10个/50HPF(P=0.3075,4B)患者的术后无病生存率比较
选取41例资料完整的患者进行影响生存期的单因素和多因素分析。单因素Cox回归分析结果显示,核分裂象>5个/50HPF(P=0.008,表3)、男性(P=0.083)和CD34阴性(P=0.055)与pGISTs术后早期复发有关,而mNIH的危险分级、肿瘤组织学类型、核分裂象(≤10个或>10个/50HPF)、肿瘤囊实性及服用伊马替尼等与预后无关。多因素Cox回归分析表明,仅核分裂象>5个/50HPF为影响pGISTs患者预后的独立危险因素(P=0.023,表4)。
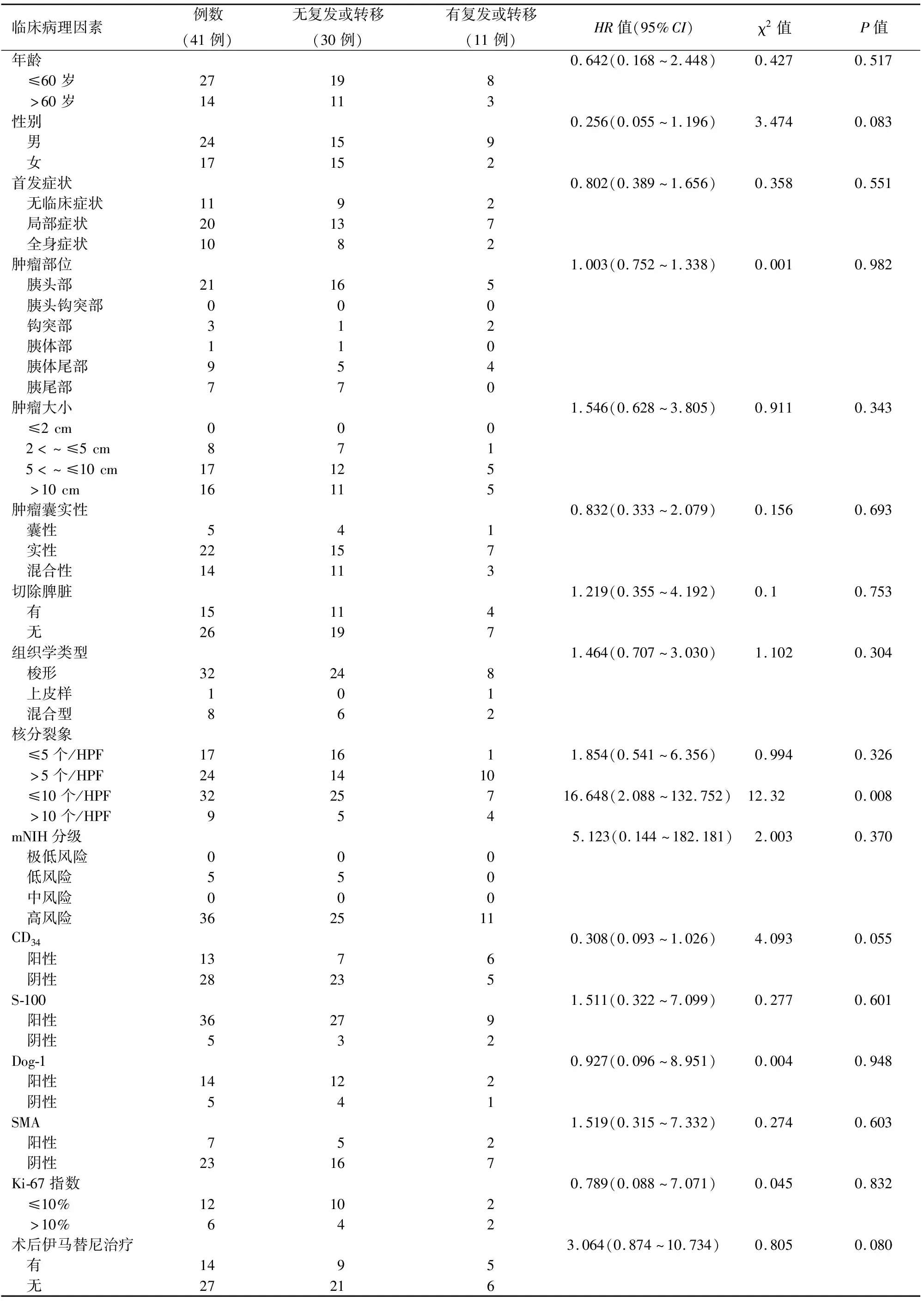
表3 41例胰腺胃肠间质瘤患者影响预后的单因素分析
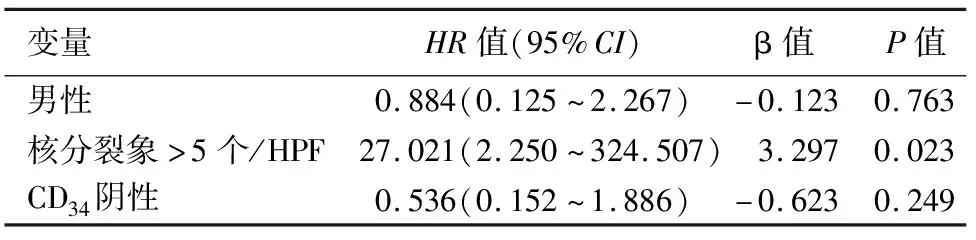
表4 41例胰腺胃肠间质瘤患者影响预后的多因素分析
讨 论
pGISTs是一种罕见的恶性肿瘤,从2004年Yamaura首次报道该种病例[12],截止至2020年,笔者检索到的国内外文献共71例,结合笔者所在医院报道的3例患者进行了文献回顾,显示几乎一半的病例来自中国,这可能与中国庞大的人口基数有关。男女间发病率无明显差异,发病年龄为55(19~84)岁,与来自胃和小肠的GISTs相比[13][65(55~74)岁],pGISTs的发病年龄更小,最早发病年龄仅为19岁。
pGISTs无典型的临床症状,部分患者体检时偶然发现,部分患者以腹痛、腹胀和腹部不适等为首发症状,一些患者伴有体重下降、乏力和贫血等全身症状。笔者总结发现,几乎所有位于胰头的肿瘤患者都未出现黄疸症状,包括最大径为19 cm的肿瘤[7],这与胰腺癌有较大区别。可能的原因有:(1)肿瘤生长的位置与胰腺癌不同;(2)肿瘤生长非常缓慢,暂未出现黄疸症状;(3)部分肿瘤主要由囊性成分组成,无法完全阻断胆管。
pGISTs缺乏典型的影像学表现。影像学检查手段主要包括CT、MRI和超声检查。肿瘤可发生在胰腺的任何部位,最好发于胰头部,其次是胰体尾部和胰尾部。肿瘤最大径为8(2~35)cm,可分为实性、囊性或囊实性。相关分析表明,发生在胰头的多为实性肿瘤,最大径>10 cm的肿瘤多为囊实性。肿瘤在动脉期表现出轻或中度强化。此外,少部分患者在诊断时已经有远处转移,包括肝脏、腹膜、网膜、肺和腹膜后转移,最常见的转移部位是肝脏和腹膜。pGISTs与胰腺癌相区别的两个影像学特征是病灶血供丰富和无局部淋巴结转移[14],但根据这两个特征来确诊还远远不够。在影像学上,pGIST还需与胰腺实性假乳头状瘤、胰腺囊腺瘤、囊腺癌和肉瘤样癌等鉴别。同样,血清肿瘤标志物对pGISTs没有特异性的诊断意义。
pGISTs确诊需要依赖组织病理学和免疫组织化学结果,必要时还需要进行基因检测辅助诊断。从组织学类型来看,pGISTs主要分为梭形、上皮样和混合型3种,是诊断的直接证据之一[15]。根据pGISTs的免疫表型特征,其主要辅助诊断的标志物为c-kit(CD117)、CD34以及Dog-1,其他指标如vimentin、SMA、S-100等蛋白表达率低或特异性不高,对诊断的帮助有限[16]。CD117是c-kit基因编码的酪氨酸蛋白激酶蛋白,c-kit突变可以导致该蛋白持续激活,从而使细胞增殖失控。大约95%的GISTs表达CD117,是GISTs的高度灵敏和特异性标志物,因此CD117阳性可以辅助确诊[17]。此外,血小板生长因子受体表达的CD34也是GISTs的重要标志物,在成纤维细胞和内皮细胞肿瘤中表达,但其灵敏性与特异性较CD117低[18]。对于pGISTs而言,典型的组织学类型联合CD117+及CD34+即可确诊,而对于拥有典型组织学表现但CD117-的病例,则需要进一步评估Dog-1的表达。Dog-1为钙离子依赖的受体激活氯离子通道蛋白,是另一种在GISTs中特异性高表达的蛋白,有报道称其表达率高于CD117分子[19],但本研究Dog-1的阳性率仅为81.5%,远远低于CD117的97.3%,此为本研究的样本量限制还是GISTs和pGISTs本身存在的差异,有待进一步探究。当分子免疫标志物为CD117-、Dog-1+或CD117-、Dog-1-时,则应进行基因检测以明确pGISTs诊断[20]。
研究报道,GISTs主要的基因突变类型为[21]c-kit基因突变(75%~85%)、PDGFRα基因突变(5%~10%)及野生型(15%~20%)。c-kit位点突变频率从高到底依次为第11、9、13及17外显子,突变形式包括小片段插入缺失、点突变、重复突变等。最常见的PDGFRα突变频率由高到低依次为第18、12、14外显子,其中80%以上为18号外显子缬氨酸到天冬氨酸的错义突变,这也是GISTs伊马替尼耐药的重要机制[22]。有文献报道,存在c-kit和PDGFRα突变的患者对酪氨酸激酶抑制剂治疗更敏感,他们更有可能从伊马替尼靶向治疗中获益[23],因此,基因检测是指导使用伊马替尼的主要证据之一。本研究14例pGISTs患者进行了基因检测,其中11例存在基因突变(78.5%),均为c-kit基因,以第11外显子的突变率最高,其次是第9外显子,以缺失型突变为主,与文献报道的GISTs相似。
GISTs的风险分级依赖病理结果。Joensuu等[3]使用肿瘤大小和有丝分裂数来定义mNIH风险分级系统,用以评估GISTs的侵袭性和转移风险,这对中、高危GISTs的患者十分重要,借助该系统判断是否需要服用伊马替尼进行术后辅助治疗,可降低患者复发、转移和死亡的风险[24]。本研究单因素和多因素Cox分析结果表明,核分裂象>5个/50HPF是pGISTs术后复发的独立危险因素,与一些研究[25]报道的核分裂象>10个/50HPF不同,这需要更大量的样本进一步分析和验证。
EUS-FNA对胰腺实体肿瘤的诊断准确率高达75%~96%[26],被认为是pGISTs最佳的术前诊断方法。然而EUS-FNA有两个缺点,一是成功取得肿瘤组织的概率较低,二是获得的肿瘤组织量往往过少,不足以进行病理检测,因此,大多数pGISTs患者在手术后才得以确诊,这可能也解释了没有术前新辅助治疗病例报道的原因。
手术是pGISTs的主要治疗方法[4]。肿瘤的大小和位置及其与周围器官的关系是决定手术方式的关键因素。位于胰头的肿瘤主要手术方式是胰十二指肠切除术,对于胰体尾部和尾部的肿瘤常行远端胰腺切除,必要时联合脾切除术,对于边界清晰的小肿瘤一般行单纯的肿瘤切除术。如果肿瘤已发生转移,可考虑联合脏器切除。一般来说,pGISTs发生区域淋巴结转移的情况很少,因此不推荐常规行区域淋巴结清扫。
pGISTs其他重要的治疗手段包括伊马替尼和碘-125放射治疗。伊马替尼是c-kit酪氨酸激酶活性的抑制剂,在GISTs治疗中的有效性已得到公认[27]。但在pGISTs中,笔者对使用和不使用伊马替尼作为术后辅助治疗的mNIH高危患者进行预后分析,发现两组无疾病生存期差异无统计学意义(P=0.08),其有效性也有待更多病例确认。碘-125粒子植入是晚期胰腺癌一种安全的治疗手段[28],但有文献报道GISTs患者对放疗的灵敏性不高[29]。既往文献报道病例中,有2例肝转移患者接受碘-125粒子植入治疗,另1例肝脏和腹膜后转移的患者接受碘-125联合伊马替尼治疗,随访时间分别为6、13、30个月,至随访期结束,3例患者均存活。因缺乏大数据对照研究,碘-125粒子植入治疗在晚期pGISTs中是否起着重要作用有待进一步探讨。
本研究结果显示,pGISTs患者5年总生存率为82.8%,与胃(82.2%)和小肠(83.3%)GISTs患者相似[13];接受根治性手术的患者术后5年总生存率为88.8%,优于国内GISTs报道的77.9%,但术后5年无疾病生存率仅为60.3%,低于文献报道[30]。大多数pGIST复发发生在切除术后24个月内,肝脏和腹膜是最常见的复发部位,复发模式与GISTs相似[31]。不愿或者不能接受根治性手术的患者预后较差,1年总生存率仅为51.9%。但本研究报道的病例3较为特殊,该患者仅接受了消化道改道手术,随访提示患者存活55个月并且状态良好,是目前报道过的未接受根治性和辅助治疗而存活时间最长的一位,或与该患者为低风险pGISTs及个体差异有关。
综上所述,pGISTs好发于胰头,大多数肿瘤体积较大,mNIH分级呈高风险。肿瘤位置、肿瘤大小和核分裂象与其影像特征有相关性。手术切除率较高,核分裂象>5个/50HPF是术后复发的独立危险因素。该病的基因突变率较高,最常见为c-kit基因的第11外显子突变,缺失突变是最常见突变类型。对于该疾病的诊断、治疗和预后,仍然需要更多的病例分析研究证实。
利益冲突所有作者声明无利益冲突
作者贡献声明韦猛、白涛:实验操作、论文撰写;陈洁、王小波、符洪源、莫运海:随访、数据收集整理、实验操作、统计学分析;黎乐群、吴飞翔:研究指导、论文修改、经费支持
