妊娠合并肺动脉高压患者围术期发生肺动脉高压危象的危险因素及麻醉管理分析
2022-06-01胡雅姣李淑英韩坤
胡雅姣,李淑英,韩坤
肺动脉高压(pulmonary arterial hypertension,PAH)是产科最危重的妊娠合并心脏病类型,一般采取剖宫产术终止妊娠[1]。PAH患者的围术期管理对于麻醉医生是巨大的挑战,该类患者最危险的并发症是肺动脉高压危象(pulmonary hypertension crisis,PHC),其死亡率极高,一旦确诊需要立即进行抢救。因此围术期早期识别高危人群、掌握其临床特点进行及时有效的抢救对提高PHC患者的生存非常重要。目前临床上尚没有准确预测PHC发生的方法,且妊娠合并PAH患者发生PHC的比例较低,相关研究报道较少。故本研究拟通过回顾性分析81例妊娠合并PAH患者的一般资料、发生PHC患者的临床表现、麻醉管理方式及产妇结局,分析围术期发生PHC的危险因素和麻醉管理要点,为该类患者制定最优化的围术期麻醉管理方案提供依据。
1 资料与方法
1.1 一般资料
研究对象:回顾性分析2015年1月至2020年12月在四川大学华西第二医院行剖宫产的妊娠合并PAH患者的临床资料,根据其围术期是否发生PHC分为PHC组和非PHC组。查阅患者的病程记录、辅助检查结果和麻醉记录,分析患者的一般资料和围术期临床资料。
纳入标准:符合2015年8月欧洲心脏病学会/欧洲呼吸病学会联合发布的《肺动脉高压诊断与治疗指南》中有关PAH的定义标准,超声心动图诊断静息状态下患者肺动脉收缩压(pulmonary arterial systolic pressure,PASP)≥36 mmHg[2]。围术期发生一次或多次PHC危象,诊断符合2016年中华医学会妇产科学分会产科学组在《妊娠合并心脏病的诊治专家共识》中对PHC的定义,为在PAH的基础上发生肺血管痉挛性收缩、肺循环阻力升高、右心排出受阻,导致突发性肺动脉压增高和心排出量降低的临床危象状态[1]。
排除标准:PAH诊断不明确者;符合妊娠合并PAH诊断,经阴道分娩患者;病历资料不完善患者。
1.2 研究方法
1.2.1 临床资料分级标准 根据中华医学会心血管病学分会肺血管病学组/中华心血管病杂志编辑委员会发布的《中国肺高血压诊断和治疗指南2018》中的分类标准,依据超声心动图测定的PASP将PAH分为轻度:PASP=36~50 mmHg,中度:PASP=51~69 mmHg,重度:PASP≥70 mmHg[3]。心功能分级采用纽约心脏病协会(NYHA)的分级标准,依据患者对一般体力活动的耐受情况将心功能分为4级,Ⅰ级:一般体力活动不受限制;Ⅱ级:一般体力活动略受限制;Ⅲ级:一般体力活动显著受限;Ⅳ级:做任何轻微活动时均感不适,休息时仍有心慌、气急等心衰表现[4]。
1.2.2 临床资料收集方法 在电子病案系统以关键词“出院诊断=肺动脉高压”和“科室=产科”查询所有符合患者的住院号,根据住院号进入患者电子病历,查阅患者病程记录、辅助检查结果和麻醉记录单。采用研究者自制的患者信息收集表,由双人查对并将临床病历资料录入电脑。一般资料包括:患者年龄、身高、体质量、术前生命体征、心功能分级、孕周、孕次、术前住院日以及PAH的病因、PAH分级、麻醉方式。围术期发生PHC的临床资料包括:患者年龄、孕周、心脏病类型、麻醉方式以及PHC发生的时间、临床表现、处理方法及产妇的转归等。
1.3 统计学分析

2 结果
2.1 两组患者一般资料比较
共纳入妊娠合并PAH患者81例,其中PHC组11例,非PHC组70例。两组患者年龄、身高、体质量、术前收缩压(SBP)、术前舒张压(DBP)、术前心率(HR)、孕周、PAH病因以及麻醉方式比较,差异均无统计学意义(P>0.05)。与非PHC组相比,PHC组患者的术前SpO2更低、心功能分级更高、怀孕次数更多、肺动脉压分级为重度者比例更多,差异有统计学意义(P<0.05)。详见表1。
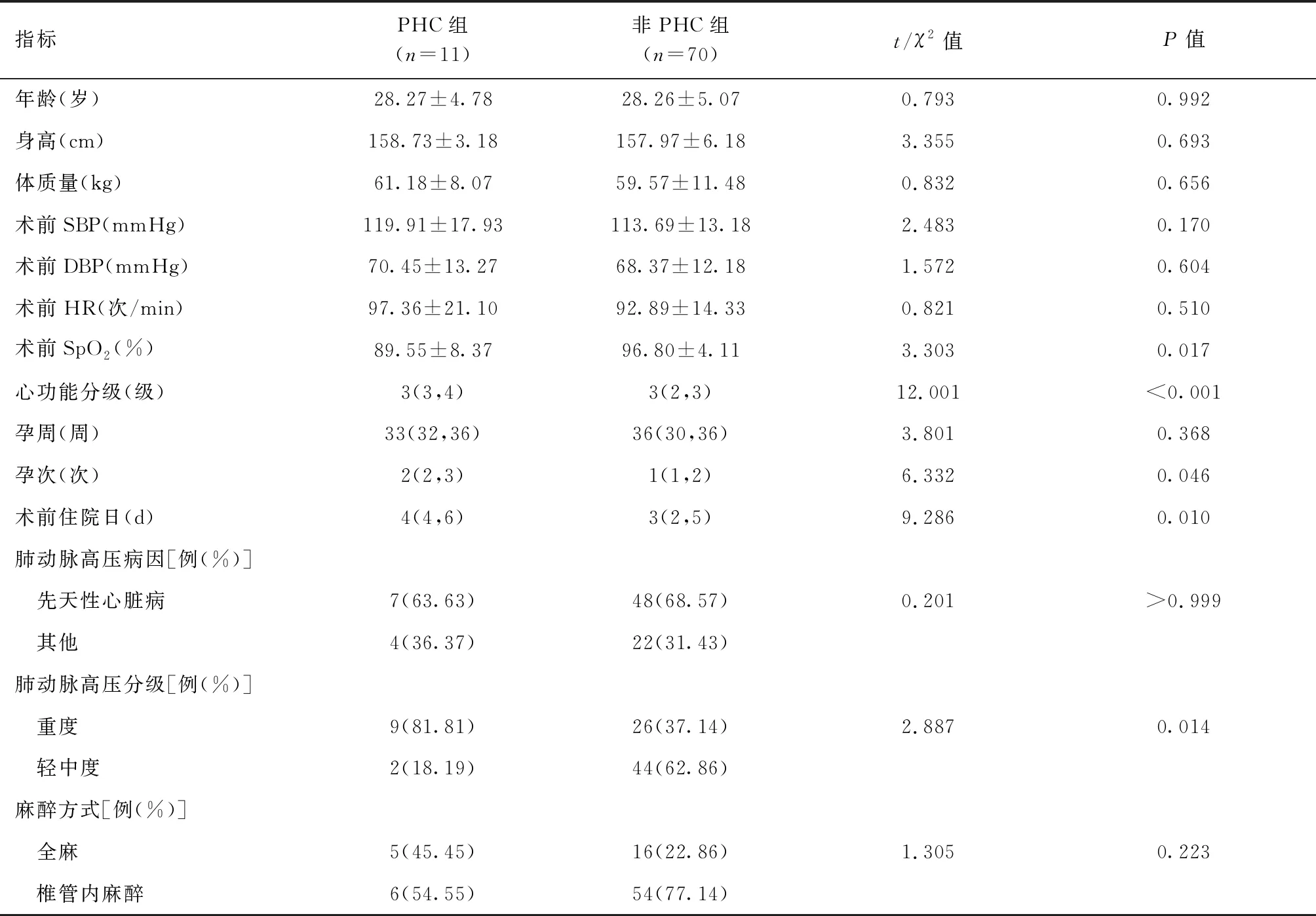
表1 两组患者一般资料比较
2.2 多因素回归分析
将两组患者一般资料有统计学差异的变量进行多因素Logistic回归分析,结果显示患者术前SpO2更低、心功能分级更高是患者发生PHC的独立危险因素。详见表2。
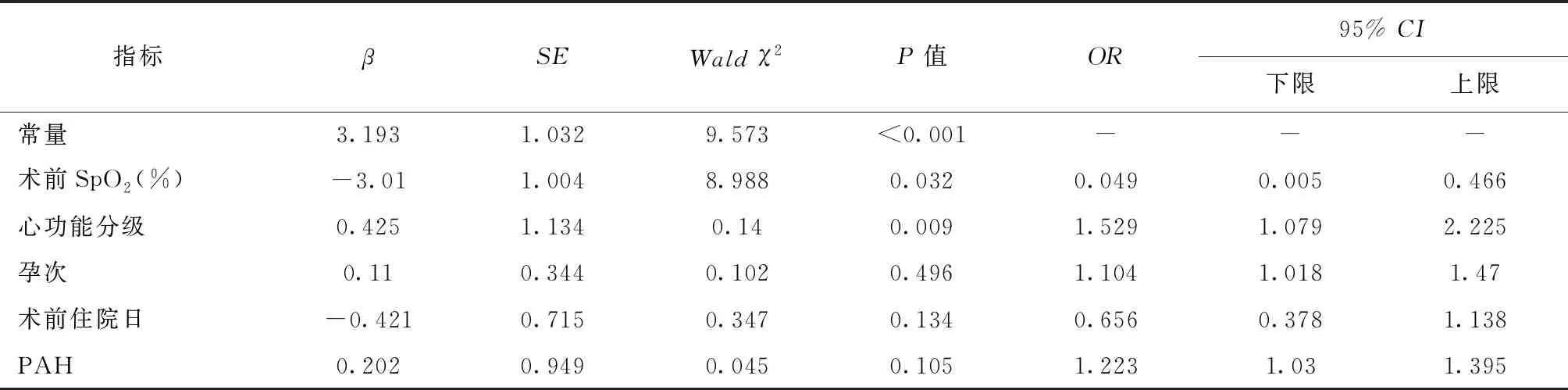
表2 围术期发生PHC危险因素的多因素Logistic回归分析
2.3 发生PHC的 11例患者相关资料
11例发生PHC的患者中行全麻患者5例,行椎管内麻醉患者6例。围术期发生PHC的时间点主要集中在麻醉起效后、取胎后、全麻拔管后及术后2 d内,其中6例都发生在取胎后。发生PHC的主要表现为SpO2下降、血压降低、心率增快或减慢、严重者发展为恶性心律失常、急性右心衰、肺水肿甚至死亡。其中1例全麻患者分别在取胎后和术后第2天发生两次PHC,表现均为SpO2降低。该例患者在手术结束后即拔除气管导管,术后两天发生心衰,重新行气管插管进行有创呼吸治疗,最终抢救无效死亡。主要治疗措施包括强心、利尿、抗心律失常、升血压、升心率、呼吸支持治疗、扩张肺动脉降低肺动脉压治疗等。详见下页表3。

表3 发生PHC的11例患者一般情况、临床表现和转归等相关资料
3 讨论
PAH患者围手术期最严重的并发症是PHC,围术期管理的目标是要尽量避免PHC的发生和进行积极有效的抢救。在我们的研究中,妊娠合并PAH患者围术期PHC的发生率约为13.58%(11/81),发生PHC的患者中死亡率约为18.2%(2/11)。妊娠合并PAH患者随着肺血管阻力逐渐增大、右心后负荷不断加重,使已受损的心、肺功能和血流动力学状态不断恶化,围手术期任何导致患者肺血管阻力短时间内急剧升高的因素都能诱发PHC,从而造成肺动脉压力接近或超过主动脉压力,最终发展为右心功能急性衰竭并危及生命[5]。
本研究发现,相对于非PHC组患者,PHC组患者术前SpO2更低、心功能分级更高、怀孕次数更多、肺动脉压分级为重度者比例更大。有研究报道既往妊娠史和PAH严重程度均与孕产妇不良结局相关[6],这也与我们的研究结果一致。部分患者在第2、3次妊娠时才被诊断为PAH,这与PAH的疾病进程有关。妊娠期的某些生理变化与PAH的发病之间存在着一定联系,如循环血量增加、高凝状态、循环中血管源性生长因子表达增加等,多重因素致使血管内皮细胞功能紊乱加剧血管收缩,大量细胞增殖促使肺血管重塑血管重建,导致肺动脉狭窄甚至闭塞,多次妊娠会加剧这些变化。同时,随着肺动脉压力的增高,肺血管阻力也不断增高,过重的后负荷使得右心室肥大和扩张,最终导致右心衰竭和造成孕产妇不良的妊娠结局。多因素分析显示患者术前SpO2低和心功能分级高是患者发生PHC的独立危险因素,该结论与张春雷等[7]在北京安贞医院进行的回顾性分析结果部分一致。心功能分级反映患者心脏病的严重程度,术前心功能分级越高,胸闷气紧、心累、气促甚至咳血等症状越严重,患者的右心状态越差,更容易失代偿从而诱发PHC。术前SpO2与右心功能和肺动脉压力相关,合并先天性心脏病等存在右向左分流的患者,肺动脉阻力增高导致右向左分流增加,左心氧合血被右心的未氧合静脉血混合稀释,SpO2下降;原发性PAH等没有右向左分流的患者,右心排血量下降,肺血流减少,肺通气/血流比例失衡也会表现为SpO2下降[8]。因此,对于术前心功能分级较高、术前SpO2较差的患者需要高度警惕围术期发生PHC的可能。
PHC组的11例患者,围术期发生PHC的时间点主要集中在麻醉起效后、取胎后、全麻拔管后及术后48 h内。椎管内麻醉时,超过胸6(T6)平面以上的交感神经阻滞可引起明显的低血压,从而减少右心灌注和降低心脏功能。此外,对呼吸功能抑制可能导致缺氧和高碳酸血症,进一步恶化PAH[9]。全身麻醉诱导时,麻醉药物的外周血管扩张及心肌抑制作用都会导致右向左分流量增加、缺氧加重,从而诱发PHC。胎儿取出后由于子宫收缩导致回心血量增加,使心脏前负荷短时间内急剧加重,同时缩宫素类药物的使用会引起肺动脉痉挛性收缩,减少右冠状动脉血流量,加重肺循环阻力并诱发右心衰竭[10]。同样要注意的是,全身麻醉的患者术毕立即拔除气管导管,患者也会面临组织低氧、呼吸衰竭等风险,缺氧、高碳酸血症、疼痛刺激、交感兴奋等因素极易诱发PHC[11]。分娩后数小时至数天也是产妇死亡的高风险期,因子宫及血管外的液体均回流至循环系统,患者的循环血量增加,这是一个血容量和心输出量快速变化的时期,容易诱发PHC并伴随不可逆的心衰或恶性心律失常[12]。
PHC的临床症状由肺动脉压升高、右心功能失代偿的程度而表现不同。轻度患者稍感胸闷憋气,典型表现包括心率增快、血压降低等心衰前期心输出量减低。重度患者常合并恶性心律失常、休克、急性右心衰竭、继发急性左心衰竭、全心衰竭,甚至心跳骤停。伴有左向右心内分流的先天性心脏病患者最多见的是血压下降伴随SpO2下降,原发性PAH患者由于没有右心到左心的分流通道,肺血管阻力急剧升高,右心射血阻力加大,表现为肺动脉压和体循环压力急剧降低,患者意识丧失甚至心跳骤停[13]。
对于妊娠合并PAH患者,围术期PHC的预防与管理重在改善右心功能,治疗以扩张肺血管床、降低肺动脉压为主要目标[14]。术前常规吸氧以改善氧合,24 h持续低流量吸氧可减轻患者肺血管阻力,减少右向左分流。早期使用前列腺素类药物和西地那非比仅在分娩和产后期间使用产妇结局更好,建议提前3个月开始使用[15]。有胸闷气紧、心累气促咳血或B型尿钠肽增高、双下肢水肿、胸腔积液等心衰症状的患者要高度重视,应予以强心、利尿等措施来纠正心力衰竭并积极对症治疗、改善心功能[16]。术中维持外周血管阻力防止血压下降、适当强心以应对胎儿胎盘娩出后回心血量的增加、防止肺血管阻力升高是术中管理的三个核心[17]。对于没有椎管内麻醉禁忌证的患者尽量选择椎管内麻醉,常用的方法是在给予去甲肾上腺素0.05~0.1 ug/kg·min持续泵注的同时进行椎管内麻醉,缓慢给予局部麻醉药物,滴定到所需的感觉阻滞水平达到T6至T8平面,维持外周血管压力不低于肺动脉压力,同时常规吸氧改善氧合,监测患者出入量、防止循环超负荷[18]。对于凝血功能异常、正在行抗凝治疗的患者,心功能情况明显不稳定、术中出现急性心衰可能性大的患者可采用全身麻醉[19]。手术时需要控制好胎儿及胎盘娩出的时间和速度,防止回心血量骤增使病情恶化,胎儿娩出后适当给予速尿减轻循环负荷。谨慎使用缩宫素,尽量使用最低有效剂量,采用持续的静脉滴注或泵注的方式更利于发挥其效果而减少其不良反应,禁止使用缩宫素及麦角新碱等收缩子宫药物[20]。全麻患者术毕建议带管回ICU进行1~2 d的有创辅助呼吸治疗,适当过度通气引起低碳酸血症可降低肺动脉平均压及肺血管阻力,从而减轻右心室负荷。产后持续静脉滴定曲前列环素联合口服西地那非,生命体征平稳后才可转回普通病房[21]。
发生PHC后,应根据临床表现和具体原因进行针对性治疗。包括停止不必要的手术操作,给予患者面罩吸入纯氧,必要时行气管插管进行有创呼吸治疗。血压降低者给予升压药物提高血压,去甲肾上腺素单次静推可同时提升体循环和肺循环压力,避免使用去氧肾上腺素,因其较去甲肾上腺素更易增加肺血管阻力而导致体肺循环压力倒置,加重PHC。心率过慢者可以给予阿托品,心率过快伴发心律失常、心力衰竭者可以给予西地兰、利多卡因等,适当补钾维持血钾水平。可使用米力农增强右心功能、前列地尔扩张肺动脉,注意这两种药物都有降低体循环压力的作用,使用的同时应予泵注去甲肾上腺素以维持体循环压力。一旦发生心源性休克心跳骤停,复苏成功的概率较低,应及时行体外膜肺氧合ECMO治疗。选择治疗心源性休克的经动脉VA-ECMO模式可以降低右心室前负荷,改善右心衰,迅速降低肺动脉压力达到挽救生命的目的[22]。
综上所述,在妊娠合并PAH患者的围术期管理中,麻醉医生应注意识别高危人群,尽量避免发生PHC,积极做好PHC高危患者的围术期管理和抢救以免给患者带来不良结局。
