微塑料对外生菌根真菌生长和抗氧化系统的影响
2022-06-01李玉婷李骄杨许晓风
李玉婷,李 莎,曹 杰,李骄杨,张 亮,*,许晓风,2
(1.南京师范大学泰州学院 化学与生物工程学院,江苏 泰州 225300; 2.南京师范大学 生命科学学院,江苏 南京 210023)
2004年,研究人员首次在海洋水体和沉积物中发现塑料碎片,并提出微塑料的概念。自此,微塑料作为一种新型持久性环境污染物逐渐成为国内外的研究热点之一。目前,学术界一般把粒径在5 mm以下的塑料颗粒称为微塑料。
塑料产品因具有使用方便、价格低廉、经久耐用和可塑性强等特点,被广泛应用于各个领域。据统计,我国塑料制品在2019年的产量达到了8 184万t。这些塑料制品在使用之后进入生态系统中,通过长时间的风化、水流、光照和生物分解等作用形成微塑料,并广泛存在于环境中。微塑料直径微小,容易迁移,湖泊、海洋、陆地等生态系统均被发现存在大量微塑料,甚至人体也会由于食物链的层层传递而出现微塑料。微塑料可吸附化学农药、抗生素、重金属、壬基苯酚等污染物,因此会对生态系统和人体健康构成严重威胁。
目前,关于微塑料的研究多集中在环境调查和水生生物毒理学方面。在环境调查方面,研究人员主要围绕海洋、河口、淡水湖和海岸区域中微塑料的来源、迁移、形态、含量等进行了调查;在水生生物毒理学研究方面,关注对象主要集中于浮游动物、鱼类、软体动物和贝类等。有研究表明,微塑料可通过地膜降解、污泥施用、大气沉降等方式在土壤中大量积累,土壤中微塑料的含量是海洋中的4~23倍。但是,迄今关于微塑料在土壤生态系统中的环境行为及其机制的研究还相对薄弱。Rillig等研究发现,蚯蚓的摄食和运动可促进微塑料在土壤内部的迁移,并且微塑料粒径越小,越容易迁移。除蚯蚓外,线虫、跳虫等动物也能够取食微塑料。土壤中的弹尾虫和线蚓肠道菌在微塑料中暴露56 d后,其群落结构和生长繁殖均受到显著抑制。此外,研究表明,将绿豆幼苗暴露在100 mg·L的聚乙烯微塑料中,其生长和水分含量均受到显著抑制;Giorgetti等发现,50 nm的聚苯乙烯微塑料能够进入洋葱根系分生区细胞中并引起氧化胁迫,使细胞生理功能发生改变(如导致有丝分裂异常);Jiang等发现,暴露在5 μm聚苯乙烯荧光微塑料中的蚕豆幼苗,其生物量和过氧化氢酶(CAT)活性显著降低,超氧化物歧化酶(SOD)和过氧化物酶(POD)活性显著升高;但连加攀等发现,乙烯-乙酸乙烯酯共聚物、线性低密度聚乙烯和聚甲基丙烯酸甲酯3种微塑料在0~1 000 mg·L的质量浓度范围内对小麦根长、苗长和干重无显著影响。
外生菌根真菌能与高等植物的根部形成菌根共生体,从而促进植物对矿质元素的吸收和对不良环境的抗性。微塑料颗粒本就具有较强的黏附性,若长期存留在土壤中,微塑料很有可能会进一步形成微米型和纳米型塑料,极容易被植物根系-外生菌根真菌共生体所产生的多糖黏液、有机酸等分泌物所捕获。同时,塑料颗粒还具有一定的柔韧性,它们可能会在受到挤压的情况下进入到狭小的根部质外体空间,进一步渗透进入根系皮层和真菌菌丝组织内,甚至进入到细胞内部。然而,关于微塑料对土壤中外生菌根真菌的毒理学效应及其作用机制等尚不明确,且在本研究检索范围内未见相关报道。为此,本研究特选取2株外生菌根真菌——彩色豆马勃(,Pt)和松乳菇(,Ld)作为供试菌株,采用固体平板法和液体培养法,研究不同粒径的单分散聚苯乙烯塑料微球(PS-MPs)对土壤外生菌根真菌生长及其抗氧化系统的影响,以期为评估微塑料对土壤微生物的生态毒性效应和揭示其作用机制等提供理论依据。
1 材料与方法
1.1 试验材料
将2株真菌(Pt和Ld)接种到Pachlewsk固体培养基中,培养14 d备用。
Pachlewsk固体培养基的配制方法如下:葡萄糖2 g,磷酸二氢钾0.1 g,酒石酸铵0.05 g,硫酸镁(MgSO)0.05 g,维生素B0.01 g,琼脂2 g,微量元素液0.1 mL,蒸馏水100 mL,pH调至5.5,高压蒸汽灭菌(121 ℃,30 min)。其中,微量元素液的配制方法如下:称取8.45 mg硼酸(HBO)、6 mg硫酸亚铁(FeSO)、5 mg硫酸锰(MnSO)、2.77 mg氯化锌(ZnCl)、0.625 mg硫酸铜(CuSO)和0.27 mg钼酸铵[(NH)MoO],溶于1 L蒸馏水中,灭菌保存。以上用到的试剂均为分析纯,购于国药集团化学试剂有限公司。
PS-MPs购自天津赛尔群科技有限公司,粒径分别为80 nm和4 μm,将其分别分散于10 mL的无菌水中(质量浓度为25 g·L),4 ℃冰箱保存备用。
1.2 PS-MPs的表征情况
将PS-MPs稀释一定倍数,稀释前后分别进行超声波分散处理10 min。分别采用Tecnai G2 F20场发射透射电子显微镜(美国FEI公司)、Gemini SEM500扫描电子显微镜(德国ZEISS公司)观察PS-MPs的形貌特征,采用Zetasizer Nano ZS 90激光粒度仪(英国Malvern公司)测定PS-MPs悬浮液的粒径分布。
1.3 试验设计
在超净工作台中,将2种粒径的PS-MPs原液(质量浓度为25 g·L)均稀释成1 000 mg·L的母液,分别取一定体积的PS-MPs母液,配制成含0(对照组)、10、20、50、100、200、300 mg·LPS-MPs的Pachlewsk液体培养液(PS-MPs稀释前后均进行超声波分散处理),分别取15、20 mL的液体培养液用于制作固体平板和液体培养基,接种一块按1.1节方法活化好的固体菌块(直径6 mm)。每个处理重复5次。全部接种后,将固体平板放置于25 ℃的培养箱内静置培养14 d,将液体培养基放置于25 ℃、120 r·min的摇床上振荡培养14 d。
1.4 测定项目与方法
固体平板培养结束后,观察真菌生长情况。液体培养结束后,对菌丝进行过滤处理,将收集的菌丝在烘箱中烘干(105 ℃),测干重(即每瓶真菌菌丝生物量)。另外取适量菌丝,分别采用硫代巴比妥酸法和分光光度法测定丙二醛(MDA)和可溶性蛋白含量,所用仪器为UV-2000型紫外-可见分光光度计[尤尼柯(上海)仪器有限公司];用DDS-11A型数显电导率仪(上海仪电科学仪器股份有限公司)测定电导率。再取适量菌丝,加入预冷磷酸缓冲液,在冰浴中研磨成匀浆,离心后制成粗酶液,然后分别采用氯化硝基四氮唑蓝光化学还原反应法、愈创木酚法和紫外分光光度法测定SOD、POD和CAT活性。
1.5 数据处理
试验数据采用Excel 2013软件进行整理和绘图,采用SPSS 19.0软件进行方差分析,对有显著(<0.05)差异的,采用Duncan氏新复极差法进行多重比较。
2 结果与分析
2.1 微塑料的表征情况
利用透射电子显微镜(TEM)、扫描电子显微镜(SEM)和激光粒度仪对PS-MPs进行相关表征(图1),可以看出,本试验所用80 nm和4 μm粒径的PS-MPs在水溶液中呈球状,平均粒径分别为80.05 nm和3.94 μm,微塑料溶液体系分布较为均匀,分散效果良好。
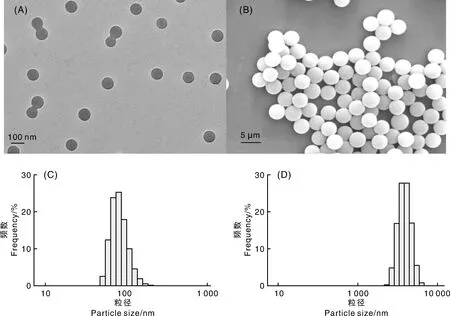
A,80 nm PS-MPs的透射电子显微镜图;B,4 μm PS-MPs的扫描电子显微镜图;C,80 nm PS-MPs的粒径分布;D,4 μm PS-MPs的粒径分布。
2.2 微塑料对外生菌根真菌生长和生物量的影响
在固体平板培养中,当使用4 μm PS-MPs处理时,随着PS-MPs质量浓度的增加,与对照组相比,Pt的生长情况逐渐受到抑制,且PS-MPs的质量浓度越高,抑制越明显;而Ld的生长情况在10~50 mg·L与对照组无明显变化,当PS-MPs的质量浓度大于100 mg·L时,其生长情况受到明显抑制(图2)。当使用80 nm PS-MPs处理时,随着其质量浓度的增加,Pt和Ld的生长情况均逐渐受到抑制,且PS-MPs的质量浓度越高,抑制越明显。
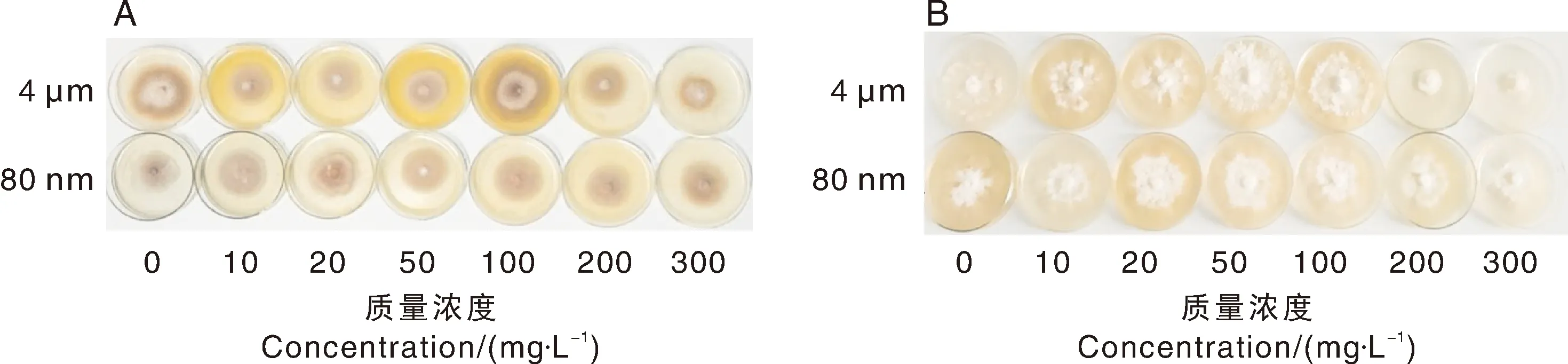
图2 聚苯乙烯塑料微球(PS-MPs)对外生菌根真菌彩色豆马勃(Pisolithus tinctorius)(A)和松乳菇(Lactarius delicious)(B)生长情况的影响
从外生菌根真菌的生物量变化(图3)来看,无论是使用哪种粒径的PS-MPs,Pt的生物量均随着PS-MPs质量浓度的升高而逐渐降低。当PS-MPs的质量浓度为300 mg·L时,与对照组相比,4 μm和80 nm粒径PS-MPs处理下,Pt的生物量分别显著(<0.05)下降了63.81%和51.46%。
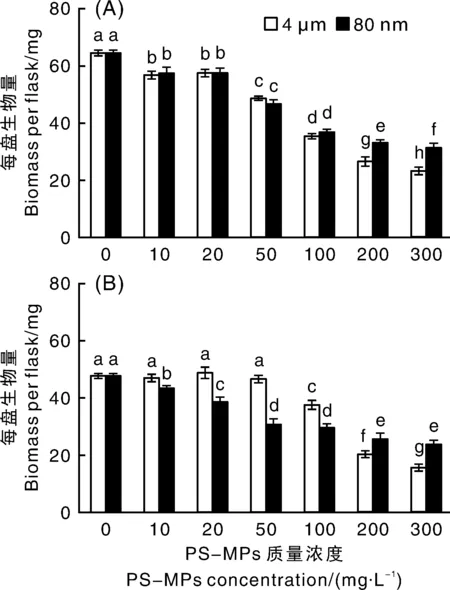
柱上无相同字母的表示处理间差异显著(P<0.05),下同。
当使用4 μm的PS-MPs处理时,Ld的生物量在10~50 mg·L处理下与对照组相比无显著变化,当PS-MPs的质量浓度大于50 mg·L时,Ld的生物量较对照组显著(<0.05)降低。当使用80 nm的PS-MPs处理时,Ld的生物量随着PS-MPs质量浓度的升高而逐渐降低。当PS-MPs的质量浓度为300 mg·L时,与对照组相比,4 μm和80 nm粒径的PS-MPs处理下,Ld的生物量分别显著(<0.05)下降了67.26%和50.15%。
当PS-MPs的质量浓度为10~100 mg·L时,4 μm和80 nm粒径的PS-MPs对Pt生物量的影响无显著差异;但当PS-MPs的质量浓度为200~300 mg·L时,4 μm较80 nm粒径PS-MPs对Pt生物量表现出显著(<0.05)更强的抑制作用。当PS-MPs的质量浓度为10~100 mg·L处理时,80 nm较4 μm粒径的PS-MPs对Ld生物量表现出显著(<0.05)更强的抑制作用;但当PS-MPs的质量浓度为200~300 mg·L时,4 μm较80 nm粒径的PS-MPs对Ld生物量表现出显著(<0.05)更强的抑制作用。
2.3 微塑料对外生菌根真菌抗氧化系统、可溶性蛋白和组织电导率的影响
2.3.1 抗氧化酶活性
随着PS-MPs质量浓度的增加,暴露于2种径粒PS-MPs的Pt和Ld,其SOD活性总体呈先升高后降低的趋势(表1)。当使用4 μm粒径的PS-MPs进行处理时,在50 mg·L的质量浓度下Pt和Ld的SOD活性均最高,分别比对照组显著(<0.05)增加了4.36倍和4.09倍。当使用80 nm粒径的PS-MPs进行处理时,在100 mg·L的质量浓度下Pt的SOD活性最高,比对照组显著(<0.05)增加了5.14倍;在50 mg·L的质量浓度下Ld的SOD活性最高,比对照组显著(<0.05)增加了6.21倍。
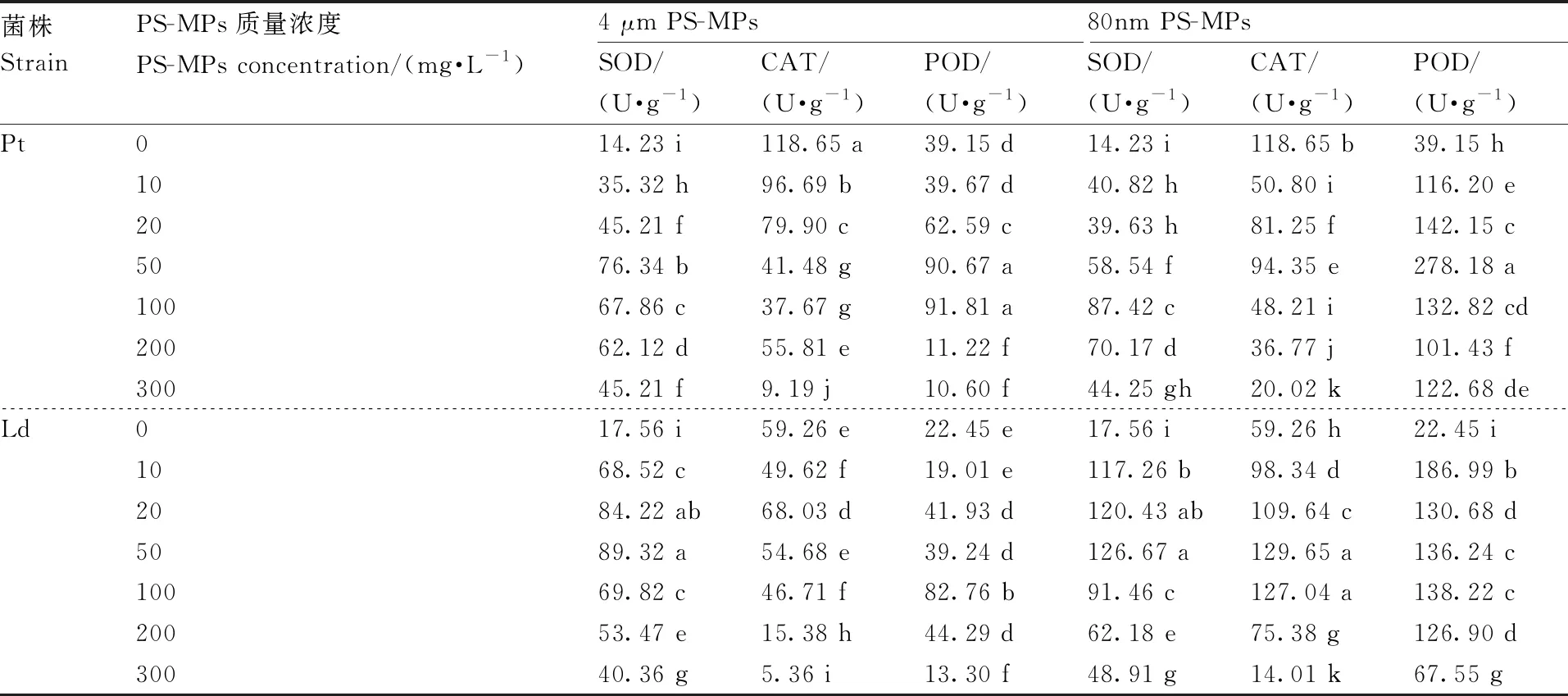
表1 微塑料对外生菌根真菌SOD、CAT和POD活性的影响
当Pt和Ld暴露于4 μm粒径的PS-MPs时(除Ld在PS-MPs质量浓度为20、50 mg·L时以外),与对照组相比,其CAT活性均显著(<0.05)降低,且当PS-MPs的质量浓度为300 mg·L时,其CAT活性最低。当Pt暴露于80 nm粒径的PS-MPs时,与对照组相比,其CAT活性均显著(<0.05)降低,且当PS-MPs的质量浓度为300 mg·L时,其CAT活性最低。但当Ld暴露于80 nm粒径的PS-MPs时,与对照组相比,其CAT活性表现出先增加后降低的趋势,当PS-MPs的质量浓度为50 mg·L时,其CAT活性最高,当PS-MPs的质量浓度为300 mg·L时,其CAT活性最低。
当使用4 μm粒径的PS-MPs进行处理时,与对照组相比,在20~100 mg·L的质量浓度下,Pt的POD活性显著(<0.05)升高,在200~300 mg·L的质量浓度下,Pt的POD活性显著(<0.05)降低;在20~200 mg·L的质量浓度下,Ld的POD活性显著(<0.05)升高,在300 mg·L的质量浓度下,Ld的POD活性显著(<0.05)降低。在100 mg·L的质量浓度下,Pt和Ld的POD活性均最高,分别比对照组显著(<0.05)增加了1.35倍和2.69倍;在300 mg·L的质量浓度下Pt和Ld的POD活性均最低,分别比对照组显著(<0.05)降低了72.92%和40.76%。
当使用80 nm粒径的PS-MPs进行处理时,与对照组相比,Pt和Ld的POD活性均显著(<0.05)升高,其中,Pt和Ld分别在PS-MPs的质量浓度为50 mg·L和10 mg·L时POD活性最高,分别比对照组显著(<0.05)增加6.11倍和7.33倍。
2.3.2 MDA含量
MDA是膜脂过氧化的最终分解产物,其含量常被用于反映植物细胞的氧化损伤程度,含量越高,说明植物细胞膜脂过氧化程度越高,细胞膜受到的伤害越严重。总的来看,除10 mg·L4 μm PS-MPs处理下的Pt和200 mg·L4 μm PS-MPs处理下的Ld外,与对照组相比,暴露于2种粒径的PS-MPs中,Pt和Ld的MDA含量均显著(<0.05)升高(图4)。当使用4 μm粒径的PS-MPs进行处理时,Pt和Ld的MDA含量分别在50、100 mg·L的质量浓度下最高,分别比对照组显著(<0.05)增加了1.89倍和56.84%;当使用80 nm粒径的PS-MPs进行处理时,Pt和Ld的MDA含量分别在300、200 mg·L的质量浓度下最高,分别比对照组显著(<0.05)增加了1.94倍和1.14倍。这表明,当暴露于含有PS-MPs的培养液中时,外生菌根真菌会发生膜脂过氧化,细胞膜会受到不同程度的伤害。另外,当2种粒径PS-MPs的质量浓度同为200~300 mg·L时,Pt和Ld的MDA含量在80 nm PS-MPs环境中显著(<0.05)更高,说明菌丝细胞膜受到的伤害更重。
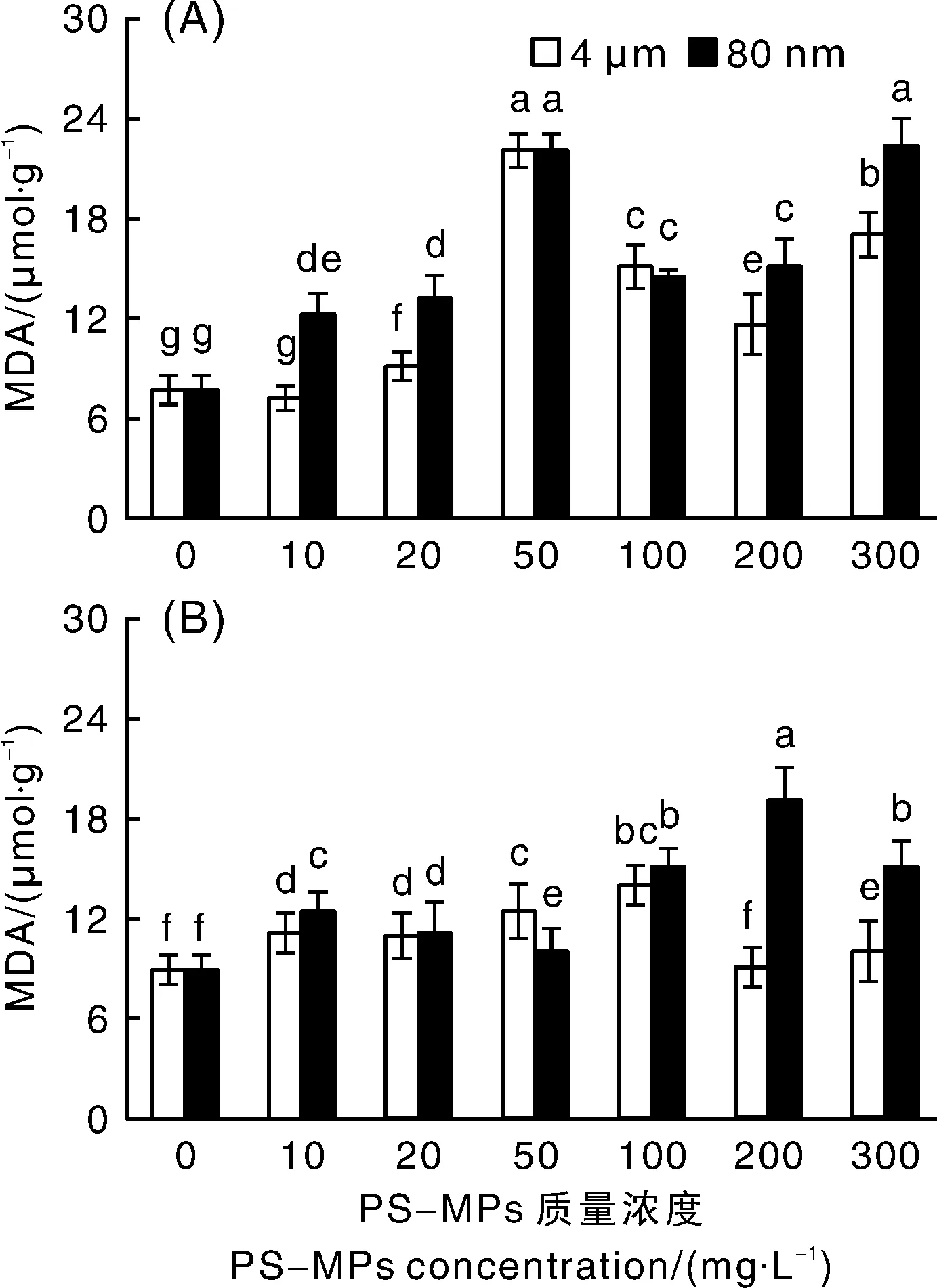
图4 聚苯乙烯塑料微球(PS-MPs)对外生菌根真菌彩色豆马勃(Pisolithus tinctorius)(A)和松乳菇(Lactarius delicious)(B)丙二醛(MDA)含量的影响
2.3.3 可溶性蛋白含量
可溶性蛋白是植物体内主要的渗透调节物质,对细胞中的生命物质和生物膜具有保护作用。当使用4 μm粒径的PS-MPs进行处理时,随着PS-MPs质量浓度的增加,Pt和Ld的可溶性蛋白含量均呈先降后升再降的趋势,但与对照组相比,总体均受显著(<0.05)抑制,且均在300 mg·L的质量浓度下最低,与对照组相比分别下降了67.39%和80.25%(图5)。当使用80 nm粒径的PS-MPs进行处理时,随着PS-MPs质量浓度的增加,Pt的可溶性蛋白含量总体呈先升后降的趋势,与对照组相比,在20 mg·L的质量浓度下显著(<0.05)升高,在300 mg·L的质量浓度下最低,与对照组相比下降了59.36%;Ld的可溶性蛋白含量呈逐渐下降的趋势,在10 mg·L的质量浓度下与对照组相比无显著变化,在200 mg·L的质量浓度下最低,与对照组相比显著(<0.05)降低了41.78%。当80 nm粒径PS-MPs的质量浓度较低(0~20 mg·L)时,与对照组相比,Pt和Ld的可溶性蛋白含量无显著变化,甚至升高,这可能是因为此时微塑料的浓度还比较低。随着PS-MPs质量浓度的上升,两株外生菌根真菌的可溶性蛋白含量均受到不同程度的抑制,进而可能影响真菌的正常代谢活动。
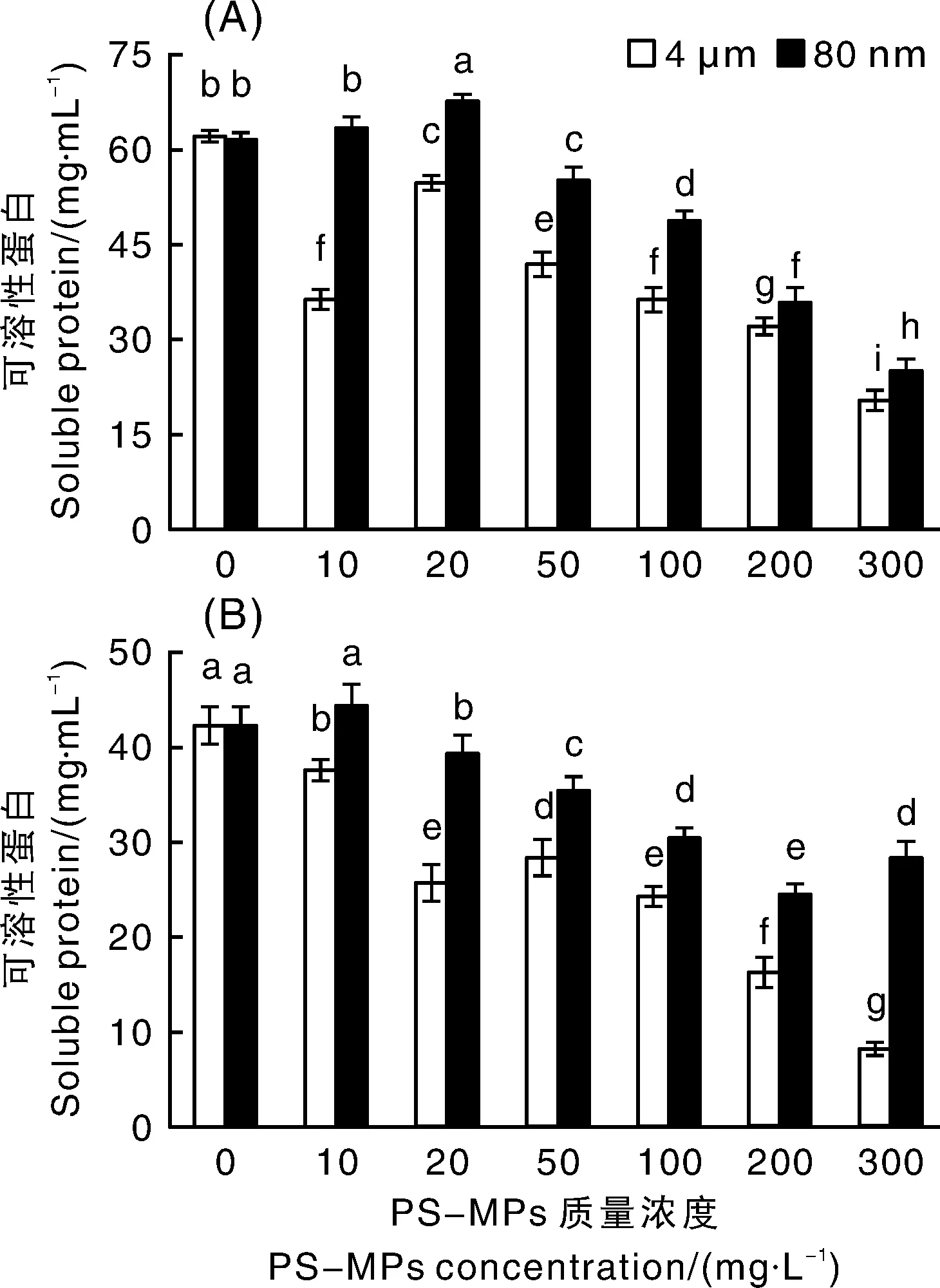
图5 聚苯乙烯塑料微球(PS-MPs)对外生菌根真菌彩色豆马勃(Pisolithus tinctorius)(A)和松乳菇(Lactarius delicious)(B)可溶性蛋白含量的影响
2.3.4 菌丝组织电导率
真菌细胞遭受逆境胁迫后,细胞膜的选择透过性会改变或丧失,细胞内物质大量外渗,从而引起组织电导率的变化。因此,菌丝组织电导率也可反映出细胞膜结构的受伤害程度。当Pt和Ld暴露于2种粒径的PS-MPs时,与对照组相比,其菌丝组织的电导率均显著(<0.05)升高,且随着PS-MPs质量浓度的增加,总体表现出先升后降的趋势,说明PS-MPs对真菌菌丝细胞膜有一定的损伤作用。中高浓度的PS-MPs致使菌丝组织电导率显著升高,暗示其细胞膜的通透性功能发生改变。
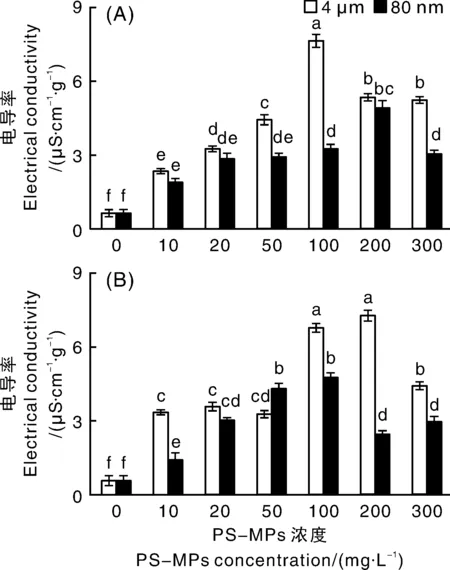
图6 聚苯乙烯塑料微球(PS-MPs)对外生菌根真菌彩色豆马勃(Pisolithus tinctorius)(A)和松乳菇(Lactarius delicious)(B)菌丝电导率的影响
当使用4 μm粒径的PS-MPs进行处理时,Pt和Ld的菌丝组织电导率分别在100、200 mg·L的质量浓度下最高,均比对照组显著(<0.05)增加11.3倍;当使用80 nm粒径的PS-MPs进行处理时,Pt和Ld的菌丝组织电导率分别在200、100 mg·L的质量浓度下最高,分别比对照组显著(<0.05)增加了6.92和7.10倍。整体而言,2种粒径的PS-MPs相比,当Pt和Ld暴露在4 μm粒径的PS-MPs中时,其菌丝电导率要相对更高。
3 讨论
目前,有关微塑料的研究主要集中在海洋、河口和湖泊等水域生态系统的污染现状,以及微塑料对藻类、贻贝、鱼类、植物种子等材料的毒理学效应及其经食物链传递对人体健康的威胁等方面,有关微塑料对土壤真菌毒性的研究在检索范围内尚未见报道。
有研究表明,添加不同浓度的微塑料地膜严重抑制小麦种子的萌发,小麦种子的发芽率随着微塑料浓度增加逐渐降低。李连祯等研究发现,聚苯乙烯微球(粒径0.2 μm)可被生菜根部大量吸收和富集,并从根部迁移到地上部。微塑料暴露会对生物的生长发育过程产生不同程度的影响。本研究发现,无论是暴露于哪种粒径的PS-MPs,菌株Pt和Ld的生长情况均随着PS-MPs质量浓度的增加整体表现为抑制作用。这可能与微塑料渗透进入真菌组织内部,扰乱外生菌根真菌对水分和养分的正常吸收和运转有关。有研究表明,微塑料在受到挤压力后,可进入到狭小的根部质外体空间。另外,微塑料还可以通过植物新生侧根边缘的狭小缝隙进入,然后渗透到根系皮层组织甚至到达导管组织中。微塑料进入组织内部后,可吸附在水分子中,阻断细胞间的连接,形成物理堵塞或者其他损伤,进而阻止营养物质的运输,从而引起细胞毒性。
POD、SOD和CAT是生物细胞内抗氧化系统的主要酶,其活性水平能反映生物受逆境影响的程度。三者通过协同作用维持生物体自由基的稳态,防止由于自由基不平衡而引起的生理损伤。高嘉蔚等报道,大型溞体内SOD活性随着聚氯乙烯(粒径100 nm或5 μm)浓度的增加,表现为先升高后逐渐降低的趋势。这与本研究结果相似。本研究中,在2种粒径不同质量浓度的PS-MPs处理下,外生菌根真菌的SOD活性始终高于对照组,且随PS-MPs质量浓度的增加,表现出先升高后降低的趋势。这表明供试真菌菌株受到了严重的环境胁迫,需要通过提高体内的SOD活性来清除多余的超氧阴离子自由基,以降低环境胁迫压力和毒害效应。有学者发现,将菜心幼苗暴露于20 μm粒径的PS-MPs中,当PS-MPs的质量浓度低于500 mg·L时,其CAT活性显著低于对照组。本研究发现,当暴露在4 μm粒径的PS-MPs中时,两株供试真菌的CAT活性均表现出显著降低的趋势(除Ld在PS-MPs质量浓度为20、50 mg·L时外),暴露于80 nm粒径PS-MPs的菌株Pt的CAT活性较对照组显著降低,说明微塑料的胁迫已经超出了菌株自身调节能力的阈值,酶活受到损伤。安菁等研究发现,当暴露于含有聚氯乙烯(粒径<15 μm)的土壤中时,大豆叶片的CAT活性随土壤微塑料含量的增加表现出先升高后降低的趋势。这与本试验中暴露于80 nm粒径PS-MPs下菌株Ld的CAT活性变化一致。这可能是因为,在10~50 mg·L的PS-MPs处理下,菌株Ld需要通过提高CAT活性来分解体内累积的HO,从而使细胞免于遭受HO的毒害;而高浓度PS-MPs处理下,CAT活性显著降低。有研究表明,暴露在聚氯乙烯(粒径3 μm)环境中,黑藻体内的POD活性随胁迫浓度增加,呈现先上升后下降的趋势。本研究中,在4 μm粒径的PS-MPs处理下,菌株Pt和Ld的POD活性在中浓度时显著升高,在低浓度或高浓度下无显著变化或显著降低,且2株菌在相同质量浓度的80 nm粒径PS-MPs处理下,其POD活性要高于4 μm粒径PS-MPs的处理。这暗示,两株供试真菌在80 nm粒径PS-MPs处理下产生的自由基更多,需要通过提高体内POD的活性来维持自由基含量的平衡。抗氧化酶活性的短暂升高可能是机体为免受外界胁迫毒害而采取的调节措施,酶活性下降暗示其所受胁迫已超出自身调节能力范围。综合来看,PS-MPs对外生菌根真菌的毒性机制可能涉及氧化应激反应。
本研究发现,当暴露于2种粒径的PS-MPs时,2株供试菌株的MDA含量比对照组显著升高(除10 mg·L4 μm PS-MPs处理下的Pt和200 mg·L4 μm PS-MPs处理下的Ld外)。有研究表明,大豆幼苗在生长初期,随着盆栽土壤中微塑料(粒径<15 μm)含量的增加,植株SOD、POD等抗氧化酶的活性显著升高,而自由基和MDA含量降低。这与本研究结果相反。我们推测,这可能是由于本试验中采用的微塑料粒径是4 μm和80 nm,粒径更小且粒径统一,比表面积和表面能更大,与真菌细胞的接触面积更大,结合微塑料的浓度、表面电荷等自身特性,及真菌细胞对微塑料的响应等多种因素,导致微塑料对真菌细胞造成严重的氧化损伤,产生大量的膜脂过氧化产物。当PS-MPs的质量浓度同为200~300 mg·L时,供试菌株的MDA含量在80 nm粒径PS-MPs条件下显著高于4 μm粒径PS-MPs,说明在80 nm粒径PS-MPs胁迫下,细胞膜受到的伤害更严重,这可能与纳米级PS-MPs更易渗入细胞内环境,对细胞膜造成损害有关。
可溶性蛋白是重要的渗透调节物质和营养物质,对细胞的生物膜起保护作用。本研究显示,在4 μm粒径PS-MPs暴露组中,菌株Pt和Ld的可溶性蛋白含量均呈先降后升再降的趋势,但总体受抑制。然而,廖苑辰等研究表明,小麦幼苗叶片的可溶性蛋白含量随PS-MPs含量增加(0~100 mg·kg),在粒径5 μm和100 nm PS-MPs暴露下,可溶性蛋白含量呈先升后降再升的趋势。这与本研究结果不同,可能是由于真菌细胞和植物细胞的细胞壁成分和机械强度不同,且试验中设置的微塑料浓度不同,导致微塑料进入细胞内的浓度也有所区别,进而对可溶性蛋白的合成和分解产生了不同的影响。在80 nm粒径PS-MPs暴露组中,菌株Pt的可溶性蛋白含量呈先升后降的趋势,而菌株Ld的可溶性蛋白含量呈逐渐下降的趋势。这可能是因为,在低浓度的80 nm粒径PS-MPs暴露下,两株真菌可溶性蛋白的产生并未受到明显影响;但随着PS-MPs质量浓度的上升,真菌的正常生命活动受影响,从而抑制了可溶性蛋白的生成。
当真菌受到逆境影响时,细胞膜被破坏,膜透性增大,细胞内的电解质外渗,以至真菌组织浸提液的电导率增大。一般来说,膜透性增大的程度与逆境胁迫强度有关,也与生物体的抗逆性强弱有关。本研究表明,在2种粒径的PS-MPs处理中,真菌菌丝组织的电导率均高于对照组。这说明PS-MPs胁迫使细胞膜受到了不同程度的伤害,且整体来看,PS-MPs质量浓度越高,对真菌细胞膜的伤害越严重。
综上,微米级和纳米级的PS-MPs暴露对外生菌根真菌生长和抗氧化系统均产生了一定影响,且PS-MPs的粒径和质量浓度不同,对外生菌根真菌的效应也有所差异,研究结果可为揭示微塑料对土壤外生菌根真菌的急性毒性提供依据,但关于其内在机制等还有待进一步研究。
