miR-1247-3p激活TGF-β1信号介导肝星状细胞与肝纤维化的关系*
2022-05-31李长安王园园杜敬佩孙爱平
李长安, 王园园, 杜敬佩, 孙爱平
1新乡医学院第三附属医院感染科(河南新乡 453000); 2新乡医学院免疫学教研室(河南新乡 453000)
肝纤维化是由各种致病因子作用导致的肝内结缔组织异常增生改变,若未及时治疗可导致肝细胞损害,最终导致肝硬化[1]。目前国内外肝纤维化治疗现状尚不理想,临床实践发现,尽管去除病因,肝纤维化进程仍可继续,甚至发展为肝硬化和肝癌[2]。miRNA是一类长度约22 nt的非编码单链RNA分子,可在转录后水平调控多种基因表达。近年研究表明,miRNA可通过调节肝星状细胞增殖、活化、迁移和凋亡,参与肝纤维化过程,且不同miRNA在肝纤维化过程中发挥着不同的促或抗纤维化作用[3]。miR-1247-3p和miR-1247-5p具有同源性。有报道显示,miR-1247-5p在人肝细胞癌中发挥抑癌作用[4],而miR-1247-3p与肝癌的关系鲜有报道。转化生长因子-β1(transforming growth factor-β 1,TGF-β1)为miRNA调控肝纤维化发生发展多个环节靶基因的重要通路之一[5]。基于此,本研究于2020年6—12月期间利用四氯化碳(CCl4)诱导大鼠肝纤维化,测定肝组织miR-1247-3p和TGF-β1的表达,并分离大鼠原代肝星状细胞,观察miR-1247-3p对肝星状细胞细胞增殖和活化的影响,以及miR-1247-3p与TGF-β1的靶向关系,旨在分子水平上为肝纤维化治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物 Wistar大鼠:30只,雄性,8周龄,体重180~220 g,购自济南朋悦实验动物繁育有限公司,动物生产许可证号SCXK(鲁)20190003;饲养于标准环境,温度20~24℃,相对湿度50%~60%,光照周期12 h/12 h,自由饮食和饮水。本研究符合医院有关动物伦理相关规定(2013[639])。
1.1.2 主要试剂与仪器 CCl4:美国RD公司。D-Hank′s液(货号JK-CS1166):上海晶抗生物工程有限公司。RNA提取试剂盒(货号SY3882)、反转录试剂盒(货号YT9036):北京伊塔生物科技有限公司。qRT-PCR试剂盒(货号F-430):北京美科美生物技术开发有限公司。组织/细胞裂解液(货号FK-MB534J)、BCA法蛋白定量试剂盒(货号FK-all2016):上海延慕实业有限公司。鼠抗人TGF-β1单克隆抗体(货号ab190503):美国Abcam公司。鼠抗人α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单克隆抗体(货号SM0610):广州深达生物制品技术有限公司。CCK-8试剂盒(货号C0037):上海碧云天生物技术有限公司。Dual Luciferase试剂盒(货号YIJI20144.2):上海一基实业有限公司。凝胶成像系统(型号iBright)、酶标仪(型号Scientific MK3):美国赛默飞世尔公司。
1.2 方法
1.2.1 动物模型构建[6]适应性饲养1周后,将大鼠随机分为对照组和模型组,每组15只;模型组大鼠皮下注射50% CCl4,1.0 mL/kg,2次/周,连续12周;对照组大鼠皮下注射等体积无菌油剂,分别于处理后第6周和第12周取肝脏组织,观察病理变化。
1.2.2 原代肝星状细胞分离与培养[7]大鼠禁食12 h,8‰戊巴比妥钠腹腔注射,1 mL/kg;麻醉后,剃毛并消毒胸腹部,暴露腹腔,将其胃肠移至腹部左侧;暴露门静脉和下腔静脉;自门静脉远端穿刺,连接注射器预注射2 mL D-Hank′s液;确认插入成功后,剪开下腔静脉,灌注D-Hank′s液30 mL,速率为7~10 mL/min;待肝脏变黄白、流出D-Hank′s液,无肉眼可见血液时,更换灌注液为含Ⅳ型胶原蛋白酶HBSS液10 min,速率为3~5 mL/min;待肝脏变软、脆,表面呈裂隙状,压之凹陷不易恢复时,停止灌注;取肝脏置于无菌皿,生理盐水冲洗,剔除血管等组织;剪碎并振荡消化,滤网过滤,2 000 r/min离心7 min,弃上清;不含FBS的DMEM培养基重悬细胞,1 000 r/min离心5 min,取上清;1 500 r/min离心上清液7 min,取沉淀;加入18% Nycodenz,混匀后加入预冷不含FBS的DMEM培养基;2 600 r/min离心20 min,吸取分层处乳白色细胞,DMEM培养基洗涤2次;1 200 r/min离心5 min,台酚蓝染色观察原代肝星状细胞活性并计数;以1×106个细胞接种于培养瓶内,37℃、5%CO2培养24 h,每3 d更换1次培养液。
1.2.3 苏木精-伊红染色(hematoxylin-eosin,HE) 分别于0、6、12周取大鼠肝脏组织,4%多聚甲醛固定24 h,制备石蜡切片;取切片,二甲苯脱蜡,乙醇梯度脱水;自来水冲洗后,苏木精染色10 min,1%盐酸乙醇冲洗;伊红染色3 min,乙醇梯度脱水,二甲苯透明,显微镜下随机选取5个视野,计算肝纤维化面积,0分为无纤维化,1分为纤维化面积<25%,2分为25%~49%,3分为50%~75%,4分为>75%。
1.2.4 实时荧光定量酶链式反应(quantitative real-time fluorescence quantitative enzyme chain reaction,qRT-PCR) 提取组织或细胞总RNA,利用逆转录酶反转录成cDNA,取出cDNA加入180 μL的ddH2O,-20℃保存待用;取2.5 μL的cDNA,分别加入5 μL的SYBER Green、1.5 μL的DEPC水、0.5 μL上游引物和0.5 μL下游引物,构成10 μL的反应体系进行PCR扩增,每个样重复3次;以GAPDH为内参,采用2-ΔΔCt法计算miR-1247-3p和TGF-β1 mRNA表达量。
1.2.5 蛋白免疫印迹法 提取组织或细胞蛋白,BCA法定量;制备分离胶和积层胶,取蛋白样品进行电泳;电泳结束后将蛋白凝胶湿法转至PVDF膜上,冰上反应1 h;TBST溶液冲洗,5%脱脂牛奶封闭1 h;TBST溶液冲洗,滴加一抗(1∶1 000),以β-actin为内参,4℃过夜孵育;TBST溶液冲洗3次,滴加二抗(1∶2 000),室温孵育2 h;TBST溶液冲洗,凝胶成像系统观察蛋白条带,Image J软件定量分析。
1.2.6 细胞转染 细胞置于含10%胎牛血清的DMEM培养基内,置于37℃、5%CO2培养箱内培养;贴壁后以0.25%胰酶消化,细胞融合度达80%时,加入DMEM培养基终止反应;随机分为空白对照组、miR-1247-3p mimic组和miR-1247-3p inhibitor组,使用Lipo3000转染剂分别转染miR-1247-3p 无意义对照序列、miR-1247-3p mimic和miR-1247-3p inhibitor,置于37℃、5%CO2培养箱内培养48 h。
1.2.7 CCK-8细胞增殖实验 取转染48 h后的细胞,以5×103个/孔接种于96孔板中,37℃、5%CO2培养箱内培养48 h;弃旧培养基,PBS溶液冲洗,每孔加入100 μL无血清DMEM培养基和10 μL的CCK-8试剂;分别于24、48、72 h利用酶标仪测定波长450 nm处吸光度(optical density,OD)值;以细胞数量为横坐标,OD值为纵坐标绘制标准曲线,OD值越大提示细胞增殖能力越强。
1.2.8 荧光素酶报告实验验证靶基因 miRDB和microT-CD数据库中查找miR-1247-3p靶基因,分析交集;Targetscan软件对交集基因进行置信水平分析,将置信区间最大的基因作为miR-1247-3p靶基因;设计pGL3质粒,分别将空白pGL3质粒、含靶基因pGL3质粒(pGL3-TGF-β1 WT)、阴性对照pGL3质粒(pGL3-TGF-β1 MUT)转染至细胞,并将miR-1247-3p NC、mimic和inhibitor转染至细胞,37℃、5%CO2培养箱内培养48 h;按照Dual Luciferase试剂盒说明书操作,单管荧光测定仪检测荧光强度,荧光强度越低提示miR-1247-3p 可与TGF-β1结合,从而抑制下游荧光素酶表达。
2 结果
2.1 模型组和对照组大鼠肝组织病理变化 与对照组比较,CCl4腹腔注射后大鼠肝组织出现纤维化增生,结构破坏,炎症细胞浸润,且随时间延长肝纤维化程度加重,见图1。对照组、模型组第6周和模型组第12周肝组织纤维化评分分别为(0.12±0.08)分、(1.54±0.12)分、(2.39±0.15)分,两两比较,差异均有统计学意义(P<0.05)。
注:A:对照组;B:模型组第6周;C模型组第12周
2.2 模型组和对照组大鼠肝组织miR-1247-3p和TGF-β1表达水平 与对照组比较,模型组大鼠肝组织miR-1247-3p和TGF-β1表达水平均显著增加(P<0.05),见表1、图2。
图2 模型组和对照组大鼠肝组织TGF-β1蛋白表达

表1 模型组和对照组大鼠肝组织miR-1247-3p和TGF-β1表达水平
2.3 miR-1247-3p对肝星状细胞增殖的影响 与空白对照组比较,miR-1247-3p mimic组肝星状细胞增殖能力显著增加,miR-1247-3p inhibitor组显著降低(P<0.05),见图3。

图3 miR-1肝星状细胞247-3p对肝星状细胞增殖的影响
2.4 miR-1247-3p对肝星状细胞活化的影响 与空白对照组比较,miR-1247-3p mimic组肝星状细胞α-SMA 蛋白表达水平显著升高,miR-1247-3p inhibitor组显著降低(P<0.05),见表2、图4。
表2 大鼠肝星状细胞α-SMA蛋白表达水平
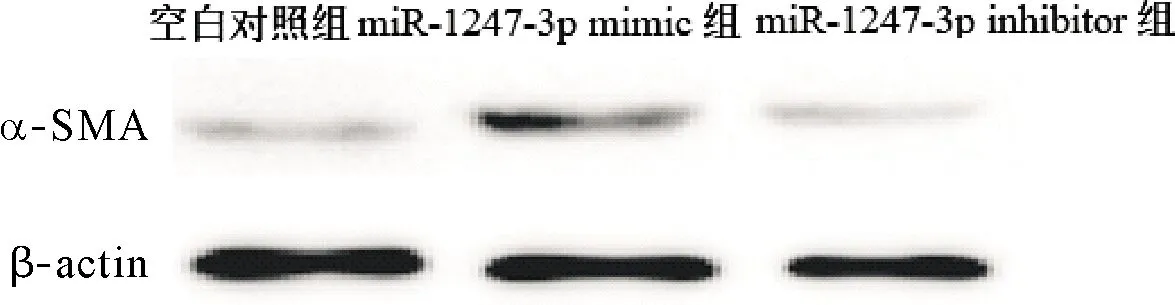
图4 大鼠肝星状细胞α-SMA蛋白表达
2.5 miR-1247-3p对肝星状细胞TGF-β1表达的影响 双荧光素酶报告实验结果显示,与WT组比较,miR-1247-3p mimic可显著抑制肝星状细胞内荧光素酶活性(P<0.05);与miR-1247-3p-NC组比较,miR-1247-3p mimic组荧光素酶活性显著降低(P<0.05),而miR-1247-3p inhibitor组无显著变化(P>0.05);与MUT组比较,miR-1247-3p mimic对肝星状细胞内荧光素酶活性无显著变化;miR-1247-3p-NC组和miR-1247-3p mimic组荧光素酶活性比较,差异无统计学意义(P>0.05),见图5。与空白对照组比较,miR-1247-3p mimic组肝星状细胞TGF-β1表达水平显著升高,miR-1247-3p inhibitor组显著降低(P<0.05),见表3、图6。
表3 大鼠肝星状细胞TGF-β1表达水平

图6 大鼠肝星状细胞TGF-β1表达
3 讨论
肝纤维化是肝脏慢性损伤引起的肝内结缔组织的异常增生,导致肝细胞功能障碍[8]。若未经有效治疗,可进一步发展为肝硬化甚至是肝癌,严重影响患者生活质量。故早期诊断和治疗对肝纤维化转归尤为重要。然而,目前临床采用的诊断和治疗有一定局限性。随着表观遗传学研究深入发现,肝纤维化过程中存在miRNA谱异常,其可通过调控靶基因表达参与肝纤维化发生发展[9]。近年有研究证实,miR-1247-3p在肝癌组织中差异表达[10],即相较于健康人群,肝细胞癌患者血清和组织中miR-1247-3p水平均显著升高。本研究亦得出类似结果,表明miR-1247-3p在肝纤维化过程中起着重要调控作用。
肌成纤维细胞是慢性肝损伤过程中产生细胞外基质的主要细胞,其中肝星状细胞为各种临床和实验性肝纤维化模型中肌成纤维细胞的主要来源[11]。研究发现,肝纤维化小鼠纤维化肝脏中几乎所有的肝星状细胞均被激活[12],表明肝星状细胞激活在肝纤维化过程中发挥重要作用,提示通过抑制其增殖和活化有可能减少甚至逆转肝纤维化过程[13]。为进一步分析miR-1247-3p在肝纤维化中的作用和调控机制,本研究以CCl4构建肝纤维化大鼠模型,并分离原代肝星状细胞,分别在动物和细胞水平进行探讨。取肝组织进行HE染色发现,CCl4腹腔注射后大鼠肝组织出现纤维化增生,结构破坏,炎症细胞浸润,且随时间延长肝纤维化程度加重,提示肝纤维化大鼠模型构建成功[14]。TGF-β1是能使正常成纤维细胞表型发生转化的细胞因子。多项研究表明,TGF-β1在肝星状细胞活化以及细胞外基质分泌与沉积中发挥重要作用[15-16]。本研究分别采用qRT-PCR和蛋白免疫印迹法测定大鼠肝脏组织TGF-β1表达发现,无论在转录水平还是在翻译水平上,肝纤维化大鼠肝组织TGF-β1表达均显著上调,符合以往研究结果。利用慢病毒感染构建miR-1247-3p过表达和抑制的细胞模型发现,上调miR-1247-3p可显著增加肝星状细胞增殖能力,下调则得到相反作用。α-SMA是肝星状细胞活化重要标志分子[17]。本研究结果显示,上调miR-1247-3p可显著增加肝星状细胞α-SMA表达,下调则可降低其表达。以上结果提示miR-1247-3p可通过促进肝星状细胞增殖和活化,参与肝纤维化进程。本研究进一步通过双荧光素酶报告实验验证miR-1247-3p与TGF-β1的靶向关系发现,TGF-β1为miR-1247-3p的靶基因,miR-1247-3p可能通过羟基化TGF-β1转录活性区域,抑制其下游因子表达,从而促进肝星状细胞增殖和活化,参与肝纤维化进展。
综上所述,miR-1247-3p可通过靶向上调TGF-β1表达,促进肝星状细胞增殖和活化,从而参与肝纤维化进展。本研究尚存在不足之处为未对下游分子机制进一步探讨,拟在今后研究中分析。
利益相关声明:本文所有作者不存在利益冲突。
作者贡献说明:李长安负责论文选题、研究设计、实验开展、论文撰写。王园园负责查阅文献、采集数据。杜敬佩负责整理数据、统计分析。孙爱平负责统计指导、终审及修改论文。
