X线照射治疗脊髓损伤大鼠的效果及其可能机制▲
2022-05-31牛延坪
王 义 牛延坪 戴 俊
(苏州大学附属第二医院骨科,江苏省苏州市 215000,电子邮箱:wangyi19900522@163.com)
脊髓损伤(spinal cord injury,SCI)是一种常见的临床疾病,给家庭和社会带来了沉重的负担[1]。机械暴力等因素可造成原发性SCI,在原发性SCI的基础上,出血、水肿、炎症、坏死等情况又可导致继发性SCI,原发性损伤和继发性损伤均可引发神经功能永久性损害[2]。研究显示在SCI急性期进行干预可以促进神经功能恢复,而减轻继发性损伤并促进脊髓组织存活可以作为SCI治疗的基础性研究[3]。
SCI后小胶质细胞及巨噬细胞被激活,然后释放炎性因子,例如肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素1β(interleukin 1β,IL-1β)等[4];过表达的炎性因子可以促进炎症反应,进而促进继发性SCI。SCI后星形胶质细胞被激活,在炎症中心快速增殖并迁移,在病变周围形成胶质瘢痕[5]。其中,中间纤维蛋白水平的增高可反映出反应性星形胶质细胞的增殖情况[5-6]。炎症和胶质瘢痕过度增生在损伤区域边缘形成屏障,阻碍神经再生[7],严重影响了SCI后的神经再生[8]。
Kalderon和Fuks于1996年发现采用X线照射对某些细胞成分进行适时干预,可抑制脊髓退化的发生,进而使脊髓的结构性再生过程不受阻碍,进而促进损伤脊髓结构的恢复[9]。研究表明,适当剂量的X线照射可清除那些激发神经组织变性的细胞因素(小胶质细胞、巨噬细胞等)[10];此外,适当剂量的X线照射可以抑制胶质瘢痕形成,从而改善神经功能[11]。因此,本研究旨在探讨X线照射治疗SCI的效果及其可能的作用机制。
1 材料和方法
1.1 试剂和仪器 HE染色试剂盒(碧云天,批号:C0105S),尼氏染色液(碧云天,批号C0117),蛋白酶抑制剂(碧云天,批号:SG2000),磷酸化蛋白酶抑制剂(碧云天,批号:P1081),二喹啉甲酸法蛋白浓度测定试剂盒(碧云天,批号:P0010),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(CST公司,批号:2858),髓鞘碱性蛋白(myelin basic protein,MBP)抗体(CST公司,批号:78896),TNF-α抗体(Novus Biologicals公司,批号:NBP1-19532),IL-1β抗体(Novus Biologicals公司,批号:NB600-633),胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(CST公司,批号:3670),波形蛋白(Vimentin)抗体(CST公司,批号:5741),二抗(南京福麦斯生物技术有限公司,批号:FMS-RB01、FMS-MS01),二氨基联苯胺(diaminobenzidine,DAB)法辣根过氧化物酶显色剂盒(碧云天,批号:P0203),ECL化学发光检测试剂盒(上海雅酶生物医药科技有限公司,批号:SQ202)。临床直线加速器放射治疗系统(Elekta公司,型号:Synergy),正置光学显微镜(日本东京尼康公司,型号:ECLPSE 80i),凝胶成像系统(Bio-Rad公司,型号:Bio-Rad GelDoc XR+)。
1.2 实验动物 75只清洁级雌性SD大鼠(动物许可证号:SCXK沪2017-0005)购自苏州大学第二附属医院实验中心,8周龄,体重(250±20)g。实验前,将大鼠置于室温(23±2)℃的房间中饲养1周,以消除新环境可能产生的生理和心理影响。
1.3 动物分组和SCI模型建立方法 采用简单随机化方法,将SD大鼠分为假手术组(Sham组)、SCI组、SCI+2 Gy组、SCI+10 Gy组和SCI+20 Gy组,每组15只。腹腔注射1%戊巴比妥钠(60 mg/kg)麻醉大鼠,麻醉成功后,以俯卧位固定;以T10为中心做长约2 cm的纵行皮肤切口,暴露出T10节段棘突后行椎板切除术暴露T10节段脊髓;除sham组外,根据Allen原理,对其他4组大鼠使用自制撞击器(10 g×6 cm)撞击暴露脊髓,造成T10段SCI,而对Sham组大鼠只做椎板切除术而不损伤脊髓。硬膜囊迅速淤血和水肿,以及大鼠出现双下肢抖动,则提示SCI模型建立成功。缝合切口并用碘附消毒,连续肌肉注射青霉素(0.8 mg/g)3 d。术后进行辅助排尿,直至恢复自主排尿。所有大鼠建模均成功,其间死亡11只(SCI组3只,SCI+2 Gy组3只,SCI+10 Gy组2只,SCI+20 Gy组3只),后续补充相应大鼠,使每组达到15只。
1.4 X线照射治疗 SCI+2 Gy组、SCI+10 Gy组和SCI+20 Gy组的大鼠在SCI后2 h分别接受2 Gy、10 Gy、20 Gy剂量的单次X线照射。以SCI部位为照射中心(T10水平),照射范围为30 mm×15 mm(长×宽),皮源距离50 cm。以200 cGy/min的剂量率使用6 MeV X射线照射。
1.5 运动功能评估 于术前及建模成功后(即术后)第1天、第14天,采用巴索-贝蒂-布雷斯纳汉(Basso-Beattie-Bresnahan,BBB)量表[12]和斜板试验[12]评估大鼠运动功能的情况。BBB量表总分21分,0分表示“完全瘫痪”,21分表示“正常运动”;斜板试验的倾斜角度可自由调节,记录大鼠可在斜板上停留5 s而不掉落的最大倾斜角。术前所有大鼠的运动功能均正常,BBB量表评分均为21分,斜板试验的最大倾斜角为73°。
1.6 脊髓组织病理染色 在术后第14天每组取8只大鼠,处死大鼠后用4%多聚甲醛进行心脏灌注,收集受损脊髓样品0.5 cm。将脱水后的脊髓样品包埋在石蜡中,然后将石蜡块制作成5 μm厚的切片。切片通过脱蜡、脱水等处理后,再使用HE染色试剂盒和尼氏染色液分别对切片进行HE染色和尼氏染色。所有切片均在正置光学显微镜下(400倍镜)观察并拍摄。尼氏小体呈现蓝色,从每个切片中随机选择3个成像区域进行分析,后通过ImageJ 1.48软件统计损伤部位中空腔及尼氏小体所占的面积比例。
1.7 免疫组织化学法检测相关蛋白的表达 将上述制备的切片在0.01 mol/L柠檬酸盐缓冲液中煮沸(95℃)15 min以修复抗原。在磷酸缓冲盐溶液中洗涤3次(5 min/次)后,将切片与下列一抗在4℃下孵育过夜:MBP(1 ∶400)、TNF-α(1 ∶200)、IL-1β(1 ∶200)、GFAP(1 ∶50)、Vimentin (1 ∶200)。切片过夜后在磷酸缓冲盐溶液中洗涤3次(5 min/次),然后与二抗(1 ∶3 000)在室温下孵育60 min,最后用DAB辣根过氧化物酶显色试剂盒显色。在正置显微镜(400倍镜)下进行观察拍摄。阳性蛋白呈现棕褐色,从每个切片中随机选择3个成像区域用以分析,使用ImageJ 1.48软件分析阳性细胞的面积比例。
1.8 蛋白免疫印迹法检测相关蛋白的表达 在术后第14天每组取7只大鼠,处死大鼠后用4%多聚甲醛进行心脏灌注,收集受损脊髓样品0.5 cm。将样品在含有蛋白酶抑制剂和磷酸化蛋白酶抑制剂的裂解液中完全匀浆后离心(4℃,14 000 r/min,15 min)。用二喹啉甲酸蛋白浓度测定试剂盒测定蛋白浓度。采用10%和12.5%凝胶电泳分离各组蛋白后,转移到聚偏二氟乙烯膜上。将聚偏二氟乙烯膜在5% BSA中封闭1 h,然后与一抗在4℃下孵育过夜:MBP(1 ∶1 000)、TNF-α(1 ∶500)、IL-1β(1 ∶1 000)、GFAP(1 ∶1 000)、Vimentin (1 ∶1 000)、GAPDH(1 ∶1 000)。将聚偏二氟乙烯膜与二抗(1 ∶3 000)在室温下孵育1 h。孵育结束后在TBST中洗涤3次(10 min/次),滴加ECL化学发光试剂进行显色,经Bio-Rad成像系统可视化。使用ImageJ 1.48软件分析条带的灰度值,以目的蛋白灰度值/内参(GAPDH)灰度值表示目的蛋白的相对表达量。
1.9 统计学分析 使用GraphPad Prism 8.0.1软件进行统计分析。计量资料以(x±s)表示,组内前后比较采用配对t检验,多组间比较采用方差分析,多重比较采用Dunnett检验。以P< 0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠的运动功能 在整个实验过程中Sham组大鼠的BBB评分和斜板试验的最大倾斜度均不变,运动功能均正常。术后各时间点,与Sham相比,其他组大鼠的BBB评分、斜板试验的最大倾斜度均降低或减小(均P< 0.05),且术后第14天,SCI组、SCI+2 Gy组、SCI+20 Gy组、SCI+10 Gy组中大鼠的BBB评分和斜板试验的最大倾斜度依次增加(均P< 0.05)。除Sham组外,其他组大鼠术后第14天的BBB评分、斜板试验的最大倾斜度均较术后第1天增加(均P< 0.05)。见表1。
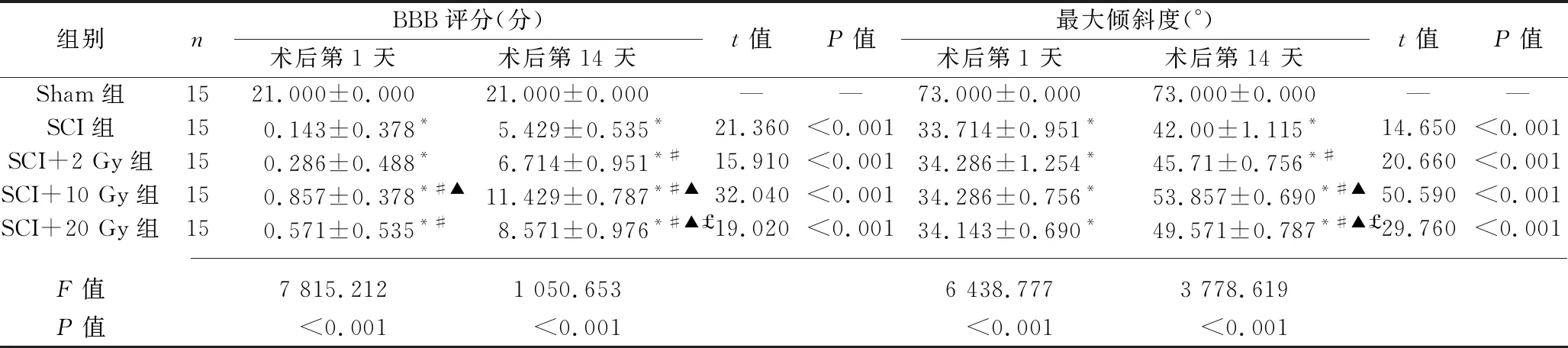
表1 各组大鼠BBB评分和斜板试验结果的比较(x±s)
2.2 各组大鼠脊髓的空腔病变情况 取脊髓样品时发现,SCI大鼠的受损脊髓因瘢痕和空腔的形成出现萎缩。术后第14天,其他组大鼠的脊髓空腔面积比例均大于Sham组(均P< 0.05),而所有X线照射组大鼠的脊髓空腔面积比例均小于SCI组,且SCI+2 Gy组、SCI+20 Gy组、SCI+10 Gy组中大鼠的脊髓空腔面积比例依次减小(均P<0.05),见表2和图1。

表2 各组大鼠脊髓的空腔面积比例的比较(x±s,%)
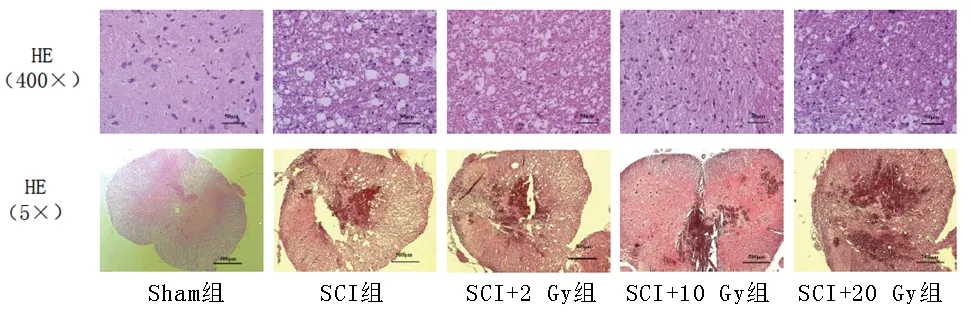
图1 各组大鼠脊髓的空腔病变情况(HE染色)
2.3 各组大鼠脊髓组织中尼氏小体所占的面积比例和MBP相对表达量的比较 术后第14天,SCI组和各个X线照射组大鼠的脊髓(受损部位)组织中尼氏小体所占面积比例及MBP相对表达量均低于Sham组(均P< 0.05),而各个X线照射组大鼠的脊髓(受损部位)组织中尼氏小体所占面积比例及MBP相对表达量均高于SCI组,且SCI+2 Gy组、SCI+20 Gy组、SCI+10 Gy组大鼠的脊髓(受损部位)组织中尼氏小体所占面积比例及MBP相对表达量依次升高(均P< 0.05),见表3和图2。

表3 各组大鼠脊髓组织中尼氏小体所占的面积比例和MBP相对表达量的比较(x±s)

图2 各组大鼠脊髓组织尼氏染色情况和MBP蛋白表达情况
2.4 各组大鼠脊髓组织炎症和胶质瘢痕形成相关蛋白的表达情况 免疫组化检测结果显示,与Sham组比较,术后第14天,其他组大鼠脊髓中的炎症因子(TNF-α和IL-1β)和中间纤维蛋白(GFAP、Vimentin)的相对表达量均增加;而与SCI组比较,各个X线照射组大鼠脊髓中的TNF-α、IL-1β、GFAP、Vimentin的相对表达量均降低(均P< 0.05),且SCI+2 Gy组、SCI+20 Gy组、SCI+10 Gy组大鼠脊髓中上述指标的相对表达量依次降低(均P< 0.05),见表4、图3和图4。
蛋白免疫印迹检测结果显示,术后第14天,其他组大鼠脊髓中的TNF-α、IL-1β、GFAP、Vimentin的相对表达量均增加(均P<0.05);与SCI组比较,SCI+10 Gy组和SCI+20 Gy组脊髓中的TNF-α、IL-1β相对表达量,SCI+2 Gy组、SCI+10 Gy组和SCI+20 Gy组脊髓中的GFAP、Vimentin相对表达量均下降(均P<0.05),而SCI+2 Gy组大鼠脊髓中TNF-α、IL-1β相对表达量差异无统计学意义(均P>0.05);SCI+20 Gy组、SCI+10 Gy组大鼠脊髓中TNF-α、IL-1β相对表达量均低于SCI+2 Gy组,且SCI+2 Gy组、SCI+20 Gy组、SCI+10 Gy组大鼠脊髓中GFAP、Vimentin的相对表达量依次降低(均P<0.05)。见表4、图3和图4。

表4 各组大鼠脊髓组织炎症和胶质瘢痕形成相关蛋白表达情况的比较(x±s)
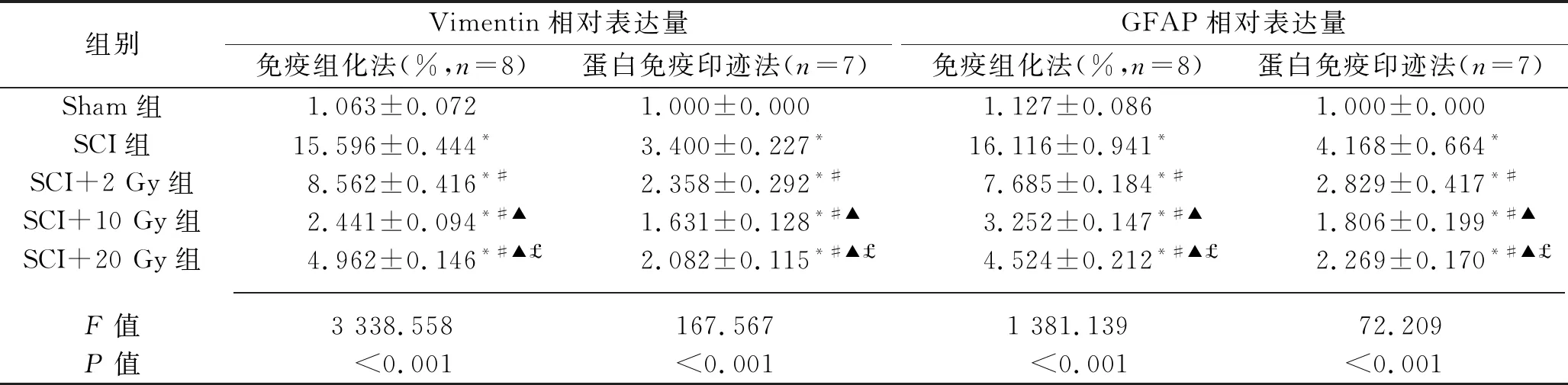
注:与Sham组比较,*P<0.05;与SCI组比较,#P<0.05;与SCI+2 Gy组比较,▲P<0.05;与SCI+10 Gy组比较,£P<0.05。

图3 各组大鼠脊髓中TNF-α和IL-1β的表达情况

图4 各组大鼠脊髓中GFAP和Vimentin的表达情况
3 讨 论
众所周知,在成人中枢神经系统损伤中,SCI具有不可逆性,神经组织再生非常有限。治疗SCI有多种策略,例如干细胞治疗、神经营养因子治疗等。其中,干细胞治疗可以通过直接替换SCI后不久死亡的神经元细胞和神经胶质细胞来促进神经功能的恢复[13],而神经营养因子治疗可以通过输送神经营养因子(如神经营养蛋白-3)诱导上行感觉轴突的趋化再生,并防止SCI后不同神经元群的萎缩和死亡[14]。前者具有组织特异性,后者具有靶向效应,但它们治疗SCI具有不可控性、无法精准分化、生物多样性、费用昂贵等缺点,适应证群体较窄。而X线照射具有抑制细胞增殖、促进细胞凋亡和减轻炎症的作用,是一种非特异性的预防性治疗[15]。X线照射治疗可单独也可联合其他疗法对SCI患者进行综合性治疗,是治疗继发性SCI的潜在疗法。
研究表明,在原发性SCI后的最初几小时内机体即可发生炎症反应,从而导致细胞凋亡和坏死、胶质瘢痕的形成[16]。Kalderon等[9]的研究结果显示,损伤后3周内是预防胶质瘢痕形成的最佳时间。然而,Morin-Richaud等[17]研究发现,在损伤后2周星形胶质细胞和少突胶质细胞的增生现象将不再显著。综合以上结果,原发性SCI后的急性期是抑制继发性SCI进展的治疗窗口期,所以本研究在SCI术后2 h进行单次X线照射治疗。本研究结果显示,SCI+2 Gy组、SCI+10 Gy组、SCI+20 Gy组大鼠术后的BBB评分、斜板试验的最大倾斜度随着时间延长而增加,且术后14 d,各个X线照射组上述指标均优于SCI组,且脊髓空腔病变面积比例小于SCI组(均P< 0.05),这提示SCI后2 h进行单次X线照射治疗可有效地改善SCI大鼠的运动功能,并可减少SCI后空腔病变的形成。当SCI发生时,许多成熟的少突胶质细胞死亡并脱髓鞘。MBP主要由成熟的少突胶质细胞合成,其对于脱髓鞘损伤后新髓鞘的及时形成至关重要[18]。本研究结果显示,术后第14天SCI各组大鼠的脊髓中尼氏小体面积比例减少、MBP的相对表达量较Sham组降低(均P<0.05),而SCI+2 Gy组、SCI+10 Gy组、SCI+20 Gy组大鼠SCI部位中尼氏小体面积比例增加、MBP蛋白的相对表达量较SCI组均升高(均P<0.05)。以上结果表明,一定剂量的X线照射治疗可减少神经元细胞的损失、促进髓鞘存活,从而促进大鼠SCI后运动功能的恢复。更重要的是,在各个X线照射组中SCI+10 Gy组的优势最显著,这可能与大剂量X线的毒性作用有关[19]。
SCI发生后,小胶质细胞和巨噬细胞被激活从而释放炎症因子,促进炎症反应。而炎症反应可以诱导中枢神经系统中神经元细胞的损伤,故控制炎症反应是治疗继发性SCI的目标之一[20]。此外,胶质瘢痕可导致脊髓形成空腔病变从而阻碍中枢神经系统功能的修复,所以抑制胶质瘢痕形成也是治疗继发性SCI的目标之一[21]。有研究表明,抑制损伤部位中GFAP和Vimentin的表达可以减少胶质瘢痕的形成,从而改善损伤脊髓的神经功能[4]。而X线照射可能通过一种不涉及细胞破坏的机制防止炎性因子上调而保护中枢神经系统[15]。综上,本研究从炎症和胶质瘢痕形成方面探讨X线照射治疗SCI的可能机制。结果显示,大鼠SCI后脊髓中的炎症因子、中间纤维蛋白的表达量均升高(P<0.05),而各个X线照射组大鼠脊髓的炎症因子、中间纤维蛋白的表达量均降低(P<0.05)。由此推测,X线照射治疗可能是通过减轻炎症、抑制胶质瘢痕形成,从而减少脊髓空腔病变、神经元细胞和髓鞘的损失,最终促进SCI大鼠的神经功能恢复。
综上所述,X线照射治疗可有效地改善SCI大鼠的神经功能,其机制可能为通过抑制炎症和胶质瘢痕形成为神经元存活和髓鞘再生提供有利的微环境。X线照射或可为治疗SCI提供一种新的策略。
