基于转录组测序筛选高盐培养下双峰驼肾皮质细胞差异表达基因
2022-05-31陈丽慧萨日娜敖特根巴雅尔朝鲁门格日乐黄海峰额尔敦木图
陈丽慧 , 萨日娜 , 宝 山 , 敖特根巴雅尔 , 朝鲁门格日乐 ,黄海峰 , 孙 波 , 额尔敦木图 , 杨 彬
(1.内蒙古农业大学兽医学院 , 内蒙古 呼和浩特 010018 ; 2.阿拉善盟动物卫生监督所 , 内蒙古 巴彦浩特 750306 ;3.内蒙古自治区巴彦淖尔市农牧业科学研究所 , 内蒙古 巴彦淖尔 015000 ; 4.鄂托克旗农牧局动物疫病预防控制中心 ,内蒙古 鄂尔多斯 016100 ; 5.阿拉善左旗农牧区生态管理综合行政执法局 , 内蒙古 巴彦浩特 750300;6.内蒙古阿拉善左旗巴润别立镇综合保障和技术推广中心 , 内蒙古 巴彦浩特 750300)
双峰驼长久以来一直生存在恶劣的干旱、缺水环境下,形成了独特的抗逆性[1]。普通家畜长期饮用盐碱水会直接导致其组织细胞渗透压失调,引起机体代谢紊乱而无法正常生存,而双峰驼长期饮用高浓度的盐碱水,日常摄入的盐量是其他家畜的6~8倍,却能维持正常的生理机能[2]。这表明双峰驼有着独特的高盐适应性,并具有强大的高盐调节机制。已有研究表明,醛固酮可以通过调控肾小管上皮细胞对钠的重吸收来调节细胞外液容量,从而维持血压的平衡,并且肾皮质远曲小管和集合管细胞中的上皮钠离子通道(Epithelial sodium channels,ENaC)可以调控钠离子的运转以维持水盐平衡[3]。本试验以双峰驼肾皮质细胞为研究对象,分别设立高渗组(Hyperosmotic stress,HS)和对照组(Control),应用RNA-Seq转录组测序和分析技术,筛选出参与高盐调控双峰驼肾皮质细胞的差异表达基因。
1 材料与方法
1.1 主要试剂与仪器 TRIzol试剂,购自美国Invitrogen 公司;NEBNext®UltraTMRNA Library Prep Kit for Illumina®,购自杭州沃森生物技术有限公司;DMEM、胶原酶,均购自美国Gibco公司;胎牛血清(Fetal bovine serum,FBS),购自哈尔滨立峰生物工程有限公司;饱和NaCl溶液,购自北京酷来搏科技有限公司。渗透压仪(Osmomat 030),德国Gonotec公司产品;分光光度计(NanoDrop 2000),美国Thermo Scientific公司产品;Agilent 2100 Bioanalyzer,美国Agilent公司产品;荧光定量PCR仪(ABI7900),美国Applied Biosystems公司产品。
1.2 试验动物及其样本采集 将成年雄性阿拉善双峰驼处死后迅速采集肾脏,切取肾脏皮质部分。用75%乙醇洗涤消毒后,保存于灭菌PBS中(内含1%青霉素-链霉素混合液),供后续细胞培养试验使用。
1.3 方法
1.3.1 双峰驼肾皮质细胞的分离培养 采集好的双峰驼肾皮质通过组织块贴壁法培养肾皮质细胞。肾脏皮质碎片在0.1% I型胶原酶的消化下,培养温度37 ℃,摇床转速200 r/min,消化时间1 h。消化至组织成蓬松絮状,离心后去掉消化液,加入含高糖DMEM、20% FBS、1%青霉素-链霉素混合液的细胞培养基,装于细胞瓶中。细胞瓶置于37 ℃、5% CO2的培养箱中培养。
1.3.2 高渗处理肾皮质细胞 为了筛选出受高盐调控的基因,试验分为2个组,即高渗组和对照组,每组4个 样本。利用渗透压仪测量培养基渗透压。高渗组:加入NaCl溶液配制渗透压为600 mOmol/kg的高渗培养基,肾皮质细胞使用高渗培养基(DMEM,10% FBS,NaCl)培养48 h。对照组:经渗透压仪测量培养基渗透压为357 mOmol/kg,肾皮质细胞使用等渗普通培养基(DMEM,10% FBS和1%青霉素-链霉素)培养48 h。
1.3.3 总RNA的抽提 使用TRIzol试剂抽提肾皮质细胞的总RNA,溶解于RNase-free水中。使用NanoDrop 2000分光光度计测定RNA浓度和纯度,Agilent 2100 Bioanalyzer 对RNA进行质量检测,合格后用于后续测序。
1.3.4 RNA-Seq检测数据的处理 对转录组测序原始数据进行过滤,获得高质量的有效测序数据。并对测序深度进行校正,得到标准化(Normalization)数据。即通过统计学模型进行假设检验概率(Pvalue)的计算,并进行多重假设检验校正,得到经过校正的P值(AdjustPvalue,Padj)。采用差异表达倍数(Fold-change)法,对数据中基因的表达进行定量,即使用Subread软件中的FeatureCounts工具,将原始数据转换为FPKM数据,计算出基因的差异表达倍数。定义Padj<0.05且|log2(Fold-change)|>1的基因为差异表达基因(Differential expression gene,DEGs)。并对筛选出受高盐调控明显的DEGs进行基因本体论(Gene Ontology,GO)分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)分析。
1.3.5 实时荧光定量PCR(qRT-PCR)检测基因表达水平 为了验证RNA-Seq结果数据的准确性,随机抽取其中3个基因进行qRT-PCR。本试验采用SYBR Green检测法,以GAPDH为内参基因进行qRT-PCR。所用的引物序列见表1,qRT-PCR结果以Ct值的形式直观展现,对各样本的目的基因和内参基因分别进行扩增,每个反应重复3次。qRT-PCR的反应条件:95 ℃预变性5 min,95 ℃变性15 s,60 ℃延伸1 min,40个循环。PCR反应结果数据采用2-ΔΔCt法进行比较和分析,计算各个基因相对于GAPDH基因的表达量。
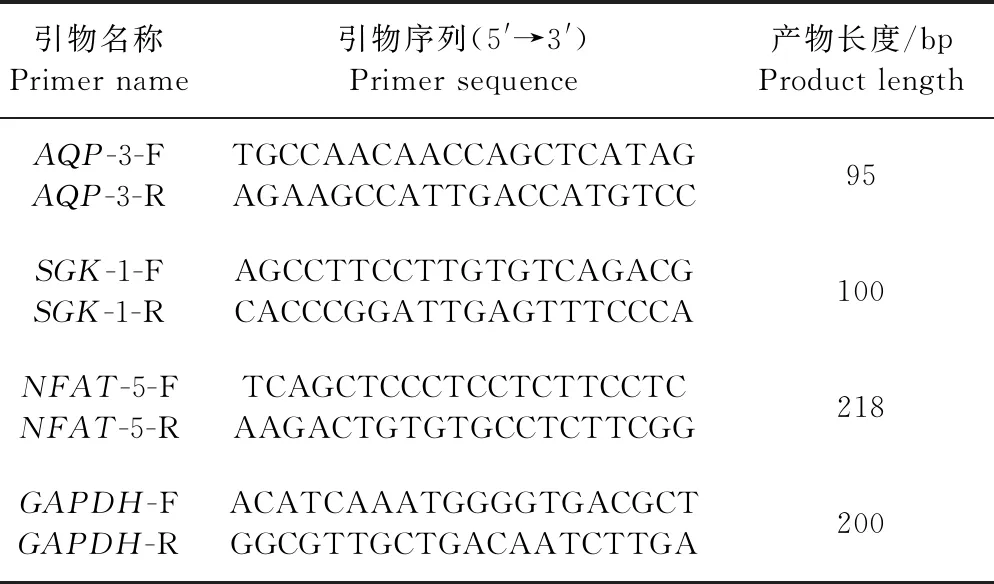
表1 实时荧光定量PCR引物
2 结果
2.1 RNA-Seq测序数据分析 RNA-Seq检测总共得到21 901条mRNA。根据筛选条件|log2(Fold-change)|>1且Padj<0.05,最终筛选出受高盐调控显著的DEGs共计4 854个,其中上调的基因有3 407个,下调的基因有1 447个。
2.2 qRT-PCR检测RNA-Seq的准确性 为了验证RNA-Seq的准确性,随机选择3个高渗处理后显著差异的基因。对这些基因进行qRT-PCR检测,分别测定其相对于内参基因GAPDH的表达水平。每个样本设3个重复,qRT-PCR结果以2-ΔΔCt值的形式直观展现。分别计算RNA-Seq测序中3个基因的log2(Fold-change)值,以此作为基因的相对表达水平。结果如图1所示,测得3个基因在qRT-PCR中的相对表达水平与RNA-Seq的检测结果总体表达趋势一致,表明本次RNA-Seq测序结果是可靠的。
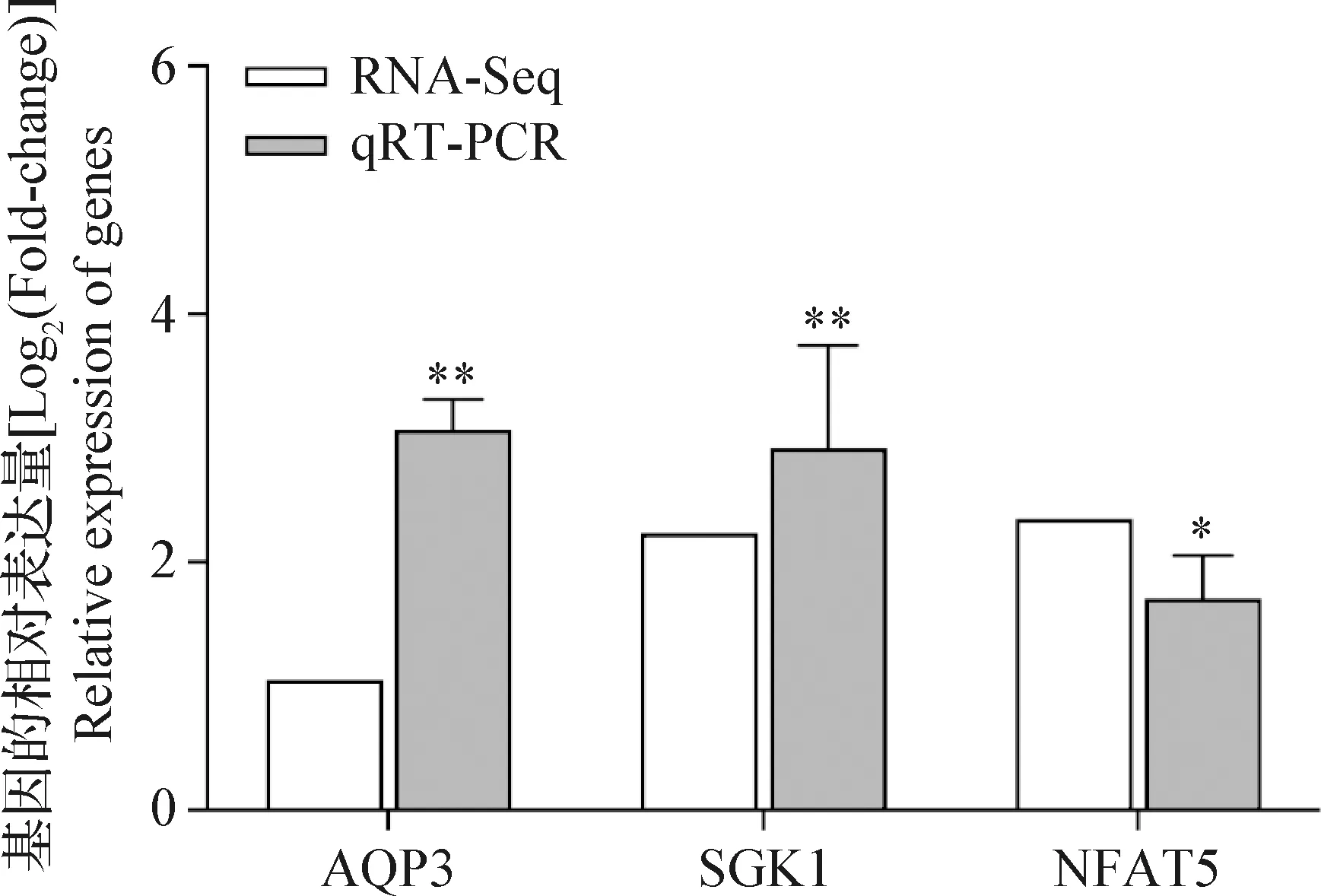
图1 差异表达基因的qRT-PCR检测
2.3 DEGs的GO注释分析 对肾皮质细胞中受高盐调控明显的DEGs进行GO注释分析,结果如图2所示,这些基因主要在生物进程(Biological process,BP)、细胞组分(Cellular component,CC)和分子功能(Molecular function,MF)中发挥作用。
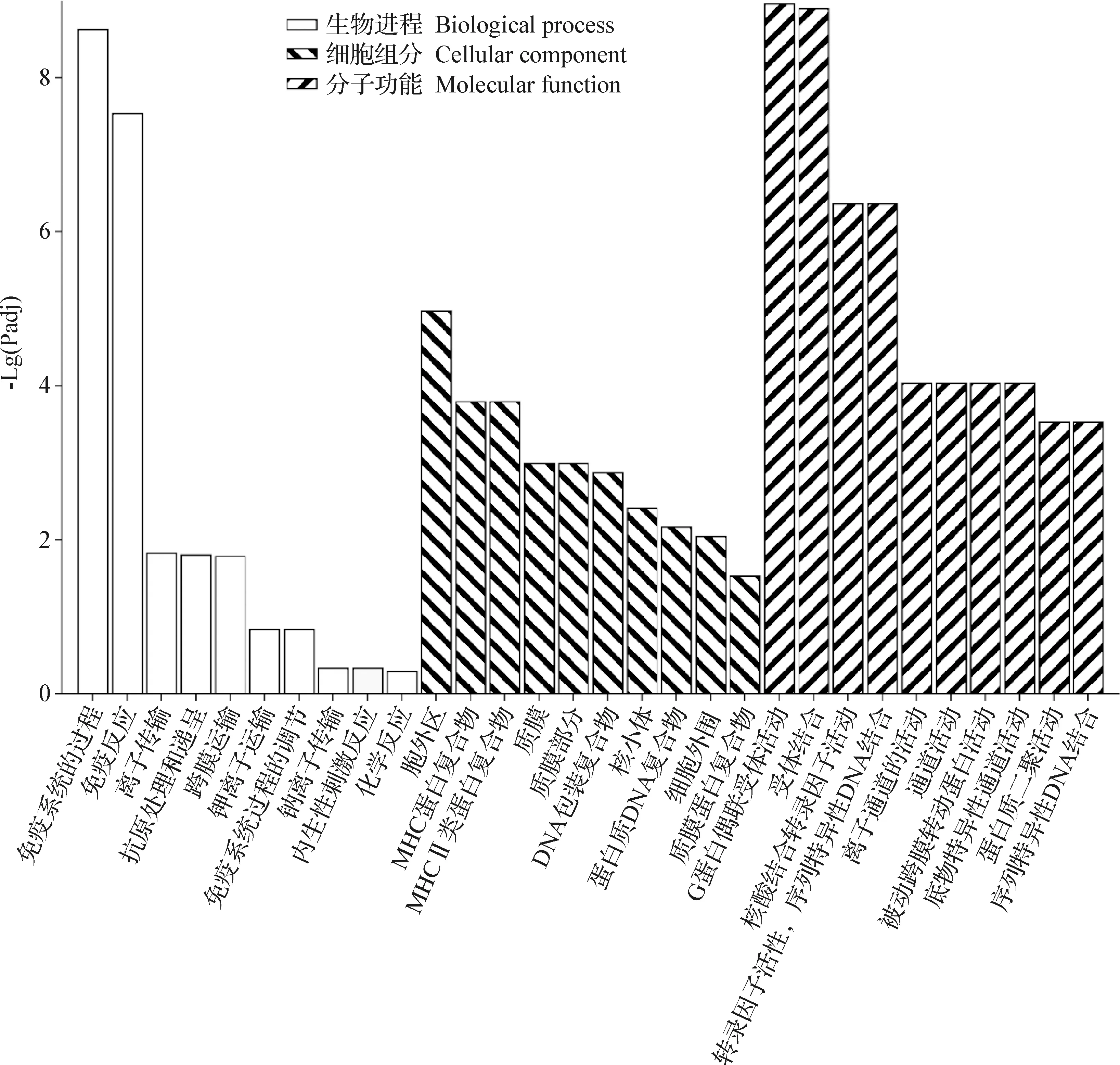
图2 高渗处理下双峰驼肾皮质细胞中DEGs的GO分类
在BP中,DEGs主要富集在两方面:一方面富集在免疫相关的途径:免疫系统的过程(Immune system process)、免疫反应(Immune response)、抗原处理和递呈(Antigen processing and presentation)和免疫系统过程的调节(Regulation of immune system process);另一方面富集在运输相关的途径:离子运输(Ion transport)、跨膜运输(Transmembrane transport)、钾离子运输(Potassium ion transport)和钠离子运输(Sodium ion transport)。除此之外,还富集在内生性刺激反应(Response to endogenous stimulus)、化学反应(Response to chemical)等。
在CC中,DEGs主要富集在胞外区(Extracellular region)、MHC蛋白复合物(MHC protein complex)、MHCⅡ类蛋白复合物(MHC class II protein complex)、质膜(Plasma membrane)、质膜部分(Plasma membrane part)、DNA包装复合物(DNA packaging complex)、核小体(Nucleosome)、蛋白质DNA复合物(Protein-DNA complex)、细胞外围(Cell periphery)和质膜蛋白复合物(Plasma membrane protein complex)。
在MF中,DEGs主要富集在两方面:一方面是物质活动相关途径:G蛋白偶联受体活动(G-protein coupled receptor activity)、核酸结合转录因子活动(Nucleic acid binding transcription factor activity)、离子通道的活动(Ion channel activity)、通道活动(Channel activity)、被动跨膜转运蛋白活动(Passive transmembrane transporter activity)、底物特异性通道活动(Substrate-specific channel activity)和蛋白质二聚活动(Protein dimerization activity);另一方面是物质结合相关途径:受体结合(Receptor binding)、转录因子活性,序列特异性DNA结合(Transcription factor activity,sequence-specific DNA binding)和序列特异性DNA结合(Sequence-specific DNA binding)。
2.4 DEGs的KEGG富集分析 对DEGs进行KEGG富集分析,将Padj<0.05的生物途径定义为DEGs显著富集KEGG途径。结果如表2所示,受到高盐环境的影响,DEGs显著富集在辅助因子和维生素代谢(Metabolism of cofactors and vitamins)、信号传导(Signal transduction)、信号分子相互作用(Signaling molecules and interaction)、运输和分解代谢(Transport and catabolism)和免疫系统(Immune system)等46条显著KEGG途径。DEGs中受高盐调控显著的信号通路有钙信号通路(Calcium signaling pathway)、JAK-STAT信号通路(JAK-STAT signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)和MAPK信号通路(MAPK signaling pathway),且有多个基因同时涉及多条途径。例如:鸟苷酸交换因子 1(SOS1)基因同时参与JAK-STAT信号通路(JAK-STAT signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、细胞因子-细胞因子受体相互作用(Cytokine-cytokine receptor interaction)和趋化因子信号通路(Chemokine signaling pathway)等。
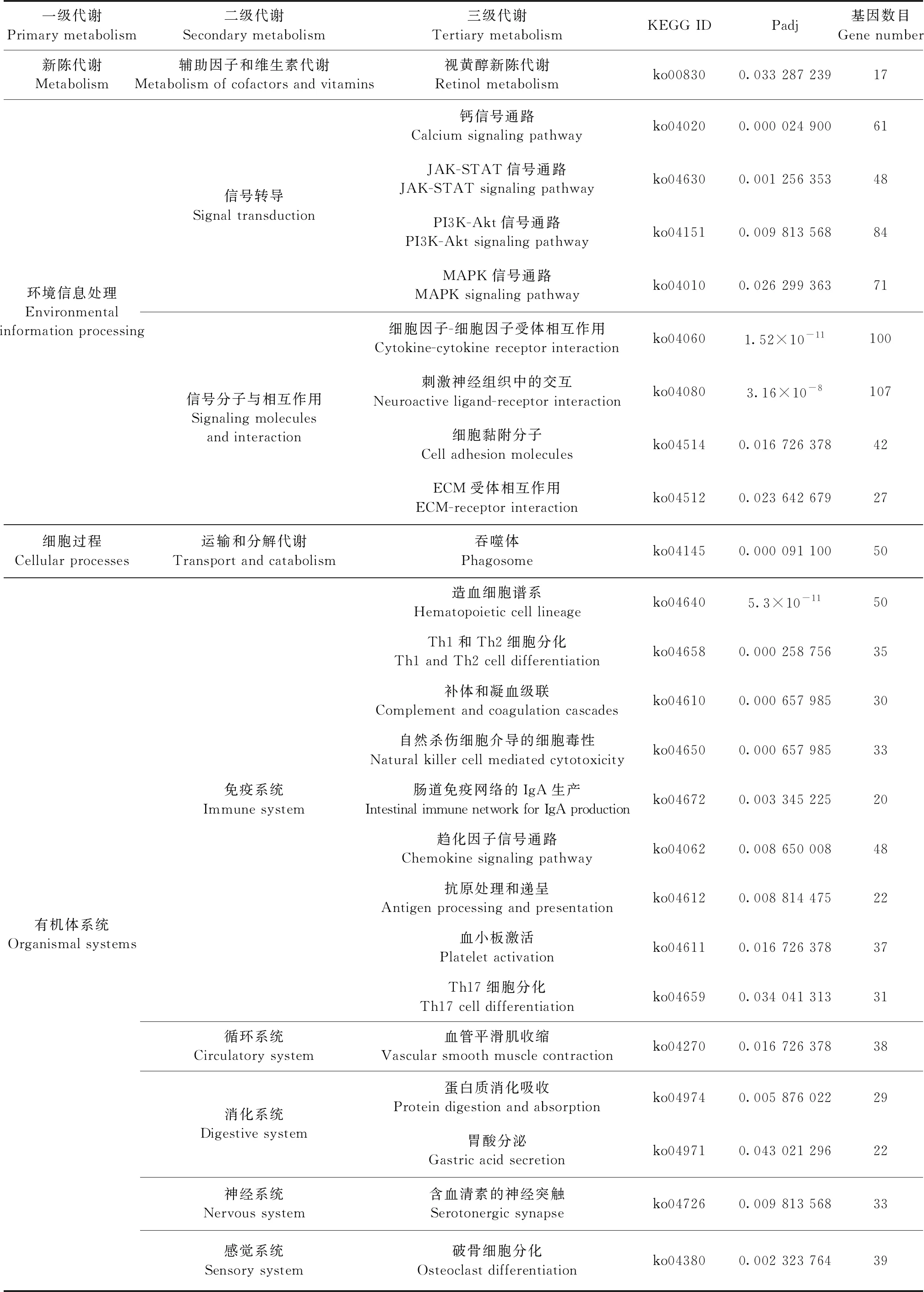
表2 差异表达基因显著富集的KEGG途径
2.4.1 新陈代谢 KEGG Pathway数据库将生物代谢通路分为3个层次,新陈代谢(Metabolism)属于一级代谢中的一种,其主要分为碳水化合物代谢(Carbohydrate metabolism)、能量代谢(Energy metabolism)和辅助因子和维生素代谢(Metabolism of cofactors and vitamins)等12个二级代谢途径。KEGG分析结果显示,17个DEGs富集在辅助因子和维生素代谢中的视黄醇新陈代谢(Retinol metabolism),主要有RDH12、DHRS9、RDH10、DHRS3、LRAT等基因参与代谢。
2.4.2 环境信息处理 环境信息处理(Environmental information processing)可分为膜转运(Membrane transport)、信号转导(Signal transduction)、信号分子及其相互作用(Signaling moleculesand interaction)共3个代谢通路。在肾皮质细胞中DEGs主要富集在信号转导和信号分子及其相互作用。
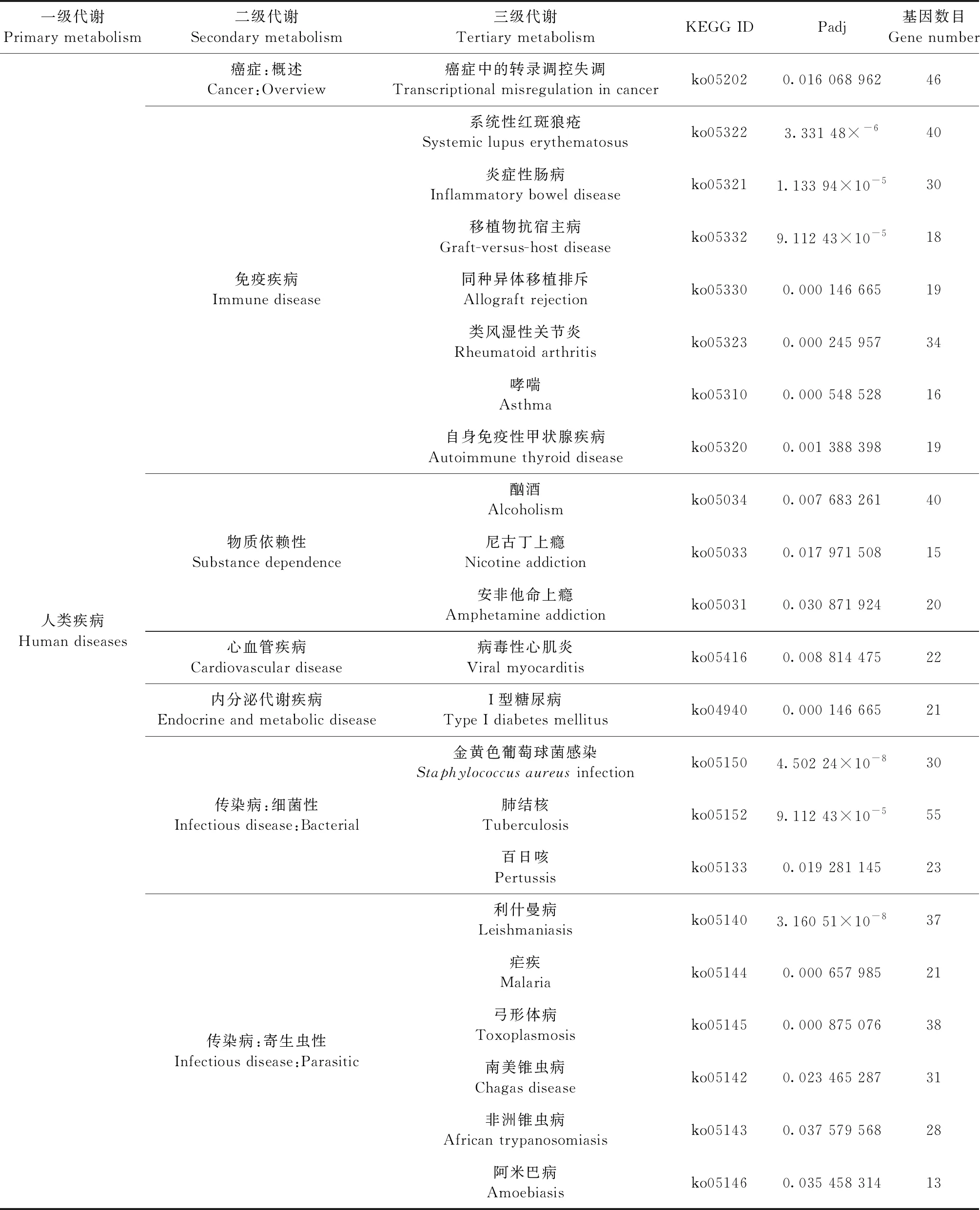
续表2
在信号传导途径中,61个DEGs参与钙信号通路(Calcium signaling pathway),如GNA15、PRKCB、NOS2、PDGFRB、AVPR1A等基因。48个DEGs参与JAK-STAT信号通路(JAK-STAT signaling pathway),如CNTF、PIK3R3、OSMR、IL7、SOS1等基因。84个DEGs参与PI3K-Akt信号通路(PI3K-Akt signaling pathway),如SGK1、PIK3R3、IL2RG、TLR4、SOS1等基因。71个DEGs参与MAPK信号通路(MAPK signaling pathway),如HSPA1L、RAC2、DUSP6、TGFB2、IL1B等基因。
在信号分子及其相互作用途径中,CNTF、IL1RN、CCR1、IL2RG、CRLF2等100个DEGs涉及细胞因子-细胞因子受体相互作用(Cytokine-cytokine receptor interaction);C3、C5AR1、ADORA1、CYSLTR2、TRPV1等107个DEGs涉及神经活性配体受体相互作用(Neuroactive ligand-receptor interaction);LOC105064248、SELPLG、ICAM3、ITGB7、CD28等42个DEGs涉及细胞黏附分子(Cell adhesion molecules);COL2A1、COL6A1、ITGB3、TNXB、ITGB7等27个DEGs涉及ECM受体相互作用(ECM-receptor interaction)。
2.4.3 细胞过程 细胞进程分为运输和分解代谢(Transport and catabolism)、细胞生长与死亡(Cell growth and death)、细胞活性(Cell motility)等5个二级代谢途径。根据KEGG分析结果显示,在肾皮质细胞中共有50个DEGs富集在运输和分解代谢中的吞噬体(Phagosome),主要有MSR1、ITGB2、CTSS、ATP6V0D2、TLR4等基因参与吞噬体的途径。
2.4.4 有机体系统 有机体系统(Organismal systems)主要包括免疫系统(Immune system)、循环系统(Circulatory system)、消化系统(Digestive system)、神经系统(Nervous system)和感觉系统(Sensory system)等9个系统。根据KEGG分析结果显示,在肾皮质细胞中共有306个DEGs涉及免疫系统;主要有CD14、CSF1R、IL1A、IL7、EPO等50个基因参与造血细胞谱系(Hematopoietic cell lineage);IL2RG、DLL1、IFNGR1、FOS、JAK3等35个基因参与Th1和Th2细胞分化(Th1 and Th2 cell differentiation);C3、C5AR1、MASP2、MBL2、KLKB1等30个基因参与补体和凝血级联(Complement and coagulation cascades);TYROBP、FCER1G、ITGB2、PIK3R3、SOS1等33个基因参与自然杀伤细胞介导的细胞毒性(Natural killer cell mediated cytotoxicity);LOC105064248、CD86、ITGB7、IL5、TNFRSF13C等20个基因参与肠道免疫网络的IgA生产(Intestinal immune network for IgA production);PRKCB、TIAM1、SOS1、CCR4、GRK4等48个基因参与趋化因子信号通路(Chemokine signaling pathway);CD74、HSPA1L、CTSS、HSPA2、CD4等22个基因参与抗原处理和递呈(Antigen processing and presentation);FCER1G、FERMT3、PIK3R3、BTK、ITGB3等37个基因参与血小板激活(Platelet activation);IL2RG、IRF4、IFNGR1、FOS、MAPK11等31个基因参与Th17细胞分化(Th17 cell differentiation)。
38个DEGs涉及循环系统中的血管平滑肌收缩(Vascular smooth muscle contraction),分别有NPPC、PRKCBPLCB2、GNA11、ADM、AVPR1A等基因。
51个DEGs涉及消化系统;主要有SLC38A2、KCNK5、ATP1B2、COL2A1、SLC1A5等29个基因参与蛋白质消化吸收(Protein digestion and absorption);PRKCB、ATP1B2、PLCB2、KCNJ15、KCNJ1等22个基因参与胃酸分泌(Gastric acid secretion)。
33个DEGs涉及神经系统中的含血清素的神经突触(Serotonergic synapse),主要有PRKCB、NRAS、PLCB2、ALOX5、SLC18A2等基因参与。
39个DEGs涉及感觉系统中的破骨细胞分化(Osteoclast differentiation),主要有TREM2、TYROBP、SPI1、PIK3R3、IL1B等基因。
2.5 筛选参与高盐代谢的重要基因 本试验对高渗组和对照组的KEGG差异途径的对比结果显示,筛选出了多个参与高盐调控的重要基因(表3)。提示这些基因的表达可能与双峰驼肾皮质细胞耐受高盐的机制有关。

表3 参与双峰驼肾皮质细胞高盐调控的重要基因
3 讨论
高盐环境是影响动物生长发育的逆境之一。长期采食高盐食物,将导致血液中钠离子滞留,保水能力提升,造成高血压等疾病[4]。然而双峰驼长期摄入高盐碱食物不会出现高血压等病症,说明为了适应高盐环境,双峰驼在进化过程中形成了特殊的高盐代谢机制。盐分调节是细胞基础生理活动之一。目前肾皮质细胞在高盐环境下的适应和保护机制仍然有很多未知的地方。
GO富集分析显示,高盐诱导下DEGs主要在免疫途径、离子运输途径、质膜部分、物质活动途径和物质结合途径显著富集。其中在BP中,DEGs重点富集在免疫相关的途径:免疫系统过程、免疫反应等。研究表明,钠离子在组织中积聚会引起炎症[5]。参与炎症反应的免疫细胞可以对高血压进行调控。高盐造成的渗透压升高,会促进巨噬细胞、T淋巴细胞等免疫细胞的活性并渗入肾脏,进而影响高血压的发生[6]。可以推测免疫途径在调控高盐诱导的高血压中发挥重要的作用。DEGs还显著富集在离子运输相关的途径:钾离子运输、钠离子传输等。这些离子的运转在渗透调控中发挥重要作用。钠、钾离子是水盐代谢的重要组成成分,细胞外液钠离子的浓度是决定细胞外液渗透压的主要因素。可以推测双峰驼通过细胞内离子的运输来调节高盐对机体的影响,确保细胞的渗透压能够维持在正常的生理水平。
在CC方面,DEGs重点富集在胞外区、细胞外围等;还富集在各种蛋白复合物的合成途径:MHC蛋白复合物、MHCⅡ类蛋白复合物和DNA包装复合物等;富集在质膜相关途径:质膜、质膜部分、质膜蛋白复合物等。说明高盐主要作用于质膜部分和各种大分子复合物的合成。
在MF中,高盐下的DEGs主要富集在物质活动相关的途径:G蛋白偶联受体活动、核酸结合转录因子活动、离子通道的活动等;还富集在物质结合相关的途径:受体结合、序列特异性DNA结合等。这些途径的富集,表明高盐的摄入会导致各种蛋白质的合成和跨膜相关活动的发生。推测高盐可以通过调控各种大分子活动,响应高盐诱导对肾皮质细胞的影响。
KEGG富集分析表明,双峰驼肾皮质细胞在高盐诱导下,DEGs主要富集在辅助因子和维生素代谢、信号转导、信号分子相互作用、运输和分解代谢、免疫系统等途径。本试验结果表明,参与调控代谢的信号传导通路可能帮助双峰驼在高盐环境的胁迫下产生一系列的适应和保护机制。一些重要的基因参与信号通路的调控:AVPR1A、SOS1、TGFB1参与钙离子信号通路、JAK-STAT信号通路和MAPK 信号通路。
AVPR1A基因在钙离子信号通路上调表达。AVPR1A是精氨酸加压素(AVP)的受体。AVP已知在高渗刺激下水平会不断升高,持续升高的AVP可以刺激肾小管细胞增殖[7],还可以刺激肾皮质集合管进行尿浓度的调节,并且AVP可以依赖水通道蛋白2 (AQP2)介导加压素调节的水分重吸收[8]。因此可以推测AVPR1A基因可能参与AVP介导的肾皮质肾小管上皮细胞在高盐刺激下的增殖,还可能参与肾皮质集合管的水分重吸收。
JAK-STAT信号通路在细胞因子介导的免疫调节中发挥重要的作用,并参与细胞的增殖、分化、凋亡[9]。有研究表明,SOS1和SOS2基因可以对外周T细胞的信号传导和功能产生作用[10]。而且SOS2在肾脏的发育过程中发挥重要作用,敲除SOS2基因会造成肾小管形态发生改变[11]。可以推测SOS家族基因可能调控肾脏的发育,对高盐环境下皮质肾小管的形态的维持发挥作用,还可以推测SOS1在JAK-STAT信号通路的上调,能够促进免疫细胞的产生来调节高盐诱导的免疫反应。
TGFB1基因参与 MAPK信号通路。TGFB1是TGFBs转化生长因子家族成员之一。TGFB1已知可通过Smad4依赖途径降低肾皮质集合管细胞上皮钠通道(ENaC)功能[12]。并且TGFB1基因可以阻断醛固酮对ENaC活性和钠转运的刺激作用,还可以降低ENaC的表达和钠泵功能[13]。在本试验的高盐诱导下,TGFB1基因在MARK信号通路中显著下调,推测其促进了ENaC的活性并激活了肾皮质集合管细胞上的钠运转。
Toll样受体(TLR)是存在于细胞表面的跨膜蛋白,对机体免疫具有重要意义。最近的研究证明,TLR在肾脏疾病的发生机制中发挥着重要作用[14]。其中,Toll样受体2(TLR2)、Toll样受体4(TLR4)在运输和分解代谢中的吞噬体途径发挥作用。激活TLR2和TLR4可以导致肾小管上皮细胞中促炎细胞因子(TNF、IL-6、IL-1α)的合成与分泌增多[15]。TLR4在血管紧张素Ⅱ(AngⅡ)诱导的肾小管上皮细胞中参与高血压肾损害的微炎症反应[16]。推测在高盐调控下,双峰驼肾皮质细胞TLR2、TLR4基因表达的下调可能通过减少高盐对肾细胞的炎症反应的发生,从而发挥高盐耐受的作用。
综上所述,本试验利用转录组测序分析,针对双峰驼肾皮质细胞进行研究,旨在从基因层面了解双峰驼适应高盐环境的根本原因,从而筛选出参与高盐调控一系列候选基因。这些在富集途径中高表达的基因,是双峰驼适应高盐环境的基础,丰富了我们对双峰驼盐分调节分子机制的认知,为解释双峰驼在极端环境下独特的生理特性提供了重要参考,也为未来高血压的防治提供了新思路。
