RNA结合蛋白Rbm38在小鼠胚胎造血发育中的功能研究*
2022-05-31吴知晓宁小伟赵海鑫
吴知晓, 宁小伟, 赵海鑫, 周 杰, 柳 迪, 刘 兵,△, 兰 雨△
(1暨南大学基础医学与公共卫生学院血液学研究所,广东 广州 510632;2中国人民解放军军事科学院军事医学研究院,北京 100850;3解放军总医院第五医学中心,北京 100071;4北京大学生命科学中心,北京 100871)
血液是生命的源泉,在机体生命活动中需要源源不断地产生,从而维持机体的不同需求。造血干细胞是一群具有自我更新能力及多系分化潜能的细胞[1],是补给这些血液细胞的关键来源。在哺乳动物中,造血干细胞主要发生于胚胎主动脉-性腺-中肾(aorta-gonad-mesonephros,AGM)区。这些造血干细胞被证明是由一群具有生血潜能的内皮细胞[2-3],即生血内皮细胞,通过内皮造血转化(endothelial-to-hematopoietic transition,EHT)过程发育而来[3-4]。随后,这些新生成的造血干细胞会通过血液循环进入胎肝扩增,并最终定植于骨髓发挥造血作用。由于参与内皮造血转化过程的细胞数量十分稀少,且时间窗口转瞬即逝[5],目前对造血干细胞发育的调控机制研究仍存在较多未知性。
RNA 是细胞内广泛存在的生物大分子,除了作为遗传物质参与基因的转录和翻译过程外,其在不同的时间与空间范围内会呈现出多种表达与修饰状态,从而精确地调控细胞的命运。哺乳动物,包括人与小鼠的单细胞转录组学研究结果显示,造血干细胞发育过程中,尤其是生血内皮细胞和造血干细胞前体阶段,均能够显著富集RNA 代谢、加工等生物学事件[6-7],这提示转录后调控在造血干细胞生成过程中可能发挥着关键作用。进一步地,Wang 等[8]系统描绘了小鼠造血干细胞发育全程的RNA 剪接图谱,发现小鼠造血干细胞在发育的不同时段会表达阶段特异性的转录本,这些可变剪接通过调控转录因子Runx1 及Myb 的表达,进而推动造血干细胞的正常发生。同样的,也有报道RNA 的m6A 甲基化修饰状态影响内皮与造血基因的表达平衡,从而决定着细胞的内皮与造血命运[9]。除mRNA 外,非编码RNA,如长链非编码RNA(long non-coding RNA,lncRNA),在内皮向造血转化的关键群体中也呈现出阶段性的表达模式。H19 lncRNA 在造血干细胞前体阶段中特异性高表达,通过抑制甲基转移酶的活性去甲基化造血转录因子的启动子区域,从而激活目的基因的表达,促进造血干细胞前体向造血干细胞的特化[10]。
RNA 结合蛋白(RNA-binding protein,RBP)是一类通过结合RNA 参与RNA 转录及转录后调控(包括剪接、多聚腺苷酸化、定位、降解和翻译)的蛋白,在RNA 介导的细胞命运决定中扮演着关键角色,如usashi-2 通过调控靶RNA(如TGF-β)的代谢和转录维持造血干细胞的自我更新、稳态及髓系偏向分化[11]。近期,Ren 等[12]的研究显示RNA 结合蛋白还能够通过RNA 非依赖的方式调控单核细胞的分化,QKI5 可直接结合染色质DNA 促进下游基因的转录过程。这些研究结果提示,RNA 结合蛋白在造血干细胞发生的命运选择过程中可能也发挥了重要的作用,但是目前还缺乏足够的证据。
Rbm38(Rnpc1)已被报道能够调控多种肿瘤抑制因子,如p53 和p21 的mRNA 翻译,从而参与细胞周期及细胞分化的过程,因而受到了广泛的关注[13]。近些年发现,其在造血系统中发挥着部分作用。例如,2017年,Alvarez-Dominguez 等[14]的研究结果显示Rbm38 是一种红系特异的翻译调节子,在红系终末分化阶段表达上调,可通过与翻译启动子复合物的相互作用促进红细胞内的蛋白翻译。敲除Rbm38能够引起成体小鼠血红蛋白降低、脾大、髓外造血增加等多种血液系统缺陷[15]。以上结果提示Rbm38在部分造血谱系分化的过程中起到调控作用,但其功能仍有待进一步解析,尤其是Rbm38 在造血干细胞发生时期的功能更是鲜有报道。本项工作将通过分析造血干细胞发育过程中各群体的单细胞转录组数据,分析Rbm38 在内皮向造血干细胞前体转化阶段的表达,并结合体内外功能实验探究Rbm38 在造血干细胞发生过程中的作用。
材料和方法
1 材料
1.1 实验动物 10~11 周龄无特定病原体(specific pathogen-free,SPF)级雌雄F1 代Rbm38基因敲除小鼠(C57 背景来源)由北京百奥赛图基因生物技术有限公司构建【动物质量合格证号:SCXK(京)2019-0001】,20~22 g,雌雄各3 只。SPF 级10~11 周龄雌性C57 背景的CD45.1/2 受体小鼠(共6 只),体重20~22 g,由 本 实 验 室 繁 育 得 来。10~11 周 龄SPF 雌 性C57/BL6小鼠若干,体重18~22 g,购自斯贝福(北京)生物技术有限公司【动物质量合格许可证号:SCXK(京)2019-0010】,用于繁殖基因型为Rbm38+/-的雌雄鼠。所有小鼠均饲养在军事科学院军事医学研究院实验动物中心的SPF 级小鼠饲养房【动物关怀及使用许可证号(IACUC):IACUC-DWZX-2021-056】。
1.2 主要试剂 α-MEM 培养液购自Gibico;胎牛血清(fetal bovine serum,FBS)、Ⅰ型胶原酶(collagenaseⅠ,COL Ⅰ)、牛血清白蛋白(bovine serum albumin,BSA)均购自Sigma;青/链霉素(penicillin streptomycin,PS)购自HyClone;D-PBS 溶液购自天津市灏洋生物制品科技有限责任公司;甲基纤维素半固体培养 基 购 自STEMCELL;2×BlueStar Master Mix 购 自MCLAB;CD45.1 APC 和CD45.2 PE流式抗体均购自eBioscience;小鼠基因型快速鉴定试剂盒购自北京阳光英锐生物科技公司;红细胞裂解液和抗凝剂为实验室自配。
2 实验方法
2.1 小鼠胚胎AGM 区及卵黄囊(yolk sac,YS)取材 10~11周龄SPF级基因型为Rbm38+/-的杂合型雌雄鼠(C57 背景),体重20~22 g,将雌雄鼠合笼后,次日中午见到白色阴栓记为胚胎期0.5 d(embryonic day 0.5,E0.5)。颈椎脱臼(断颈)处死E11.5 基因型为Rbm38+/-的雌鼠(共5 只),在75%乙醇中浸泡3 min,将小鼠平放在10 cm皿上充分暴露腹部皮肤,用剪刀和镊子将腹部皮肤剪开,取出串珠样孕囊,在解剖显微镜下分离成单个孕囊,从单个孕囊的两侧子宫角撕开,分离胎盘,获得由卵黄囊包裹的胚胎,用镊子撕开卵黄囊,截断脐血管和卵黄血管后分离E11.5小鼠胚胎(体节数约为46~47个)和卵黄囊(用作备用),从胚胎上肢芽下方和下肢芽上方截断背脊侧,分离原肠后得到含有AGM 区的组织,将组织平放,可以看到AGM 区与周围组织存在明显界限,钝性分离后即得到实验所需AGM区,分别将AGM区和卵黄囊放进已提前加入200 μL 含10% FBS α-MEM培养液的1.5 mL小型离心管中,编号后以作备用。
2.2 单细胞悬液制备 将含有目的组织(AGM区和卵黄囊)的离心管,310×g离心3 min,弃上清,卵黄囊组织每管加入400 μL 0.1%Ⅰ型胶原酶,AGM 区组织每管加入200 μL 0.1%Ⅰ型胶原酶,用力摇晃1 min,37 ℃金属浴消化20~30 min,每隔5 min 摇晃一次样品管观察消化效果,消化结束后向得到的均一液体中加入双倍体积含10% FBS 的α-MEM 培养液进行中和,310×g离心6 min,弃上清,用1 mL 含2%FBS/PBS 的溶液重悬获得单细胞悬液,计数,以作备用。
2.3 PCR鉴定小鼠胚胎/成体小鼠基因型
2.3.1 小鼠胚胎组织基因型鉴定 在解剖显微镜下取出小鼠胚胎鼠尾放进已提前加入50 μL 新鲜配制组织消化液的1.5 mL EP 管中,75 ℃金属浴15 min,待样本冷却,13 523 ×g离心2 min,上清液即为小鼠胚胎组织的DNA 样本,按照20 μL 配制PCR 反应体系,PCR 反应条件:95 ℃3 min;94 ℃10 s、62 ℃10 s、72 ℃20 s,反应32 个循环;72 ℃5 min,冷却至4 ℃,待反应结束后,将产物点样至提前配制并冷却好的2%琼脂糖凝胶中,电泳30 min 后,通过全自动电泳凝胶成像分析仪观察条带的大小和位置以鉴定基因型。将鉴定结果按照基因型的不同将实验分为实验组和对照组,实验组小鼠胚胎基因型为Rbm38-/-,认为是敲除型胚胎,对照组小鼠胚胎基因型为Rbm38+/+和Rbm38+/-,分别认为是野生型胚胎和杂合型胚胎。
2.3.2 成体小鼠鼠尾基因型鉴定 用剪刀剪取新生3 周龄成体小鼠鼠尾尖端放入1.5 mL 离心管,后续操作同小鼠胚胎组织基因型鉴定。认为基因型为Rbm38-/-是敲除型小鼠,认为基因型是Rbm38+/+是野生型小鼠,认为基因型Rbm38+/-是杂合型小鼠。根据基因型鉴定结果保留基因型为Rbm38+/-的杂合型雌雄鼠。
2.4 体外造血细胞集落形成实验 采用前期已经报道的实验方法[16-17]。每个35 mm 培养皿(Petri dish)中加入2 mL 甲基纤维素半固体培养基,分别将实验组(共计获得5 个基因型为Rbm38-/-的敲除型胚胎)和对照组(共计获得5个胚胎,其中有2个基因型为Rbm38+/-的杂合型胚胎,3 个基因型为Rbm38+/+的野生型胚胎)中消化好的AGM 区和卵黄囊的单细胞悬液分别按照1 个和1/2 个胚胎当量(embryo equivalent,ee)接种至培养皿中,轻柔吹打混匀,避免产生过多气泡,做好标记,将培养皿放置在5% CO2、37℃饱和湿度培养箱培养7 d 后,观察各类集落形态,包括粒细胞/巨噬细胞集落(colony-forming unit-granulocyte and macrophage,CFU-GM)和混合系细胞集落(colony-forming unit-mix,CFU-Mix)形态,并记录集落数量。
2.5 受体移植实验(AGM区直接移植)
2.5.1 受体小鼠准备 采用前期已经报道的实验方法[18-19]。将10~11 周龄雌性C57 背景的CD45.1/2受体小鼠(n=6),体重20~22 g,置于照射专用鼠盒,放置于照射专用台进行小鼠全身60Co 照射,4.5 Gy两次剂量照射(每次间隔2 h),照射结束后放回SPF级小鼠动物房,在4 h内完成受体小鼠的移植。
2.5.2 供体细胞制备 同方法2.2 制备AGM 区单细胞悬液,放于4 ℃冰箱备用。总计获得3个基因型为Rbm38-/-的敲除型胚胎,2 个基因型为Rbm38+/-的杂合型胚胎和1个基因型为Rbm38+/+的野生型胚胎。
2.5.3 保护细胞制备 颈椎脱臼(断颈)处死一只CD45.1/2小鼠,取一条股骨用2%FBS/PBS 反复冲洗至股骨发白,吹打混匀并计数,置于4 ℃冰箱备用。
2.5.4 尾静脉注射 按照每个受体鼠2×104个骨髓保护细胞与供体细胞混合均匀后经尾静脉注射移植入受体小鼠体内。
2.5.5 外周血嵌合率检测 分别在第4、8、12 和16周对各受体小鼠进行尾静脉采血(约20 μL),置于已加入200 μL 抗凝剂的1.5 mL 离心管中,310×g离心6 min,弃上清,按照CD45.1 APC 和CD45.2 PE 流式抗体说明书配制抗体,4 ℃避光15 min,然后加入800 μL 红细胞裂解液裂解10~15 min(视采血量多少而定),用双倍体积的PBS 溶液进行中和,310×g离心6 min,弃上清,加入100 μL PBS 溶液重悬细胞,用BD FACSCalibur 检测外周血嵌合率,以评估供体细胞是否重建了受体小鼠的造血系统(认为嵌合率≥5%为重建成功)。
3 统计学处理
流式数据由FlowJo_V10分析。其余实验数据由GraphPad Prism 8.3.0 处理,计量资料采用均数±标准差(mean±SD)表示。用秩和检验和t检验进行差异性分析,以P<0.05为差异有统计学意义。
结果
1 Rbm38 分子在造血干细胞发育过程中不同阶段的表达情况
造血干细胞发育是一个复杂的动态过程,基于前期本实验室在单细胞水平上用CD41-CD43-CD45-CD3 1+CD201-Kit-CD44+[8],CD41-CD43-CD45-CD31+CD20 1+Kit+CD44+[18], CD31+CD45-CD41lowKit+CD201high、CD31+CD45+Kit+CD201high、 Lin-Sca-1+Kit+CD201+和CD45+CD201+CD48-CD150+(ESLAM)[7]这几组细胞表面分子标志组合分别实现了对造血干细胞发育过程中的动脉内皮细胞(arterial endothelial cell,AEC)、生血内皮细胞(hemogenic endothelial cell,HEC)、Ⅰ型造血干细胞前体(type 1 pre-hematopoietic stem cell,T1 pre-HSC)、Ⅱ型造血干细胞前体(type2 prehematopoietic stem cell,T2 pre-HSC)、胚胎12 d 造血干 细 胞(embryo 12 hematopoietic stem cell,E12-HSC)、胚胎14 d 造血干细胞(embryo 14 hematopoietic stem cell,E14-HSC)以及成体造血干细胞(adult hematopoietic stem cell,Adult HSC)这7 个群体的高度富集,并对这7 个群体进行了单细胞转录组测序,通过数据分析显示约30 种RNA 结合蛋白基因在造血干细胞发育过程中具有差异性表达,且不同的RNA 结合蛋白具有不同的表达模式,其中Rbm38分子差异表达较为明显,见图1A。尤其是在动脉内皮细胞向生血内皮细胞和Ⅰ型造血干细胞前体的转化过程中,Rbm38的RNA水平显著增加,并且在后续造血干细胞成熟的过程中维持高水平表达,见图1B。
2 Rbm38基因敲除小鼠模型的构建
基于上述单细胞测序数据分析的结果,利用CRISPR/Cas9技术构建了Rbm38基因敲除小鼠模型。通过在NM_019547 转录本的1 号外显子上游和3 号外显子下游的非保守区域设计了两条小向导RNA(small guide RNA,sgRNA),从而在Rbm38基因中产生4 kb 的染色体缺失,这种染色体片段的缺失会导致Rbm38基因无法正常转录与翻译,从而造成该基因的敲除,见图2。Rbm38杂合型敲除小鼠发育正常,且能够正常繁育。本实验室将获得的杂合型敲除小鼠相互自交,从而获得E11.5Rbm38敲除小鼠胚胎。利用PCR 方法鉴定胚胎基因型用作后续实验。
3 Rbm38 对AGM 区和卵黄囊生成造血祖细胞的能力的影响
取材实验组和对照组E11.5 小鼠胚胎显示,实验组和对照组胚胎均发育正常,体节大小相近(46~47 个体节),见图3A。CFU-C 实验显示,对照组和实验组均产生较多数量的粒细胞/巨噬细胞集落和以红系为主的混合系细胞集落,形态上均无显著差异,见图3B。对实验组和对照组集落形成数量进行秩和检验差异性分析,统计分析结果显示,AGM区和卵黄囊在甲基纤维素半固体培养基中形成的集落数量无统计学差异(P>0.05),见图3C、表1。
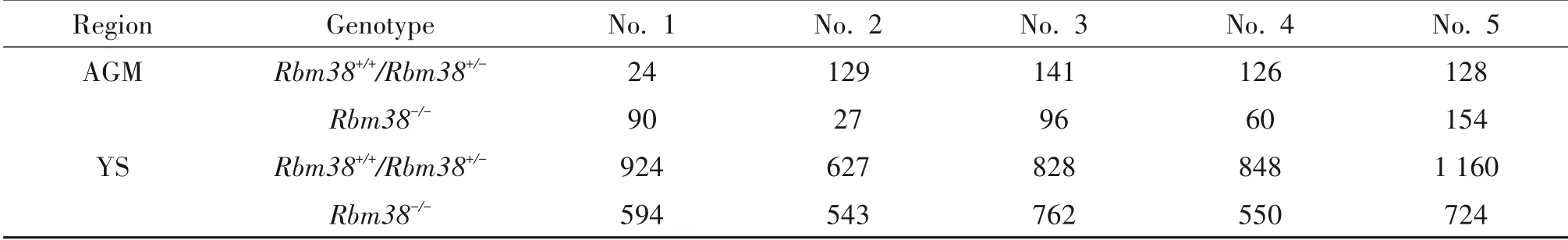
表1 AGM区和YS体外集落形成数量Table 1. Numbers of colony-forming units of aorta-gonad-mesonephrosn(AGM)region and YS(n=5)
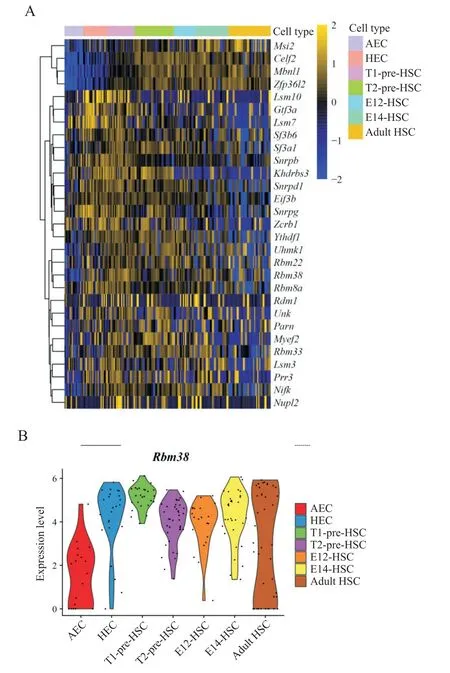
Figure 1. Expression of Rbm38 molecule at different stages during hematopoietic stem cell development. A:heat map of RNA-binding protein gene expression in different cell types during hematopoietic stem cell development,colors represent the intensity of gene expression;B:violin plot showing the expression of RNA-binding protein Rbm38 in 7 cell clusters related to generation and maturation of hematopoietic stem cell. The result suggests the Rbm38 was significantly up-regulated during the transition from arterial endothelial cell to hemogenic endothelial cell and maintained at a relatively high level during subsequent hematopoietic stem cell maturation.图1 Rbm38分子在造血干细胞发育过程中不同阶段的表达情况
4 Rbm38对AGM区产生造血干细胞的作用
为进一步探究敲除Rbm38是否会影响AGM 区产生功能性的造血干细胞(具有移植重建能力)。流式分析结果显示,对照组和实验组AGM 区来源的细胞均能够在受体小鼠体内重建造血系统(嵌合率≥5%),见图4A;对外周血嵌合率进行t检验差异性分析,统计分析结果显示,实验组和对照组外周血嵌合率无统计学差异(P>0.05),见图4B。
讨论
本项工作通过分析小鼠造血干细胞起源相关细胞群体的单细胞转录组测序数据,结果显示RNA 结合蛋白分子Rbm38在动脉内皮向生血内皮转化过程中表达水平明显升高,且在后续造血干细胞成熟过程中维持较高水平表达,提示其在内皮-造血转化的起始阶段具有潜在的调控功能以及在造血干细胞的分化和成熟过程中可能发挥着至关重要的作用。而以往关于Rbm38的研究主要报道它通过稳定细胞周期蛋白p21 等从而在疾病的发生发展中发挥一定的调控作用[20-21]。已知在小鼠胚胎期内皮向造血转化阶段细胞周期活跃[18],再结合Zhang 等[15]报道了Rbm38 对小鼠成体稳态造血至关重要,于是我们构建了Rbm38基因全敲除小鼠,结合体内外功能实验以进一步探讨Rbm38对胚胎期造血干细胞生成过程的影响。
在造血祖细胞生成相对丰富的E11.5 发育阶段,我们没有观察到明显的胚胎发育异常。同时,体外造血细胞集落形成实验提示,敲除Rbm38并不影响AGM 区和卵黄囊造血祖细胞的生成数量和分化功能。进一步的体内移植实验表明敲除Rbm38不影响AGM 区产生功能性的造血干细胞。这些结果说明Rbm38对胚胎期造血干细胞的生成没有明显的影响,本项工作初步探索了Rbm38 在胚胎期造血干细胞生成过程中的作用,为未来研究RNA 结合蛋白介导的转录后调控对于造血干细胞生成的影响提供了分子基础。
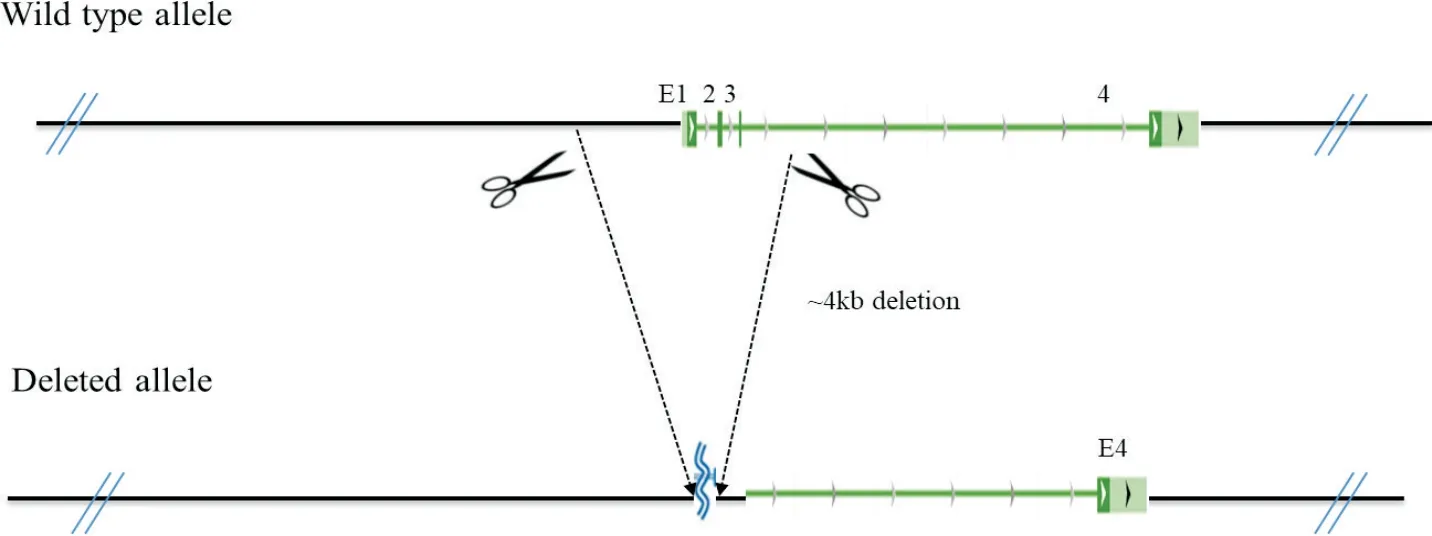
Figure 2. The targeting strategy of Rbm38 gene knockout mice. Two sgRNAs were designed to generate a 4 kb chromosomal deletion at the Rbm38 locus in the mouse genome. Note:this design is based on transcript NM_019547 of gene Rbm38.图2 Rbm38基因敲除小鼠模型的构建

Figure 3. The effect of Rbm38 in generating hematopoietic progenitor cell of aorta-gonad-mesonephrosn(AGM)region and yolk sac(YS). A:representative images of E11.5 Rbm38+/+and Rbm38-/-embryos;B:representative images of colony-forming units(CFU)of E11.5 AGM region and YS,the genotypes of the embryos were listed on the left;C:numbers of CFU of E11.5 AGM region and YS with the indicated genotype determined by methylcellulose CFU-culture assay. Mean±SD. n=5.图3 Rbm38对AGM区和卵黄囊生成造血祖细胞能力的影响
通过对胚胎和成体阶段造血干细胞的比较性分析,目前已有研究报道了一系列阶段特异性的造血调控关键分子,例如Bmi-1[22]和Lin28b[23]等,这些调节因子介导了胚胎期和成体期造血干细胞的细胞特性转变。因此,我们猜测,Rbm38在胚胎期和成体期可能对造血系统存在功能上的差异。另一方面,我们的单细胞测序的数据分析结果与2021年许亚菲等[24]的研究结果类似,多种RNA 结合蛋白分子在生血内皮细胞及Ⅰ型造血干细胞前体阶段特异性高表达,考虑到此时RNA 的代谢以及加工事件十分活跃[18],我们推测,多种RNA 结合蛋白分子很可能在内皮造血转化过程中协同促进了RNA 有关的转录后调控过程。一方面其他关键的RNA 结合蛋白在Rbm38敲除后可能代偿了其RNA加工方面的部分作用;另一方面,RNA 结合蛋白发挥作用的时期可能贯穿造血干细胞发生、成熟以及发挥造血功能等多个时期,Rbm38 是否参与造血干细胞在胎肝中的扩增以及后续的谱系分化值得我们进一步关注。有趣的是,RNA 结合蛋白分子ZFP36 家族成员Zfp36l2,单细胞转录组测序数据表明该分子的编码基因Zfp36l2显著表达于E12~E14胎肝中,敲除ZFP36I2的E14.5胎肝中造血祖细胞的数量明显减少[25],提示RNA 结合蛋白分子的确可能影响了胎肝中造血干细胞的生成。
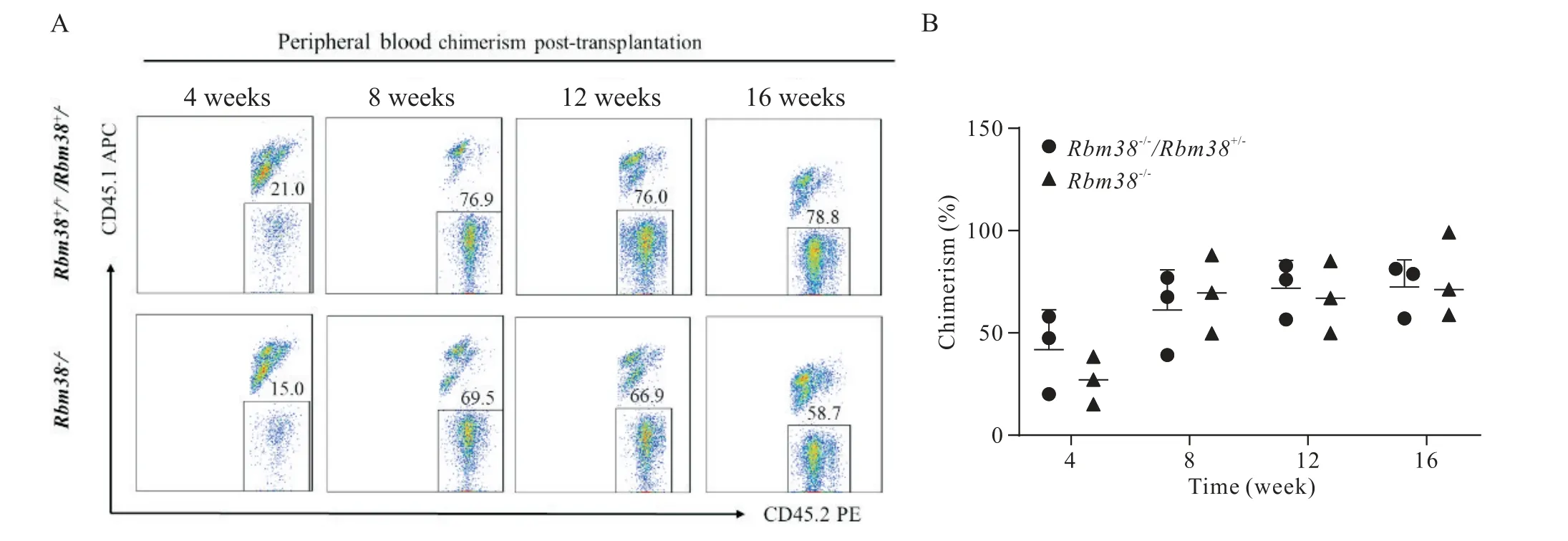
Figure 4. Identifying the specific role of Rbm38 in generating functional hematopoietic stem cell in aorta-gonad-mesonephrosn(AGM)region by in vivo transplantation assay. A:representative FACS plots display the donor chimerism of peripheral blood at 4 to 16 weeks post-transplantation in the indicated genotype;B:statistic analysis showing the donor chimerism at 4 to 16 weeks in the indicated genotype. Mean±SD. n=3.图4 Rbm38对AGM区产生造血干细胞的作用
传统的观点认为RNA 结合蛋白只能通过结合RNA 来间接调控基因的转录,然而近期越来越多的证据表明RNA 结合蛋白还可直接与染色质相互作用,影响靶基因的表达,可见RNA 结合蛋白分子的调控模式是十分复杂的。在后续的研究中,除了对已有单细胞转录组测序数据的挖掘外,系统描绘造血发生过程中与染色质相互作用的RNA 结合蛋白分布图谱,可能更有助于我们深入地理解RNA 结合蛋白调控细胞命运转变的分子机制,从而鉴定出内皮造血转化过程中发挥关键作用的RNA 结合蛋白分子,为解析造血干细胞起源和成熟过程中的分子调控规律和优化造血干细胞体外再生策略提供参考。
