内质网应激激活STING信号通路并降低胰岛β细胞活力*
2022-05-31彭荣东何学敏文哲瑶艾鹤英朱延华石国军陈燕铭
彭荣东, 何学敏▲, 王 瑨, 文哲瑶, 艾鹤英, 朱延华,鲁 岩, 石国军△, 陈燕铭△
(1中山大学附属第三医院内分泌与代谢病学科,广州市肥胖分子机理与转化重点实验室,广东省糖尿病防治重点实验室,广东 广州 510275;2中山大学附属第三医院临床免疫中心,广东 广州 510275)
糖尿病是一种以高血糖为特征,严重危害人类身心健康的慢性疾病,且目前尚未有治愈手段。糖尿病患者长期使用外源性药物,带来了严重的经济负担,大部分患者不能很好地控制血糖,从而诱发多种并发症,威胁着患者的健康和生命。因此,寻找更加有效的糖尿病治疗靶点是非常迫切的需求。炎症介导的胰岛β 细胞损伤是糖尿病发生和发展的关键特征[1]。研究证实,胰岛微环境存在多种促炎因子,而1型干扰素被认为是重要的炎症因子之一[2]。1型干扰素的主要来源之一是干扰素基因刺激因子(stimulator of interferon genes,STING)及其下游蛋白TANK 结合激酶1(TANK-binding kinase 1,TBK1)和干扰素调节因子3(interferon regulatory factor 3,IRF3)信号通路,在抵御病原体入侵、诱导炎症和细胞损伤等方面起着重要作用[3]。然而,STING 信号通路在糖尿病导致胰岛β 细胞损伤过程中的作用仍是未知的。
内质网应激(endoplasmic reticulum stress,ERS)是导致β 细胞损伤或死亡的另一个重要因素,比如在糖尿病发病前的非肥胖型糖尿病小鼠以及1 型和2型糖尿病(type 2 diabetes mellitus,T2DM)患者的胰岛中,可以检测到ERS 标志物C/EBP 同源蛋白(C/EBP homologous protein,CHOP)的积累[4-6],暗示了ERS 可能参与糖尿病状态下的胰岛β 细胞死亡。不能正确折叠的蛋白质堆积在内质网中,诱发长期不可逆的ERS,进而激活下游CHOP 通路,促进细胞死亡。一个非常直接的证据就是1 型糖尿病Akita 小鼠,由于其胰岛素前体第96 位的半胱氨酸突变成酪氨酸,导致另一个半胱氨酸不能与之形成二硫键来促进胰岛素前体的正确折叠,胰岛素前体持续堆积在胰岛β 细胞内,进而诱导β 细胞的ERS 和死亡[7]。另有研究证实,内质网分子蛋白激酶R 样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)的突变会影响蛋白质合成的调控,导致合成蛋白过多,从而诱发β 细胞凋亡[8]。此外,ERS还在多种疾病中促进炎症因子表达而导致细胞死亡,如早期酒精性肝病[9]、心脏炎症和纤维化[10]等。
目前已经有报道证实,ERS 与STING 信号通路的相互作用是导致心肌肥大、外伤性大脑损伤[11]和酒精性肝病[9]的重要致病因素。它们可以通过钙通量的改变和活性氧的产生密切联系[12],也可以直接相互作用来诱导炎症因子的表达[10]。鉴于STING 信号通路与ERS 的密切关系,以及糖尿病条件下炎症反应是导致胰岛β 细胞功能减退和耗竭的重要因素,本研究拟探讨胰岛β 细胞中是否存在STING 信号通路,以及ERS 下STING 信号激活对胰岛β 细胞活力的影响。
材料和方法
1 人胰岛单细胞RNA 测序(single-cell RNA se⁃quencing,scRNA-Seq)数据分析
从PubMed 上获取健康人和T2DM 患者的胰腺组织的RNA 测序数据集(ArrayExpress E-MTAB-5061)[13]并对其进行分析。通过筛选并排除线粒体含量>12%或待检测基因<200 的低质量细胞后,用Seurat 3.0 软件对数据集进行归一化、降维、缩减和聚类分析[14],最终筛选到了2 358 个胰腺细胞的数据,其中包括1 561个内分泌细胞。并根据相关激素基因的表达谱,把这些内分泌细胞聚集分成了5 个细胞簇[13]。然后,用Seurat 3.0 与ggplot2 R 包一起生成单独的UMAP 图和气泡图。未检测到靶基因mRNA 表达的患者数据不用于后续分析。分析工作流程如图1所示。
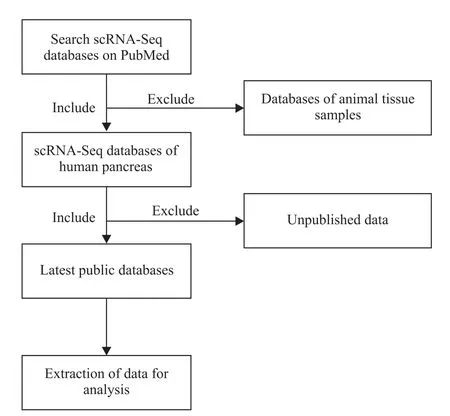
Figure 1. Flow chart of the searching strategy of human pancreatic scRNA-Seq databases.图1 人胰腺scRNA-Seq数据库筛选流程图
2 实验动物
4~6 周的雄性db/db小鼠[B6.BKS(D)-Leprdb/J)]和同窝野生型(wild-type,WT)小鼠购自Cavens 实验动物中心(中国常州),许可证号为SCNK(苏)2021-0013,每种5 只。所有小鼠均被饲养在SPF 级、温度(72±3°F)和空气(50±20%相对湿)恒定的房间中,接受12 h 的光照/黑暗循环,并给予标准饮食和自来水。饲养9 周后,将小鼠用过量的异戊巴比妥钠处死,摘取胰腺组织。此时,小鼠体重分别为(47.26±5.14)g和(28.32±1.33)g,血糖值分别为HI(超过血糖仪的测量范围)和(7.98±1.54)mmol/L。动物实验方案预先获得中山大学实验动物伦理委员会批准,动物实验程序均在《赫尔辛基宣言》指导下进行。
3 方法
3.1 免疫荧光染色 将分离的胰岛组织进行固定、脱水、石蜡包埋和切片。切片再经过一系列的脱蜡和复水步骤,并用柠檬酸缓冲液进行抗原修复,再用1%牛血清白蛋白和0.3% Triton X-100 的封闭液进行破膜和封闭;之后向切片加入抗STING 抗体和抗胰高血糖素(glucagon)抗体(Cell Signaling Technology)于4 ℃中孵育过夜,然后用Alexa Fluor 488 偶联山羊抗小鼠Ⅱ抗、Alexa Fluor 647 偶联山羊抗兔Ⅱ抗和DAPI(Cell Signaling Technology)进行染色[15]。我们使用DMI8 徕卡显微系统对组织切片进行观察和成像。每组均有5个样本。
3.2 细胞培养及处理 小鼠胰岛β 细胞系Min6、NIT-1 和beta-TC-6 购自广州亚历山生物医药公司;高表达STING 蛋白的阳性对照细胞——小鼠巨噬细胞系RAW264.7[16]购自广州剪刀手基因技术有限公司。Min6 和NIT-1 细胞使用添加了1×105U/L 青霉素、100 mg/L 链霉素,100 μmol/L β-巯基乙醇和10%胎牛血清(HyClone)的RPMI-1640 培养液,而beta-TC-6 和RAW264.7 细胞使用添加了1×105U/L 青霉素、100 mg/L 链霉素和10%胎牛血清的DMEM 培养液。所有细胞均置于37 ℃、5%CO2浓度的细胞培养箱中培养。我们将细胞种于6 孔板,当细胞密集度达到70%~80%就进行药物处理。STING 信号通路激动剂5,6-二甲基呫吨酮-4-乙酸(5,6-dimethylxanthenone-4-acetic acid,DMXAA;MedChemExpress)的处理浓度为50 mg/L[16],用7.5%碳酸氢钠(NaHCO3)溶液作为对照。ERS 激动剂类胡萝卜素(thapsigargin,TG;MedChemExpress)的处理浓度为0.5 μmol/L[17],以同体积的二甲基亚砜(dimethyl sulfoxide,DMSO)溶剂作为对照。细胞处理结束后,分别通过Western blot 分析和RT-qPCR 检测STING 信号通路的蛋白和mRNA 表达水平。每组样品均有3 个重复实验。
3.3 Western blot 分析 用含有蛋白酶和磷酸酶抑制剂的1×SDS 裂解液处理细胞获得细胞裂解液,再用聚丙烯酰胺凝胶电泳分离等量(30 μg)的蛋白质样品,然后转移到固定化转移到PVDF 膜(Millipore)。PVDF 膜在5%牛奶中进行室温封闭1 h,然后加入抗STING 抗体(13647S,Cell Signaling Technology)、抗p-TBK1 抗体(5483S,Cell Signaling Technology)、抗TBK1 抗体(38066S,Cell Signaling Technology)、抗p-IRF3 抗体(29047S,Cell Signaling Technology)、抗IRF3抗体(4302S,Cell Signaling Technology)、抗β-actin 抗体(A5441,Sigma)及抗GAPDH 抗体(2118S,Cell Signaling Technology)于4 ℃孵育过夜。在室温孵育Ⅱ抗2 h 后,用HRP 底物ECL(Bio-Rad)对印迹进行显像,通过ChemiDocTM XRS+成像系统(Bio-Rad)进行成像扫描,并用ImageJ 软件对蛋白的灰度值进行统计[18]。每组样品均有3 个重复实验。
3.4 RT-qPCR 首先用Trizol 试剂(Sigma)提取细胞 总RNA,再 用PrimeScript ™RT reagent Kit with gDNA Eraser 试剂盒(TaKaRa)进行逆转录以生成模板cDNA。随后使用TB Green®Premix Ex Taq™II 试剂盒(TaKaRa)在ABI QuantStudio 5 PCR 系统上进行荧光定量PCR,反应体系依据产品制造商的指示进行。将目的基因与内参照GAPDH 进行归一处理,得到目的基因mRNA 的相对表达水平[3]。本研究所使用的mRNA特异性引物序列见表1。每组样品均有3个重复实验。

表1 RT-qPCR引物序列Table 1. Sequences of the primers for RT-qPCR
3.5 CCK-8 法检测细胞活力 将消化下来的细胞,按照每孔2×104个接种于含完全培养液的96孔板中,置于37 ℃、5% CO2的细胞培养箱过夜贴壁,然后进行相应的细胞处理。处理完毕,按照CCK-8 试剂盒(DOJINDO)的实验步骤检测细胞活力,然后将各组数值与对照组进行归一化,以相对活力来表示[19]。每组样品均有3个重复实验。
4 统计学处理
采用GraphPad Prism 8 软件进行统计分析。数据以均数±标准误(mean±SEM)表示。符合正态分布的计量资料,两组间比较采用t检验,多组间比较采用方差分析;非正态分布的计量资料,则采用Mann-Whitney检验。以P<0.05为差异有统计学意义。
结果
1 通过已发表scRNA-Seq 数据库鉴定并比较健康人和T2DM 患者胰岛β 细胞的STING 信号通路基因表达情况
ArrayExpress E-MTAB-5061 数据库包括6 例健康供体和4例T2DM 患者供体,其性别、年龄、体重指数(body mass index,BMI)和HbA1c 等基本临床信息列于表2[13]。
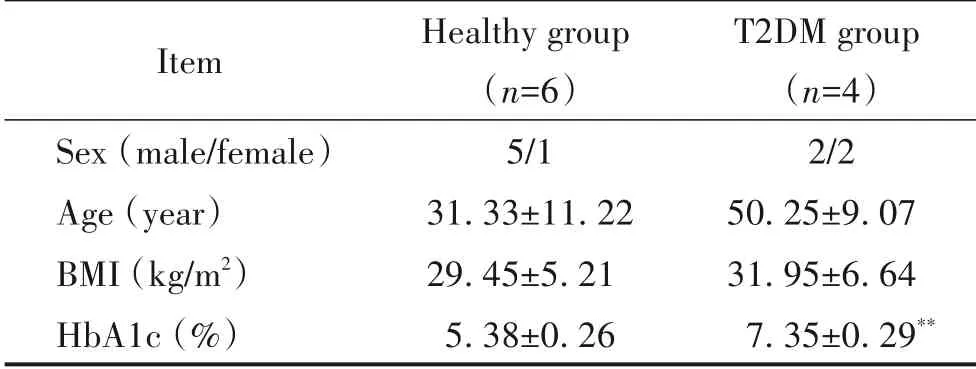
表2 scRNA-Seq分析数据来源的病人临床基线资料Table 2. Baseline characteristics of donors enrolled for scRNASeq analysis
我们从该数据库中共鉴定出2 358 个胰腺细胞,其中1 561 个为内分泌细胞。我们根据激素基因表达谱对内分泌细胞进行重新聚类,鉴定出5 个细胞簇,包括α、β、γ、δ 和ε 细胞(图2A、B)。气泡图证实了β 细胞中有STING、TBK1和IRF3基因的mRNA 表达,而干扰素β(interferon β,IFN-β/IFNB)的表达较低(图2C)。未激活状态的STING蛋白定位于内质网膜上[3],其活性受内质网稳态的影响,因此我们还分析了ERS 相关基因[如转录激活因子4(activating transcription factor 4,ATF4)、X 盒结合蛋白1(X-box binding protein 1,XBP1)、DNA 损伤诱导转录本3(DNA damage inducible transcript 3,DDIT3)和内质网到细胞核信号传导蛋白1(endoplasmic reticulum to nucleus signaling 1,ERN1)]的表达。结果表明,胰岛β细胞中也表达上述ERS相关基因(图2C)。为了评估糖尿病对STING 信号通路和ERS 的影响,我们比较了健康对照组和T2DM 患者STING 通路基因TBK1和IRF3以 及ERS 相关基 因ATF4和XBP1的表达水平。结果表明,只有XBP1在T2DM 患者胰岛β细胞中有升高趋势,但差异无统计学显著性(P>0.05),而其他基因未检测到显著变化(图2D)。
2 鉴定与比较小鼠胰腺组织β 细胞和小鼠β 细胞系的STING信号通路
我们采用免疫荧光染色法检测小鼠胰腺组织以验证上述scRNA-Seq 结果。染色结果显示,小鼠胰岛β 和α 细胞均表达STING 蛋白,与scRNA-Seq 数据一致;STING 主要表达在胰岛β 细胞的细胞核周围,呈点状分布;db/db小鼠β 细胞STING 表达较对照小鼠显著增加(图3A-2)。我们还在胰腺组织血管内皮细胞中检测到大量的STING蛋白(图3A-1)。
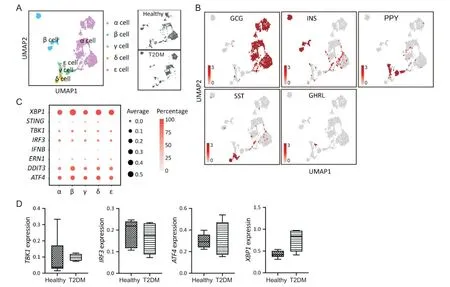
Figure 2. Identification of STING pathway and endoplasmic reticulum stress by scRNA-Seq dataset of pancreatic islets from healthy and type 2 diabetes mellitus(T2DM)donors. A:clustering and annotation of the endocrine cells using public scRNA-Seq dataset(ArrayExpress E-MTAB-5061)from healthy and T2DM donors(right),or combined donors(left);B:clusters of endocrine cell types based on their hormone expression profiles(GCG:glucagon;INS:insulin;PPY:pancreatic polypeptide;SST:somatostatin;GHRL:ghrelin);C:bubble plot showing selected gene expression in endocrine cell types(bubble size indicates mean expression level of genes in each cluster,and color saturation indicates the percentage of cells that expressing the gene in respective cluster);D:TBK1,IRF3,ATF4 and XBP1 expression in healthy and T2DM donors.Mean±SEM. n=3.图2 通过scRNA-Seq对人胰岛β细胞STING信号及内质网应激相关基因的鉴定与比较
为了在胰岛β 细胞系中验证STING 信号通路的是否可被激活,我们使用了3 种小鼠胰岛β 细胞系,即beta-TC-6、Min6 和NIT-1,以 及 阳 性 对 照 细 胞RAW264.7。DMXAA 处理上述细胞后,RAW264.7细胞的STING 信号通路被激活,表现为磷酸化TBK1(phosphorylated TBK1,p-TBK1)和 磷 酸 化IRF3(phosphorylated IRF3,p-IRF3)蛋白水平显著升高;在DMXAA 刺激15 min后,我们检测到STING的表达持续减少(图3B)。虽然3 个小鼠胰岛β 细胞系均表达TBK1 和IRF3,但仅有beta-TC-6 细胞表达STING蛋白;且只有beta-TC-6 细胞经DMXAA 刺激后,p-TBK1 和p-IRF3 蛋白水平显著升高(图3C)。而Min6和NIT-1 细胞经DMXAA 刺激后检测不到p-TBK1 和p-IRF3信号(图3D、E)。
3 比较3 种胰岛β 细胞中STING 信号通路相关分子的mRNA水平
为了进一步比较上述β 细胞系STING 通路的基础表达水平,我们对Min6、NIT-1 和beta-TC-6 细胞进行了RT-qPCR 分析。与Western blot 结果一致,beta-TC-6细胞中STING、TBK1和IRF3的基础mRNA水平显著高于Min6 和NIT-1 细胞(图4A~C)。此外,我们还分析了DMXAA 处理后这些细胞系STING 信号成分和下游IFN-β 的mRNA 水平。DMXAA 处理2 h后,beta-TC-6 细胞表现出显著升高的Sting 和IFN-β mRNA 水平,而在Min6 和NIT-1 细胞中均未观察到类似的诱导(图4D~G)。
4 ERS 激活STING 信号通路并协同降低胰岛β 细胞活力
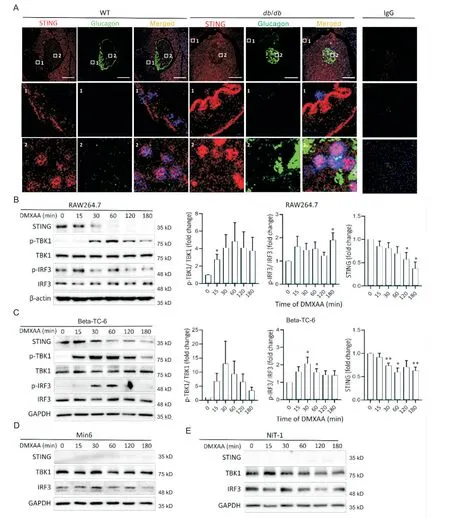
Figure 3. Identification of STING signaling pathway in mouse pancreatic β cells and β cell lines. A:immunofluorescence staining of STING protein expression in non-β cells(A-1)and β cells(A-2)of WT mice and db/db mice(scale bar=50 μm);B:the protein expression and activation of STING signaling pathway in RAW264.7 macrophage cell line with DMXAA(50 mg/L)treatment for indicated time;C:the protein expression and activation of STING signaling pathway in beta-TC-6 cell line with DMXAA(50 mg/L)treatment for indicated time;D and E:the protein expression and activation of STING signaling pathway in Min6 and NIT-1 cell lines with DMXAA(50 mg/L)treatment for indicated time. Mean±SEM. n=3.*P<0.05 vs 0 min group.图3 小鼠胰腺组织β细胞和β细胞系中STING信号通路的鉴定与比较
为了检测ERS 状态下胰岛β 细胞STING 信号通路的活性,我们采用了TG 处理细胞并检测STING 通路组分的激活状态。TG 处理能显著诱导beta-TC-6细胞中TBK1和IRF3磷酸化(图5A)。为了证实ERS对STING 信号通路的激活是否会对胰岛β 细胞的活力产生影响,我们用TG、DMXAA 或TG+DMXAA 处理beta-TC-6 细胞,然后用CCK-8 法检测细胞活力。结果显示,在TG 处理12 h 后,beta-TC-6 细胞活力显著降低,并随处理时间的延长,细胞活力逐渐降低(图5B);DMXAA 单独处理细胞48 h 后可显著降低细胞活力(图5C);当TG 和DMXAA 联合应用时,与单独使用TG 或DMXAA 处理相比,beta-TC-6 细胞活力进一步降低(图5D)。

Figure 4. Comparisons of mRNA expression profiles of STING signaling pathway-related molecules in 3 mouse pancreatic islet β cell lines. A,B and C:the basal mRNA levels of STING,TBK1 and IRF3 in Min6,NIT-1 and beta-TC-6 cell lines;C,D,E and F:the mRNA expression of STING,TBK1,IRF3 and IFN-β in Min6,NIT-1 and beta-TC-6 cell lines after treatment with DMXAA for 2 h. Mean±SEM. n=3.##P<0.01 vs beta-TC-6 group;**P<0.01 vs Min6-control group;△△P<0.01 vs NIT-1-control group;▲P<0.05 vs beta-TC-6-control group.图4 3种小鼠胰岛β细胞系中STING信号通路mRNA表达谱的比较
讨论
STING 信号通路可以感知细菌入侵或宿主细胞损伤,是先天免疫反应的重要组成部分[20]。STING分子表达存在着显著的细胞差异性,如STING 蛋白在免疫细胞[21]和内皮细胞[22]中高表达,但肝细胞中未 检 测 到STING 表 达[23]。胰 岛β 细 胞 是 否 表 达STING 信号通路相关蛋白,及其活性是否被糖尿病状态所影响仍不清楚。本研究系统分析了STING 信号通路相关基因在人和小鼠胰岛β 细胞及3 种小鼠胰岛β 细胞系中的表达,并进一步通过beta-TC-6 胰岛β 细胞系,研究了STING 信号通路与ERS 产生协同作用对胰岛β细胞活力的影响。
已发表的研究通过免疫荧光染色分别在人与小鼠胰岛β 细胞中检测到STING 蛋白的表达[24-25]。本研究显示STING 在小鼠胰腺的内皮细胞以及胰腺外分泌腺细胞中均有较强的表达,而在β 细胞表达相对较弱(图3A)。上述文献与本研究中的结果差异可能源于抗体不同,但均明确提示STING 蛋白及其信号通路在胰岛β 细胞中的存在。已有文献表明静息稳态下,STING 定位于内质网和高尔基体[3,26];被HSV 感染、双链DNA 或cGAMP 等刺激因子激活后,STING 被重新定位到核周区[27-28];另一研究显示STING 的自激活突变体荧光染色信号分布于核周和非内质网微粒体区[29]。我们的荧光染色结果亦显示STING 主要分布在胰岛β 细胞核周的点状小泡,且db/db小鼠胰岛β 细胞的STING 蛋白表达较WT 小鼠的显著增强。因此,基于STING 在db/db小鼠β 细胞核周的分布模式及其较野生型小鼠更高的表达水平,我们推测糖尿病小鼠胰岛β 细胞中STING 信号通路呈一定的激活状态;但需要更多的证据来明确STING 通路在db/db小鼠胰岛β细胞是否是呈较强的活性状态。研究报道高脂导致的脂毒性会诱发线粒体DNA 泄 露到胞质从而激活STING 信号通路[30];Sting全身敲除的小鼠其胰岛素敏感性及葡萄糖耐量均得到显著改善,但胰岛β 细胞特异性敲除Sting的小鼠其胰岛素分泌能力显著下降[31],表明STING 信号通路在不同组织、不同状态下的功能是比较复杂的,有待于更多的深入研究。
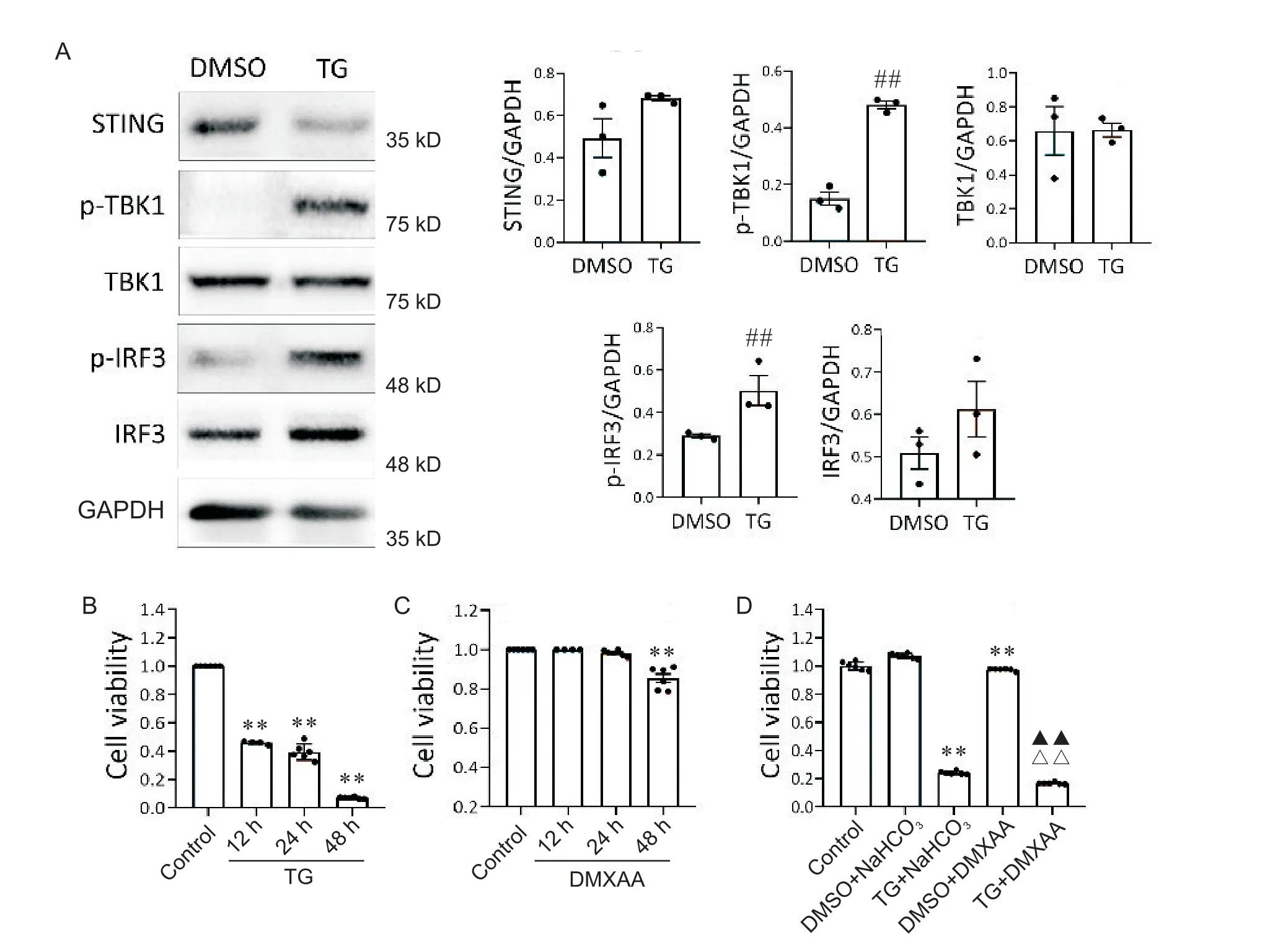
Figure 5. Activation of STING signaling pathway under endoplasmic reticulum stress and their synergistical effect on the viability of beta-TC-6 cells. A:Western blot was used to detect the expression of STING signaling pathway-related proteins in beta-TC-6 cells with TG(0.5 μmol/L)treatment;B,C and D:the viability of beta-TC-6 cells after treated with TG(0.5 μmol/L)for 12,24 and 48 h(B),DMXAA(50 mg/L)for 12,24 and 48 h(C),or TG(0.5 μmol/L)combined with DMXAA(50 μmol/L)for 24 h(D)was detected by CCK-8 assay. Mean±SEM. n=3 to 6.##P<0.01 vs DMSO group;**P<0.01 vs control group;△△P<0.01 vs TG+NaHCO3 group;▲▲P<0.01 vs DMSO+DMXAA group.图5 内质网应激下beta-TC-6细胞STING信号通路的激活及其协同影响细胞活力
我们的研究证实STING蛋白在beta-TC-6小鼠胰岛β 细胞系中有表达且可被其激动剂激活,而NIT-1和Min6 细胞系对STING 激动剂无明显反应,提示STING通路可能与β细胞生理学功能的调控有关,且beta-TC-6 是研究STING 通路与β 细胞功能的合适细胞系。而上述不同小鼠细胞系中STING 信号通路活性存在差异,可能有以下原因。首先,这些细胞系来自不同遗传背景的小鼠。Min6 细胞来自C57BL/6 小鼠胰岛瘤细胞[32],NIT-1 细胞来自转NOD/LT 小鼠胰岛β 细胞腺瘤细胞[33],beta-TC-6 细胞来自转染了SV40的C57BL/6和C3HEB/FEJ小鼠杂交后子代的原代胰岛[34-35];其次,不同细胞系表达和分泌不同种类的激素,例如,有报道显示Min6 细胞和beta-TC-6 细胞分泌胰岛素、胰高血糖素和生长抑素[36-37],而NIT-1细胞只分泌胰岛素和胰高血糖素,但不分泌生长抑素[38];最后,在连续的细胞传代过程中,Min6 细胞系会失去对葡萄糖的反应性[39];而beta-TC-6 细胞系虽然保持着对葡萄糖的反应性,但己糖激酶的表达量发生了显著改变[35]。
STING 信号通路可以感知线粒体和基因组损伤而泄露的DNA,然后启动炎症反应[40]。我们的研究显示beta-TC-6细胞中持续激活STING信号通路会导致β 细胞活力显著降低(图5C),与前期其它关于STING 激活导致细胞死亡的研究一致[41-42]。我们还证实STING 信号通路和ERS 同时激活后,细胞活力较单独激活均显著下降(图5D),提示在T2DM 中,STING 信号通路和ERS 之间的协同作用可能在β 细胞功能障碍和损伤过程中发挥重要作用。
综上所述,我们证实人和小鼠胰腺组织中胰岛β细胞均检测到STING 的表达,而beta-TC-6 细胞是一种适合于体外研究STING 信号通路的胰岛β 细胞系。ERS 和STING 信号通路均可显著抑制β 细胞的活力,且二者协同作用可进一步破坏胰岛β 细胞的活力,提示这两条通路均可能参与β 细胞损伤过程而与糖尿病等密切相关。虽然糖尿病小鼠胰岛β 细胞和胰岛β 细胞系的STING 信号通路激活机制及其参与糖尿病等的发病过程的分子机制仍有待进一步研究,但我们的工作提供了重要的证据和线索,并提示STING 信号通路和ERS 反应可作为保护β 细胞活力从而治疗糖尿病的潜在靶点。
