脉冲电磁场通过Wntβ-catenin信号通路改善膝骨关节炎大鼠炎症反应的机制
2022-05-31柏中喜方兴刚马龙祥贺昱霖
柏中喜,方兴刚,马龙祥,贺昱霖
十堰市太和医院(湖北医药学院附属医院)康复中心水疗理疗科,湖北十堰 442000
前言
膝关节骨性关节炎(膝骨关节炎)作为最常见的关节退行性疾病,严重影响患者的正常生活,导致活动受限,生活无法自理等[1]。脉冲电磁场对患者的初期病症有一定的治疗作用[2-3]。有研究表明,Wntβ-catenin信号通路在膝骨关节炎中易被激活,从而调节关节软骨基质等的分解和代谢[4-5]。将Wntβ-catenin信号通路作为治疗膝骨关节炎的靶点是目前亟待解决的关键性问题。本研究选取90只SD大鼠构建膝骨关节炎模型,探讨脉冲电磁场通过Wntβ-catenin信号转导机制改善膝骨关节炎大鼠炎症反应的机制。
1 资料与方法
1.1 实验动物
本实验选用SD 大鼠90 只,雌性,购自中国医学科学院动物所(北京华阜康生物科技有限公司),饲养环境为室温,相对湿度控制在(50±5)%左右,12 h光照与12 h 黑夜交替。每天正常自由饮水进食并保持正常活动,小鼠适应环境1周后开始实验。所有大鼠的鼠龄及体重之间的差异不存在统计学意义(P>0.05)。本实验经十堰市太和医院(湖北医药学院附属医院)伦理委员会批准进行,均按美国《实验动物使用和处理指南》实施。
1.2 实验分组
90 只大鼠随机分为为正常组(n=30)、模型组(n=30)和脉冲电磁场组(n=30)。各组大鼠采用分笼饲养,除正常组,其他各组均进行膝骨关节炎建模。
1.3 膝骨关节炎大鼠模型的构建
实验前各大鼠禁食禁水。将超净工作台紫外杀菌30 min,取浓度为10%的水合氯醛对大鼠做麻醉处理,将麻醉后的大鼠仰卧于实验台上,用碘伏消毒左后肢,于左侧膝关节内侧做长度约为2 cm 的纵形切口,分离皮下及肌肉组织,将关节囊打开后外翻髌骨,露出膝关节,切断内侧副韧带同时切除掉内侧1/3的半月板,避免关节软骨面出现损伤,将切口缝合后再次用碘伏消毒[6]。术后第2 天促进大鼠运动,每天30 min,连续4周即可。
1.4 脉冲电磁场治疗
构建大鼠膝骨关节炎模型6周之后,用电脑骨伤治疗仪(型号:XY-K-GS-III;生产厂家:河南翔宇医疗设备股份有限公司)对大鼠进行脉冲电磁场治疗:将两个磁极分别固定于右膝关节内外侧,设置频率20 Hz,强度为8 mT,每次干预40 min,1 次/d,5 d/周,共计干预2 周即可。脉冲磁场的频率、强度、作用时间、间隔等参数的选择均来自文献[7]。
1.5 观测指标及方法
1.5.1 大鼠局部皮温、膝关节周径和Lequesne MG 评分测定使用红外测温仪测量各组大鼠的左侧膝关节局部温度,用卷尺测量各大鼠的左膝关节周径,局部温度和膝关节周径均测量3次,计算平均值。从局部疼痛刺激反应、关节肿胀程度和关节活动范围这3个方面完成Lequesne MG测定[8]。
1.5.2 大鼠Mankin's 评分制备切片后用二甲苯脱蜡,然后在不同浓度的酒精中浸泡5 min,蒸馏水冲洗2 min 后用甲苯胺蓝染液染色10 min,将多余染液除掉,酒精脱水,二甲苯透明,中性树脂封片备用。于光学显微镜下观察各组大鼠标本软骨以及基质的失染程度。参照Mankin's评分标准,所得分值越高说明软骨基质失染程度越高,关节退变越严重;反之则表明软骨基质失染程度低,关节退变程度轻[9]。
1.5.3 大鼠软骨细胞凋亡调控蛋白Western Blot检测取各组大鼠右胫骨平台全层软骨,提取总蛋白,通过聚丙烯酰胺凝胶电泳,分别加入Caspase-3 和Caspase-8 单克隆抗体,在4℃的温度下孵育24 h,再加入二抗在常温下孵育2 h,DAB 显色后,以磷酸甘油醛脱氢酶(GAPDH)作为参照,根据图像分析软件测定电泳条带的光密度值(OD值),蛋白相对表达量=目的蛋白条带OD值/GAPDH蛋白条带OD值。
1.5.4 大鼠滑膜IL-1β、MMP-13、TNF-α表达测定取各组大鼠滑膜组织,加入磷酸盐缓冲(1 g:10 mL)粉碎,于4°C 条件下以2 500 r/min 离心10 min,取上清液通过ELISA法同时结合促炎大鼠试剂盒分析炎性细胞因子表达,包括白细胞介素-1β(Interleukin-1β,IL-1β)、肿瘤坏死因子α(Tumor Necrosis Factor α,TNF-α)和基质金属蛋白酶(Matrix Metalloproteinase,MMP-13)。在测定之前,均质化冷冻组织样品(50 nM Hepes,1 mM EDTA,150nM NaCl和1%Triton-X)。
1.5.5 大鼠关节软骨Wnt 和β-catenin mRNA 表达测定加入Trizol 试剂,从各组大鼠关节软骨组织中提取总RNA。用分光光度法和1%琼脂糖凝胶电泳测定RNA 的浓度和纯度。利用PrimescriptTM RT 试剂盒和寡核苷酸引物将分离出的RNA反转录到cDNA,利用实时定量PCR 技术做分析,以甘油醛-3-磷酸脱氢酶为内参,采用2-△△ct 法分析Wnt 和β-catenin mRNA表达。
1.5.6 大鼠关节软骨Wnt 和β-catenin 蛋白表达测定取各组大鼠关节软骨,提取总蛋白,通过聚丙烯酰胺凝胶电泳,分别加入Wnt 和β-catenin 单克隆抗体,在4℃下孵育24 h,再加入二抗在常温下孵育2 h,DAB显色后,以GAPDH 作为参照,根据图像分析软件测定电泳条带的OD 值,蛋白相对表达量=目的蛋白条带OD值/GAPDH蛋白条带OD值。
1.5.7 大鼠线粒体膜电位的检测利用荧光探针经过JC-1 荧光染色对大鼠关节软骨细胞线粒体进行染色标记后进行流式细胞仪测定,线粒体膜电位经过流式细胞仪测定后可反映JC-1荧光染色强度变化,JC-1在线粒体内形成的聚合物在流式细胞检测中主要表现为红色荧光染色。当线粒体膜电位去极化发生异常改变时,线粒体以绿色荧光染色为主。对检测得到的大鼠关节软骨细胞胞浆流式图进行卡门的设置,可进一步将分离提纯后大鼠关节软骨细胞胞浆中所含有的关节软骨细胞分离出来;再次进行流式细胞分析绘制流式图,通过对比染色呈现红色荧光线粒体与绿色荧光线粒体的荧光强度来反映大鼠关节软骨细胞胞浆中线粒体的膜电位。
1.6 统计学方法
采用SPSS 20.0软件进行统计学分析。计量资料用均数±标准差表示,组间比较用单因素方差分析,组间两两比较用LSD-t检验;计数资料用%表示,组间比较用χ2分析。P<0.05表示差异有统计学意义。
2 结果
2.1 大鼠局部皮温、膝关节周径和Lequesne MG评分测定
相较于正常组,其余2组的局部皮温、膝关节周径和Lequesne MG评分均上调;脉冲电磁场组与模型组相对比,局部皮温、膝关节周径和Lequesne MG评分均下调,脉冲电磁场组优于模型组。3组大鼠膝关节周径和Lequesne MG评分的差异有统计学意义(P<0.05);局部皮温的差异则不存在统计学意义(P>0.05)。详见表1。
2.2 大鼠Mankin's评分
大鼠关节组织标本染色图显示相比较于正常组,模型组和脉冲电磁场组大鼠的软骨结构、软骨细胞、潮线完整性、甲苯胺蓝染色加深(图1)。由表2可知,模型组和脉冲电磁场组大鼠的Mankin's评分的总评分均上调。脉冲电磁场组与模型组相比,上述各指标评分均下调,脉冲电磁场组优于模型组(P<0.05)。
表1 各组大鼠局部皮温、膝关节周径和Lequesne MG评分(± s,n=30)Table 1 Local skin temperature,knee circumference and Lequesne MG score of rates in each group(Mean±SD,n=30)
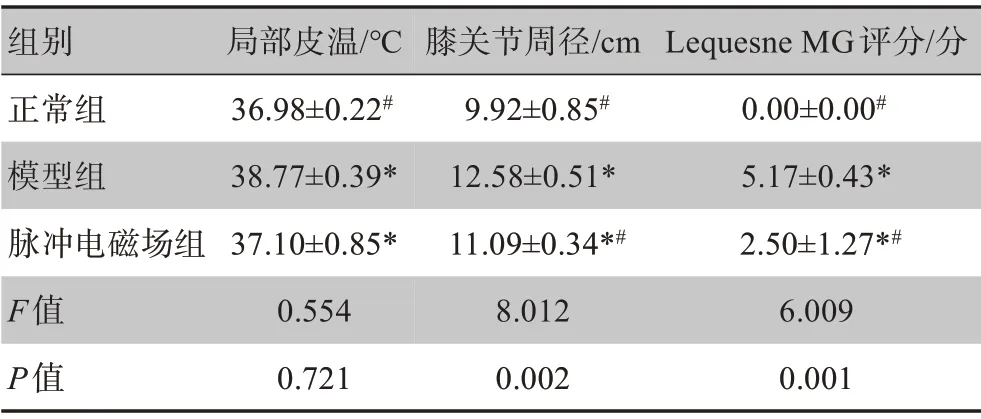
表1 各组大鼠局部皮温、膝关节周径和Lequesne MG评分(± s,n=30)Table 1 Local skin temperature,knee circumference and Lequesne MG score of rates in each group(Mean±SD,n=30)
*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05
组别正常组模型组脉冲电磁场组F值P值局部皮温/℃36.98±0.22#38.77±0.39*37.10±0.85*0.554 0.721膝关节周径/cm 9.92±0.85#12.58±0.51*11.09±0.34*#8.012 0.002 Lequesne MG评分/分0.00±0.00#5.17±0.43*2.50±1.27*#6.009 0.001
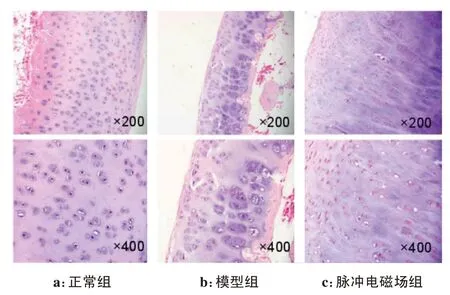
图1 各组大鼠关节组织标本染色图Figure 1 Staining of rat joint tissue specimens in each group
2.3 大鼠软骨细胞凋亡调控蛋白Western Blot检测
相较正常组,其余2 组的软骨细胞凋亡调控蛋白Caspase-3 和Caspase-8 均上调;脉冲电磁场组与模型组相比,上述各指标评分均下调,脉冲电磁场组优于模型组(P<0.05)。详见表3、图2。
2.4 大鼠滑膜IL-1β、MMP-13、TNF-α表达测定
相较正常组,其余2 组的滑膜IL-1β、MMP-13、TNF-α 表达均上调;脉冲电磁场组与模型组相比,上述各指标评分均下调,脉冲电磁场组优于模型组(P<0.05)。详见表4。
2.5 大鼠关节软骨Wnt和β-catenin mRNA表达测定
相较正常组,其余2组的关节软骨Wnt和β-catenin mRNA 表达均上调;脉冲电磁场组与模型组相比,上述各指标评分均下调,脉冲电磁场组优于模型组(P<0.05)。详见表5。
2.6 大鼠关节软骨Wnt和β-catenin蛋白表达测定
相较正常组,其余2 组的关节软骨Wnt 和βcatenin 蛋白表达均上调;脉冲电磁场组与模型组相比,上述各指标评分均下调,脉冲电磁场组优于模型组(P<0.05)。详见表6、图3。
2.7 大鼠关节软骨细胞中线粒体膜电位的比较
相较正常组,其余2 组的关节软骨线粒体膜电位
均下调;脉冲电磁场组与模型组相比,线粒体膜电位有所上调,脉冲电磁场组优于模型组中(P<0.05)。详见表7。
表2 各组大鼠Mankin's评分(± s,n=30)Table 2 Mankin's score of rats in each group(Mean±SD,n=30)
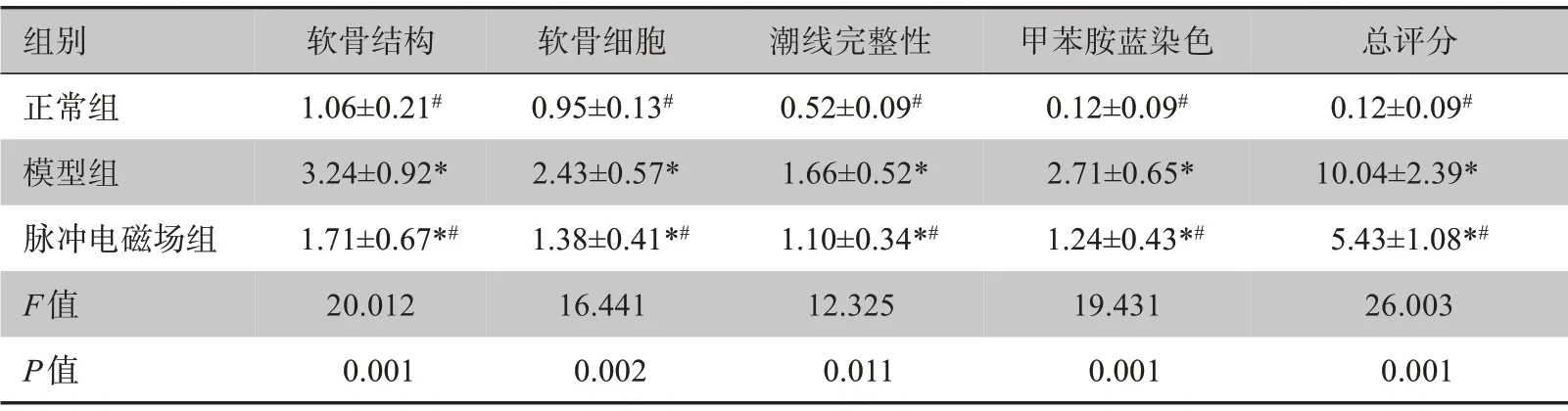
表2 各组大鼠Mankin's评分(± s,n=30)Table 2 Mankin's score of rats in each group(Mean±SD,n=30)
*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05
组别正常组模型组脉冲电磁场组F值P值软骨结构1.06±0.21#3.24±0.92*1.71±0.67*#20.012 0.001软骨细胞0.95±0.13#2.43±0.57*1.38±0.41*#16.441 0.002潮线完整性0.52±0.09#1.66±0.52*1.10±0.34*#12.325 0.011甲苯胺蓝染色0.12±0.09#2.71±0.65*1.24±0.43*#19.431 0.001总评分0.12±0.09#10.04±2.39*5.43±1.08*#26.003 0.001
表3 大鼠软骨细胞凋亡调控蛋白表达(± s,n=30)Table 3 Expressions of proteins regulating chondrocytes apoptosis in rats(Mean±SD,n=30)

表3 大鼠软骨细胞凋亡调控蛋白表达(± s,n=30)Table 3 Expressions of proteins regulating chondrocytes apoptosis in rats(Mean±SD,n=30)
*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05
组别正常组模型组脉冲电磁场组F值P值Caspase-3/GAPDH 1.14±0.13#1.48±0.14*1.39±0.07*#16.723 0.001 Caspase-8/GAPDH 0.76±0.11#1.20±0.14*1.00±0.12*#19.002 0.001
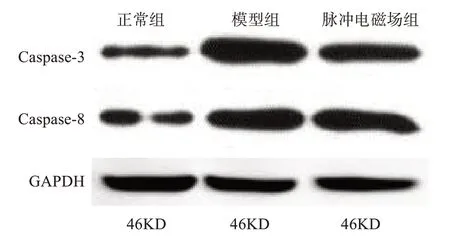
图2 大鼠软骨细胞凋亡调控蛋白表达Figure 2 Expressions of proteins regulating chondrocytes apoptosis in rats
表4 大鼠滑膜IL-1β、MMP-13、TNF-α表达(± s,n=30)Table 4 Expressions of synovial IL-1β,MMP-13,TNF-α in rats(Mean±SD,n=30)

表4 大鼠滑膜IL-1β、MMP-13、TNF-α表达(± s,n=30)Table 4 Expressions of synovial IL-1β,MMP-13,TNF-α in rats(Mean±SD,n=30)
*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05
组别正常组模型组脉冲电磁场组F值P值IL-1β(ng/mL)3.13±1.59#25.63±4.31*7.46±2.00*#18.435 0.001 TNF-α(ng/mL)0.73±0.03#2.53±0.24*1.04±0.89*#15.942 0.003 MMP-13(ng/mL)0.12±0.03#0.28±0.05*0.17±0.01*#18.115 0.001
表5 大鼠关节软骨Wnt和β-catenin mRNA 表达(± s,n=30)Table 5 Wnt and β-catenin mRNA expressions in rate articular chondrocytes(Mean±SD,n=30)
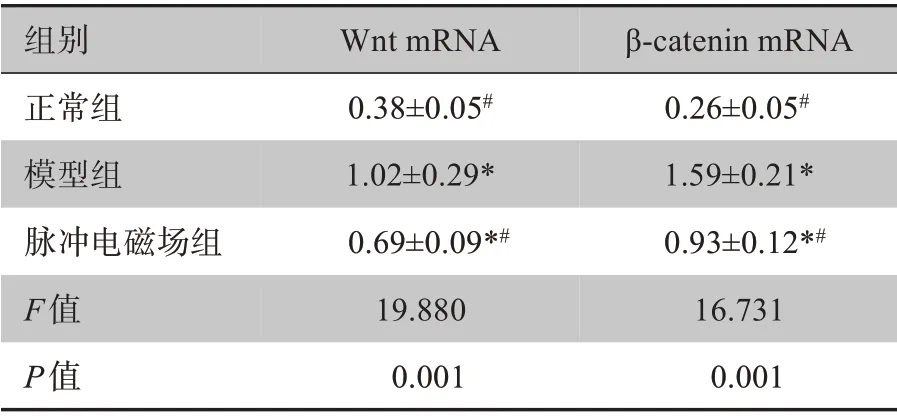
表5 大鼠关节软骨Wnt和β-catenin mRNA 表达(± s,n=30)Table 5 Wnt and β-catenin mRNA expressions in rate articular chondrocytes(Mean±SD,n=30)
*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05
组别正常组模型组脉冲电磁场组F值P值Wnt mRNA 0.38±0.05#1.02±0.29*0.69±0.09*#19.880 0.001 β-catenin mRNA 0.26±0.05#1.59±0.21*0.93±0.12*#16.731 0.001
表6 大鼠关节软骨Wnt和β-catenin蛋白表达(± s,n=30)Table 6 Wnt and β-catenin protein expressions in rat articular chondrocytes(Mean±SD,n=30)
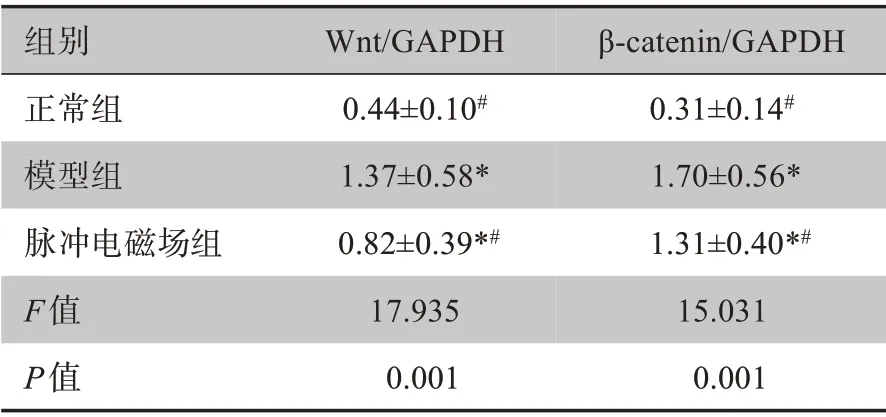
表6 大鼠关节软骨Wnt和β-catenin蛋白表达(± s,n=30)Table 6 Wnt and β-catenin protein expressions in rat articular chondrocytes(Mean±SD,n=30)
*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05
组别正常组模型组脉冲电磁场组F值P值Wnt/GAPDH 0.44±0.10#1.37±0.58*0.82±0.39*#17.935 0.001 β-catenin/GAPDH 0.31±0.14#1.70±0.56*1.31±0.40*#15.031 0.001

图3 大鼠关节软骨Wnt和β-catenin蛋白表达Figure 3 Wnt and β-catenin protein expressions in rat articular chondrocytes
表7 大鼠关节软骨细胞中线粒体膜电位的比较(AU,± s,n=30)Table 7 Comparison of mitochondrial membrane potential in rat articular chondrocytes(AU,Mean±SD,n=30)
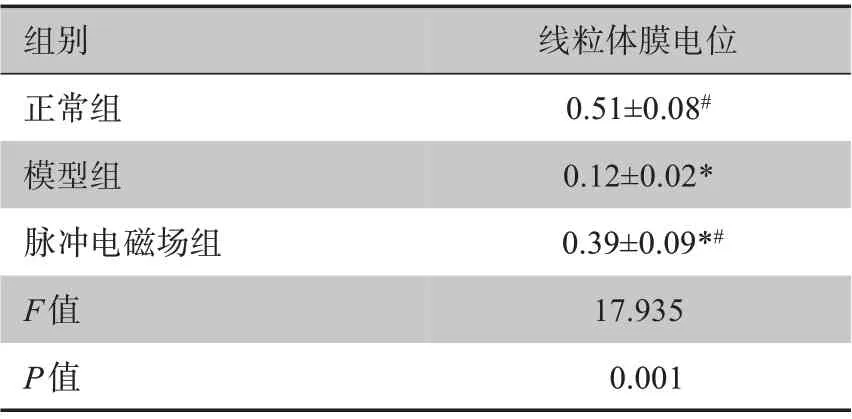
表7 大鼠关节软骨细胞中线粒体膜电位的比较(AU,± s,n=30)Table 7 Comparison of mitochondrial membrane potential in rat articular chondrocytes(AU,Mean±SD,n=30)
*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05
组别正常组模型组脉冲电磁场组F值P值线粒体膜电位0.51±0.08#0.12±0.02*0.39±0.09*#17.935 0.001
3 讨论
骨关节炎作为中老年人群常见的一种慢性退行性关节疾病,常发于45 岁以上的人群[10]。目前有关膝骨关节炎的有效治疗仍缺乏相应的措施,脉冲电磁场在膝骨关节炎的治疗中应用频率越来越高。然而,脉冲电磁场治疗膝骨关节炎的作用机制尚不完全明确[11]。Wntβ-catenin 信号转导通路一旦激活就会增加白细胞介素和肿瘤坏死因子的表达,促进MMP-13大量生成[12-13]。而MMP-13水平的异常升高又会作用于细胞外基质,导致关节软骨的破坏,在促进膝骨关节炎的发生和发展过程中发挥着关键性作用[14]。本研究表明经过脉冲电磁场治疗后患者的膝关节周径、Lequesne MG 评分、Mankin's 评分、Wntβcatenin 表达以及滑膜IL-1β、MMP-13、TNF-α 水平均出现显著的下调,降低了炎症因子表达,抑制了Wntβ-catenin 信号转导。与模型组比较,脉冲电磁场组膝关节周径、Lequesne MG 评分和Mankin's 评分均下调(P<0.05),这些指标的变化说明抑制了膝骨关节炎模型大鼠的炎症反应;与模型组比较,脉冲电磁场组滑膜IL-1β、MMP-13、TNF-α表达均下调,这些指标的具体变化说明有效修复了软骨损伤。
脉冲电磁场能在一定程度上促进速关节腔组织的有效修复,其主要原理是通过改变膜电位从而增加关节软骨和滑膜的通透性[15-16],使局部组织出现一定程度的软化,缓解膝关节的退行性改变,加速组织的新陈代谢[9]。Wntβ-catenin信号转导通路对关节的形成以及调控软骨细胞功能发挥着重要的作用。βcatenin 作为Wntβ-catenin 信号转导通路的关键组成部分,其在细胞内的表达高低对膝骨关节炎的发生发展起着至关重要的作用[17-18]。Wntβ-catenin基因和蛋白的异常表达会引发软骨细胞肥大化,出现终端分化。因此,Wntβ-catenin 信号转导通路是治疗膝骨关节炎的关键靶位点。
Wntβ-catenin 信号具有多种下游靶基因,包括控制细胞凋亡和坏死的基因,一旦启动这些基因,细胞就会启动凋亡或坏死程序[19-20]。而这些基因的启动异常会造成细胞凋亡和坏死的异常,目前针对Wntβcatenin 信号对细胞凋亡的调控作用研究比较多,因其与肿瘤细胞的增殖有关。Wntβ-catenin 信号可上调被感染的巨噬细胞的促凋亡蛋白Bax的表达、下调抗凋亡蛋白Bcl-xl 和Mcl-1 的表达,并启动主要依赖于Caspase 途径的凋亡程序,导致细胞线粒体膜电位下降和Caspase-3 的活化,从而诱导巨噬细胞凋亡。Wntβ-catenin 信号主要通过调节细胞周期调控基因Cyclin、凋亡抑制基因Survivin 的表达抑制一些癌细胞的凋亡;通过上调促凋亡蛋白BIM、Bax 和下调抗凋亡蛋白Mcl-1 的表达促进细胞凋亡;通过抑制炎性因子TNF-α 的过度分泌、下调活性氧ROS 的含量抑制细胞坏死。
综上所述,脉冲电磁场能够通过抑制膝骨关节炎中的Wntβ-catenin 信号转导通路,从而降低骨关节细胞中炎症因子的表达,延缓膝骨关节的进一步退化。
