外源茉莉酸甲酯和赤霉素对茜草生长、相关酶活性及主要活性成分含量的影响研究
2022-05-31周可心颜永刚张健健胡本祥1杨冰月
彭 亮,罗 瑶,李 翡,沈 霞,周可心,颜永刚,张健健,胡本祥1, ,杨冰月*
外源茉莉酸甲酯和赤霉素对茜草生长、相关酶活性及主要活性成分含量的影响研究
彭 亮1, 2,罗 瑶1, 2,李 翡3,沈 霞1, 2,周可心1, 2,颜永刚1. 2,张健健4,胡本祥1, 4,杨冰月1, 2*
1. 陕西中医药大学药学院/陕西省秦岭中草药应用开发工程技术研究中心,陕西 西安 712046 2. “秦药”研发重点实验室,陕西 西安 712046 3. 陕西中医药大学附属医院,陕西 咸阳 712000 4. 陕西国际商贸学院,陕西 西安 712046
以茜草为研究对象,探讨施加外源不同浓度茉莉酸甲酯(methyl jasmonate,MeJA)和赤霉素(gibberellins,GA3)对茜草幼苗生长、相关酶活性及主要活性成分含量的影响。取大小一致的1月龄茜草实生苗转入霍格兰营养液中培养30 d后,分别添加不同浓度的MeJA(25、50、100、150 μmol/L)和GA3(50、100、200、400 mg/L)继续培养7 d,测定茜草的地上、地下部分长度和干鲜质量、渗透调节物质含量、抗氧化酶活性及5种主要活性成分的含量。在所选择浓度范围内,MeJA对茜草幼苗生长的影响为低浓度促生,高浓度抑制;GA3的影响则表现为低浓度抑制,高浓度促生。生理活性方面,50 μmol/L MeJA和400 mg/L GA3处理下,叶绿素、游离脯氨酸和总蛋白含量显著增高;过氧化物酶(peroxidase,POD)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)活性因激素种类及浓度而呈差异性,150 μmol/L MeJA和50 mg/L GA3处理下活性较强。MeJA和GA3的浓度对茜草活性成分积累影响很大,50~150 μmol/L MeJA可以显著促进茜草幼苗中茜草素、羟基茜草素、1,8-二羟基蒽醌、甲基异茜草素和大叶茜草素的积累,且随着MeJA浓度的增加促进作用越强(<0.05);200、400 mg/L GA3处理可以明显增强活性成分的积累(<0.05)。茜草幼苗的生长发育、生理活性及主要活性成分的积累受外源MeJA和GA3浓度的影响,50 μmol/L MeJA和400 mg/L GA3诱导能够显著提高茜草幼苗生物量及促进茜草幼苗中茜草素、羟基茜草素、1,8-二羟基蒽醌、甲基异茜草素和大叶茜草素的积累。
茜草;茉莉酸甲酯;赤霉素;抗氧化酶;渗透调节物质;茜草素;羟基茜草素;1,8-二羟基蒽醌;甲基异茜草素;大叶茜草素
茜草L.为茜草科(Rubiaceae)茜草属植物,其干燥根及根茎是我国传统大宗药材之一,始载于《神农本草经》,具有凉血、祛瘀、止血、通经等功效[1-2]。现代药理研究表明,茜草有止血、抗肿瘤、抗癫痫、抗病毒、抗微生物和保肝作用[3],主要活性物质为蒽醌及其苷类、萘醌及其苷类、香豆素类和三萜类等[4]。茜草分布广泛,主产于陕西、河南、安徽、河北、山东等省,以陕西、河南出产者量大且质优,现为15种陕西省“秦药”区域特色中草药品种之一[5]。近年来,随着茜草化学成分、药理活性研究的深入及临床应用的增加,其市场需求量增大,然而流通的茜草药材仍以野生品为主,仅在陕西、河南等地有少量人工种植[6-7]。茜草受环境,遗传及生长年限等因素影响,不同产地及来源药材品质差异性较大[8]。课题组前期已开展茜草野生变家种,种子质量标准,指纹图谱,转录组学等研究[9-11],在此基础上借鉴外源激素可以提高药材产量和促进有效成分积累这一有效手段[12],筛选激素的种类和浓度,以非生物诱导子的方式外源添加给茜草,对改善茜草药材品质具有一定的研究价值。
茉莉酸甲酯(methyl jasmonate,MeJA)和赤霉素(gibberellins,GA3)作为2种非常重要的植物激素,参与调节高等植物的多种生理事件并发挥重要作用[13-14]。研究证实,施加MeJA和GA3会诱导植物的生长发育、渗透调节物质、抗氧化酶活性和次生代谢产物积累发生一系列的变化,原因与外源激素使植物处于胁迫环境而致体内积累大量活性氧和MDA有关。如胡正平等[15]用MeJA处理川续断幼苗后,指出150 μmol/L MeJA可以显著提高川续断皂苷Ⅵ的积累,且SOD等活性发生相应变化。Hou等[16]用MeJA处理丹参和绒毛栗色鼠尾草的毛状根后,发现丹参酮类成分的含量明显增加。GA3处理可以迅速打破重楼根茎的休眠且诱导生芽[17],对丹参种苗生长也有促进作用[18],在增加太子参根长度的同时降低了其直径[19]。茜草方面,Bulgakov等[20]研究表明,1 μmol/L和10 μmol/L MeJA处理虽然使茜草愈伤组织生物量显著降低,但蒽醌类成分却明显增加;Fan等[21]研究发现采用10 μmol/L MeJA处理可以提高茜草悬浮细胞中红紫素的含量。然而,MeJA和GA3作为用来促进药用植物生长和次生代谢产物积累的2种有效激素,外源施加对茜草植株的生长发育及茜草素等主要活性成分的影响尚待研究。基于此,本研究以茜草为材料,研究MeJA和GA3对茜草生长发育、叶绿素含量、渗透调节物质、抗氧化酶系统及茜草素等主要活性成分的影响,旨在为通过外源激素改善茜草药材品质提供参考。
1 仪器、试剂与材料
1.1 仪器
电热鼓风干燥箱(上海一恒科学仪器有限公司);Waterse-2695高效液相色谱仪、Waters 2998检测器(美国waters公司);KQ-200DE型数控超声波清洗器(昆山市超声仪器有限公司);XS-02型多功能高速粉碎机(上海兆申科技有限公司);SHZ-D(III)循环水式真空泵(巩义市予华仪器有限责任公司);FA2104型十万分之一电子分析天平(上海民桥精密科学仪器有限公司);酶标仪A-5082(Tecan Austrla Gmbh Untersbergetr公司)。
1.2 试剂
对照品茜草素(批号AF20082801)、大叶茜草素(批号AF20071951)、羟基茜草素(AF20032706)、1,8-二羟基蒽醌(批号AF21012620)、甲基异茜草素(批号AF21020862)均购自成都埃法生物科技有限公司(质量分数≥98%);色谱纯乙腈、甲醇(赛默飞世尔科技有限公司);总蛋白(total protein,TP)、总超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)测试盒(批号分别为20210414、20210418、20200102、20210419、20210417)、96孔板,均购于南京建成生物工程研究所;纯净水(杭州娃哈哈集团有限公司);其他试剂均为分析纯(天津市天力化学试剂有限公司)。
1.3 材料
供试的茜草种子采集于陕西省王益区,由第四次全国中药资源普查王益区普查队提供,经陕西中医药大学药学院胡本祥教授鉴定为茜草L.的成熟种子。
2 方法
2.1 种苗培养
选取优质饱满、大小基本一致的茜草种子,流水下冲洗24 h,10% H2O2浸泡消毒15 min,蒸馏水冲洗干净,擦拭种子表面多余水分后均匀撒入吸饱水的塑料盆(30 cm×35 cm,装满有机质土)中,上面覆盖约0.5 cm薄土,表面喷洒适量水,置于组培室中模拟室温环境下进行育苗培养,培养条件为温度25 ℃、光照时间8 h/d。
2.2 幼苗水培
选取“2.1”项下培养至10 cm左右高度且大小一致的茜草幼苗进行移栽,移栽至放有珍珠岩的塑料盆(27 cm×16 cm×7 cm)中进行水培,1/2 Hogland营养液培养1周后转至Hogland营养液中继续培养3周,营养液刻度线处于盆高度的2/3,在此期间注意营养液的补充和更换,培养条件为温度25 ℃、光照时间8 h/d。
2.3 外源添加MeJA和GA3处理
茜草幼苗水培4周后,于Hogland营养液中添加MeJA,至终浓度为25、50、100、150 μmol/L;添加GA3,至终质量浓度为50、100、200、400 mg/L,纯Hogland营养液作为对照(CK),每处理3次重复(12株茜草/盆),在此期间注意营养液的补充和更换,培养7 d后取样。
2.4 测定指标及方法
2.4.1 生长指标 每盆随机选取5株茜草(每浓度处理共15株),使用数显游标卡尺测定地上和地下部分长度,精确度为0.01 cm;称取地上、地下部分鲜质量,经过105 ℃(30 min)杀青后于60 ℃烘箱进行干燥,称取干质量,精确度均为0.01 g。
2.4.2 生理指标 叶绿素含量测定采用乙醇-丙酮混合液浸泡法[22],单位表示为mg/g;POD活性测定采用比色法,SOD活性采用黄嘌呤氧化酶法,CAT活性采用钼酸铵法,MDA含量采用TBA法,游离脯氨酸(free proline,PRO)含量测定采用酸性茚三酮法,TP含量采用考马斯亮蓝法测定,具体操作步骤按照试剂盒说明书进行。
2.4.3 供试品溶液制备 精密称取药材粉末(过6号筛)约1.0 g,置于50 mL三角瓶中,加入60%甲醇20 mL,称定质量,加热回流30 min,待冷却至室温后再次称定质量并补足减失的质量,摇匀,滤过,取续滤液于25 mL量瓶中并定容至刻度,进样前过0.22 μmol/L微孔滤膜,即得供试品溶液。
2.4.4 对照品溶液制备 分别精密称取茜草素对照品3.10 mg、羟基茜草素对照品2.90 mg、甲基异茜草素对照品2.30 mg、1,8-二羟基蒽醌对照品2.50 mg、大叶茜草素对照品2.80 mg,置于容量瓶中,加甲醇溶解并定容至刻度,临进样前用0.22 μmol/L微孔滤膜过滤,即得含茜草素 0.31 mg/mL、羟基茜草素0.29 mg/mL、甲基异茜草素0.23 mg/mL、1,8-二羟基蒽醌对照品0.25 mg/mL、大叶茜草素0.28 mg/mL对照品溶液。
2.4.5 色谱条件 色谱柱Agilent 5 TC-C18(250 mm×4.6 mm,5 μm);流动相:0.1%磷酸水溶液(A)-甲醇(B),梯度洗脱(0~5 min,21%~40% B;5~10 min,40%~45% B;10~15 min,45%~45% B;15~25 min,45%~63% B;25~35 min,63% B;35~50 min,63%~80% B;50~60 min,80%~85% B;60~65 min,85%~100% B);体积流量为1.0 mL/min;柱温30 ℃;进样量10 μL,检测波长为240 nm。
2.4.6 线性关系考察 取茜草素、羟基茜草素、甲基异茜草素、1,8-二羟基蒽醌及大叶茜草素混合对照品溶液,分别进样5、10、15、20、25 μL,按上述色谱条件注入色谱仪,记录峰面积,分别以各成分的峰面积()对进样量()作回归分析,计算回归方程,见表1。
表1 5种主要活性成分的线性关系考察结果
Table 1 Linear regression equation of five main active components
化合物回归方程r线性范围/μg 茜草素Y=1 690 509 X+156 9260.999 51.55~7.75 羟基茜草素Y=1 692 056 X+237 0500.999 91.45~7.25 甲基异茜草素Y=1 676 233 X+978 9470.999 91.15~5.75 1,8-二羟基蒽醌Y=1 308 256 X-342 3010.999 51.25~6.25 大叶茜草素Y=1 547 538 X+427 8280.999 61.40~7.00
2.4.7 精密度试验 精密吸取“2.4.4”项下的混合对照品溶液,分别连续进样6次,记录峰面积,计算相对标准偏差。结果表明,各个对照品的峰面积比值RSD均小于2%,表明仪器精密度较好。
2.4.8 重复性试验 取6份茜草药材粉末在相同条件下平行制备供试品溶液,按上述色谱条件分析。结果表明,各特征峰的相对保留时间RSD均小于2%,各特征峰的峰面积比值RSD均小于3%。
2.4.9 稳定性试验 取6份茜草粉末制备供试品溶液,分别在0、2、4、8、16、24 h进样。结果表明,茜草粉末各特征峰的相对保留时间RSD均小于1%,各特征峰的峰面积值RSD均小于3%。
2.4.10 加样回收率试验 精密称取茜草粉末样品0.05 g,置具塞离心管中,平行6份,分别加入一定体积的对照品溶液,精密加入50%甲醇(含0.5%甲酸)5 mL,按照“2.4.3”项方法制备供试品溶液,在“2.4.5”项条件下平行进样分析,计算回收率和RSD值。结果茜草素、羟基茜草素、甲基异茜草素、1,8-二羟基蒽醌及大叶茜草素的平均回收率分别为102.56%、98.89%、100.87%、100.02%、99.06%,RSD值分别为2.30%、0.66%、2.00%、0.96%、1.00%。
2.5 数据处理
采用Microsoft Excel 2013软件对数据进行处理,测定结果表示为形式,用SPSS19.0软件进行方差分析,Duncan法进行多重比较分析,Original 2019b绘图。
3 结果与分析
3.1 MeJA和GA3对茜草幼苗生长的影响
由表2可知,外源添加MeJA对茜草幼苗的影响表现为低浓度促生,高浓度抑制。50 μmol/Lol/L MeJA处理组对茜草幼苗的促生作用最大,除地下部分长度外,其余生长指标与CK组差异显著(<0.05),地上部分长度、地上部分鲜/干质量、地下部分鲜/干质量分别增加了20.09%、52.49%、107.11%、46.67%、27.28%;而150 μmol/L MeJA(T5)处理组对茜草幼苗的抑制作用最强,地上部分长度、地下部分长度、地上部分鲜/干质量分别较CK组降低了18.53%、20.24%、66.15%、33.50%。另一方面,GA3对茜草幼苗的影响则在实验所选浓度范围内表现为高浓度促进生长,400 mg/L GA3(T9)能够显著提高茜草幼苗的各项生长指标,与CK组相比差异显著(<0.05),地上部分长度、地下部分长度、地上部分鲜/干质量、地下部分鲜/干质量分别增加了24.65%、19.59%、91.98%、242.29%、119.08%、298.18%。说明MeJA和GA3作为常用的植物外源激素影响茜草的生长发育,当质量浓度合适时,可用来提高茜草的生物量。
3.2 MeJA和GA3对茜草幼苗叶片叶绿素和渗透调节物质含量的影响
添加外源MeJA和GA3后,茜草幼苗的叶绿素含量因外源激素的种类和浓度不同而呈现差异性(图1)。其中,MeJA处理下茜草幼苗叶片叶绿素含量随激素浓度的增加表现为先上升后降低,总叶绿素含量在50 μmol/L MeJA(T3)处理时达到最大值,为CK组的1.27倍。GA3处理下茜草幼苗叶片叶绿素含量则表现为随激素浓度的增加逐渐升高,总叶绿素含量在400 mg/L GA3(T9)处理时达到最大值,为CK组的1.26倍。可知,添加适当浓度的MeJA和GA3可以提高茜草幼苗的光合能力,但MeJA浓度过高会抑制茜草幼苗叶片的光合系统。
游离脯氨酸和蛋白作为植物体内的渗透调节物质,在植物遭受外源刺激的时候可以发挥重要的生理活性[23]。由图2可知,茜草幼苗中PRO和TP的含量随着MeJA质量浓度的增加表现为先上升后下降,在50 μmol/L MeJA(T3)处理组达到最高点,分别为CK组的1.62倍和1.87倍(<0.05)。不同于MeJA,茜草幼苗中PRO和TP的含量随着GA3质量浓度的增加不断增高,在400 mg/L GA3(T9)处理组达到最大值,分别为CK组的1.27倍和2.04倍(<0.05)。可知,由于外源激素的刺激,茜草幼苗体内会通过积累脯氨酸和蛋白质以适应外在环境变化,且因刺激源不同而表现出差异。
表2 不同浓度MeJA和GA3处理下茜草幼苗生长情况
Table 2 Growth of R. cordifolia seedlings under MeJA and GA3 with different concentrations
编号处理地上长度/cm地下长度/cm地上鲜质量/g地上干质量/g地下鲜质量/g地下干质量/g T1CK48.68±3.92c11.66±1.01c2.69±0.28cd0.51±0.04d0.87±0.08c0.11±0.01d T225 μmol/L MeJA53.92±4.82bc8.88±0.92d2.62±0.43cd0.59±0.13d1.10±0.13b0.11±0.02d T350 μmol/L MeJA58.46±5.52ab12.30±1.78bc4.11±0.29ab1.05±0.15bc1.44±0.13b0.14±0.02c T4100 μmol/L MeJA39.86±6.62d8.60±0.37d1.64±0.14de0.52±0.06d0.65±0.22d0.06±0.01e T5150 μmol/L MeJA39.66±1.55d9.30±0.82d0.91±0.18e0.34±0.05e0.86±0.05c0.09±0.01d T650 μmol/L GA328.64±2.94e8.88±1.42d1.03±0.10e0.27±0.06e0.41±0.06e0.09±0.03d T7100 μmol/L GA342.28±3.05d12.68±0.58abc2.01±0.12de0.68±0.08d 0.99±0.10bc0.15±0.04c T8200 μmol/L GA348.24±4.17c13.30±0.60ab3.49±0.22bc1.27±0.18ab1.85±0.18a0.30±0.05b T9400 μmol/L GA360.68±10.55a11.06±2.26a5.17±0.97a1.73±0.32a1.91±0.21a0.44±0.06a
不同小写字母表示处理间在0.05水平差异显著,P<0.05;下表同
Different lowercase letters indicate the significant difference among different MeJA and GA3 treatments at 0.05 level, P < 0.05; same as below
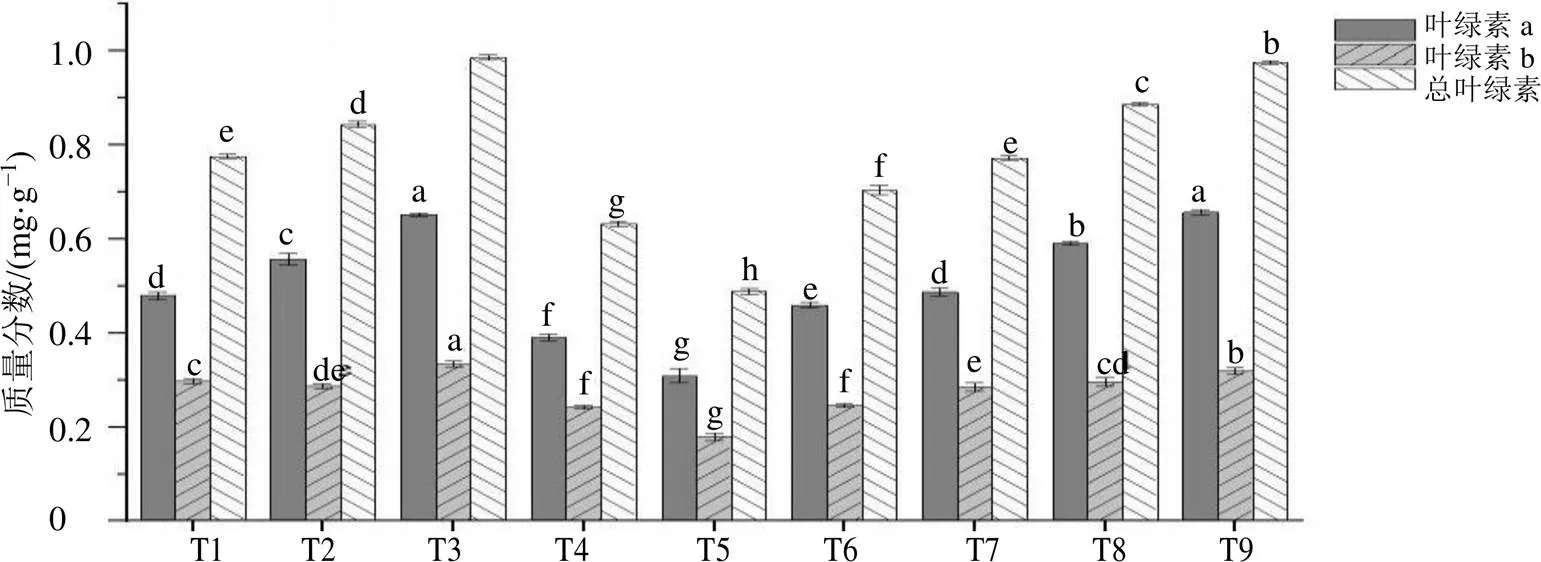
不同小写字母表示处理间在0.05水平差异显著,P<0.05;下图同
3.3 MeJA和GA3对茜草幼苗抗氧化酶活性和膜脂过氧化作用的影响
植物体内的抗氧化酶系统可以通过协同作用,将植物体内的H2O2转化成H2O,以保持体内的活性氧在较低的水平上[19]。外源添加MeJA和GA3后,茜草幼苗POD活性的动态变化趋势表现为随着MeJA浓度的增加先降后增,150 μmol/L MeJA(T5)处理POD活性最大,为CK组的1.38倍(<0.05);GA3处理与MeJA不同,表现为逐渐降低,50 mg/L GA3(T6)处理组POD活性最大,与CK组同样存在显著性差异(<0.05)(图3-A)。茜草幼苗SOD活性随MeJA和GA3质量浓度的增加呈现出逐渐增高的变化趋势,并均在浓度最高点达到最高值,150 μmol/L MeJA(T5)处理是CK组的2.21倍(<0.05),200 mg/L GA3(T8)处理组为CK的1.13倍(<0.05)(图3-A)。茜草幼苗CAT活性的动态变化趋势与POD一致,150 μmol/L MeJA(T5)处理POD活性最大,为CK组的2.67倍(<0.05);50 mg/L GA3(T6)处理组CAT活性最大,为CK组的6.11倍(<0.05)(图3-B)。因此,茜草幼苗在遭受外源激素干扰产生过氧化伤害时,体内抗氧化酶活性会受到诱导而发生改变,从而发挥活性氧清除作用,以减轻过氧化伤害,其活性变化程度与外源激素的种类及浓度有关。
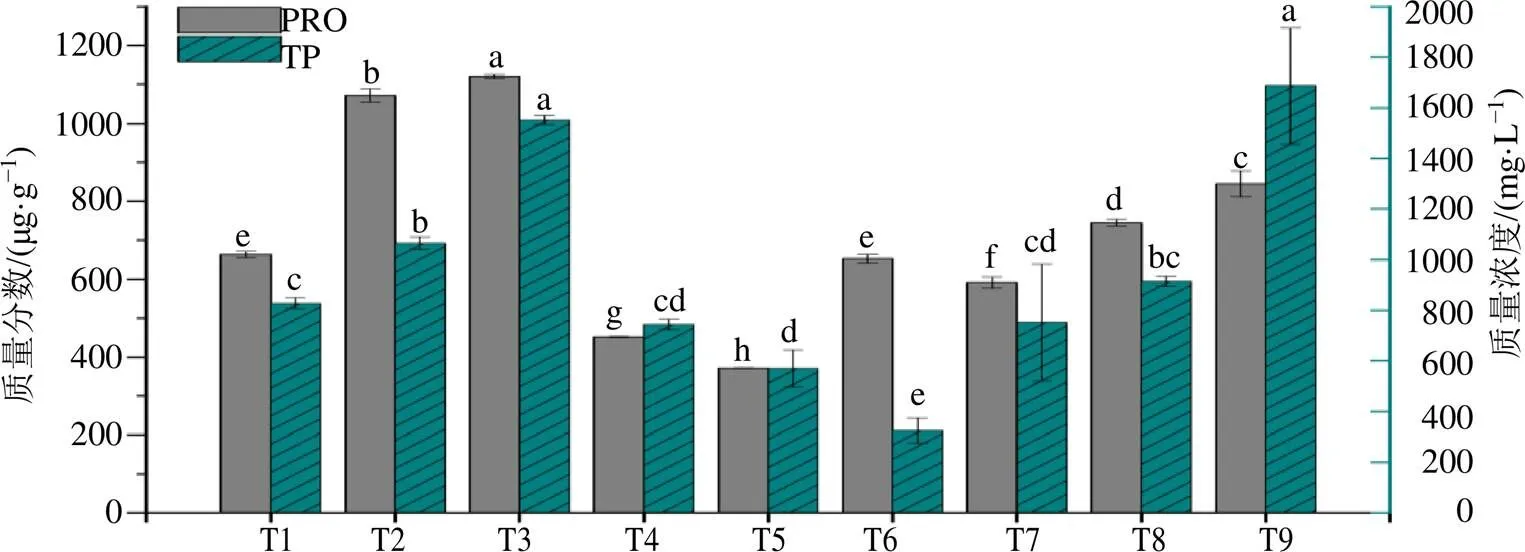
图2 MeJA和GA3处理对茜草幼苗PRO和TP含量的影响
同时,外源添加MeJA后,茜草幼苗MDA含量随着MeJA质量浓度的增加呈现先升后降,150 μmol/L MeJA(T5)处理组活性最低,比CK组降低了43.84%(<0.05),50 μmol/L MeJA(T3)处理组活性最高,为CK组的1.47倍(<0.05)(图3-B)。添加GA3后,茜草幼苗MDA含量随着GA3浓度增加而逐渐降低,400 mg/L GA3(T9)处理组比CK组降低了43.90%(<0.05),50 mg/L GA3(T6)处理组则是CK组1.42倍(<0.05)(图3-B)。以上结果表明,外源添加MeJA或GA3后,会对茜草幼苗产生膜脂过氧化作用伤害,且与二者的浓度存在一定相关性。
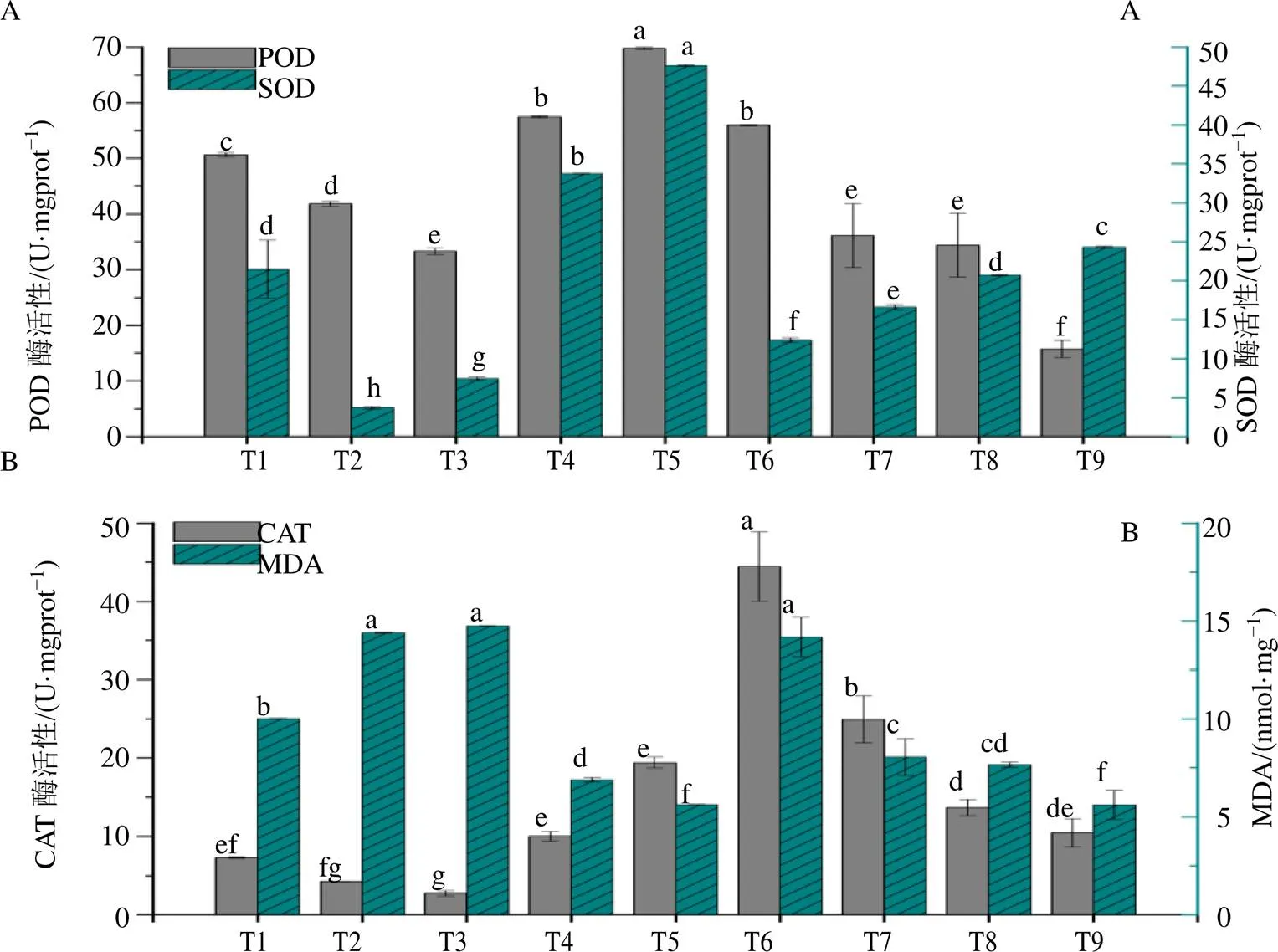
图3 MeJA和GA3处理对茜草幼苗SOD、POD (A) 和CAT、MDA (B) 的影响
3.4 MeJA对茜草幼苗中5种主要活性成分含量的影响
由图4可知,除25 μmol/L MeJA(T2)处理组抑制1,8-二羟基蒽醌和大叶茜草素的积累外,外源添加50~150 μmol/L MeJA(T3~5)可以显著促进茜草幼苗中5种主要活性成分的积累,且随着MeJA质量浓度的增加促进作用越强,150 μmol/L MeJA(T5)处理下含量最高,茜草素、羟基茜草素、1,8-二羟基蒽醌、甲基异茜草素和大叶茜草素的含量分别为CK组的5.26、6.86、1.22、4.75、1.80倍(<0.05)。
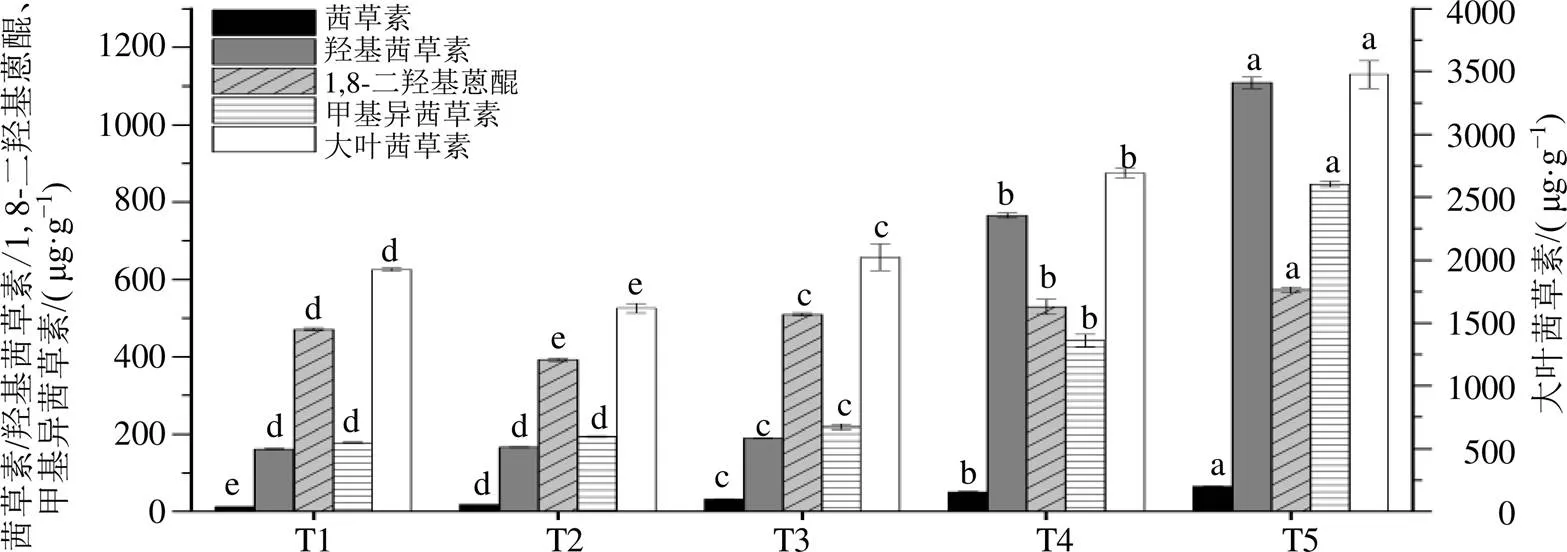
图4 MeJA处理对茜草中茜草素、羟基茜草素、1,8-二羟基蒽醌、甲基异茜草素和大叶茜草素含量的影响
3.5 GA3对茜草幼苗中5种主要活性成分含量的影响
由图5可知,GA3对茜草幼苗中5种主要活性成分积累的影响表现为低质量浓度抑制,高质量浓度促进。50 mg/L(T6)和100 mg/L(T7)GA3处理均明显降低了茜草幼苗中茜草素、羟基茜草素、1,8-二羟基蒽醌、甲基异茜草素和大叶茜草素的含量,其中50 mg/L GA3(T6)相比CK组分别降低了50.50%、67.65%、67.84%、71.93%和71.93%(<0.05);200 mg/L(T8)和400 mg/L(T9) GA3处理则促进了茜草幼苗中5种活性成分的积累,除1,8-二羟基蒽醌外,其余4种成分与CK组相比差异显著(<0.05),其中400 mg/L GA3(T9)处理后茜草素、羟基茜草素、甲基异茜草素和大叶茜草素分别为CK组的2.65、2.98、1.44、1.33倍(<0.05)。

图5 GA3处理对茜草中茜草素、羟基茜草素、1,8-二羟基蒽醌、甲基异茜草素和大叶茜草素含量的影响
4 讨论
植物激素属于一类对植物生长发育有显著作用的微量有机物质,在植物体内合成,常用的有生长素类、赤霉素类、茉莉酸类、细胞分裂素类和脱落酸类等[12]。大量研究表明,植物激素作为外源诱导子可以有效调节药用植物的生长发育过程,具有增强抗逆与抗病性、提高产量、促进次生代谢产物积累等作用[24-25]。其中,茉莉酸化合物是普遍存在的激素植物,包括茉莉酸及其衍生物MeJA,MeJA在植物增强氧化应激、促进酶活性和次生代谢产物积累及相关基因表达水平等方面发挥着关键作用;GA的基本结构是赤霉烷,根据发现时间的先后命名为GA1、GA2、GA3等,GA3活性最大,能对植物生长和发育产生深远而多样的影响,MeJA和GA3通过调控药用植物生长发育和次生代谢物积累,在药材品质改善方面取得了一系列成果[26-27]。因此,通过外源施加MeJA和GA3考察茜草的生长发育情况,分析其生理特性及主要活性成分积累变化,可为茜草人工种植过程中植物激素的使用提供参考。
药用植物的生长发育与其品质密切相关,也是中药材种植过程中的重要考虑指标。本研究结果表明,MeJA和GA3对茜草幼苗生长发育的作用受浓度影响较大,前者为低浓度促生,高浓度抑制,后者则刚好相反。外源施加50 μmol/L MeJA(T3)和400 mg/L GA3(T9)能够促进茜草幼苗的各项生长指标,与对照组相比,地上、地下部分长度和鲜干质量显著增加(<0.05)。说明MeJA和GA3作为常用的植物外源激素,能够影响茜草的生长发育,当质量浓度合适时,可用来提高茜草的产量,与在丹参[18]、太子参[19]等的研究结果一致。
叶绿素含量是胁迫环境下植物耐受性的重要指标之一,添加MeJA和GA3后,茜草幼苗叶绿素含量随着前者浓度的增加先增后降,50 μmol/L MeJA(T3)处理下含量最高;GA3处理则表现为质量浓度越高叶绿素含量越高,400 mg/L GA3(T9)处理组含量最高。可知,高质量浓度MeJA和低质量浓度GA3会导致茜草叶片内叶绿素含量显著降低。渗透调节物质游离脯氨酸和蛋白的含量随着MeJA质量浓度的增加先上升后下降,而随着GA3质量浓度的增加不断增高,推测原因为茜草幼苗的生理特征应对胁迫作用时的反应存在激素种类与浓度差异性。
外源添加MeJA和GA3会使植物处于胁迫环境而遭受伤害,此时植物体内的POD、SOD和CAT等抗氧化酶往往通过协同作用来有效缓解这种胁迫伤害。如李洁等[28]研究发现随着MeJA浓度的增大,远志愈伤组织中SOD、CAT、POD活性呈先上升后下降的趋势。本研究中,茜草幼苗POD、CAT、SOD活性在MeJA和GA3处理中表达不同,且同一激素不同质量浓度间差异显著,分析原因为在本实验中MeJA和GA3质量浓度范围内积累产生的超氧阴离子及过氧化物量未超过其体内抗氧化酶系统的清除能力,表现为MeJA诱导浓度越高抗氧化酶活性越强,而GA3低质量浓度抗氧化酶活性更强。MDA含量则随着MeJA质量浓度的增加先升后降,随GA3浓度的增加逐渐降低,可知MeJA或GA3浓度适当时,能够通过减少MDA含量,和抗氧化酶系统一起协同调控植物体内活性氧代谢平衡,从而促进植株生长、增加茜草生物量。
国内外研究人员已在通过添加外源激素来提高药用植物次生代谢产物积累,改善药材品质和生产生物活性物质方面取得了一系列的研究进展,如通过MeJA处理甘西鼠尾草毛状根后,发现丹酚酸B、迷迭香酸、隐丹参酮和丹参酮IIA等有效成分明显高于对照组[29];Li等[30]研究表明,GA3可以促进丹参毛状根的生长,增加丹参酮和丹酚酸的含量。本研究中,外源添加不同浓度的MeJA和GA3能够显著影响茜草中5种主要活性成分的积累,二者均表现为低浓度抑制,高浓度促进,50 μmol/L~150 μmol/L MeJA(T3~T5)和200~400 mg/L(T8~T9) GA3处理可以显著提高茜草素、羟基茜草素、甲基异茜草素、1,8-二羟基蒽醌和大叶茜草素的含量,其中150 μmol/L MeJA(T5)处理组羟基茜草素的含量是CK组的6.86倍(<0.05)。与前人研究证实MeJA和GA3作为外源诱导子,可以促进相关成分积累量增加的结论一致,原因与次生代谢物生物合成途径中关键酶基因和转录因子的表达量上调有关[29-30]。
综上所述,外源MeJA和GA3刺激可以影响茜草幼苗生长发育、生理活性及主要有效成分的积累,且适当浓度可以显著增加茜草生物量及大叶茜草素等有效成分的含量,为今后在茜草人工种植过程中通过外源诱导子改善药材品质提供了一定的参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S].一部. 2020: 245.
[2] 陈毅, 王海丽, 薛露, 等. 茜草的研究进展 [J]. 中草药, 2017, 48(13): 2771-2779.
[3] Wang K, Gao L, Zhang Q,. Revealing the mechanisms and the material basis ofL. on abnormal uterine bleeding with uniting simultaneous determination of four components and systematic pharmacology approach-experimental validation [J]., 2020, 189: 113475.
[4] Hu Y Y, Zhang X J, Zhang Z H,. Qualitative and quantitative analyses of quinones in multi-originspecies by ultra-performance liquid chromatography- tandem mass spectrometry combined with chemometrics [J]., 2020, 189: 113471.
[5] 纪宝玉, 裴莉昕, 陈随清, 等. 茜草药材的HPLC指纹图谱研究 [J]. 中国实验方剂学杂志, 2013, 19(23): 87-90.
[6] He D B, Bai X, Ma Y H,. One new nucleoside and three furanpentanone derivatives from the aerial part ofL [J]., 2021, 41: 125-128.
[7] 乔玄, 赵丽, 张磊, 等. 陕西不同产地茜草HPLC指纹图谱研究 [J]. 现代中医药, 2015, 35(1): 57-60.
[8] 王闽予, 何民友, 李国卫, 等. 不同产地茜草药材UPLC指纹图谱研究及化学计量学分析 [J]. 广东药科大学学报, 2020, 36(5): 609-614.
[9] 彭亮, 王媛媛, 黄涛, 等. ICP-MS法测定陕西不同产地野生茜草中9种重金属元素 [J]. 中草药, 2018, 49(6): 1418-1423.
[10] 彭亮, 张岗, 颜永刚, 等. 茜草转录组分析及其蒽醌类化合物合成相关基因的挖掘 [J]. 中草药, 2018, 49(8): 1890-1896.
[11] 彭亮, 孙涛, 王媛媛, 等. 陕产茜草种子质量分级标准研究 [J]. 中南药学, 2017, 15(9): 1224-1227.
[12] 樊建, 沈莹, 邓代千, 等. 植物生长调节剂在中药材生产中的应用进展 [J]. 中国实验方剂学杂志, 2022, 28(3): 234-240.
[13] Wu K, Xu H, Gao X H,. New insights into gibberellin signaling in regulating plant growth-metabolic coordination [J]., 2021, 63: 102074.
[14] Gutiérrez-Gamboa G, Pérez-Álvarez E P, Rubio-Bretón P,. Changes on grape volatile composition through elicitation with methyl jasmonate, chitosan, and a yeast extract in Tempranillo (L.) grapevines [J]., 2019, 244: 257-262.
[15] 胡正平, 徐娇, 周涛, 等. 茉莉酸甲酯对川续断根中川续断皂苷Ⅵ合成积累的影响 [J]. 药学学报, 2021, 56(8): 2302-2307.
[16] Hou Z N, Li Y Y, Su F,. The exploration of methyl jasmonate on the tanshinones biosynthesis in hair roots ofBunge andf.Stib [J]., 2021, 167: 113563.
[17] Wang M L, Chen J Q, Zhang X D,. Gibberellin A3 induces polyaerial shoot formation and increases the propagation rate in Parisrhizomes [J]., 2021, 167: 113511.
[18] 马俊莹, 房海悦, 龙雪栋, 等. 不同质量浓度赤霉素对丹参种苗建成与药材质量的影响 [J]. 东北林业大学学报, 2018, 46(8): 60-62.
[19] Zhang J Q, Zhou T, Zhang C,. Gibberellin disturbs the balance of endogenesis hormones and inhibits adventitious root development ofthrough regulating gene expression related to hormone synthesis [J]., 2021, 28(1): 135-147.
[20] Bulgakov V P, Tchernoded G K, Mischenko N P,. Effect of salicylic acid, methyl jasmonate, ethephon and cantharidin on anthraquinone production bycallus cultures transformed with the rolB and rolC genes [J]., 2002, 97(3): 213-221.
[21] Fan X, Hu G S, Li N,. Effects of lovastatin, clomazone and methyl jasmonate treatment on the accumulation of purpurin and mollugin in cell suspension cultures of[J]., 2013, 11(4): 396-400.
[22] 彭亮, 杨冰月, 张岗, 等. 干旱胁迫对远志种子萌发及幼苗生长和生理特性的影响 [J]. 西北植物学报, 2018, 38(4): 741-749.
[23] Afzal I , Akram M W , Rehman H U,. Moringa leaf and sorghum water extracts and salicylic acid to alleviate impacts of heat stress in wheat[J]., 2019, 129: 169-174.
[24] Gee D M, La A, Rp A,. The role of methyl jasmonate in enhancing biomass yields and bioactive metabolites insp. (Bacillariophyceae) revealed by proteome and biochemical profiling [J].s, 2021, 249: 104381.
[25] K Zalewski, B Nitkiewicz, M Stolarski,. The influence of exogenous methyl jasmonate on the germination and, content and composition of flavonoids in extracts from seedlings of yellow and narrow-leafed lupine [J]., 2020, 87: 103398.
[26] Liu R, Wang Z R, Zheng J Y,. The effects of methyl jasmonate on growth, gene expression and metabolite accumulation inFort [J]., 2022, 177: 114482.
[27] Xie W, Han C, Zheng Z Q,. Determination of Gibberellin A3 residue in fruit samples by liquid chromatography-tandem mass spectrometry [J]., 2011, 127(2): 890-892.
[28] 李洁, 胡本祥, 彭亮, 等. 水杨酸和茉莉酸甲酯对远志愈伤组织生长和相关酶活性及化学成分的影响 [J]. 中草药, 2019, 50(12): 2976-2982.
[29] Li J, Li B, Luo L,. Increased phenolic acid and tanshinone production and transcriptional responses of biosynthetic genes in hairy root cultures ofMaxim. treated with methyl jasmonate and salicylic acid [J]., 2020, 47(11): 8565-8578.
[30] Li W R, Liu C F, Liu J L,. Transcriptomic analysis reveals the GRAS family genes respond to gibberellin inhairy roots [J]., 2020, 21(1): 727-740.
Effects of exogenous methyl jasmonate and gibberellins on growth, related enzyme activities and contents of active constituents of
PENG Liang1, 2, LUO Yao1, 2, LI Fei3, SHEN Xia1, 2, ZHOU Ke-xin1, 2, YAN Yong-gang1, 2, ZHANG Jian-jian4, HU Ben-xiang1, 4, YANG Bing-yue1, 2
1. Shaanxi Qinling Application Development and Engineerig Center of Chinese Herbal Medicine, College of Pharmacy, Shaanxi University of Chinese Medicine, Xi’an 712046, China 2. Key Laboratory for Research of "Qin medicine"of Shaanxi Administration of Traditional Chinese Medicine, Xi’an 712046, China 3. Affiliated Hospital of Shaanxi University of Chinese Medicine, Xianyang 712000, China 4. Shaanxi Institute of International Trade and Commerce, Xi’an 712046, China
To study the effects of exogenous methyl jasmonate (MeJA) and gibberellins (GA3) on seedling growth, related enzyme activities and the contents of main active components of.One-month-old seedlings ofwere cultured in Hoagland nutrient solution for 30 d, and then added with different concentrations of MeJA (25, 50, 100, 150 μmol/L) and GA3 (50, 100, 200, 400 mg/L) for 7 d, respectively. The length, dry and fresh weight, osmotic adjustment substance content, antioxidant enzyme activities and five main active components ofwere measured.The effect of MeJA on the growth ofseedlings was promoted by low concentration and inhibited by high concentration in the concentration range selected in this experiment. The effect of GA3 was inhibited by low concentration and promoted by high concentration. In physiological activities, the contents of chlorophyll, free proline and total protein increased significantly under 50 μmol/L MeJA and 400 mg/L GA3 treatment; The activities of POD, SOD, CAT and the content of MDA were different with the hormone types and concentrations. The activities were stronger under 150 μmol/L MeJA and 50 mg/L GA3 treatment. The concentration of MeJA and GA3 had a great influence on the accumulation of active components in. The accumulation of alizarin, purpurin, 1, 8-dihydroxyanthraquinone, rubiadin and mollugin was significantly promoted by 50—150 μmol/L MeJA in. seedlings, and the promotion was stronger with the increase of MeJA concentration (< 0.05); the accumulation of active components was significantly enhanced by 200 and 400 mg/L GA3 treatment (< 0.05).The growth, physiological activities and accumulation of main active components of.seedlings are affected by the concentration of exogenous MeJA and GA3. MeJA (50 μmol/L) and GA3 (400 mg/L) can significantly increase the biomass ofseedlings and promote the accumulation of alizarin, purpurin, 1,8-dihydroxyanthraquinone, rubiadin and mollugin inseedlings.
L.; methyl jasmonate; gibberellins; antioxidant enzyme; osmotic adjustment substance; alizarin; purpurin; 1,8-dihydroxyanthraquinone; rubiadin; mollugin
R286.2
A
0253 - 2670(2022)11 - 3463 - 09
10.7501/j.issn.0253-2670.2022.11.024
2021-12-03
陕西省教育厅项目(19JK0225);陕西省中医药管理局项目(2021-QYZL-02);2018年医疗服务与保障能力提升补助资金(中医药事业传承与发展部分)“全国中药资源普查项目”(财社[2018]43号);陕西中医药大学“秦药”品质评价及资源开发学科创新团队项目(2019-QN01)
彭 亮,博士,副教授,研究方向为中药资源评价与利用,分子生药学。E-mail: ppengliang@126.com
杨冰月,博士,副教授,研究方向为中药品种、质量及资源开发。E-mail: 304951774@qq.com
[责任编辑 时圣明]
