附子-大黄药对治疗阳虚类疾病配伍机制研究进展
2022-05-31陈家琪包丹丹岳天祥李范珠朴寄纲
陈家琪,包丹丹,张 悦,岳天祥,张 钶,李范珠*,朴寄纲*
附子-大黄药对治疗阳虚类疾病配伍机制研究进展
陈家琪1,包丹丹2#,张 悦1,岳天祥1,张 钶1,李范珠1*,朴寄纲1*
1. 浙江中医药大学药学院,浙江 杭州 311403 2. 浙江中医药大学附属第一医院(浙江省中医院),浙江 杭州 310053
附子-大黄为典型的寒热药对,首见于《金匮要略》之大黄附子汤,二药配伍可发挥减毒增效的作用,故已广泛应用于临床。基于中药配伍理论阐释了附子-大黄药对配伍关系,通过综述近年来关于其配伍的研究,从其配伍后毒性及有效成分体外含量、体内代谢变化,药效变化和治疗阳虚类疾病的应用等方面具体阐释了附子-大黄药对减毒增效的内在配伍机制,以期为中药复方配伍规律的总结提供科学依据和参考,为临床更安全有效地应用附子-大黄药对提供理论依据。
附子;大黄;药对;阳虚;配伍机制;减毒增效
药对作为中药配伍的最小单位,是历代医家长期遣方用药的经验总结,以临床病证所采用的相应治法为前提,以中药七情配伍理论和药性理论等为依据,由相对固定的2味中药配伍而成,隐含着复方的规律性特征与辨证施治的内涵[1]。附子有“回阳救逆第一品药”之称,但在《神农本草经》中明确被列为下品中药,“下品多毒,不可久服”[2];而素有“将军”之称的大黄,虽为泻下良药,但其苦寒之性峻烈[3]。中药的毒性不仅指其毒副作用还可指其偏性之性,故二药单独使用均具有一定的毒性,但其配伍可达到减毒增效的效果。附子-大黄药对首见于《金匮要略》之大黄附子汤,其重用附子以温阳散寒、止腹胁疼痛,配用大黄以泻下通便、荡涤积滞,主治寒积便秘,二药配伍为典型的寒热配伍,并开创温下之先河[4]。有学者统计《中医方剂大辞典》发现含附子-大黄药对的方剂共266首,可见其已广泛应用于临床[5]。研究表明以寒制热对附子的减毒作用强于以甘缓毒、以柔克刚、调正抑毒3种配伍类型[6]。因此,揭示附子-大黄药对配伍机制,对深入探究以寒制热的减毒机制、研究其复方配伍规律、指导其复方临床使用等都具有重要意义。本文基于中药七情配伍理论和药性理论对附子-大黄药对配伍关系进行阐释,为其配伍研究提供中医理论基础;从其配伍后毒性及有效成分体外含量、体内代谢变化,药效变化及治疗阳虚类疾病的应用方面综述近年来关于其配伍的研究,并参考现代研究文献,更全面地阐释附子-大黄药对配伍的减毒增效机制。
1 附子-大黄药对配伍关系
“药有个性之专长,方有合群之妙用”,善用有毒中药并通过配伍纠正偏性和制约毒性是中医用药的特色。
《神农本草经》所创立的七情配伍理论是经长期临床实践对不同中药配伍所产生的药理作用的归纳与总结,它从单行、相须、相使、相恶、相畏、相杀、相反7种配伍中揭示了中药配伍的增效、减毒、减效、增毒的4大规律,其中相杀、相畏配伍是有毒中药配伍减毒的主要理论依据。附子-大黄药对相畏、相杀以实现减毒,大黄可降低附子毒性成分含量以减轻其毒副作用,附子在保持大黄泻下功效的同时降低大黄寒性成分含量而缓解其峻烈之性。中药药性包括四气、五味、归经、升降浮沉、毒性等,是中药作用的基本性质和特征的高度概括,四气五味是其重要组成部分[7]。张景岳在《类经》中指出:“所谓毒者,因气味之偏也”,部分有毒药物的气味峻烈燥急,或以辛苦气燥、辛散走窜之性为胜,或以大寒大热之气为胜[8]。为制约气味峻猛药物的毒性,药物可按气味相反配伍如附子-大黄药对,虽不可相辅相成,但可形成牵制效应从而调其偏性制其毒性[8]。从“寒、热、温、凉”四气方面分析,附子性热,易助阳化火、耗伤阴津;大黄性寒,易伤人阳气、胃气,二药通过寒热配伍以制约其寒热偏性所过之弊。附子可缓和大黄苦寒之性,大黄可佐制附子辛热之性并保留原有泻下之功效,二药互制互补,共奏温阳祛寒、泻下攻积之功[4,8-9]。从“酸、苦、甘、辛、咸”五味方面分析,附子味辛,具有发散、行气之功,但辛散太过可耗伤气阴;大黄味苦,具有降泄通下作用,但苦寒太过易败胃。二药属辛苦配伍,大黄可制附子之辛散,使附子有温经止痛及散寒之功,而无伤阴耗气之弊,可起辛开苦降、调理气机、调和脾胃的作用;辛味属阳,苦味属阴,二药配伍还可共同调整机体的阴阳平衡[8-10]。综上,基于中药七情配伍理论和药性理论,附子-大黄药对配伍关系可从相畏相杀配伍、寒热配伍、辛苦配伍3个方面进行阐释,均体现了其配伍后去性取用和减毒增效的特点,证明了二药配伍使用的合理性和科学性。
2 附子-大黄药对配伍后活性成分的变化
2.1 配伍大黄对附子毒性及有效成分的影响
2.1.1 对毒性及有效成分体外含量变化的影响 生物碱是附子具有明显特征的主要有效成分,包括C19型二萜生物碱类、C20型二萜生物碱类、酰胺类、季铵盐类、阿朴啡类等,非生物碱部分可分为黄酮类、多糖、皂苷等。其中数量最多的C19型二萜生物碱多以乌头碱骨架为主,根据酯键连接情况可分为醇胺型、单酯型和双酯型生物碱,酯键数量与附子毒性密切相关,其毒性从小到大依次为醇胺型、单酯型、双酯型[11-12]。双酯型C19二萜生物碱是生附子中含量最高、毒性最强的一类生物碱,包括乌头碱(aconitine,AC)、新乌头碱(mesaconitine,MA)、次乌头碱(hypaconitine,HA)等,导致生附子具有极强的心脏急性毒性、神经毒性等,但其在低浓度时可发挥适当的药效[13]。炮制或煎煮可使双酯型生物碱水解转化成毒性较弱和药效较温和的单酯型生物碱,包括苯甲酰新乌头原碱(benzoylmesaconine,BMA)、苯甲酰乌头原碱(benzoylaconine,BAC)、苯甲酰次乌头原碱(benzoylhypaconine,BHA)等,甚至还可进一步水解为毒性更弱的醇胺型生物碱,包括乌头原碱(aconine,ACN)等,从而促进毒性物质转化,生物活性增强,一定程度上减弱附子毒性[11-14]。
传统医学常用的减毒方法除了依法炮制、控制剂量、延长煎煮,还有合理配伍,其可调偏性制毒性以增加用药安全,同时促进药效发挥[12]。现代研究表明生附子及其炮制品(黑顺片、白附片等)与大黄按一定比例配伍后,其毒性成分含量均可降低以实现减毒,也有学者对大黄减弱附子毒性的具体机制及物质基础进行了深入探究。梁佳佳等[15]对生附子-大黄药对配伍前后溶液中AC、MA、HA提取后测定其含量,对比发现配伍后这3种双酯型生物碱含量均明显降低,证实大黄可显著降低双酯型生物碱体外含量以减弱生附子毒性。有研究通过检测黑顺片-大黄按不同比例配伍煎煮适宜时间后水煎液中BMA、BAC、BHA含量,比较可知这3种单酯型生物碱含量在配伍后均明显下降,配伍比例为1∶1时三者含量均最低,即1∶0>2∶1>1∶2>1∶1,表明大黄在合煎过程中可通过降低黑顺片中单酯型生物碱含量实现减毒,且1∶1配伍时减毒效果较佳[16]。也有研究通过对比不同配伍比例的黑顺片-大黄提取液中的总生物碱含量(1∶1>2∶1>1∶2>1∶0),说明1∶1配伍后提取液中有效成分含量较高,利于黑顺片的药效发挥[17]。周静波[18]分别测定生附子、白附片、黑顺片配伍大黄煎煮适宜时间后酯型生物碱含量,对比发现配伍后各组的酯型生物碱含量均降低,其中生附子组含量下降幅度最高,说明大黄可促进生附子及其炮制品有毒组分的水解以实现减毒,对生附子减毒作用最明显。该研究通过附子-大黄有效部位配伍发现附子总碱配伍大黄总蒽醌后AC、MA、HA含量明显呈下降趋势,且降低幅度与大黄总蒽醌的量呈正相关性,说明大黄蒽醌类化合物可促进双酯型生物碱水解,因为其分子中多带有酸性基团,能与双酯型生物碱发生反应。叶强[17]通过观察黑顺片-大黄及附子总碱-大黄多糖配伍煎煮6 h内AC、MA、HA的溶出率曲线,发现其趋势基本一致:AC、MA、HA溶出率均先以较快速度达到峰值但其大小低于配伍前,说明煎煮前期配伍大黄或大黄多糖均可提高双酯型生物碱溶出速度但不使其体外含量增加;之后溶出率随煎煮时间延长逐渐下降,也随大黄多糖比例的增加而下降,说明配伍能促进双酯型生物碱水解进而降低其含量,且大黄多糖为大黄加快附子毒性成分溶出并促进其水解从而实现减毒的物质基础。除此之外也发现附子总碱配伍大黄鞣质后,水煎液中AC、MA、HA的溶出也随大黄鞣质比例的升高逐渐减缓,说明大黄鞣质也可为大黄实现减毒的物质基础,机制为弱酸性的大黄鞣质会与双酯型生物碱发生酸碱中和反应,生成不被肠道所吸收的鞣酸乌头碱盐[17-18]。
2.1.2 对毒性及有效成分体内代谢的影响 大黄对附子的减毒作用不仅通过在体外影响其双酯型和单酯型生物碱含量而实现,还能通过影响二者在体内的代谢过程包括吸收、分布、代谢和排泄,引入药动学深入分析更全面阐释配伍后大黄对附子的减毒增效机制。Zhang等[19]对AC、BAC、CAN(可分别代表双酯型、单酯型、醇胺型生物碱)的药动学进行了研究,结果表明3种生物碱均能被快速吸收,BAC的达峰时间(max)最短,而AC的峰浓度(max)最大;毒性最大的AC消除半衰期(1/2)最小,在体内较BAC和ACN更易代谢及更快消除;这3种生物碱分布于所有器官中,而AC的分布速度最慢及区域最小;AC和ACN主要通过尿液排泄,而BAC则通过粪便排泄。说明附子在快速发挥药效的同时也产生了很强的毒性,尽管毒性最强的双酯型生物碱会以较快速度代谢和消除,故抑制双酯型生物碱的吸收应是减弱附子毒性的关键。Liu等[20]对附子单提液和大黄附子汤中HA、BMA、BAC、BHA在大鼠血浆中的药动学差异进行研究,结果发现正常大鼠ig大黄附子汤后HA、BMA、BAC、BHA的max、血药浓度-时间曲线下面积(AUC0~t)、清除率(CL)与附子单提液相比均显著性减小,其中BMA、BAC、BHA的1/2、平均驻留时间(MRT0~)、表观分布容积(d)均显著性增大,HA的max呈显著性延长,说明大黄附子汤可通过抑制附子中HA、BMA、BAC、BHA的吸收,并明显减慢毒性更强的HA吸收速度来减弱附子的毒性,并通过延长毒性较弱的BMA、BAC、BHA在体内的滞留时间和延缓其消除使大黄附子汤的疗效增强。为深入探究大黄附子汤中附子-大黄药对配伍机制,任常谕[16]研究了黑顺片-大黄药材配伍对HA、BMA、BAC、BHA在正常比格犬体内药动学的影响。结果与黑顺片单煎液比较,发现黑顺片-大黄水煎液中的HA、BMA、BAC、BHA的max均显著性延长,AUC0~t和max均呈下降趋势,说明大黄可延缓这4种生物碱的吸收并降低其在体内的吸收程度,进而减弱附子毒性。同时双酯型生物碱HA的1/2比另3种单酯型生物碱短,也表明在体内双酯型生物碱会比单酯型生物碱消除更快,从而减少其毒副作用。结果也发现其MRT0~t和d呈上升趋势,说明大黄可延长其在体内的滞留时间,利于其更好地分布于靶器官从而促进附子药效的发挥。改善附子毒性成分的分布也可减少其在非靶向部位的剂量以减少附子的毒副作用。机体不同的生理病理状态会对指标性成分的药动学参数产生不同的影响[21]。张艳等[22]研究发现附子总生物碱配伍大黄蒽醌给药后,附子总生物碱的7种指标性成分在阳虚便秘大鼠体内的总入血量较正常大鼠更大、代谢也更快,说明总生物碱在发挥治疗作用时吸收程度会增加、代谢加快、生物利用度增加,进而促进其药效的发挥。
2.2 配伍附子对大黄毒性及有效成分的影响
2.2.1 对毒性及有效成分体外含量变化的影响 大黄所含化学物质种类繁杂,主要包括蒽醌类、蒽酮类、鞣质类、多糖类、二苯乙烯类、苯丁酮类、色原酮类、黄酮类等成分[23]。其中蒽醌、蒽酮类成分是大黄属植物的特征性成分,也是大黄发挥药效的主要活性成分[24]。蒽醌类在大黄活性成分中含量最高,可分为游离型与结合型[25]。游离型蒽醌包括大黄酸、大黄酚、大黄素、芦荟大黄素、大黄素甲醚等;结合型蒽醌如大黄酸葡萄糖苷、大黄素葡萄糖苷等是糖基与游离型蒽醌结合而成的糖苷,可通过水解或代谢转化为相应的游离型蒽醌而发挥泻下作用[24-26]。蒽酮类主要包括番泻苷A~F、大黄二蒽酮A~C、掌叶二蒽酮A~C等[25],其中番泻苷A具有较强的间接致泻作用,其在肠道中很少被吸收,给药后大部分到达结肠,经肠内细菌代谢成大黄酸蒽酮、大黄酸等游离成分而发挥泻下作用[27]。现代研究表明在大黄中,除结合型蒽醌类与蒽酮类成分有一定的泻下攻积功效外,游离蒽醌类成分有一定的清热泻火和利湿退黄功效,该功效体现于大黄解热降温、抗炎、抗病原微生物、利尿、保肝利胆等药理作用[23,28];鞣质类成分有一定的凉血止血和收敛止泻作用,可作为大黄发挥泻下和止泻双向调节作用的物质基础,但含量过高会导致便秘[29-30]。生大黄性苦寒、泻下峻烈,直接使用对胃肠道有刺激作用,长期单独服用具有胃肠毒性、肝毒性、肾毒性等[24],而蒽醌类为其主要毒性成分,如大黄酸和大黄素可诱导肾小管上皮细胞凋亡,具有明显的细胞毒性作用[31]。但可通过炮制(酒炙、蒸制、炒炭)使生大黄有效成分发生变化,进而减缓其苦寒药性及泻下作用,减少其不良反应,同时可增强其他功效,如酒大黄可引药上行,善清上焦血分热毒;熟大黄活血祛瘀功效增强;大黄炭凉血止血功效增强[32-33]。
除炮制减毒外,大黄还可与附子寒热配伍,达到去性取用的效果。由于大黄毒性和附子毒性相比较弱,故关于附子-大黄药对配伍机制研究大多集中于大黄对附子的减毒,且多采用生大黄与附子及其炮制品进行配伍研究,由于生大黄单独使用易造成不良反应,为增加临床用药安全,附子对大黄的减毒机制也需深入研究。胥鹏鹏等[34]研究发现生附子等热性药按不同比例与大黄配伍后对其致泻性有抑制作用,且抑制作用随生附子量的增加而增强,但与空白组相比仍保持泻下功效。说明附子作为热性药不仅可缓和大黄之寒,还可减缓并保持其通下走泻作用,实现去性取用。叶强等[4]研究发现黑顺片-大黄配伍后合煎液中总蒽醌和游离蒽醌含量较其分煎后的混合液均有所降低,说明在共同煎煮作用下,酸性的游离蒽醌会与附子生物碱发生酸碱反应,导致其和总蒽醌含量均下降,表明配伍附子后可使大黄峻猛的泻下作用得到缓和,变大黄的寒下为温下。周静波[18]分别测定生附子、白附片、黑顺片配伍大黄煎煮适宜时间后总蒽醌、结合型蒽醌和游离型蒽醌含量,发现配伍后各组的三者含量均呈下降趋势,与配伍附子量成正比,且生附子组三者含量下降最为明显,说明配伍生附子及其炮制品均可缓和大黄的泻下作用及其药性,其中生附子对大黄的减毒作用最明显;比较2种蒽醌的含量变化,发现结合型蒽醌下降比例大于游离型蒽醌,说明生物碱易促进结合型蒽醌水解并与之发生反应,且结合型蒽醌中和生物碱的能力大于游离型蒽醌。曾灵娜等[35]通过分别测定大黄与生附子、熟附子等含生物碱类药材配伍煎煮前后的游离蒽醌含量,对比发现所有合煎样品的游离蒽醌含量呈下降趋势,其中生附子影响最大。因为熟附子经过炮制部分生物碱含量会降低,而在合煎时生物碱又易与游离蒽醌结合,导致其煎出量降低,从而缓和大黄药性。有研究从组分配伍出发,发现附子总碱、多糖与大黄总蒽醌配伍煎煮后,总蒽醌和游离蒽醌含量也均较单煎液明显降低,说明除附子总碱外附子多糖也可抑制游离蒽醌溶出[17]。在附子总碱-大黄鞣质配伍研究中,由于乌头类生物碱会与大黄鞣质发生反应,故推测配伍后附子也可使大黄鞣质含量下降,抑制其止泻作用,从而有利于大黄在总蒽醌含量下降的同时保持泻下作用[17]。
2.2.2 对毒性及有效成分体内代谢的影响 药对经过配伍后,由于中药成分复杂,各成分之间在体内会发生相互作用,体内代谢过程又决定着药物进入体循环的速度、剂量和停留时间,从而影响配伍后的药效,故引入药动学可对大黄蒽醌类成分配伍后体内代谢变化深入研究。大量药动学研究表明大黄中大黄酸等蒽醌类成分多符合二室开放模型,分布广泛,且大黄酸口服吸收最大血药浓度及生物利用度均优于大黄药材中所含其他游离蒽醌,为大黄经胃肠道给药后吸收入血的主要有效成分,具有吸收快、max高、1/2较低等动力学特点[21]。故延缓大黄酸等蒽醌类成分的吸收和消除应是对大黄实现去性存用及减毒增效的关键。Liu等[36]通过建立超高效液相色谱-串联质谱法对给予大黄提取物和大黄附子汤后的大鼠血浆中浓度较低且易受干扰的大黄酚和大黄素的药动学进行测定比较,结果发现大黄附子汤组大黄酚和大黄素max均显著降低、max均显著延迟,大黄酚1/2延迟,说明配伍附子及细辛可抑制并减缓其吸收,缓和大黄的强效泻下和苦寒药性,增加临床使用的安全性。龚小红[37]通过对比不同剂量附子-大黄合煎液及其单煎液给药正常大鼠后的芦荟大黄素、大黄酸、大黄素、大黄酚等主要游离蒽醌体内药动学特征,发现正常大鼠ig附子-大黄合煎液后这4种游离蒽醌的1/2在各个剂量下均显著增大,max在低、中剂量下变化不明显但在高剂量下也均显著增大,说明配伍附子不仅可延缓大黄在体内的消除,延长其在体内作用的持续时间,保证大黄泻下作用的持久,还可减缓大黄蒽醌的吸收,缓和大黄峻烈的药效,体现了附子-大黄配伍在吸收和消除方面的减毒增效特点。该研究也通过整合药动学/药效学模型发现配伍附子能减慢大黄游离蒽醌在效应室和中央室之间平衡速度而减慢其吸收速率,能增强其与受体的亲和力,在保证大黄泻下作用持久的同时减轻其毒性,实现去性取用。
附子-大黄药对配伍后活性成分体外含量变化见表1,体内代谢变化见表2。
3 附子-大黄药对配伍后药效变化
3.1 增强抗炎、镇痛作用
研究证实附子具有抗炎、镇痛的药理活性[38],高鹏等[39]为探究不同配伍比例大黄对附子的增效存效作用,采用耳部肿胀法、扭体法对给予黑顺片-大黄合并提取液的小鼠进行抗炎、镇痛实验。在抗炎实验中发现高剂量配伍给药组小鼠耳肿胀抑制率在一定范围内随大黄配伍比例增加而上升,且具有较好的量效关系,配伍比例为1∶1和1∶3的高剂量组抗炎效果最佳,说明配伍大黄后可增强附子的抗炎活性,并与大黄的量成正比;在镇痛实验中发现配伍比例为1∶1和1∶3时的高、低剂量组小鼠扭体次数均低于单用附子组,具有较好的量效关系,配伍比例为1∶3的高剂量组镇痛疗效最佳,说明配伍大黄后也可增强附子的镇痛活性,也与大黄的量成正比。其实大黄本身也具有抗炎、抗病原微生物等药理活性[23],大黄总蒽醌对小鼠扭体模型也有一定的镇痛作用[40],进而附子配伍大黄后便能发挥“1+1>2”的药效,从而可用于治疗与全身炎症反应综合征相关疾病。
表1 附子-大黄药对配伍后活性成分体外含量变化
Table 1 Changes of active ingredients of Aconiti Lateralis Radix Preparata - Rhei Radix et Rhizomain vitro after compatibility
配伍方式配伍组合被影响的药物活性成分体外含量变化及机制作用文献 药材配伍生附子-大黄生附子提取液中AC、MA、HA含量下降减毒15 促进酯型生物碱水解,导致合煎液中其含量下降减毒18 大黄促进结合蒽醌水解并与其和游离蒽醌反应,导致合煎液中二者含量均下降减毒18 合煎液中游离蒽醌含量下降减毒35 黑顺片-大黄黑顺片合煎液中BMA、BAC、BHA含量下降减毒16 提取液中总生物碱含量上升,利于其药效发挥增效17 促进AC、MA、HA等酯型生物碱水解,导致合煎液中其含量下降减毒17-18 大黄与游离蒽醌发生酸碱反应,导致合煎液中其和总蒽醌含量下降减毒4 促进结合蒽醌水解并与其和游离蒽醌反应,导致合煎液中二者含量均下降减毒18 组分配伍附子总碱-大黄总蒽醌附子与AC、MA、HA发生酸碱反应并促进其水解减毒18 大黄与游离蒽醌发生酸碱反应并抑制其溶出,导致其和总蒽醌含量下降减毒17 附子总碱-大黄多糖附子加快AC、MA、HA溶出并促进其水解减毒17 附子多糖-大黄总蒽醌大黄抑制游离蒽醌溶出,导致其和总蒽醌含量下降减毒17 附子总碱-大附子与AC、MA、HA发生酸碱反应生成不被肠道所吸收的鞣酸乌头碱盐减毒17-18 黄鞣质大黄鞣质含量下降,抑制其止泻作用,利于保持泻下作用增效17
表2 附子-大黄药对配伍后活性成分体内代谢变化
Table 2 Metabolic changes of active ingredients of Aconiti Lateralis Radix Preparata - Rhei Radix et Rhizomain vivo after compatibility
被影响的药物活性成分变化机制作用文献 附子或其炮制品延缓并抑制HA、BMA、BAC、BHA吸收延长tmax,降低AUC0~t、Cmax减毒16,20 HA消除快于BMA、BAC、BHAt1/2较BMA、BAC、BHA更短减毒20 延长BMA、BAC、BHA滞留时间,并改善其分布延长MRT0~t,增大Vd增效16,20 大黄减缓并抑制大黄酚和大黄素吸收延长tmax,降低Cmax减毒36 减缓5种游离蒽醌的吸收延长tmax减毒37 延长5种游离蒽醌在体内作用的持续时间延长t1/2增效37
3.2 增强肠蠕动及排便作用
有研究通过测定附子-大黄不同比例配伍后对阳虚便秘小鼠及大鼠的排便时间、排便量、小肠推进率的影响,比较发现配伍后各组动物首粒排便时间显著缩短,3 h内排便粒数显著增加,小肠推进率明显提高,其疗效优于附子或大黄单煎剂,且附子-大黄配伍比为1∶2时疗效最佳[41]。丘振文等[42]还通过研究发现附子-大黄配伍后可增大阳虚便秘大鼠离体回肠活动强度,疗效也优于二药单煎剂,且配伍比为2∶1时增强幅度最大。故附子-大黄配伍后可保持大黄泻下作用的持久,增强阳虚便秘动物肠平滑肌蠕动能力,促进其排便,可用于治疗阳虚型便秘。
3.3 增强强心作用
现代研究表明,附子在发挥强心作用的同时也具有心脏毒性,心脏毒性是由双酯型生物碱直接或间接作用于心脏导致的,机制与脂质过氧化反应等有关[12]。双酯型生物碱可通过降低超氧化物歧化酶(superoxide dismutase,SOD)活性,减弱自由基清除能力,从而使心肌细胞中氧自由基(reactive oxygen species,ROS)蓄积,对线粒体内膜上的脂质造成过氧化损伤等,导致其功能障碍,最终引起心肌能量代谢异常、心肌细胞损伤而产生心脏毒性[43-44]。与此相反,大黄能通过具有抗氧化能力的多种成分如酚酸类物质没食子酸、儿茶素等共同作用降低ROS含量,从而减轻ROS对线粒体及心肌细胞造成的氧化损伤[45-46]。因此附子配伍大黄后可增强机体清除ROS的能力,使心肌细胞抗氧化能力增强。研究发现附子配伍运用的强心机制主要为提高心肌细胞抗氧化损伤能力、调节细胞因子及神经内分泌因子、调节信号通路[47],故配伍大黄可利于附子强心作用的发挥,可用于治疗心血管疾病。
3.4 增强抗缺氧能力
附子配伍大黄后除可改善ROS对心肌细胞的氧化损伤外,也可因大黄能阻止丙二醛和一氧化氮等ROS的释放,提高SOD的活性,减轻ROS对脑组织、神经元以及血脑屏障的损伤,对急性缺氧动物模型有不同程度的拮抗作用[20,45]。对常压下出现脑缺血缺氧反应的小鼠ip大黄附子汤能有效提高其生存时间,大黄附子汤还可对抗因异丙肾上腺造成的小鼠缺氧和亚硝酸钠与氰化钾中毒造成的细胞缺氧[48]。故附子-大黄配伍后可增强抗缺氧能力,提高机体抗应激能力,可用于预防缺氧性心脑血管疾病。
4 附子-大黄药对配伍后治疗阳虚类疾病的应用
4.1 治疗阳虚型便秘
功能性便秘指排除肠管器质性病变、全身系统性疾病及药物等继发性因素所致的便秘[49]。脾肾阳虚型是功能性便秘的一种常见中医证型,除便意缺乏、便次减少、排便困难等主要表现外,还具备畏寒喜温、形寒肢冷、精神不振等特征[50],中医理论认为其病机在于阳虚失煦、阴寒内生、津液滞行致大肠传送失常,温阳通便为其治则[51]。大黄附子汤中附子温里散寒,大黄苦寒泻下,大黄得附子可制其苦寒之性、留其走泄之用,而附子得大黄可制其大毒之性、留其温阳之性,二药配伍共奏温阳通便之功效,可治疗阳虚型便秘[37]。王海等[52]通过分别对脾气虚弱型便秘患者进行大黄附子汤加减治疗和莫沙比利治疗,发现大黄附子汤加减治疗对阳虚便秘有更好疗效,且安全性高。霍黎生等[51]研究表明大黄附子汤对阳虚型便秘治疗作用确切,机制与其提高小肠推进率、增加结肠Cajal间质细胞(interstitial cells of Cajal,ICC)数量以改善结肠功能有关。附子、大黄单用均会对结肠ICC产生毒性[53],从而使ICC数量减少、结肠推动无力,但二药配伍可通过抑制附子毒性和大黄寒性来减轻对ICC的损伤。王岚等[41]通过测定给予阳虚便秘动物附子-大黄合煎液后的排便量、首粒排便时间、肠推进率,与阳性药物组(通便灵胶囊)比较发现二药配伍治疗阳虚便秘的疗效更显著,作用机制与其调节胃肠激素及肠神经递质的分泌有关。丘振文等[42]也研究证实附子-大黄配伍对阳虚便秘动物具有确切的治疗作用,机制与增强肠蠕动有关。大黄为泻下药的代表,可用于治疗一切阳邪积滞如肠道积滞、大便秘结等症[23]。而附子具有回阳救逆、补火助阳、逐风寒湿邪之功效,常用于治疗亡阳虚脱、肢冷脉微等病症,邵峰等[54]利用脾阳虚小鼠模型研究发现附子可使脾阳虚小鼠逐渐恢复正常。综上,附子-大黄配伍对阳虚型便秘有较好的治疗作用,二药各尽所能,附子主治阳虚,大黄主治便秘,共奏温阳通便之功效。
4.2 治疗慢性肾衰竭
慢性肾衰竭是在慢性肾脏疾病基础上出现肾功能减退直至衰竭的临床综合征[55]。肾纤维化特别是肾间质纤维化,几乎是所有慢性肾脏疾病的最终结局,因此阻止肾纤维化是治疗慢性肾衰竭的重点[56]。大量研究已证实大黄附子汤可缓解肾间质纤维化,改善和增强肾功能,且安全性高,可用于临床有效治疗慢性肾衰竭[57-59]。张琳琳等[57]发现大黄附子汤能有效降低慢性肾衰竭小鼠尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,Scr)的水平,改善肾功能;同时下调对肾纤维化起关键作用的转化生长因子-β1(transforming growth factor-β1,TGF-β1),上调骨形态发生蛋白-7(bone morphogenetic protein-7,BMP-7)和肾组织Smad6蛋白的表达,改善肾纤维化。涂玥[58]发现大黄附子汤可下调肾小管损伤模型鼠肾组织中TGF-β1和磷酸化c-Jun氨基末端激酶(phosphorylated c-Jun-terminal kinase,p-JNK)表达,干扰TGF-β1/JNK通路中相关信号转导,进而减轻肾小管上皮细胞凋亡,改善肾小管损伤和肾间质纤维化。附子与大黄作为大黄附子汤中的2味主药,配伍后浓煎灌肠可明显降低慢性肾衰竭患者BUN和Scr以治疗慢性肾衰竭[60]。从现代药理学分析,附子具有强心、抗炎、镇痛、免疫调节等药理作用,可防治慢性肾衰竭患者感染并发症和心血管事件的发生,也能改善血液循环,增加肾血流量,改善肾功能[38]。有研究通过代谢组学方法发现琥珀酸为大黄导致肾毒性的内源性标记物,并测定ig大黄附子汤4周后的大鼠尿液中琥珀酸含量发现其与空白组无显著性差异,且观察组织切片发现大鼠肾脏无显著性病变产生,说明附子-大黄配伍能减轻大黄对肾脏造成的损伤[61]。同时大黄中的大黄酸可通过抑制肾小球系膜细胞增殖进而抑制系膜基质的合成与沉积,改善肾小球病变及肾功能紊乱[62];其大黄素也可抑制TGF-β1以阻止肾间质纤维化,激活细胞自噬以改善肾小管上皮细胞损伤[63]。从中医方面分析,慢性肾衰竭主要病机为本虚标实,本虚在于久病多虚,累及脾肾,脾肾皆亏虚即阳虚;标实在久病入络,水湿、浊毒、湿热、瘀血内停[57]。附子-大黄配伍可以大黄通腑降浊、活血化瘀,以附子温通脾肾、扶正祛邪,二药合用既可温补脾肾之阳以培本,又可通泻浊毒以治标[64]。综上,作为大黄附子汤主要成分的附子-大黄配伍可通过抗纤维化、抗炎、改善血流、改善肾小管上皮细胞损伤等途径延缓慢性肾衰竭的进程。
4.3 治疗糖尿病肾病
糖尿病肾病是糖尿病的严重并发症,也是导致患者死亡的重要原因之一,临床特征为蛋白尿、高血压、肾功能损害等,近年来发病率逐年上升[65]。此病性质以脏腑阴阳气血虚为本虚,以痰湿、瘀血阻滞、郁结为标实,中晚期中医辨证主要以阴阳两虚、瘀阻肾络为主,其基本治疗原则为补虚祛邪[66-67]。而大黄附子汤中大黄峻下可通利水谷、推陈致新,附子、细辛温阳可扶正祛邪,3药寒热并用,寒则下其积滞,热则祛其寒实,标本兼治,可用于治疗糖尿病肾病[66-68]。马德睿等[66]通过与给予常规西医治疗的糖尿病肾病患者对比观察大黄附子汤加减灌肠治疗的疗效,发现治疗4周后灌肠治疗组有效率更高,说明大黄附子汤加减灌肠对糖尿病肾病患者疗效显著。现代研究证实附子多糖、大黄素、大黄酸等活性成分具有降糖、调脂等作用,能改善胰岛素抵抗,均对糖尿病肾病有一定的治疗作用。于乐等[69]通过建立脂肪细胞胰岛素抵抗模型研究发现附子多糖可促进其对葡萄糖的消耗和摄取,从而发挥降血糖作用。洪海棉等[70]研究发现大黄素也可提高脂肪细胞对胰岛素的敏感度,促进其摄取葡萄糖,进而可治疗2型糖尿病及糖尿病肾病,作用机制与激活腺苷酸激活蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)和过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor,PPARγ)信号通路有关。也有研究发现大黄素可通过抑制核因子-κB抑制蛋白激酶(inhibitor of NF-κB kinase,IKK)活性而阻断NF-κB信号通路,抑制诱导型一氧化氮合酶和一氧化氮的产生,保护胰岛β细胞免受损伤,进而延缓1型糖尿病及糖尿病肾病的发展[71]。Zheng等[72]研究发现大黄酸可通过抑制氨基己糖途径,抑制肾小球系膜细胞表型糖尿病葡萄糖运载体1(glucose transporter 1,GLUT1)的过度表达,下调TGF-β1和p21蛋白的表达,使细胞外基质合成减少,防止肾小球基底膜增厚,改善高血糖和肾小球的病变,延缓病情恶化。综上大黄-附子配伍可改善机体血糖和肾功能,可用于治疗糖尿病及糖尿病肾病。
4.4 治疗原发性肝癌
原发性肝癌是常见恶性肿瘤,起病隐匿,进展迅速,治疗困难,预后差,死亡率高[73]。中医药治疗肝癌的优势在于能有效稳定病情,改善临床症状,减轻化疗不良反应,提高患者生活质量,故其在肝癌治疗中发挥着重要作用[74]。中医认为肝癌的病机即正虚为本,气滞、血瘀、邪毒、痰凝为标,脏腑气血亏虚或脾虚失运均易引起肝癌,因此中医治疗肝癌应以扶正祛邪为总则,再治以清热解毒、行气活血、疏肝解郁、消积散结等[75]。而大黄附子汤中大黄虽是苦寒之品,但与附子、细辛配伍合用可温下寒结,使实邪从下而去,同时能温补脾阳,可用于治疗素体阳虚、寒邪内结的肝癌[75]。李自波等[76]通过建立原位移植肝癌小鼠模型评价新加大黄附子汤(大黄、附子、肉桂、吴茱萸)对肝癌的治疗作用,发现其可抑制肿瘤生长,减少肿瘤的浸润,从而延长荷瘤小鼠的存活时间。赵金龙等[77]运用系统药理学分析发现大黄附子汤中核心化合物山柰酚、β-谷甾醇、芦荟大黄素等可通过调节化学致癌、细胞色素P450及视黄醇代谢等相关信号通路从而多靶点发挥抗癌活性。现代研究表明大黄可抗肿瘤、抗炎、抑菌、抗氧化、增强免疫等,具有保肝利胆、清热解毒、逐瘀通经等传统功效[23],其中大黄素、大黄酸、大黄酚-8--β--吡喃葡萄糖苷、大黄酚-1--β--葡萄糖苷、丹叶大黄素等活性成分能够作用于14个靶蛋白,通过调节与细胞凋亡、转移、炎症、免疫相关的信号通路从而发挥抗肝癌作用[78]。尤其是大黄素,其可抑制肝癌细胞增殖、促进其凋亡、抑制其迁徙及侵袭等具有较强抗肝癌活性[79]。附子作为温阳药也常用于恶性肿瘤的治疗,有研究发现附子粗多糖和酸性多糖可增强荷瘤小鼠的细胞免疫功能,提高抑癌基因的表达和肿瘤细胞凋亡率,延长其存活时间[80]。故附子-大黄配伍后可相反相成,发挥温里散寒、泻下止痛的功效实现补虚扶正,进而更好地发挥二药治疗肝癌等恶性肿瘤的作用。
4.5 治疗重症脓毒症
脓毒症是感染诱发的全身炎症反应综合征,严重时可发展为多器官功能障碍综合征,且发病率一直呈上升趋势[81]。胃肠是脓毒症最易损害的器官,其黏膜损伤会导致肠道菌群侵袭入血而进一步加重全身炎症反应,诱发多器官功能障碍综合征[82]。因此,有效防治胃肠屏障功能损伤对提高脓毒症临床疗效和改善预后意义重大。大量现代临床研究证实大黄附子汤可通过抗菌消炎以增强消化道黏膜功能,加快胃肠蠕动以减少肠道细菌移位,治疗患者的胃肠黏膜损伤,改善胃肠功能障碍,进而治疗重症脓毒症且安全性高[83-86]。从现代药理学分析,附子中的生物碱具有抗炎、镇痛等药理作用,可治疗严重的炎性渗出,但其毒性较强、易造成毒副作用[10];大黄中的蒽醌衍生物不仅可促进肠道蠕动,还可抗炎、抗病原微生物、抗毒素等[28]。陈德昌等[87]发现大黄可明显降低胃肠功能障碍患者循坏血内肿瘤坏死因子-α和内毒素含量以抑制内源性感染,促进胃肠功能恢复以治疗脓毒症。从中医方面分析,《伤寒论》中六经传变认为脓毒症主要责于阴阳的虚实盛衰,故“扶阳气,存阴液”的治疗理论贯穿始终[88]。大黄附子汤配伍可以附子扶正祛邪,温运脾胃,变大黄的寒下为温下;也可以大黄佐制附子的毒性;同时辅以细辛辛散温通,助附子温里散寒而止痛,助大黄运化水谷,提振大肠传化糟粕之力[85-86]。综上,大黄附子汤中三药合用寒热并投、刚柔共济、通腹脏、调气血、去邪正安,可通过促进胃肠蠕动、加快内毒素的排出、抑制炎症反应使重症脓毒症患者的胃肠功能恢复进而治疗重症脓毒症。
附子-大黄药对配伍后治疗阳虚类疾病的应用及机制见表3。
表3 附子-大黄药对配伍后治疗阳虚类疾病的应用及机制
Table 3 Application and mechanism of Aconiti Lateralis Radix Preparata - Rhei Radix et Rhizoma in treatment of yang deficiency diseases after compatibility
临床应用治疗机制文献 治疗阳虚型便秘提高小肠推进率,增加ICC数量,改善结肠功能51 调节胃肠激素及肠神经递质的分泌41 增强肠蠕动42 治疗慢性肾衰竭降低BUN、Scr水平,改善肾功能57,60 下调TGF-β1,上调BMP-7、肾组织Smad6蛋白的表达,改善肾纤维化57 下调TGF-β1、p-JNK表达,减轻肾小管上皮细胞凋亡,改善肾纤维化58 大黄酸可抑制系膜基质的合成与沉积,改善肾小球病变及肾功能紊乱62 大黄素可激活细胞自噬,改善肾小管上皮细胞损伤64 治疗糖尿病肾病附子多糖可促进脂肪细胞对葡萄糖的消耗和摄取,降低血糖69 大黄素可激活AMPK和PPARγ信号通路,促进脂肪细胞摄取葡萄糖,降低血糖70 大黄素可阻断NF-κB信号通路,抑制诱导型一氧化氮合酶和一氧化氮的产生,保护胰岛β细胞免受损伤71 大黄酸可抑制氨基己糖途径,抑制GLUT1的过度表达,下调TGF-β1和p21蛋白的表达,防止肾小球基底膜增厚,改善高血糖和肾小球的病变72 治疗原发性肝癌调节化学致癌、细胞色素P450及视黄醇代谢等相关信号通路,发挥抗癌活性77 大黄多种活性成分均可调节与细胞凋亡、转移、炎症、免疫相关的信号通路,抑制肝癌78 大黄素可抑制肝癌细胞增殖、促进其凋亡、抑制其迁徙及侵袭等79 附子粗多糖和酸性多糖可增强细胞免疫功能,促进抑癌基因的表达和肿瘤细胞凋亡的凋亡80 治疗重症脓毒症抗菌抗炎,增强消化道黏膜功能,治疗胃肠黏膜损伤83-84 加快胃肠蠕动,减少肠道细菌移位,改善胃肠功能障碍83,85-86
5 结语与展望
经典药对是经医家长期临床实践发掘的简单配伍组合,其配伍可实现减毒增效[1]。源于大黄附子汤的附子-大黄药对便为寒热配伍的经典药对,其中大黄可通利水谷、荡涤积滞、通腹泻浊、推陈致新,附子可补火助阳、散寒止痛、温运脾胃、扶正祛邪,二药互制互补具有温散寒凝以开闭结、通下积滞以畅肠胃之效,可治疗脾肾阳虚证,以及寒凝淤滞所致的“阴结”杂症[22,68,89]。药对配伍后,由于中药成分复杂,其成分之间的相互作用会发生在体外溶出、体内代谢等各个环节,其相制减毒、协同增效的效果正是这些综合作用的体现[1]。整理近现代大黄附子汤或附子-大黄配伍后药效学和临床应用文献研究,发现配伍多用于治疗阳虚类疾病。配伍可增强肠蠕动和排便作用,可用于治疗阳虚便秘等消化系统疾病;促进肾功能及血糖的改善,可用于治疗慢性肾衰竭、糖尿病肾病等肾脏疾病;增强对肿瘤生长及浸润的抑制作用,可用于治疗肝癌等癌症;增强抗炎抗菌活性,可用于治疗重症脓毒症与全身炎症反应综合征相关疾病;除此之外,配伍可增强强心作用和抗缺氧能力以拮抗心率减慢和心肌缺血,临床也可用于预防和治疗缺血性心脏病和缓慢型心率失常的治疗[89];可增强镇痛作用,用于治疗寒实腹痛、急性胃痛等痛症[90]。中药的毒与效是客观存在的,尤其在疗效显著的大毒中药中,毒和效既是矛盾,又是统一的,甚至可实现毒与效的转化[11]。附子的双酯型生物碱在不同的病理状态下,既可作为有毒物质又可转化为有效物质,实现毒效转化,超过一定剂量或治疗疗程将产生心脏及神经毒性;而大黄的蒽醌及其衍生物剂量适宜时发挥药效,剂量过高则产生毒性;故临床使用该药对时应整合分析其“毒-效”关系,合理控制剂量,且遵循中医药“辨证论治”的诊治原则,根据患者疾病状况、机体状态进行个体化用药,实现减毒增效[91]。
随着科学技术的进步,现代研究手段的介入为附子-大黄药对配伍机制的研究提供了新思路及科学依据。在物质基础方面的研究(图1)除了测定其配伍前后毒性及有效成分体外含量变化,还引入了药动学等对其配伍后活性成分的体内代谢动态变化进行研究,可深入探讨配伍前后活性成分的变化规律,进而更全面地揭示附子-大黄药对配伍的减毒增效机制,并对阐明药对药效物质基础、药效产生时间规律及作用机制均具有重要意义[21]。但因中药配伍后化学成分复杂多变,只分析有效成分体外含量变化并不能代表配伍后的整体功能,也不能由几个有效成分的体内过程代表1味中药[2,92]。因此,可采用系统生物学的思路对药对配伍后所有发生变化的成分进行整体分析。系统生物学常采用基因组学、转录组学、蛋白组学、代谢组学和网络药理学等多组学技术对生物体的信息进行获取和分析,其研究特点十分符合中医药的“整体观”“辨证论治”,目前在中药研究方面已非常广泛,尤其适用于建立中药多组分、多靶点整体效应的药效评价系统[92]。之后可将多组学技术应用于附子-大黄药对配伍机制的研究,如通过代谢组学[93]找出药对配伍后在体内发挥药效的内源性差异代谢物,并与配伍后体外发生含量变化的化学成分整合分析,进一步挖掘该药对配伍的内在药效物质基础及治疗阳虚类等不同疾病时的作用机制,以期为临床的合理用药提供参考,为研究复方配伍规律及中药新药开发提供思路与方法。
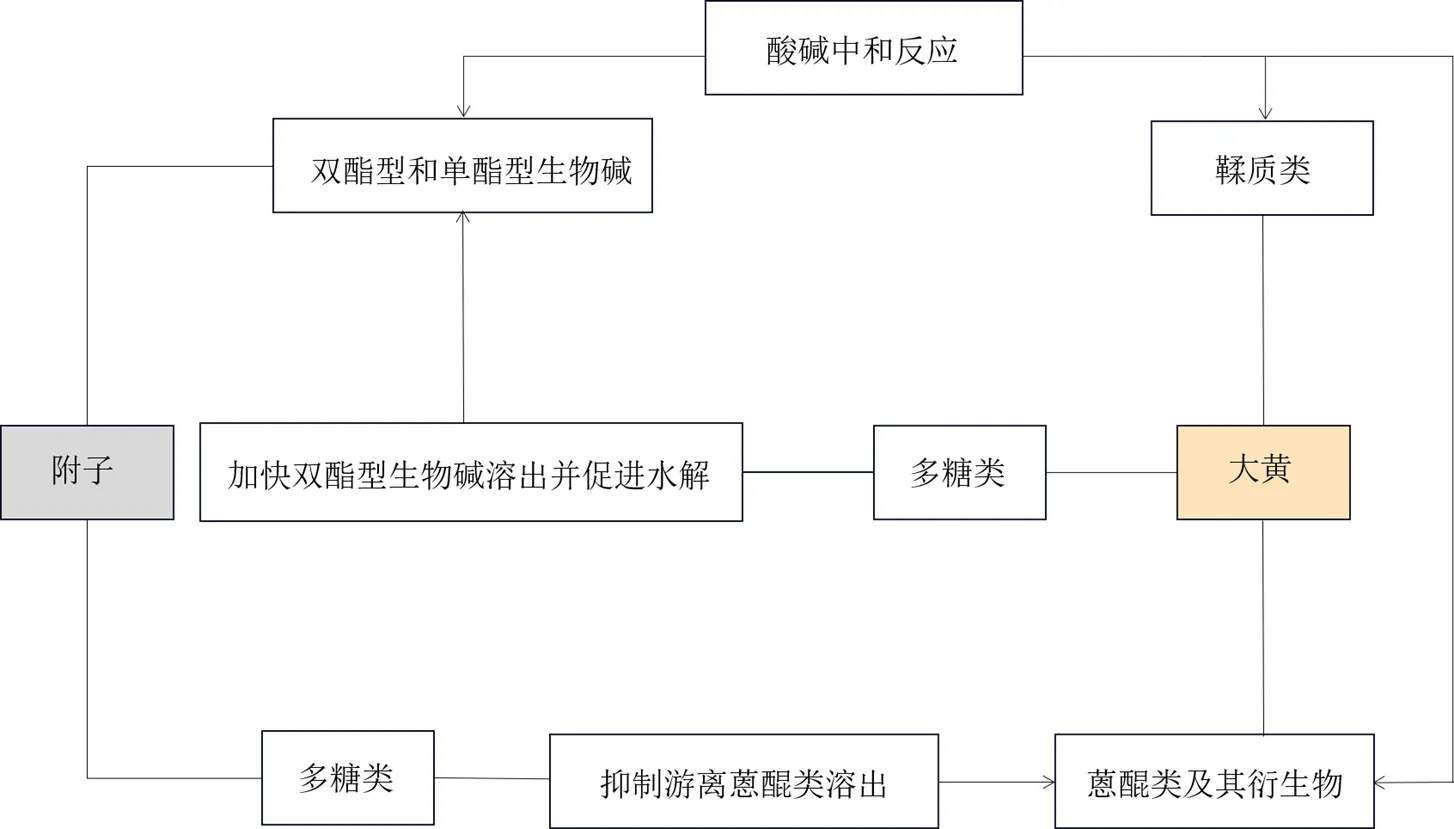
图1 附子-大黄药对配伍减毒增效的物质基础
利益冲突 所有作者均声明不存在利益冲突
[1] 宋佳, 高晓霞, 田俊生, 等. 中药药对配伍机制的现代研究[J]. 中草药, 2017, 48(21): 4367-4374.
[2] 李芸霞, 彭成. 基于毒效整合分析的附子药动学、药效学研究 [J]. 世界中医药, 2017, 12(11): 2579-2584.
[3] 赵琦, 陈艳琰, 徐顶巧, 等. 甘草缓大黄峻烈之性的研究进展 [J]. 中草药, 2021, 52(7): 2134-2143.
[4] 叶强, 刘刚彦, 郭力, 等. 大黄附子配伍对蒽醌类成分影响的研究 [J]. 现代中医药, 2011, 31(4): 72-74.
[5] 胡海燕. 附子大黄成分配伍对结肠ICC的作用机制研究 [D]. 成都: 成都中医药大学, 2013.
[6] 张广平, 朱晓光, 杨海润, 等. 药性理论指导的附子配伍减毒试验研究 [J]. 世界中医药, 2014, 9(2): 129-131.
[7] 李梦缘, 刘汶. 从《金匮要略》下利方特点探析四气五味组方思路 [J]. 环球中医药, 2021, 14(6): 1081-1082.
[8] 冯哲, 周学平. 中药性味相制配伍减毒的方法探要 [J]. 中华中医药杂志, 2013, 28(3): 595-598.
[9] 张莉, 秦鸣放. 浅谈《金匮要略》大黄附子汤治疗急腹症体会 [J]. 江西中医药, 2007, 38(5): 50-51.
[10] 顾俊菲, 刘培, 陶伟伟, 等. 药对配伍策略及其内在机制研究述评 [J]. 中华中医药杂志, 2021, 36(1): 45-49.
[11] 熊亮, 彭成, 缪璐琳, 等. 基于“毒-效整合分析思路”探讨有毒中药附子的物质基础 [J]. 世界中医药, 2017, 12(11): 2568-2578.
[12] 姜波, 常晶晶, 张春蕾, 等. 附子心脏毒性及配伍减毒增效机制研究进展 [J]. 药物评价研究, 2021, 44(6): 1346-1353.
[13] 张晓晨, 郑清阁, 杨菁华, 等. 附子C19二萜生物碱结构及活性研究进展 [J]. 中草药, 2020, 51(2): 531-541.
[14] 谭婉莹, 夏勇, 李艳苹, 等. 附子心脏毒-效物质基础及相关作用机理研究 [J]. 中药药理与临床, 2019, 35(3): 95-101.
[15] 梁佳佳, 杨丽娜, 郑卫华, 等. 附子炮制及与大黄配伍后酯型生物碱的含量变化研究 [J]. 世界科学技术—中医药现代化, 2014, 16(1): 38-44.
[16] 任常谕. 附子配伍大黄主要成分的药代动力学研究 [D]. 成都: 西南交通大学, 2015.
[17] 叶强. 附子配伍大黄调控药性物质基础研究 [D]. 成都: 成都中医药大学, 2008.
[18] 周静波. 附子配伍甘草、大黄、干姜调控药性物质基础研究 [D]. 成都: 成都中医药大学, 2009.
[19] Zhang H, Sun S, Zhang W,. Biological activities and pharmacokinetics of aconitine, benzoylaconine, and aconine after oral administration in rats [J]., 2016, 8(8): 839-846.
[20] Liu X, Li H, Song X Q,. Comparative pharmacokinetics studies of benzoylhypaconine, benzoylmesaconine, benzoylaconine and hypaconitine in rats by LC-MS method after administration ofextract and Dahuang Fuzi Decoction [J]., 2014, 28(7): 966-973.
[21] 毛营营, 栗焕焕, 任晓亮. 附子-甘草药对配伍研究进展 [J]. 天津中医药大学学报, 2021, 40(1): 119-127.
[22] 张艳, 王平, 孟宪丽. 大黄药动学研究进展与展望 [J]. 中药与临床, 2016, 7(2): 90-94.
[23] 王玉, 杨雪, 夏鹏飞, 等. 大黄化学成分、药理作用研究进展及质量标志物的预测分析 [J]. 中草药, 2019, 50(19): 4821-4837.
[24] 陈艳琰, 唐于平, 陈嘉倩, 等. 大黄资源化学研究进展与利用策略 [J]. 中草药, 2018, 49(21): 5170-5178.
[25] 傅兴圣, 陈菲, 刘训红, 等. 大黄化学成分与药理作用研究新进展 [J]. 中国新药杂志, 2011, 20(16): 1534-1538.
[26] Cao Y J, Pu Z J, Tang Y P,. Advances in bio-active constituents, pharmacology and clinical applications of rhubarb [J]., 2017, 12: 36.
[27] Kon R, Ikarashi N, Nagoya C,. Rheinanthrone, a metabolite of sennoside A, triggers macrophage activation to decrease aquaporin-3 expression in the colon, causing the laxative effect of rhubarb extract [J]., 2014, 152(1): 190-200.
[28] Duval J, Pecher V, Poujol M,. Research advances for the extraction, analysis and uses of anthraquinones: A review [J]., 2016, 94: 812-833.
[29] 金丽霞, 金丽军, 栾仲秋, 等. 大黄的化学成分和药理研究进展 [J]. 中医药信息, 2020, 37(1): 121-126.
[30] Qin Y, Wang J B, Kong W J,. The diarrhoeogenic and antidiarrhoeal bidirectional effects of rhubarb and its potential mechanism [J]., 2011, 133(3): 1096-1102.
[31] 郭鹏, 张铁军, 朱雪瑜, 等. 大黄毒性的现代研究与减毒对策 [J]. 中草药, 2009, 40(10): 1671-1674.
[32] 笪红远, 江振洲, 王翠芬, 等. 大黄酸和大黄素在体外对人肾小管上皮细胞的毒性作用研究 [J]. 中草药, 2009, 40(1): 102-105.
[33] 祝婷婷, 刘晓, 汪小莉, 等. 大黄不同方法炮制后药理作用及化学成分变化研究进展 [J]. 中国新药杂志, 2016, 25(8): 883-887.
[34] 胥鹏鹏, 段秀俊, 王嘉琛, 等. 热性药附子、肉桂、桂枝与干姜对寒性药大黄致泻作用的影响 [J]. 山西中医学院学报, 2017, 18(1): 10-12.
[35] 曾灵娜, 王伽伯, 张萍, 等. 中药调剂规范化研究(Ⅲ): 含不同类型成分的中药对大黄蒽醌煎出量的影响 [J]. 中国中药杂志, 2012, 37(2): 202-206.
[36] Liu X, Li H, Wu L,. Simultaneous quantification of chrysophanol and physcion in rat plasma by ultra fast liquid chromatography-tandem mass spectrometry and application of the technique to comparative pharmacokinetic studies ofetextract alone and Dahuang Fuzi Decoction [J]., 2015, 980: 88-93.
[37] 龚小红. 基于整合药动学/药效学方法研究大黄附子配伍治疗阳虚便秘的增效减毒作用 [D]. 成都: 成都中医药大学, 2017.
[38] 陈荣昌, 孙桂波, 张强, 等. 附子及其复方中药的药理作用研究进展 [J]. 中草药, 2014, 45(6): 883-888.
[39] 高鹏, 叶祖光. 附子大黄配伍减毒存效实验研究 [J]. 中药新药与临床药理, 2014, 25(5): 542-546.
[40] 陈一村, 秦永洁, 蔡聪艺, 等. 大黄总蒽醌对小鼠扭体模型的镇痛作用 [J]. 现代生物医学进展, 2010, 10(3): 558-559.
[41] 王岚, 彭成, 郭力. 附子大黄配伍对阳虚便秘动物的治疗作用及其机制研究 [J]. 中国中西医结合消化杂志, 2006, 14(2): 82-85.
[42] 丘振文, 唐洪梅, 罗丹冬, 等. 大黄附子不同配伍对阳虚便秘动物肠运动的影响 [J]. 药品评价, 2009, 6(2): 57-59.
[43] 赵佳伟, 何家乐, 马增春, 等. 附子对H9c2心肌细胞系线粒体的毒性作用机制 [J]. 中国药理学与毒理学杂志, 2015, 29(5): 816-824.
[44] Ma L Q, Yu Y, Chen H,. Sweroside alleviated aconitine-induced cardiac toxicity in H9c2 cardiomyoblast cell line [J]., 2018, 9: 1138.
[45] 杜兆远, 刘永武, 张娜, 等. 大黄的作用机制及临床的研究现状 [J]. 黑龙江医学, 2021, 45(9): 1001-1004.
[46] 王宇卿, 李淑娇, 姜旭. HPLC-ABTS-DAD-Q-TOF/MS在线检测大黄抗氧化活性成分 [J]. 中国医院药学杂志, 2019, 39(11): 1149-1152.
[47] 于武华, 钟凌云. 附子的强心作用及其机理研究进展 [J]. 江西中医药, 2021, 52(3): 77-80.
[48] 邵玉刚. 探讨大黄附子汤的基本药理与临床用药措施 [J]. 临床医药文献电子杂志, 2015, 2(2): 230.
[49] 王冬冬, 吴相柏. 功能性便秘的诊治进展 [J]. 中国全科医学, 2019, 22(24): 3016-3022.
[50] 霍黎生, 孙龙, 陈强, 等. 大黄附子汤对阳虚型慢传输便秘排便功能的影响 [J]. 陕西中医, 2016, 37(12): 1686-1687.
[51] 霍黎生, 臧亮, 孙龙, 等. 大黄附子汤对脾肾阳虚型慢传输型便秘大鼠排便功能的影响研究 [J]. 现代中西医结合杂志, 2017, 26(2): 128-130.
[52] 王海, 刘月姮, 杨立平, 等. 大黄附子汤加减治疗老年脾气虚弱型便秘的临床研究 [J]. 辽宁中医杂志, 2020, 47(2): 124-126.
[53] 吴至久, 王飞. 益气养血温阳方对泻药性便秘大鼠结肠Cajal间质细胞表达影响 [J]. 中国实验方剂学杂志, 2013, 19(2): 219-222.
[54] 邵峰, 李赛雷, 刘荣华, 等. 附子对脾阳虚小鼠的抗寒泻作用 [J]. 中国实验方剂学杂志, 2011, 17(14): 176-178.
[55] 陈香美, 倪兆慧, 刘玉宁, 等. 慢性肾衰竭中西医结合诊疗指南 [J]. 中国中西医结合杂志, 2015, 35(9): 1029-1033.
[56] Liu Y. Cellular and molecular mechanisms of renal fibrosis [J]., 2011, 7(12): 684-696.
[57] 张琳琳, 张海晨, 宋云霄, 等. 大黄附子汤对腺嘌呤致慢性肾衰竭小鼠外周血TGF-β1、BMP-7水平及肾组织Smad 6、P38蛋白表达的影响 [J]. 中医杂志, 2019, 60(24): 2138-2142.
[58] 涂玥. 经方“大黄附子汤”及其有效成分减轻肾小管损伤分子机制的研究 [D]. 南京: 南京中医药大学, 2015.
[59] 李怡静. 大黄附子汤加减方治疗脾肾阳虚型慢性肾衰的临床观察 [D]. 福州: 福建中医药大学, 2019.
[60] 赵平. 大黄附子不同配伍比例灌肠治疗慢性肾衰竭 [J]. 中国实验方剂学杂志, 2012, 18(15): 302-304.
[61] 李嬛. 大黄附子汤配伍机制初探及治疗急性胰腺炎的物质基础研究 [D]. 南京: 南京中医药大学, 2014.
[62] 刘倩, 郭更新, 刘爱翔, 等. 大黄酸对肾病综合征大鼠系膜细胞增生的影响及其机制 [J]. 细胞与分子免疫学杂志, 2017, 33(11): 1544-1549.
[63] Ma L B, Li H, Zhang S C,. Emodin ameliorates renal fibrosis in rats via TGF-β1/Smad signaling pathway and function study of Smurf 2 [J]., 2018, 50(2): 373-382.
[64] 窦芳, 丁一, 姚敏娜, 等. 大黄素通过激活自噬对TGF-β1诱导的HK-2细胞纤维化因子的影响 [J]. 中国药理学通报, 2018, 34(11): 1555-1559.
[65] 孙林, 赵浩. 糖尿病肾病现状与挑战 [J]. 中华肾病研究电子杂志, 2019, 8(2): 49-54.
[66] 马德睿, 张莹, 黄琛, 等. 大黄附子汤灌肠治疗糖尿病肾病临床观察 [J]. 亚太传统医药, 2021, 17(6): 69-72.
[67] 张景祖, 翟继功, 单培鑫, 等. 金匮肾气丸加减佐治阴阳两虚型糖尿病肾病的临床观察 [J]. 中国民间疗法, 2019, 27(20): 56-59.
[68] 熊壮, 刘扬扬, 麻译丹, 等. 刘铁军教授对大黄“荡涤胃肠, 推陈致新, 通利水谷”与“安和五脏”内涵新解 [J]. 时珍国医国药, 2018, 29(7): 1743-1744.
[69] 于乐, 吴伟康. 附子多糖对胰岛素抵抗脂肪细胞模型葡萄糖摄取的影响 [J]. 亚太传统医药, 2009, 5(7): 11-13.
[70] 洪海棉, 谢秀利, 洪桂祝, 等. 大黄素激活AMPK、PPARγ对3T3-L1脂肪细胞葡萄糖摄取的影响 [J]. 中国药理学通报, 2015, 31(11): 1569-1575.
[71] Bae U J, Song M Y, Jang H Y,. Emodin isolated fromprevents cytokine-induced β-cell damage and the development of type 1 diabetes [J]., 2015, 16: 9-19.
[72] Zheng J M, Zhu J M, Li L S,. Rhein reverses the diabetic phenotype of mesangial cells over-expressing the glucose transporter (GLUT1) by inhibiting the hexosamine pathway [J]., 2008, 153(7): 1456-1464.
[73] 中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版) [J]. 临床肿瘤学杂志, 2011, 16(10): 929-946.
[74] 王睿林, 王立福, 王仲霞, 等. 中药治疗肝癌研究现状 [J]. 传染病信息, 2012, 25(3): 189-192.
[75] 邹建华, 肖战说, 李刘生, 等. 《金匮要略》类方在肝癌治疗中的应用 [J]. 山东中医杂志, 2021, 40(12): 1297-1301.
[76] 李自波, 姚静静, 杜振华, 等. 新加大黄附子汤对小鼠原位移植肝癌的治疗作用 [J]. 河南大学学报: 医学版, 2017, 36(3): 156-159.
[77] 赵金龙, 陈国铭, 邝梓君, 等. 大黄附子汤作用机制的靶标与通路探讨 [J]. 中国中医基础医学杂志, 2019, 25(4): 550-555.
[78] 王玉, 杨雪, 靳晓杰, 等. 基于中医药整合药理学平台、GEO数据库芯片及分子对接探讨大黄抗肝癌的作用机制 [J]. 中草药, 2020, 51(20): 5207-5219.
[79] 舒遵华, 王慧林, 刘扬扬, 等. 大黄素抗肝癌作用机制的研究进展 [J]. 吉林中医药, 2020, 40(2): 278-280.
[80] 董兰凤, 刘京生, 苗智慧, 等. 附子多糖对H22和S180荷瘤小鼠的抗肿瘤作用研究 [J]. 中国中医基础医学杂志, 2003, 9(9): 14-17.
[81] Dellinger R P, Levy M M, Rhodes A,. Surviving sepsis campaign: International guidelines for management of severe sepsis and septic shock: 2012 [J]., 2013, 41(2): 580-637.
[82] 陈分乔, 许文忠, 高海运, 等. 中药肠胃舒对脓毒症胃肠功能障碍患者的抗炎效果及肠道机械屏障保护作用 [J]. 中国中西医结合急救杂志, 2016, 23(5): 458-460.
[83] 李军. 大黄附子汤治疗危重脓毒症疗效及对患者胃肠功能改善研究 [J]. 陕西中医, 2019, 40(6): 718-721.
[84] 胡雄, 孙晓铭. 依替米星注射液合用大黄附子汤对急诊重症脓毒症患者胃肠功能障碍的影响 [J]. 现代中西医结合杂志, 2019, 28(22): 2453-2456.
[85] 黄丹, 张晓震, 俞辰斌, 等. 早期应用大黄附子汤改善脓毒症患者胃肠功能障碍的临床研究 [J]. 中国中西医结合急救杂志, 2016, 23(4): 393-398.
[86] 王宏, 吴锡平. 大黄附子汤治疗危重症并发胃肠功能障碍验案1则 [J]. 江苏中医药, 2015, 47(9): 55-56.
[87] 陈德昌, 景炳文, 杨兴易, 等. 大黄对创伤后危重病脓毒症患者的治疗作用 [J]. 中华创伤杂志, 2003, 19(1): 17-19.
[88] 张元. 从六经辨证的角度看脓毒症的发生发展及其治疗 [J]. 环球中医药, 2018, 11(3): 408-410.
[89] 梁晓夏, 张保国, 刘庆芳. 大黄附子汤现代药效学研究与临床运用 [J]. 中成药, 2008, 30(11): 1670-1673.
[90] 刘桂芳, 周强, 仝小林. 大黄附子汤的临床应用和药理研究进展 [J]. 中华中医药学刊, 2010, 28(9): 1848-1851.
[91] 彭成, 肖小河, 李梢, 等. 中药“毒与效”整合分析的研究进展和前沿分析 [J]. 中国科学基金, 2017, 31(2): 176-183.
[92] 王胜鹏, 陈美婉, 王一涛. 中药药对的系统研究(I): 理论与物质基础研究 [J]. 世界科学技术—中医药现代化, 2012, 14(2): 1317-1321.
[93] 马骏, 曼琼, 邓毅, 等. 代谢组学在中药七情配伍中的应用研究进展[J]. 中草药, 2020, 51(1): 276-280.
Research progress on compatibility mechanism of drug pair ofandetin treatment ofdeficiency diseases
CHEN Jia-qi1, BAO Dan-dan2, ZHANG Yue1, YUE Tian-xiang1, ZHANG Ke1, LI Fan-zhu1, PIAO Ji-gang1
1. School of Pharmacy, Zhejiang Chinese Medical University, Hangzhou 311403, China 2. The First Affiliated Hospital of Zhejiang Chinese Medical University (Zhejiang Provincial Hospital of Traditional Chinese Medicine), Hangzhou 310053, China
Fuzhi () and Dahuang (et) (RALP-RRR) is a typical cold-heat drug pair, which was first found in Dahuang Fuzi Decoction of “”. The compatibility of two drugs can play the roles of toxicity-reducing and efficacy-enhancing, so they had been widely used in clinical practice. Based on the theory of compatibility of traditional Chinese medicine, the compatibility relationship of RALP-RRR in recent years was reviewed in this paper. The internal compatibility mechanism of RALP-RRR for reducing toxicity and enhancing efficacy was interpreted specifically from the following three aspects: changes of toxic or active ingredients contentand metabolismafter compatibility, pharmacodynamic changes and application in treatment of yang deficiency diseases, in order to provide scientific basis and reference for summarizing the compatibility rules of traditional Chinese medicine compound and provide theoretical basis for safer and more effective clinical application of RALP-RRR.
;et;drug pair;deficiency;compatibility mechanism; toxicity reducing and efficacy enhancing
R283.21
A
0253 - 2670(2022)11 - 3518 - 13
10.7501/j.issn.0253-2670.2022.11.030
2022-02-05
国家自然科学基金资助项目(81873014);国家自然科学基金资助项目(82074027);浙江省中医药优秀青年人才基金项目(2021ZQ036);浙江省自然科学基金资助项目(LZ21H280001)
陈家琪(2001—),女,在读本科。E-mail: jiaqi202122@163.com
李范珠,男,教授,国务院特殊津贴专家,主要从事新型给药系统及靶向制剂的研究。E-mail: lifanzhu@zcmu.edu.cn
朴寄纲,男,博士,讲师,主要从事新型给药系统及靶向制剂的研究。E-mail: jgpiao@zcmu.edu.cn
#共同第一作者:包丹丹,女,硕士,主治医师,主要从事新型给药系统及靶向制剂的研究。E-mail:baodandan1990@163.com
[责任编辑 崔艳丽]
