暴马桑黄细胞色素P450家族CYP5150AW6基因克隆及表达分析
2022-05-31李亚伟刘增才孙婷婷乌木提巴合提别克
李亚伟,刘增才,孙婷婷,乌木提·巴合提别克,邹 莉*
暴马桑黄细胞色素P450家族基因克隆及表达分析
李亚伟1,刘增才1,孙婷婷2,乌木提·巴合提别克1,邹 莉1*
1. 东北林业大学林学院,黑龙江 哈尔滨 150040 2. 哈尔滨学院食品工程学院,黑龙江 哈尔滨 150086
为深入了解细胞色素P450家族基因在暴马桑黄生长发育调控中的功能。采用PCR技术获得目的基因的cDNA序列全长,通过生物信息学在线软件分析其编码的氨基酸序列;采用同源重组的方法构建原核表达载体;采用荧光定量PCR技术分析其不同发育阶段的表达特性。暴马桑黄中克隆得到的基因开放阅读框(open reading frame,ORF)序列全长1758 bp,编码585个氨基酸,相对分子质量为66 080,经国际P450命名委员会命名为;跨膜区预测表明CYP5150AW6蛋白不具有跨膜结构;亚细胞定位显示CYP5150AW6蛋白在细胞质和线粒体中修饰合成;系统进化分析结果表明,暴马桑黄CYP5150AW6蛋白与灵芝CYP5150L8蛋白亲缘关系最近,符合物种分类原则;SDS-PAGE结果证实在75 000~100 000出现目的蛋白条带(包含20 000的标签蛋白),说明所获得的基因能够成功表达出蛋白;从荧光定量分析结果中可以看出基因转录水平从菌丝体阶段到子实体阶段生长逐渐升高,并且在子实体阶段达到最高,说明该基因可能与暴马桑黄的生长发育相关。通过对基因的鉴定与分析,为进一步研究该基因在暴马桑黄生长发育调控过程的功能提供了理论依据。
暴马桑黄;细胞色素P450基因;生长发育;表达分析;荧光定量PCR
桑黄是一种非常珍贵且具有广阔研究与开发价值的药用真菌,因被发现多寄生在桑树的枝干上,子实体颜色为黄褐色,故而得名,民间也称桑臣、桑耳等[1]。桑黄是一类传统的药用真菌,东汉时期《神农本草经》中记载:“桑耳,黑者,主女子漏下赤白汁,血病癥瘕积聚,阴痛,阴阳寒热无子。”桑耳即为桑黄。“桑黄”一词最初出现在隋唐时期甄权编著的《药性论》中,把桑耳与“桑黄”合二为一,并首次记载桑黄药性平,无毒[2]。桑黄有“森林软黄金”的美称,近年来由于诸多文献报道,桑黄在抗肿瘤、降血糖、抗氧化、增强免疫力等方面具有良好的效果,且不会出现不良反应,因此受到广大消费者的喜爱和追捧[3]。桑黄中的三萜、黄酮、多糖、酚类等化合物是其发挥药用效果的主要活性成分[4]。药用真菌中活性成分的含量和生物合成途径中相关基因的表达量有着密切的联系,随着分子生物学技术的不断进步与发展,使用现代生物技术对药用真菌的功能基因进行鉴定已成为目前研究的热点。
细胞色素P450(CYP450)是广泛存在于动物、植物、真菌及细菌中的含有血红素和硫羟基的多功能蛋白[5]。其功能大致可分为2类:一是参与催化激素、脂肪酸、甾醇类及萜类化合物等一些具有重要功能的内源物质的生物合成代谢过程[6];如研究证明桑黄[4, 7-8]、灵芝[9-12]、茯苓[13]、猪苓[14]等药用真菌中部分细胞色素P450基因能参与萜类及甾醇类化合物的合成。二是参与多种外源物质的生物氧化过程,如除草剂、杀虫剂、药物及有毒物质等,如青霉菌[15]解磷能力及白腐真菌[16-17]对有机污染物和农业废弃物的降解作用。目前,对真菌基因功能的研究多集中于萜类及甾醇类化合物的生物合成代谢过程,而对于激素的合成代谢以及生长调控相关基因的研究相对较少,但在植物中有研究证明CYP450能参与生物体的生长调控,杨杰等[18]发现白桦、及3个基因具有组织特异性和激素诱导表达特异性,在白桦的生长发育和抵御胁迫中起着重要作用。
目前,对于暴马桑黄中基因的研究报道相对较少。本实验以一种生长于暴马丁香树上的桑黄—暴马桑黄(Pilát) L. W. Zhou & Y. C. Dai为研究对象。通过克隆暴马桑黄CYP450家族的基因,并对其进行生物信息学分析以及不同发育阶段的基因表达水平分析,丰富对暴马桑黄CYP450基因功能的研究,同时为进一步研究该基因在暴马桑黄生长调控中的作用奠定基础。
1 材料与试剂
1.1 材料
试验所用的菌株为暴马桑黄菌种DL101(登录号为KP974834)、大肠杆菌克隆菌株DH5α、表达菌株BL21(DE3)和原核表达载体pET-32a(+)均保藏于东北林业大学森林保护学科实验室。
1.2 试剂
QuickCutR I、QuickCutd III、PremixTaq 酶、TB Green™ Premix Ex Taq™ II(Tli RNaseHPlus)、5×In-Fusion HD 试剂盒、PrimeScript II 1stStrand cDNA Synthesis Kit 和PrimeScript ™ RT reagent Kit with gDNA Eraser(Perfect Real Time)均从大连Takara公司购买得到。植物总RNA提取试剂盒和琼脂糖凝胶DNA回收试剂盒均购于北京天根生化公司。质粒提取试剂盒购于上海Omega公司。SDS-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS- PAGE)试剂盒购买于北京索莱宝公司。
2 方法
2.1 试验引物
本实验中所用到的引物序列如表1所示。
2.2 CYP5150AW6基因克隆
暴马桑黄菌丝体总RNA使用植物总RNA提取试剂盒进行提取,采用1%琼脂糖凝胶电泳检测,并用分光光度计检测其浓度和质量,然后快速反转录为cDNA。之后用cDNA作为模板,以-F1、-R1(表1)作为引物进行PCR扩增。PCR扩增的产物经凝胶电泳检测后,用琼脂糖凝胶DNA回收试剂盒进行纯化回收,再用琼脂糖凝胶电泳检测回收产物的浓度,并送哈尔滨擎科生物有限公司进行测序。
2.3 CYP5150AW6基因序列分析
测序结果提交到NCBI,并对目的基因序列进行开放阅读框(open reading frame,ORF)和保守结构域预测;利用生物信息学软件预测和分析基因编码的氨基酸序列:用ProtParam软件预测目的蛋白的理化性质;用纽普生物在线工具预测目的蛋白的跨膜区;用SignalP 5.0 sever预测目的蛋白的信号肽;用PSORT II预测目的蛋白的亚细胞定位;用SOPMA和SWISS-MODEL分别预测目的蛋白的二级结构和三级结构;用MEGA 5.2.2预测目的蛋白系统进化关系[7, 19-21]。
表1 引物序列与预测片段大小
Table 1 Primer sequences and predicted fragment size
引物名称引物序列(5’-3’)预测片段大小/bp CYP5150AW6-F1(PCR)AAACGGCCAATGGAATTGTCTA1800 CYP5150AW6-R1TGTGTCACAACTTCTCCTCGAGTG CYP5150AW6-F2(PCR)TATCGGATCCGAATTCATGGAATTGTCTACCGCCGGG1790 CYP5150AW6-R2GTGCGGCCGCAAGCTTTCACAACTTCTCCTCGAGTGC pET-32a-F (RT-PCR)TAATACGACTCACTATAGGG 712 pET-32a-RGCTAGTTATTGCTCAGCGG CYP5150AW6-F3(qRT-PCR)CACTCGGGGACCATCACCGCAAACA 155 CYP5150AW6-R3GTCAAACTCCTTCGTCCCACCTCGC a-tubulin-F (qRT-PCR)CCAGCAAGCGTTACCGATT 129 α-tubulin-RTCCACGACGTCCATCGTTC
下划线部分表示同源臂
The underlined part represents the homologous arm
2.4 CYP5150AW6基因原核表达载体构建
以-F1、-R1为引物扩增产物,纯化回收得到DNA,以DNA模板,以F2R2为引物,通过PCR得到基因开放阅读框。用限制性内切酶R I和d III对pET-32a质粒进行双酶切,酶切产物纯化回收后,用In-Fusion HD试剂盒将其与基因ORF进行同源重组,得到pET-32a-重组质粒,随后转入大肠杆菌DH5α感受态细胞中。从转化后的大肠杆菌中提取质粒,用引物pET-32a-F、pET-32a-R(表1)进行PCR检测。之后,将PCR检测结果中显示阳性的质粒送哈尔滨擎科生物公司测序。
2.5 CYP5150AW6基因诱导表达及检测
将检测结果中正确的pET-32a-质粒转入大肠杆菌BL21(DE3)感受态细胞后进行菌落PCR检测,将阳性菌落接种到LB液体培养基(含Amp质量浓度为100 μg/mL)中37 ℃过夜振荡培养,取50 μL菌液加入新鲜LB液体培养基(含Amp质量浓度为100 μg/mL)中振荡培养,当600达到0.6~0.8时收集阴性对照菌液,在剩余的菌液中加入 IPTG(终浓度为1 mmol/L)诱导表达,收集不同诱导时间段的菌液进行SDS-PAGE检测。
2.6 荧光定量检测
将长满培养皿的暴马桑黄菌株接种至PD液体培养基中振荡培养,分别收集6、8、10、12和14 d的菌丝。同时将暴马桑黄菌株接种到栽培袋中,收集原基和子实体[8]。将收集得到的暴马桑黄材料利用植物总RNA提取试剂盒,分别提取总RNA,之后,利用反转录试剂盒将总RNA反转录为cDNA,以基因作为内参,每组设置3个重复。在核酸扩增荧光检测仪上进行qRT-PCR反应,反应程序:95 ℃、3 min;95 ℃、30 s,56 ℃、30 s,72 ℃、1 min,40个循环;95 ℃、10 s,55 ℃、30 s,95 ℃、30 s。根据得到的不同t值,按照公式2−ΔΔCt对暴马桑黄不同发育阶段基因相对转录水平进行计算[22]。
经过单因素分析结果表明,激励信号的幅值越大,检测效果越好;不同的激励信号频率对柴油凝点的检测区别不大,但考虑到频率是影响阻抗的重要因素之一,因此,对其进行下一步的正交试验考察。
3 结果与分析
3.1 CYP5150AW6基因全长获得
以暴马桑黄菌丝总RNA反转录得到的cDNA作为模板,使用所设计的引物在1000~2000 bp扩增出单一的1条基因条带,与预测目的基因大小(1800 bp)基本一致(图1)。纯化回收的产物送哈尔滨擎科生物公司测序。
3.2 生物信息学分析
3.2.1 理化性质预测 利用NCBI网站上的ORF Finder进行ORF查找,结果显示基因序列中含有1个1758 bp的ORF,编码585个氨基酸(图2),具有P450超家族的PLN03195保守结构域(图3)。ProtParam软件分析结果表明,CYP5150AW6蛋白中亮氨酸的含量最高是11.3%,半胱氨酸的含量最低是0.5%,蛋白相对分子质量是66 080,分子式为C2994H4710N800O841S22,原子总数为9367,理论等电点为9.02,亲水性的总平均值是−0.136,不稳定系数为是38.52,说明CYP5150AW6蛋白是亲水性的稳定蛋白。

M-Marker 1-目的条带
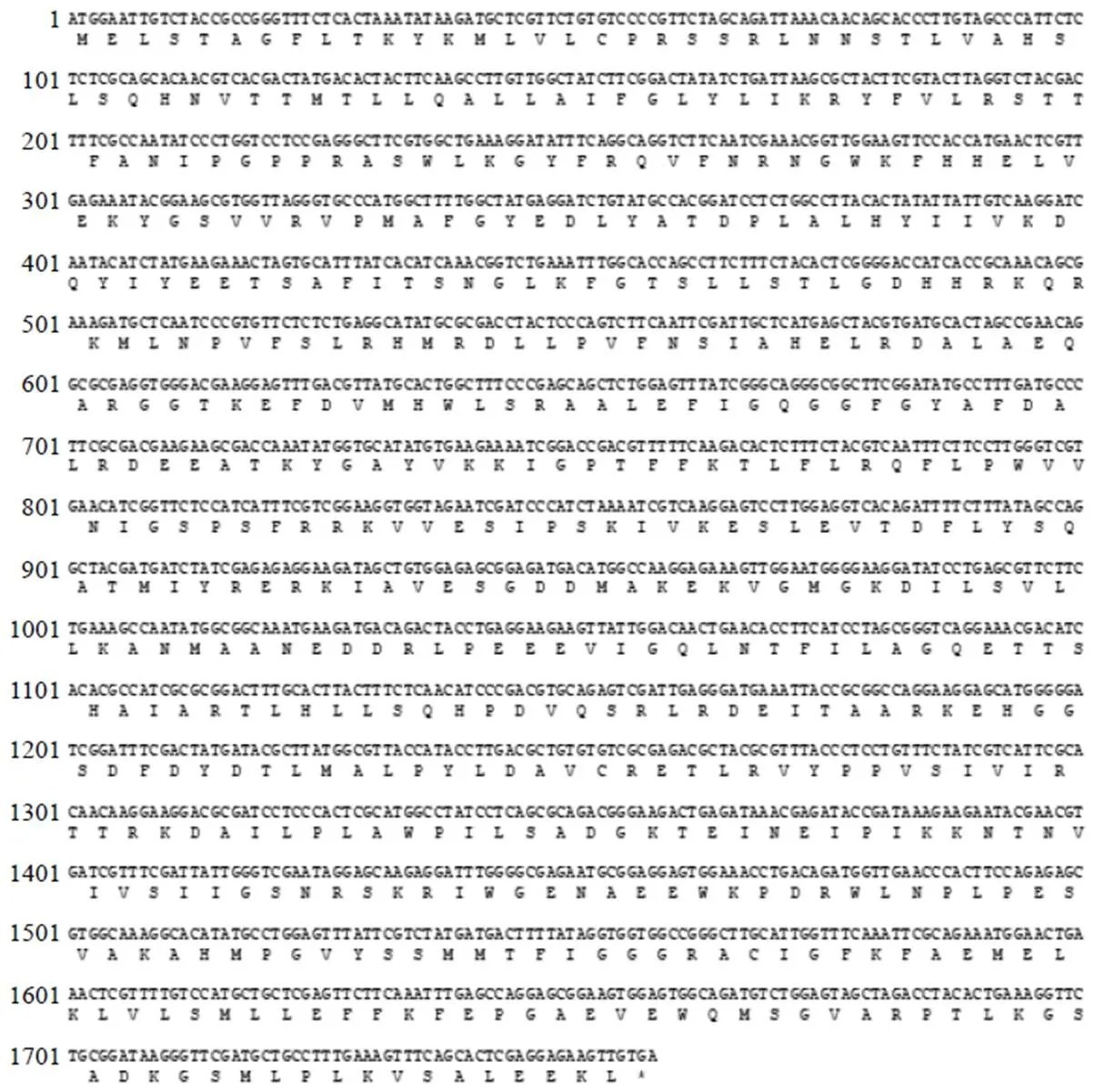
图2 CYP5150AW6基因cDNA序列全长及其编码的氨基酸序列
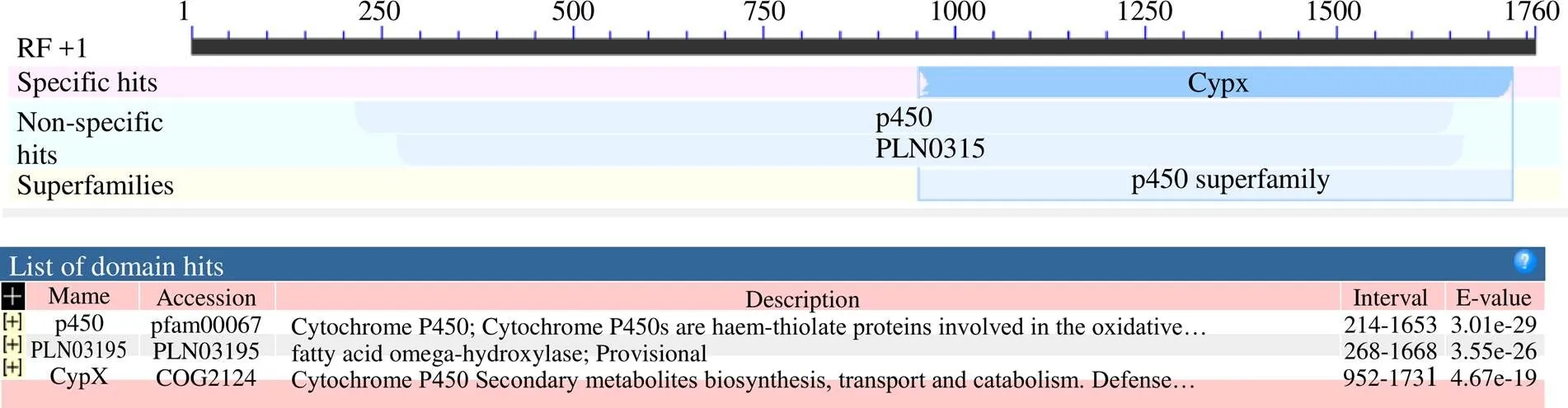
图3 CYP5150AW6蛋白的结构域分析
3.2.2 CYP5150AW6蛋白跨膜区分析 跨膜区就是蛋白质序列中能够跨越细胞膜的区域,多为α-螺旋结构,且多数由20~25个疏水性氨基酸构成。跨膜区预测是判断一个蛋白有无传递信号或物质的能力,对其功能的分析具有重要的意义[23]。使用纽普生物-在线工具-蛋白质跨膜区预测对CYP5150AW6蛋白进行预测分析,结果见图4,表明此蛋白不具有跨膜结构。
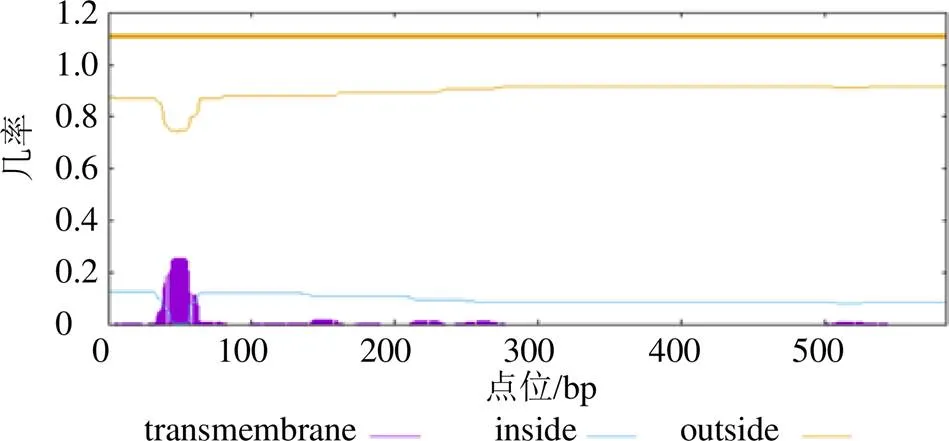
图4 CYP5150AW6蛋白的跨膜区预测结果
3.2.3 CYP5150AW6蛋白信号肽分析 信号肽是引导新合成的蛋白质分泌通路转移的短肽链,序列长度多数为5~30个氨基酸[24]。使用SignalP 5.0 sever进行信号预测,结果显示CYP5150AW6蛋白不存在信号肽(图5)。

图5 CYP5150AW6蛋白信号肽预测结果
3.2.4 CYP5150AW6蛋白亚细胞定位分析 蛋白质是构成细胞的基本有机物,是植物生命活动的物质基础和主要体现者。蛋白质亚细胞的定位预测对蛋白质功能的研究具有重要的价值,更是生物信息学分析的重要环节,通过对蛋白质的亚细胞定位预测分析,有利于深入了解该蛋白的功能性值[25]。使用在线软件PSORT II分析CYP5150AW6蛋白的亚细胞定位,结果显示其主要定位于细胞质、线粒体、内质网、细胞核、高尔基体和过氧化物酶体,其依次比例大约为10∶6∶2∶2∶1∶1。因此,表明CYP5150AW6蛋白主要在细胞质和线粒体中完成蛋白质的加工与修饰。
3.2.5 CYP5150AW6蛋白二级结构及分析 蛋白质二级结构(secondary structure of protein)是指多肽主链骨架原子沿一定的轴盘旋或折叠而形成的特定的构象,即肽链主链骨架原子的空间位置排布,不涉及氨基酸残基侧链。蛋白质二级结构主要包括α-螺旋、β-折叠、β-转角和无规卷曲四种形式。蛋白质二级结构预测对蛋白质三级结构的预测和构建起到重要的作用[26]。使用SPOMA在线软件对CYP5150AW6蛋白的二级结构进行预测分析(图6),结果显示有49.06%的CYP5150AW6蛋白处于α螺旋状态,有12.14%处于延伸状态,有5.30%处于转角状态,有33.50%处于无规则卷曲状态,表明目的蛋白大部分的氨基酸都处于卷曲状态。

图6 CYP5150AW6蛋白的二级结构预测
3.2.6 CYP5150AW6蛋白三级结构及分析 使用SWISS-MODEL在线软件对CYP5150AW6蛋白三维结构进行预测分析,用Cytochrome P450 3A4(SMTL ID:4ny4.1.A)为模板,预测结果见图7。
3.2.7 CYP5150AW6系统进化分析 从NCBI数据库中挑选与暴马桑黄CYP5150AW6氨基酸序列具有一定同源性的细胞色素P450家族的氨基酸序列,使用MEGA5.2.2软件构建CYP5150AW6蛋白系统进化树。结果如图8所示,所有的CYP450家族基因编码的蛋白聚为一大分支,说明其具有一个共同的起源。随后又大致分为2个小分支,ERG24家族基因编码的蛋白聚为一支,其它的聚为一支。在次一级的分支中,暴马桑黄CYP5150AW6蛋白与灵芝CYP5150L8蛋白聚为一支,说明两者亲缘关系相对比较近,可能因为两者都为多孔药用真菌。以上结论符合物种分类原则。

图7 CYP5150AW6蛋白的三级结构预测
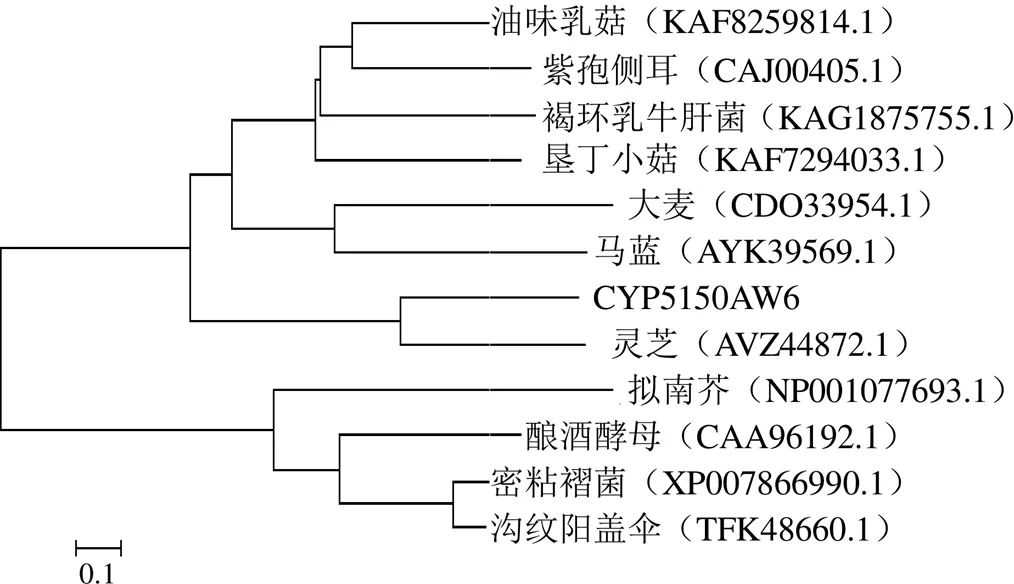
图8 CYP5150AW6系统进化分析
3.3 pET-32a-CYP5150AW6重组质粒的获得
将线性化的pET-32a质粒和基因ORF重组后,得到pET-32a-重组质粒,以pET-32a-F、pET-32a-R(表1)为引物进行PCR扩增检测。结果显示在2000~4000 bp出现明显条带,与预测目的片段大小一致(图9)。阳性质粒送至哈尔滨擎科生物公司测序后得到电子序列,序列分析结果表明重组质粒pET-32a-构建成功。
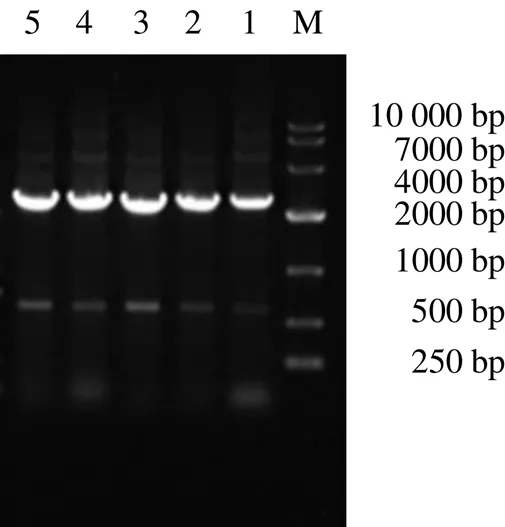
M-Marker 1~5-目的条带
3.4 重组质粒pET-32a-CYP5150AW6原核表达分析
将测序结果正确的重组质粒pET-32a-转入到大肠杆菌感受态细胞BL21(DE3)后,利用终浓度为1 mmol/L IPTG诱导重组蛋白表达。SDS-PAGE检测结果中显示,在IPTG诱导2、4、6、8和10 h后,均在75 000~100 000表达出一条较一致的蛋白条带,大小为86 080 bp(包含20 000 bp的标签蛋白),表明蛋白的表达量随诱导时间变化不大,且蛋白表达量都处于较高水平(图10)。进一步证明重组质粒pET-32a-构建成功,并能通过IPTG诱导成功表达出目的蛋白。
3.5 CYP5150AW6基因在桑黄不同发育阶段的表达水平
提取不同发育阶段(菌丝体、原基、子实体)的暴马桑黄材料的总RNA,反转录得到cDNA,以cDNA作为模板,采用qRT-PCR技术检测基因的表达水平。结果见图11,可以看出基因表达水平在不同的发育阶段呈现依次上升趋势,且在子实体阶段达到最高,约为起始阶段(菌丝阶段第6天时)的12倍。
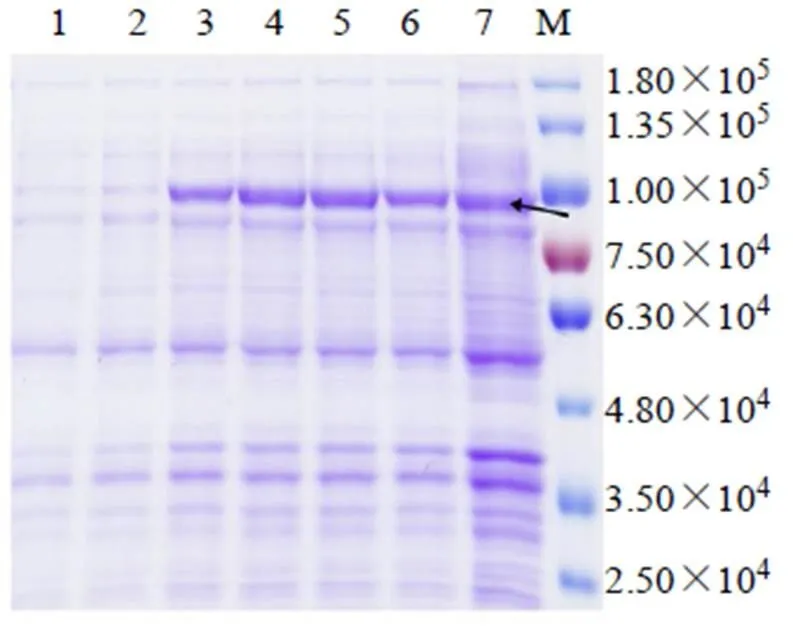
1-空白对照:质粒pET-32a未经诱导表达的菌体蛋白 2~7-质粒pET-32a-CYP5150AW6经1 mmol/L IPTG诱导0、2、4、6、8、10 h表达的菌体蛋白 M-Marker 箭头指示为目的蛋白
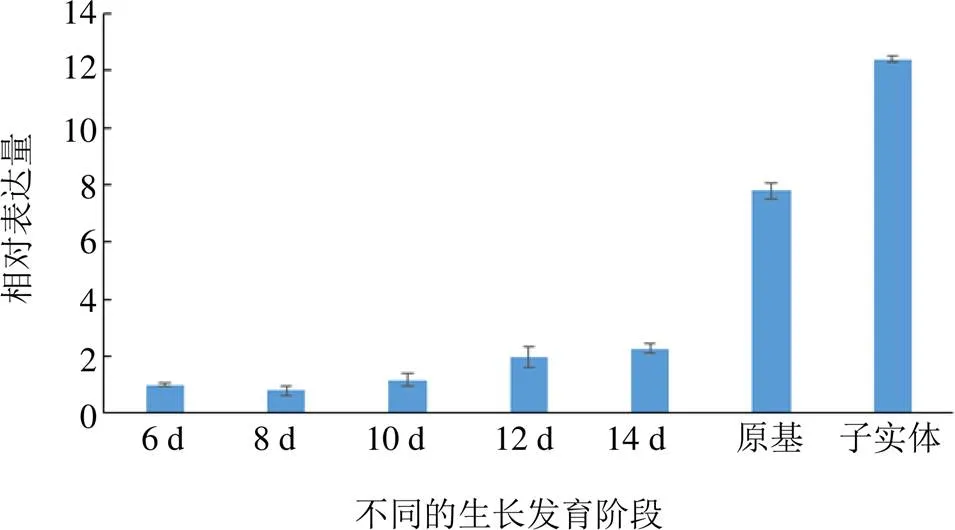
图11 CYP5150AW6基因在暴马桑黄不同发育阶段的转录水平
4 讨论
CYPs在微生物和动植物体内广泛存在,并参与到生物体的能量交换和物质代谢过程中,具有多种催化功能,被誉为万能的催化剂[6]。近些年来,对于P450家族基因的研究越来越引起广大研究者的关注。本实验利用PCR技术克隆得到了基因的全cDNA序列,并进行生物信息学分析,结果表明基因具有完整的ORF;CYP5150AW6蛋白具有P450超家族的保守结构域,是P450家族基因;CYP5150AW6蛋白不具有跨膜区和信号肽,属于亲水的稳定蛋白。亚细胞定位结果显示该蛋白主要位于细胞质和线粒体中,表明其在细胞质和线粒体中修饰合成。系统进化分析显示,暴马桑黄CYP5150AW6蛋白与灵芝CYP5150L8蛋白聚为一支,说明两者亲缘关系较近。推测暴马桑黄基因的功能可能与灵芝基因功能相似。
本实验基于基因全长,以pET-32a作为表达载体,构建了重组质粒pET-32a-,转入大肠杆菌BL21(DE3)中,并成功诱导表达出目的蛋白,说明该基因能够表达出蛋白。同时进行了不同IPTG诱导时间蛋白表达量测定,结果显示不同诱导时间蛋白表达量变化不大。说明在原核表达系统中,诱导时间长短与CYP5150AW6蛋白表达量没有明显的相关性,而在真核表达中两者的相关性还有待于进一步检测验证。通过对基因在暴马桑黄不同发育阶段的表达水平检测,发现该基因的转录水平从菌丝阶段到子实体阶段不断增加,说明该基因可能与暴马桑黄的生长发育过程有关。
目前随着研究的深入,超过30万种的CYPs基因在生物体内被发现。在真菌中,有约8.5万种基因被发现,可分为32个Clan,805个Family,且功能多种多样[13, 27]。有研究证明细胞色素P450基因除了能参与萜类和甾醇类化合物的合成,还具有参与催化生物体生长发育的作用。在植物中,母洪娜等[28]研究发现,“橙红丹桂”中的基因在花器官中的表达量最高,且从铃梗期开始逐渐升高。王蕾等[29]发现烟草CYP71D亚家族基因在根、叶、花中特异表达,部分能参与IAA激素、温度等逆境胁迫反应。张杰等[30]克隆了马铃薯中的基因,此基因在根中表达量最高,能使油菜素甾醇(BR)失活,进而调节植株生长发育,此外,在拟南芥中也已证明和植株生长发育有关[31]。上述研究结果表明基因能参与生物体生长发育的调控,但当前在真菌中关于基因的研究报道相对较少,且多集中于萜类、甾醇的合成相关基因的研究。在暴马桑黄中参与生长调控的基因尚未见报道。本试验通过克隆,分子鉴定和差异表达分析初步判断基因可能与暴马桑黄的生长发育有关,但其具体调控途径和作用机制有待进一步研究。
利益冲突 所有作者均声明不存在利益冲突
[1] 常堃, 蔡婧, 李军, 等. 桑枝栽培食药用菌研究综述 [J]. 湖北农业科学, 2017, 56(24): 4681-4684.
[2] 包海鹰, 杨烁, 李庆杰, 等. “桑黄”的本草补充考证 [J]. 菌物研究, 2017, 15(4): 264-270.
[3] 陈万超, 杨焱, 张劲松, 等. 桑黄类真菌活性代谢产物的研究进展 [J]. 食用菌学报, 2020, 27(4): 188-201.
[4] 于忠洋, 姜洋, 翟明霞, 等. 桑黄麦角甾醇生物合成关键酶PlERG24基因克隆与表达分析 [J]. 中草药, 2020, 51(22): 5825-5832.
[5] 解敏敏. 烟草重要基因篇: 8.烟草P450基因 [J]. 中国烟草科学, 2015, 36(2): 118-120.
[6] 王海燕, 图力古尔, 陈强, 等. 真菌细胞色素P450研究进展 [J]. 食用菌学报, 2010, 17(2): 97-102.
[7] 刘增才, 王世新, 孙婷婷, 等. 暴马桑黄SbLSD基因克隆及差异表达分析 [J]. 中南林业科技大学学报, 2020, 40(11): 100-108.
[8] 孙婷婷. 桑黄三萜生物合成途径关键酶基因的挖掘及分析 [D]. 哈尔滨: 东北林业大学, 2017.
[9] 曾欣宜, 朱英杰, 李滢, 等. 基于全基因组的紫芝细胞色素P450分析 [J]. 中国现代中药, 2016, 18(12): 1555-1559.
[10] Wang W F, Xiao H, Zhong J J. Biosynthesis of a ganoderic acid inby expressing a cytochrome P450 gene from[J]., 2018, 115(7): 1842-1854.
[11] 方星, 师亮, 徐颖洁, 等. 灵芝甾醇14α-脱甲基酶基因的克隆及超量表达对三萜合成的影响 [J]. 菌物学报, 2011, 30(2): 242-248.
[12] Lan X T, Yuan W, Wang M,. Efficient biosynthesis of antitumor ganoderic acid HLDOA using a dual tunable system for optimizing the expression of CYP5150L8 and aP450 reductase [J]., 2019, 116(12): 3301-3311.
[13] 唐静. 茯苓细胞色素P450基因PcCYPs的克隆及功能分析 [D]. 武汉: 华中农业大学, 2020.
[14] 刘蒙蒙, 邢咏梅, 郭顺星. 药用真菌猪苓菌核细胞色素P450基因的克隆、序列分析及表达差异的鉴定 [J]. 中国药学杂志, 2017, 52(11): 918-923.
[15] 张建峰, 王冠雄, 黄佳, 等. 温度和干旱胁迫下绳状青霉菌P1的溶磷能力研究 [J]. 西北农林科技大学学报: 自然科学版, 2021, 49(3): 86-92.
[16] 殷茹, 刘依林, 王剑桥, 等. 白腐真菌降解持久性有机污染物的研究进展 [J]. 地球与环境, 2020, 48(6): 747-757.
[17] 代广辉. 白腐真菌降解农业废弃物秸秆的研究进展 [J]. 辽宁科技学院学报, 2020, 22(3): 17-19.
[18] 杨杰, 孙璐, 王思瑶, 等. 3个白桦细胞色素P450基因生物信息学及表达分析 [J]. 南京林业大学学报: 自然科学版, 2018, 42(6): 27-34.
[19] 周彩霞, 赵治巧, 唐宇佳, 等. 产木聚糖酶嗜热真菌鉴定、酶基因克隆及生物信息学分析 [J]. 基因组学与应用生物学, 2021, 40(1): 197-203.
[20] 周延清, 邵露营, 郭萌萌, 等. 地黄C3H基因的克隆及生物信息学分析 [J]. 广西植物, 2020, 40(9): 1281-1287.
[21] 徐子娴, 朱云国, 李珊, 等. 冬虫夏草菌NADPH-细胞色素P450还原酶基因的生物信息学分析 [J]. 菌物研究, 2021, 19(1): 54-62.
[22] 庾蕾, 刘建平, 庄志雄, 等. 实时RT-PCR基因表达相对定量REST软件分析与2(-ΔΔCT)法比较 [J]. 热带医学杂志, 2007, 7(10): 956-958.
[23] Krogh A, Larsson B, von Heijne G,. Predicting transmembrane protein topology with a hidden Markov model: Application to complete genomes [J]., 2001, 305(3): 567-580.
[24] Almagro Armenteros J J, Tsirigos K D, Sønderby C K,. SignalP 5.0 improves signal peptide predictions using deep neural networks [J]., 2019, 37(4): 420-423.
[25] 陈行健, 胡雪娇, 薛卫. 基于多层次稀疏编码预测蛋白质亚细胞定位 [J]. 生物工程学报, 2019, 35(4): 687-696.
[26] Jones D T. Protein secondary structure prediction based on position-specific scoring matrices [J]., 1999, 292(2): 195-202.
[27] Nelson D R. Cytochrome P450 diversity in the tree of life [J]., 2018, 1866(1): 141-154.
[28] 母洪娜, 樊蕾, 叶缘铭, 等. 桂花OfCYP82C4基因的克隆及表达分析[J]. 分子植物育种: 2021, 2: 1-11.
[29] 王蕾, 赵泽玉, 陈明丽, 等. 烟草CYP71D亚家族的生物信息学分析 [J]. 中国烟草科学, 2020, 41(2): 79-85.
[30] 张杰, 邓孟胜, 蔡诚诚, 等. 马铃薯StCYP734A1基因克隆、表达模式及生物信息学分析 [J]. 分子植物育种, 2019, 17(15): 4883-4893.
[31] Youn J H, Kyun M. ARF7 increases the endogenous contents of castasterone through suppression of BAS1 expression in[J]., 2016, 122: 25.
Cloning and expression analysis ofgene of cytochrome P450 family in
LI Ya-wei1, LIU Zeng-cai1, SUN Ting-ting2, Wumuti Bahetibieke1, ZOU Li1
1. College of Forestry, Northeast Forestry University, Harbin 150040, China 2. Department of Food Engineering, Harbin University, Harbin 150086, China
To explore the function ofgene of cytochrome P450 family in the regulation of growth and development of.The full-length cDNA sequence of target gene was obtained by PCR, and the amino acid sequence was analyzed by bioinformatics online software. Prokaryotic expression vectors were constructed by homologous recombination. The qRT-PCR technology was used to analyze the expression characteristics in different developmental stages.The total length of the P450 gene (ORF) was 1758 bp, encoding 585 amino acids with a relative molecular weight of 66 080, and it was namedby P450 international naming committee. The prediction of the transmembrane region showed that CYP5150AW6 protein did not have a transmembrane structure. Subcellular localization showed that CYP5150AW6 was modified and synthesized in cytoplasm and mitochondria. Phylogenetic analysis showed that CYP5150AW6 protein was closely related to CYP5150L8 protein of, which was in accord with the principle of species classification. SDS-PAGE results confirmed the presence of target protein bands between 75 000—100 000 (containing 20 000 of the labeled protein), indicating that the obtained gene could successfully express the protein. According to the results of qRT-PCR analysis, the transcript level ofgene increased gradually from mycelium stage to fruiting body stage, and reached the highest level in fruiting body stage, indicating that this gene may be related to the growth and development of..Through the identification and analysis ofgene, it provides a theoretical basis for further study of the function ofgene in the regulation of growth and development of..
(Pilát) L. W. Zhou & Y. C. Dai; cytochrome P450 gene; growth and development; expression analysis;qRT-PCR
R286.12
A
0253 - 2670(2022)11 - 3448 - 08
10.7501/j.issn.0253-2670.2022.11.022
2021-10-12
中央高校基本科研业务费资助项目(2572020DF06)
李亚伟,男,硕士研究生,现从事食用菌技术研究。E-mail: 2664508708@qq.com
邹 莉,女,博士,教授,主要从事食用菌技术研究。E-mail: 13903650896@163.com
[责任编辑 时圣明]
