地黄苷D对皮质酮诱导的PC-12细胞损伤的保护作用及机制研究
2022-05-31卢仁睿王慧慧冯卫生郑晓珂
张 莉,卢仁睿,王慧慧,李 孟,冯卫生, 2*,郑晓珂, 2*
地黄苷D对皮质酮诱导的PC-12细胞损伤的保护作用及机制研究
张 莉1,卢仁睿1,王慧慧1,李 孟1,冯卫生1, 2*,郑晓珂1, 2*
1. 河南中医药大学药学院,河南 郑州 450046 2. 河南省中药开发工程技术研究中心,河南 郑州 450046
研究从地黄中分离得到的地黄苷D对皮质酮诱导的肾上腺嗜铬细胞瘤细胞(PC-12细胞)的保护作用及机制。以500 μmol/L皮质酮处理PC-12细胞24 h建立损伤模型,同时给予氟西汀和地黄苷D进行干预,采用MTT法检测细胞存活率;采用流式细胞术检测细胞凋亡、活性氧(reactive oxygen species,ROS)以及线粒体膜电位水平;采用In-Cell Western法检测细胞内凋亡相关蛋白半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)、剪切型Caspase-3(cleaved Caspase-3)、B淋巴细胞瘤2(B-cell lymphoma 2,Bcl-2)和Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)表达;采用高内涵细胞成像系统检测细胞内脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)蛋白表达。地黄苷D明显提高皮质酮诱导的PC-12细胞存活率(<0.05、0.01);抑制细胞凋亡和细胞内ROS水平(<0.01);升高线粒体膜电位(<0.01);下调细胞Bax/Bcl-2蛋白表达(<0.05);上调BDNF蛋白表达(<0.01)。酪氨酸激酶受体B(tyrosine kinase receptor B,Trk B)拮抗剂K252a能够拮抗地黄苷D对PC-12细胞凋亡的抑制作用。地黄苷D可能是通过激活BDNF-Trk B通路,抑制细胞凋亡通路,从而保护皮质酮诱导的PC-12细胞损伤。
地黄苷D;脑源性神经营养因子-酪氨酸激酶受体B通路;线粒体凋亡通路;皮质酮;抑郁症
抑郁症是临床常见的心境障碍疾病,主要症状表现为情感低落、丧失兴趣、注意力降低、思维迟缓、言语动作减少[1]。抑郁症发病率呈逐年上升趋势,据2019年世界卫生组织统计的最新数据显示,全球大约有3.5亿抑郁症患者[2]。目前临床常用的抗郁药类型包括单胺氧化酶抑制剂(monoamine oxidase inhibitor,MAOI)、三环类药物、选择性5-羟色胺再吸收抑制剂(selective serotonin reuptake inhibitor,SSRI)等[3]。但有报道指出,抗抑郁药一般服用1~2周后才会逐渐起效,且一些患者服药后产生性功能障碍、嗜睡、体质量增加、失眠、恶心等不良反应[4]。因此,从中药中寻找抗抑郁新药很有意义。本课题组近年来致力于从中药中筛选出具有抗抑郁活性的化学成分,发掘抗抑郁新药前体,以期开发出具有我国自主知识产权的抗抑郁新药。
地黄是玄参科植物地黄Libosch.的块根,列为四大怀药之一。地黄药用始载于《神农本草经》,后张仲景《金匮要略·百合狐惑阴阳毒病脉证治》中将百合地黄汤(由百合、生地黄2味药物组成)用于治疗百合病(一种以行、卧、饮食等皆觉不适及神情恍惚为主要表现的神志疾病)。现代药理学研究已证实百合地黄汤能改善模型小鼠的抑郁症状[5],还有研究指出地黄乙醇提取物能够改善慢性不可预见性轻度应激诱发的抑郁样行为[6]。因此,本课题组对近年来从地黄中提取、分离得到的化合物进行了抗抑郁活性筛选,发现从地黄中分离得到的地黄苷D对小鼠抑郁模型的抑郁症状有较好的改善作用。进一步查阅文献发现,目前已有报道的地黄中的抗抑郁成分有梓醇[7]、毛蕊花糖苷[8]和松果菊苷[9],关于地黄苷D抗抑郁活性的研究尚无报道。本研究采用皮质酮诱导的大鼠肾上腺嗜铬细胞瘤细胞(PC-12细胞)损伤模型,探究地黄苷D对PC-12细胞的保护作用,以及对神经营养因子表达和神经凋亡通路的影响。
1 材料
1.1 细胞株
PC-12细胞购自中国科学院上海细胞库。
1.2 药材
生地黄购自河南省焦作市温县,经河南中医药大学董诚明教授鉴定为玄参科多年生草本植物地黄Libosch.的干燥块根,标本保存在河南中医药大学中药化学研究室。
1.3 药品与试剂
DiaionHP-20、MCIGelCHP-20购自日本三菱化学公司;ToyopearlHW-40C、ToyopearlHW-40购自日本TOSOH公司;SephadexLH-20购自美国Parmacia Biotech公司;160~200目柱色谱硅胶H购自青岛海洋化工厂;RPMI 1640培养基(批号2110284)购自美国Gibco公司;胎牛血清(批号20010502)购自杭州四季青生物工程研究所;皮质酮(批号16063)购自美国Cayman Chemical Inc;氟西汀(批号T0450)购自上海百舜生物科技有限公司;DAPI(批号C1002)购自上海碧云天生物技术有限公司;双抗、二甲基亚砜、活性氧(reactive oxygen species,ROS)检测试剂盒、线粒体膜电位(mitochondrial membrane potential,MMP)检测试剂盒购自北京索莱宝科技有限公司,批号分别为200200912、1121E0316、20210915、20210914;PE偶联Annexin-V凋亡检测试剂盒(批号9074586)购自美国BD公司;酪氨酸激酶受体B(tyrosine kinase receptor B,Trk B)拮抗剂K252a(批号128M4104V)购自美国Sigma公司;胰酶(批号J190017)、MTT(批号715F055)购自Biosharp公司;半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)抗体(批号ab13847)、B淋巴细胞瘤2(B-cell lymphoma 2,Bcl-2)抗体(批号ab59348)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号ab32503)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)抗体(批号ab205067)购自英国Abcam公司;剪切型Caspase-3(cleaved Caspase-3)抗体(批号9661S)购自美国CST公司;羊抗兔二抗(批号C80911-11)、羊抗鼠二抗(批号C80816-10)购自美国LI-COR公司;β-actin抗体(批号AC004)购自美国ABclonal公司;其他试剂均为进口或国产分析纯。
1.4 仪器
Forma 3111型细胞培养箱(美国Thermo Fisher Scientific公司);SW-CJ-2FD型超净工作台(苏州安泰空气技术有限公司);iMark酶标仪(美国Bio-Rad公司);Arium611VF型超纯水仪(德国Sartorius公司);微量加样器、5810型离心机(德国Eppendorf公司);ECLIPSE TS100型倒置显微镜(日本Nikon公司);HVA-85型全自动高压灭菌锅(上海申安医疗器械厂);FACS Aria III流式细胞仪(美国BD公司);Odyssey CLx双色红外激光成像系统(美国LI-COR公司);高内涵成像分析系统(美国Perkin Elmer公司);AB204-N型万分之一精密分析天平(瑞士Mettler Toledo公司);APEX II型质谱仪、AVANCE 500 III型核磁共振波谱仪(德国Bruker公司);DFZ-3型真空干燥箱(上海医用恒温设备厂)。
2 方法
2.1 地黄苷D的制备
地黄苷D为本课题组制备[10],具体方法:称取20 kg生地黄,用10倍量的95%乙醇加热回流提取2次,对提取液进行减压、浓缩和离心,然后过柱洗脱。将得到的甲醇部位旋干并用10%甲醇溶液溶解滤过,滤液依次用10%、30%、50%、70%和100%甲醇水溶液洗脱;将10%甲醇部位用甲醇溶解,使用硅胶柱色谱结合ToyopearlHW-40、SephadexLH-20、MCI Gel CHP-20、ODS等进行分离纯化及干燥。最后,通过光谱技术鉴定化合物的结构,确定得到的单体化合物SDH-1-15(36 mg)为地黄苷D,经高效液相色谱仪面积归化一法测定质量分数为98.57%。
2.2 MTT法检测细胞存活率
PC-12细胞以4×104/mL接种于96孔板中,设置对照组、模型组、氟西汀(0.3 μmol/L)组和地黄苷D(5、10、20 μmol/L)组。模型组和各给药组加入500 μmol/L皮质酮,各给药组再加入相应药物,对照组加入不含药物的培养基,处理24 h后,每孔加入20 μL MTT,4 h后采用酶标仪检测490 nm处的吸光度()值,计算细胞存活率[11]。
细胞存活率=给药/对照
2.3 流式细胞仪检测细胞凋亡
PC-12细胞以8×104/mL接种于6孔板中,设置对照组、模型组、氟西汀(0.3 μmol/L)组和地黄苷D(10 μmol/L)组。模型组和各给药组加入500 μmol/L皮质酮,各给药组再加入相应药物,对照组加入不含药物的培养基,处理24 h后,收集贴壁细胞和上清中悬浮细胞,按照PE偶联Annexin-V凋亡检测试剂盒说明书进行操作后上机检测,对2和42个象限的数值之和进行处理,统计为细胞凋亡率[12]。
2.4 流式细胞仪检测细胞内ROS水平
细胞处理及分组同“2.3”项下方法,按照ROS检测试剂盒说明书进行操作后在流式细胞仪上进行检测,对P3的数值进行处理,统计为细胞内ROS含量[11]。
2.5 流式细胞仪检测MMP
细胞处理及分组同“2.3”项下方法,按照MMP检测试剂盒说明书进行操作后在流式细胞仪上进行检测,对绿色荧光的数值进行处理,统计为线粒体中JC-1单体比率[13]。
2.6 In-Cell Western法检测细胞凋亡通路关键蛋白表达
PC-12细胞以4×104/mL接种于96孔板中,分组同“2.3”项下方法,在给药处理24 h后,吸取上清,依次用甲醛固定,Triton透化,牛血清白蛋白封闭2 h后,浸泡在Caspase-3、cleaved Caspase-3、Bax、Bcl-2和β-actin一抗[均以1∶200溶于牛血清白蛋白(bovine serum albumin,BSA)]中过夜孵育,再以二抗(以1∶500溶于BSA)孵育1 h,然后PBST清洗4次,5 min/次;PBS清洗1次,5 min/次,采用Odyssey CLx双色红外激光成像系统扫描结果,对荧光数值进行处理,统计为蛋白表达量[11]。
2.7 高内涵细胞成像系统检测BDNF蛋白表达
PC-12细胞以4×104/mL接种于96孔板中,设置对照组、对照+K252a(10 nmol/L)组、模型组、模型+K252a(10 nmol/L)组、氟西汀(0.3 μmol/L)组、氟西汀(0.3 μmol/L)+K252a(10 nmol/L)组、地黄苷D(10 μmol/L)组和地黄苷D(10 μmol/L)+K252a(10 nmol/L)组。除对照组和对照+K252a组外,其余各组加入500 μmol/L皮质酮,各给药组再加入相应药物,对照组加入不含药物的培养基,处理24 h后,吸取上清,依次用甲醛固定,Triton透化,封闭液封闭,一抗孵育(均以1∶200溶于BSA)过夜,二抗(均以1∶500溶于BSA)孵育1 h,然后加入2 μg/mL的DAPI复染5 min,然后用PBS清洗2次,5 min/次,采用Opera Phenix高内涵筛选系统检测结果,对荧光数值进行处理,统计为蛋白表达量[14]。
2.8 流式细胞仪检测K252a处理后的细胞凋亡情况
细胞处理及分组同“2.7”项下方法,按照PE偶联Annexin-V凋亡检测试剂盒说明书进行处理后,在流式细胞仪上进行检测,对2和42个象限的数值之和进行处理,统计为细胞凋亡率[12]。
2.9 统计学分析
3 结果
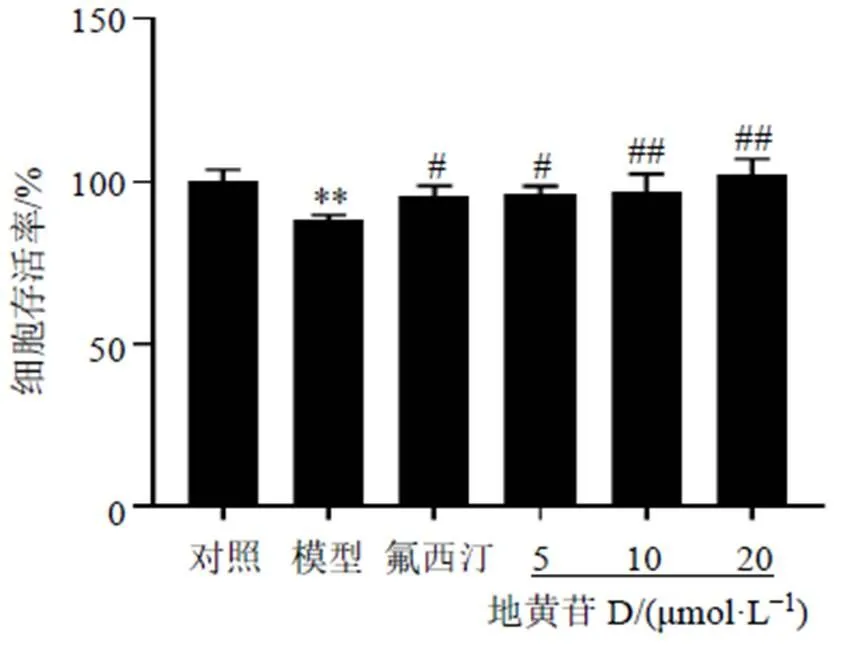
3.1 地黄苷D对皮质酮诱导的PC-12细胞存活率的影响
如图1所示,与对照组相比,模型组细胞存活率显著降低(<0.01);与模型组相比,各给药组细胞存活率均显著升高(<0.05、0.01),因此后续采用10 μmol/L地黄苷D进行实验。
3.2 地黄苷D对皮质酮诱导的PC-12细胞凋亡的影响
如图2所示,与对照组相比,模型组细胞凋亡率显著升高(<0.01);与模型组相比,各给药组细胞凋亡率均显著降低(<0.01),表明地黄苷D能够缓解细胞损伤。
与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01,下图同
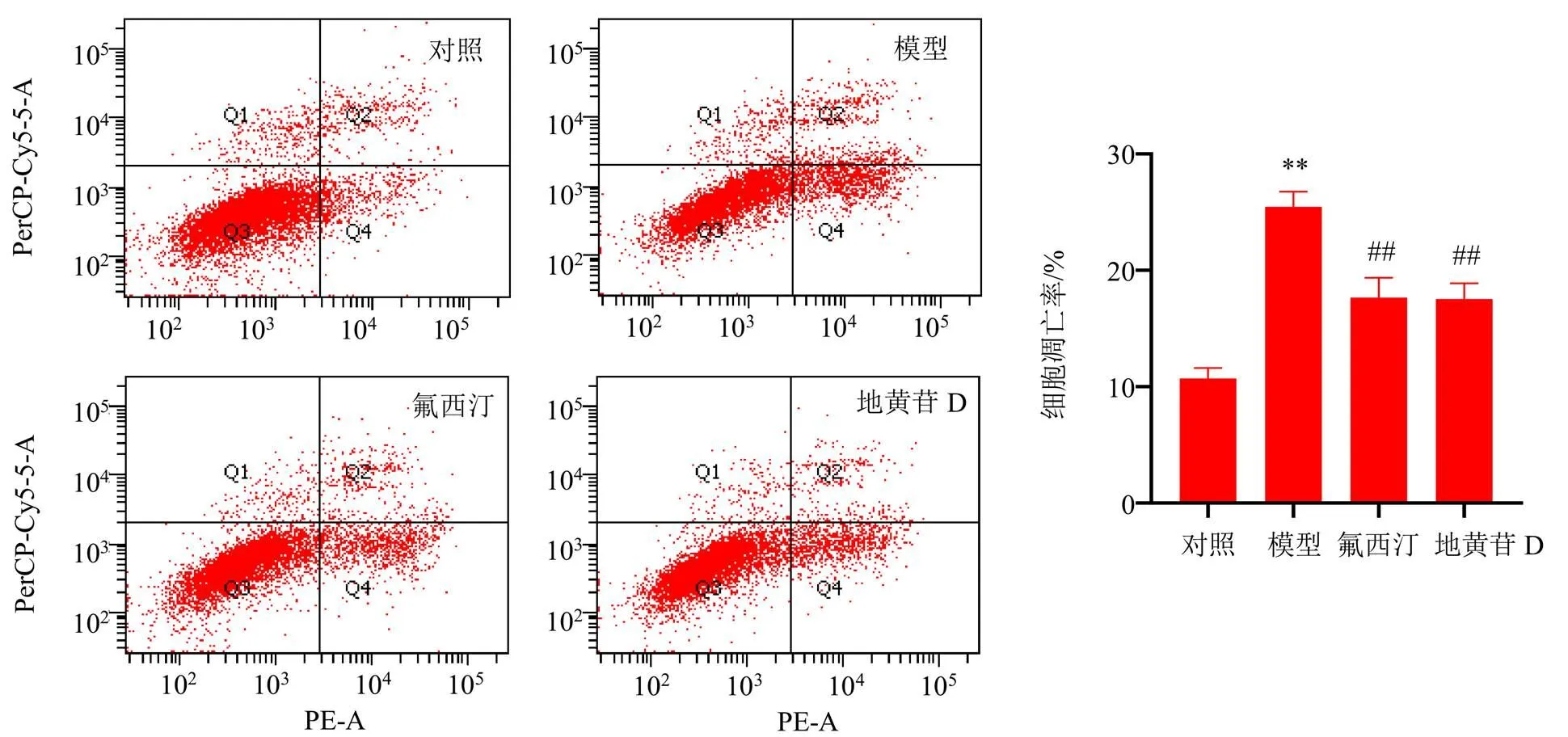
图2 地黄苷D对皮质酮诱导的PC-12细胞凋亡的影响(, n = 3)
3.3 地黄苷D对皮质酮诱导的PC-12细胞内ROS水平的影响
如图3所示,与对照组相比,模型组细胞内ROS水平显著升高(<0.01),细胞内氧化应激水平增加;与模型组相比,各给药组细胞内ROS水平显著降低(<0.05、0.01),细胞内氧化应激损伤降低。
3.4 地黄苷D对皮质酮诱导的PC-12细胞MMP的影响
如图4所示,与对照组相比,模型组细胞内JC-1单体比率显著升高(<0.01),即MMP降低,线粒体功能下降;与模型组相比,各给药组细胞内JC-1单体比率显著降低(<0.01),MMP升高,细胞损伤得到改善。
3.5 地黄苷D对皮质酮诱导损伤的PC-12细胞凋亡蛋白的影响
如图5所示,与对照组相比,模型组细胞cleaved Caspase-3/Caspase-3和Bax/Bcl-2均显著升高(<0.05、0.01);与模型组相比,各给药组细胞Bax/Bcl-2均显著降低(<0.05),cleaved Caspase-3/ Caspase-3降低,但不具有显著性差异,表明地黄苷D能够抑制皮质酮诱导的细胞凋亡进程。

图3 地黄苷D对皮质酮诱导的PC-12细胞内ROS水平的影响(, n = 3)

图4 地黄苷D对皮质酮诱导的PC-12细胞MMP的影响(, n = 3)

图5 地黄苷D对皮质酮诱导的PC-12细胞凋亡相关蛋白表达的影响(, n = 3)
3.6 地黄苷D对皮质酮诱导的PC-12细胞BDNF蛋白表达的影响
如图6所示,与对照组相比,模型组细胞BDNF蛋白表达显著降低(<0.01);与模型组相比,各给药组细胞BDNF蛋白表达显著升高(<0.01);给予K252a后,各给药组细胞BDNF蛋白表达显著降低(<0.05),表明K252a可拮抗地黄苷D对细胞的保护作用。
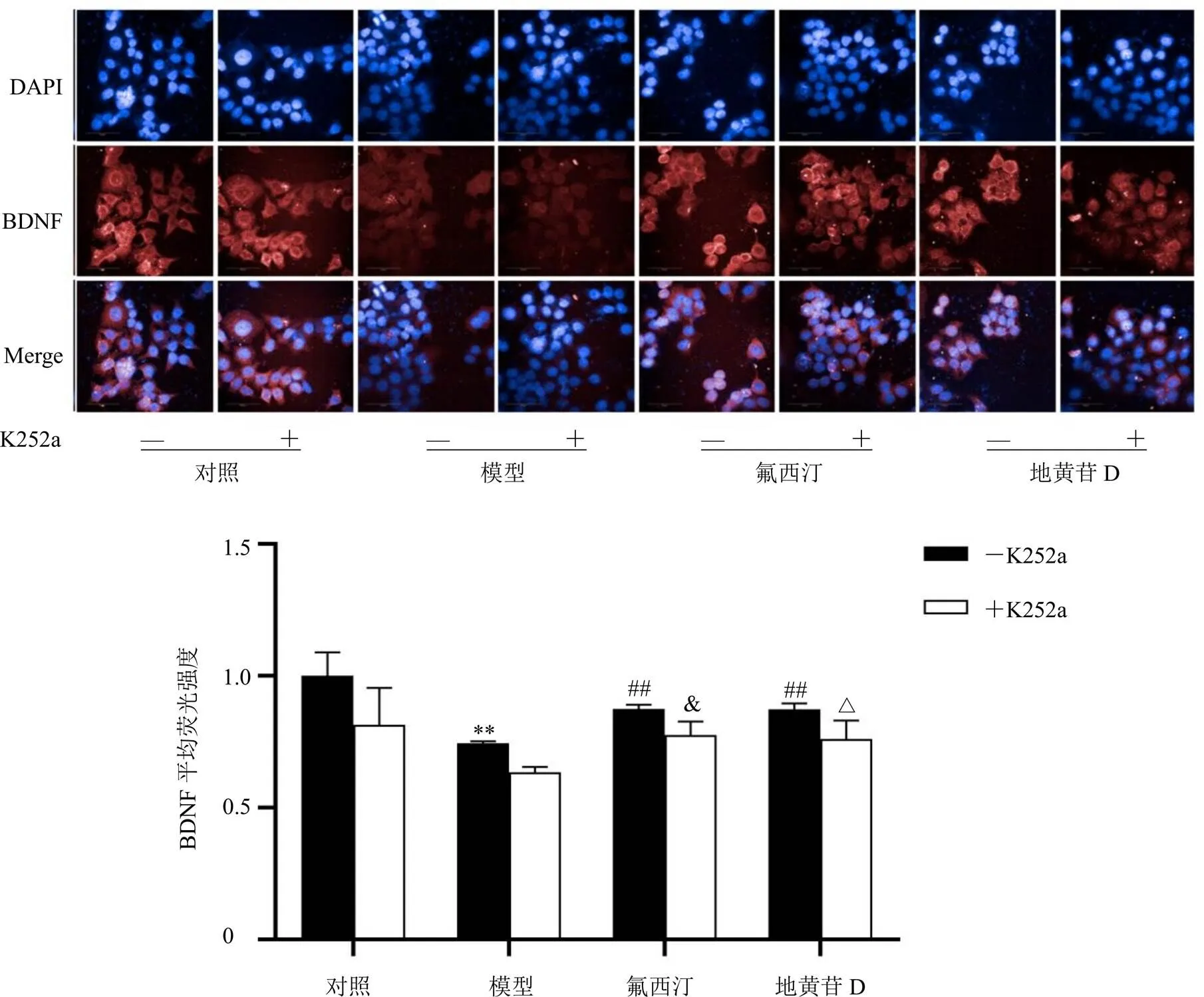
与氟西汀组比较:&P<0.05;与地黄苷D组比较:△P<0.05
3.7 K252a拮抗地黄苷D对皮质酮诱导的PC-12细胞凋亡的抑制作用
如图7所示,与对照组相比,模型组细胞凋亡率显著升高(<0.01);与模型组相比,各给药组细胞凋亡率显著降低(<0.01);给予K252a后,各给药组细胞凋亡率显著升高(<0.05、0.01),表明K252a拮抗了地黄苷D对PC-12细胞凋亡的抑制作用,表明地黄苷D的抗凋亡作用可能是通过BDNF-TrkB通路介导的。
4 讨论
抑郁症的重要表现包括过高的糖皮质激素和皮质酮水平,两者均可诱发神经元和胶质细胞相关的凋亡、自噬和突触可塑性的改变等病理变化[15]。因此可采用皮质酮刺激神经元细胞来模拟抑郁症的内环境,建立抑郁症体外细胞模型。PC-12细胞由于具有典型的神经元和糖皮质激素受体特征,常被应用于研究神经元损伤的体外模型[16]。因此,本研究采用皮质酮诱导损伤PC-12细胞建立抑郁模型,探究地黄苷D是否能够改善细胞损伤,并进一步探究其可能的作用机制。
抑郁症的发病与应激密切相关,大脑的海马结构最易受到高活性自由基如ROS应激反应损害,从而导致海马神经细胞凋亡,故抑郁症、ROS与神经细胞凋亡3者之间有密切联系[17]。临床研究和实验研究均发现,抑郁症患者和模型动物均表现出抗氧化物质的减少和氧化通路的激活[18],抑郁症常用药物氟西汀的抗抑郁机制涉及到其抗氧化及抑制中枢氧化应激性损伤的功能[19]。线粒体是提供三磷酸腺苷(adenosine triphosphate,ATP)的主要场所,线粒体合成的ATP为机体提供能量,因此,线粒体功能对于维持细胞正常功能至关重要。线粒体具有双层膜结构,其内外膜通透性的差异可以使线粒体内膜两侧形成质子梯度,维持MMP。正常的MMP是维持线粒体进行氧化磷酸化、产生ATP的先决条件,MMP的稳定有利于维持细胞的正常生理功能[20]。线粒体酶呼吸链可产生ROS,一些刺激会导致ROS水平异常增高,从而导致线粒体膜通透性改变,引起MMP的降低,诱导线粒体功能紊乱[21]。近年来研究发现,多种细胞在不同因子作用下发生凋亡时均伴有MMP的下降,且MMP在细胞凋亡早期病理变化以前就开始下降,该过程早于DNA片段化[22]。本研究结果显示,皮质酮诱导后的细胞ROS水平上升,MMP明显下降,凋亡水平明显上升;地黄苷D给药后有效抑制了ROS水平,提升了MMP水平,降低了凋亡水平。
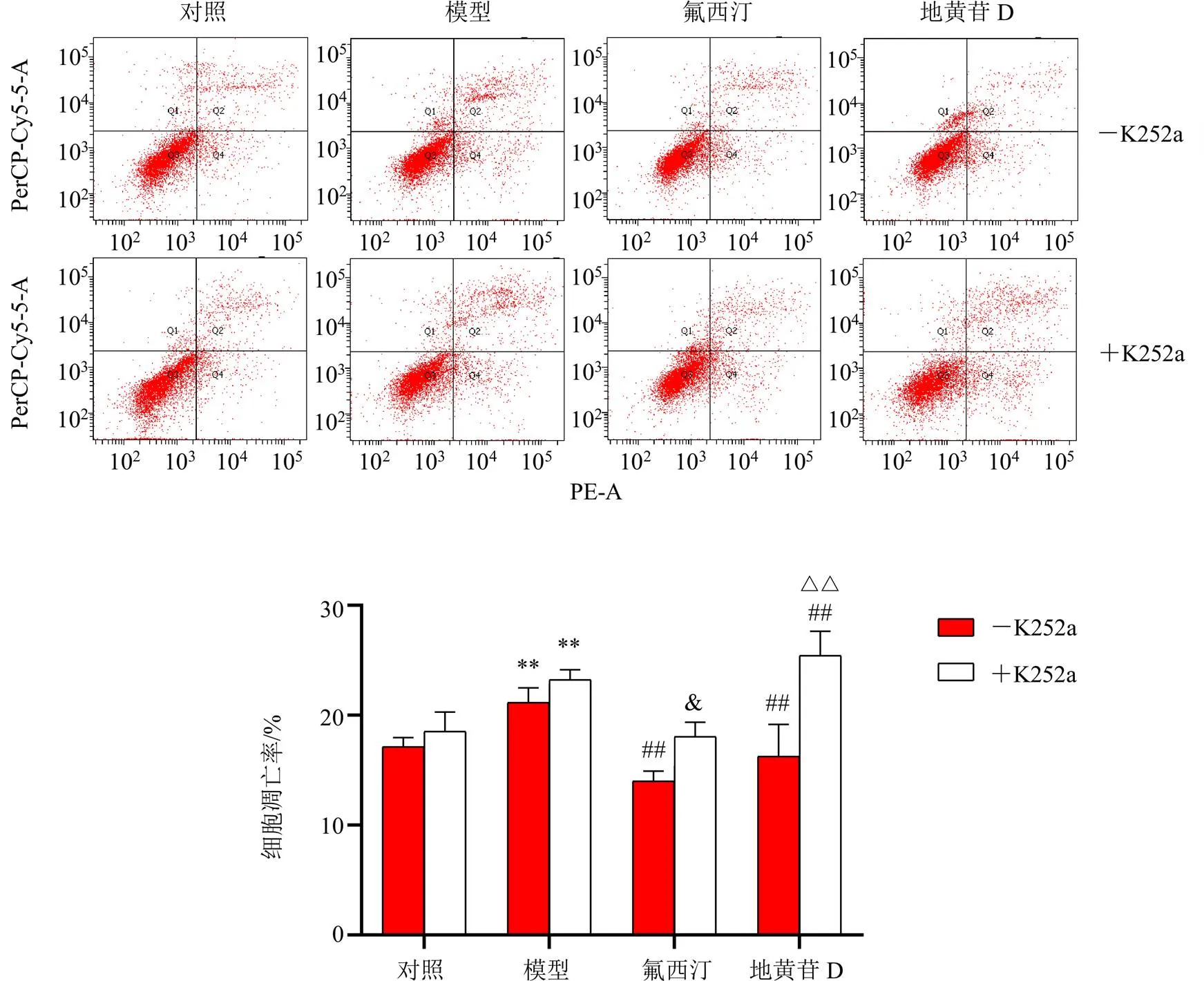
与氟西汀组比较:&P<0.05;与地黄苷D组比较:△△P<0.01
细胞凋亡途径根据启动过程主要包括线粒体途径、死亡受体途径和内质网途径3种途径,而线粒体途径在介导细胞凋亡中承担着重要角色[23]。当氧化应激发生时,ROS过度积累,导致机体抗氧化系统紊乱,体内氧自由基代谢失衡诱导神经细胞线粒体氧化应激,损伤线粒体,使细胞MMP下降,进而导致线粒体膜通透性发生改变,从而促进一系列凋亡因子(如Bcl-2家族、Caspase家族等)释放,引起细胞凋亡[22]。Bcl-2家族蛋白在细胞凋亡和线粒体外膜完整性的调控中都有很重要的功能。Bax是最早发现的Bcl-2家族促凋亡蛋白,它在正常细胞中主要定位于细胞质,受到凋亡刺激后发生构象变化,转位到线粒体上,直接寡聚化或与线粒体膜通透性转换孔道相互作用,在线粒体的外膜形成大的孔道,引起细胞色素C的释放,激活下游Caspases凋亡反应[24]。Bcl-2可以通过抑制Bax孔道的形成抑制凋亡。Caspases是一组存在于细胞质中的具有相似结构的天冬氨酸蛋白水解酶,其级联反应是细胞凋亡的执行者[25]。Bax/Bcl-2值的增加能够诱导线粒体功能障碍,从而释放一些凋亡相关因子,激活下游细胞凋亡过程中关键的执行分子之一Caspase-3的表达,使其被切割活化为cleaved Caspase-3,进而诱导细胞凋亡[26]。抗抑郁药物可以通过调节神经细胞凋亡通路的关键蛋白的表达水平来调节细胞凋亡[27]。本研究结果显示,经皮质酮刺激后,细胞内凋亡通路关键蛋白cleaved Caspase-3/Caspase-3和Bax/Bcl-2值均明显上升;经地黄苷D处理后,Bax/Bcl-2和cleaved Caspase-3/Caspase-3的比值均有不同程度地降低,表明地黄苷D能够通过抑制线粒体凋亡途径,保护PC-12细胞免受皮质酮损伤。
研究发现,BDNF是抗抑郁药物的重要靶点[28]。BDNF在海马和皮层高表达,由神经元合成,是5-羟色胺(5-hydroxytryptamine,5-HT)能神经元的生长因子,可以营养和保护5-HT能神经元,促进神经元生长,促使神经突触重塑,促进神经递质的合成。有研究表明,激发抑郁症产生的神经源性压力可促使BDNF表达降低[29]。给予药物治疗后,抑郁模型大鼠脑内BDNF含量增加[30]。临床研究也发现,抗抑郁药物或电休克治疗后,BDNF水平升高[31]。进一步查阅文献发现,BDNF的抗抑郁作用可通过Trk B激活、-甲基--天冬氨酸受体(-methyl--aspartic acid receptor,NMDA)受体活性增强以及抗氧化3条途径来实现,其中Trk B受体激活可以通过2个方面来实现,一是BDNF和Trk B结合后,使环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)磷酸化,CREB在神经系统发育、抑郁、成瘾、生理周期调控和长期记忆的形成中发挥重要作用;二是Trk B与BDNF结合被激活后,Trk B形成同型二聚体,导致酪氨酸残基磷酸化,进而激活其下游多条信号通路,包括磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)、细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)和磷脂酶C(phospho-1ipase C,PLC)这些有助于神经元正常发育生存与分化的信号转导通路,进而发挥抗抑郁作用[28]。因此,Trk B在BDNF发挥抗抑郁作用的过程中有着重要意义。K252a是Trk B拮抗剂,可以通过阻断BDNF与其受体Trk B的结合,阻断BDNF-Trk B通路[32]。在免疫荧光检测结果中发现,皮质酮诱导后PC-12细胞内BDNF表达明显下降,而地黄苷D能有效提高细胞内BDNF表达,从而改善细胞损伤。进一步研究发现,给予K252a后,地黄苷D对PC12细胞BDNF表达的上调作用明显减弱,表明K252a可以拮抗地黄苷D的神经保护作用,表明BDNF-Trk B通路是地黄苷D的神经保护作用的相关通路,BDNF是地黄苷D发挥抗抑郁作用的靶点之一。本研究结果表明,地黄苷D发挥抗抑郁作用,一方面是由于抑制了高浓度皮质酮诱导的神经细胞凋亡,另一方面是由于提高BDNF表达,促进神经细胞的生长和修复,保护神经细胞,2种作用相互促进,共同发挥抗抑郁作用。
有研究指出,机体内BDNF表达的上升可以下调Bax、Caspase-3的表达,从而发挥抗凋亡作用而保护神经细胞[33]。还有研究者发现当BDNF与Trk B结合并磷酸化酪氨酸515位点时,还会激活PI3K-蛋白激酶B(protein kinase B,Akt)通路,进而抑制凋亡通路的启动[34]。因此本研究进一步考察了加入TrkB拮抗剂K252a后,在阻断BDNF-Trk B通路的情况下对凋亡水平的影响。结果发现,地黄苷D对PC-12细胞凋亡的抑制作用可以被K252a拮抗,表明BDNF-Trk B通路可能处于凋亡通路的上游,地黄苷D抑制凋亡通路可能是由BDNF-TrkB通路介导的。
综上所述,地黄苷D可能是地黄发挥抗抑郁作用的重要物质基础之一。地黄苷D可有效缓解由高浓度皮质酮诱导的PC-12细胞损伤,其作用机制可能为提高BDNF表达,并通过BDNF-TrkB通路发挥抗凋亡作用,最终保护神经细胞,从而发挥抗抑郁作用。
利益冲突 所有作者均声明不存在利益冲突
[1] 刘宗凤. 脑电指标与老年抑郁症的相关性研究 [J]. 山东医学高等专科学校学报, 2021, 43(3): 215-217.
[2] Taciak P P, Lysenko N, Mazurek A P. Drugs which influence serotonin transporter and serotonergic receptors: Pharmacological and clinical properties in the treatment of depression [J]., 2018, 70(1): 37-46.
[3] 王建军, 张文广. 抑郁症治疗中药物相互作用引起的反应 [J]. 兵团医学, 2017, 52(2): 58-60.
[4] Braund T A, Tillman G, Palmer D M,. Antidepressant side effects and their impact on treatment outcome in people with major depressive disorder: An iSPOT-D report [J]., 2021, 11(1): 417.
[5] 赵洪庆, 唐林, 吴碧茹, 等. 百合地黄汤抑制NLRP3炎症小体激活改善焦虑性抑郁症模型大鼠海马神经元损伤 [J]. 中国实验方剂学杂志, 2021, 27(20): 7-14.
[6] Wang J M, Pei L X, Zhang Y Y,. Ethanol extract ofexerts antidepressant-like effects on a rat chronic unpredictable mild stress model by involving monoamines and BDNF [J]., 2018, 33(3): 885-892.
[7] 张江南, 刘克辛. 梓醇的研究进展 [J]. 药物评价研究, 2019, 42(8): 1680-1684.
[8] 王维刚, 王芃, 阳志强, 等. 毛蕊花糖苷药理作用研究进展 [J]. 国际药学研究杂志, 2020, 47(12): 1078-1087.
[9] 王慧慧, 卢仁睿, 张莉, 等. 地黄中松果菊苷对皮质酮诱导PC-12细胞凋亡的抑制作用及机制研究 [J]. 中国临床药理学杂志, 2021, 37(18): 2447-2450.
[10] 冯卫生, 李孟, 郑晓珂, 等. 生地黄化学成分研究 [J]. 中国药学杂志, 2014, 49(17): 1496-1502.
[11] 张莉, 王慧慧, 徐瑞豪, 等. 皂角刺提取物对皮质酮诱导PC-12细胞损伤的保护作用研究 [J]. 中药材, 2020, 43(6): 1473-1477.
[12] 冯卫生, 杨方方, 张莉, 等. 南葶苈子水提物对多柔比星诱导H9c2细胞凋亡和氧化应激的抑制作用 [J]. 中国药学杂志, 2018, 53(23): 1999-2007.
[13] 郑晓珂, 杨方方, 张莉, 等. 南葶苈子抑制氧化应激与自噬通路抗H2O2诱导的H9c2细胞损伤作用研究 [J]. 中草药, 2019, 50(1): 157-165.
[14] 张雯, 宋俊科, 朱晓瑜, 等. 异鼠李素激活Sirt1/PGC-1α信号通路抑制MPP+诱导的SH-SY5Y细胞损伤 [J]. 药学学报, 2019, 54(11): 1976-1981.
[15] 赵慧亮, 高耀, 向欢, 等. 复方柴归方对皮质酮诱导PC12细胞损伤的保护作用及转录组学机制研究 [J]. 中药药理与临床, 2021, 37(2): 126-132.
[16] Jin W Q, Xu X H, Chen X N,. Protective effect of pig brain polypeptides against corticosterone-induced oxidative stress, inflammatory response, and apoptosis in PC12 cells [J]., 2019, 115: 108890.
[17] 孙阳, 图娅, 郭郁, 等. 针刺对慢性束缚应激抑郁模型大鼠海马凋亡相关因子的影响 [J]. 针刺研究, 2019, 44(6): 412-418.
[18] Abuelezz S A, Hendawy N, Magdy Y. Targeting oxidative stress, cytokines and serotonin interactions via indoleamine 2,3 dioxygenase by coenzyme Q10: Role in suppressing depressive like behavior in rats [J]., 2017, 12(2): 277-291.
[19] Safhi M M, Qumayri H M, Masmali A U M,. Thymoquinone and fluoxetine alleviate depression via attenuating oxidative damage and inflammatory markers in type-2 diabetic rats [J]., 2019, 125(2): 150-155.
[20] 刘珂娣, 段佳林, 苏晶, 等. 紫铆花素对PC12细胞氧化应激损伤的保护作用及对线粒体功能的影响研究 [J]. 中国药房, 2020, 31(24): 2974-2981.
[21] Anderson G, Maes M. Oxidative/nitrosative stress and immuno-inflammatory pathways in depression: Treatment implications [J]., 2014, 20(23): 3812-3847.
[22] 武冬, 符莹莹, 刘丹平, 等. 艾司洛尔对脓毒症大鼠心肌细胞线粒体膜电位及心肌组织NF-κB表达的影响 [J]. 生物医学工程与临床, 2019, 23(4): 379-386.
[23] 朱玲玲, 赵捷平, 窦勤玲, 等. 线粒体凋亡途径在槲皮素诱导U937细胞凋亡中的作用研究 [J]. 中国免疫学杂志, 2018, 34(10): 1466-1471.
[24] 马淇, 刘垒, 陈佺. 活性氧、线粒体通透性转换与细胞凋亡 [J]. 生物物理学报, 2012, 28(7): 523-536.
[25] 王珑, 王实涛. 抑郁症氧化应激发病机制及针刺治疗研究进展 [J]. 针灸临床杂志, 2017, 33(11): 76-80.
[26] 王春景, 盛月, 周强, 等. 香叶木素通过线粒体凋亡途径对人乳腺癌MCF-7细胞增殖及凋亡的影响 [J]. 中药新药与临床药理, 2020, 31(2): 149-155.
[27] 刘林, 刘检, 刘羽, 等. 百事乐加味方对脑卒中后抑郁模型大鼠海马-前额叶皮层神经细胞凋亡蛋白的影响 [J]. 中国中医药信息杂志, 2019, 26(4): 61-67.
[28] 徐嘉珂, 白洁. BDNF及其受体在抗抑郁症中的作用及其机制研究 [J]. 生命科学, 2014, 26(4): 357-361.
[29] 张峻, 孟虹媛, 杨伟. 百乐眠胶囊联合喹硫平治疗轻中度抑郁症的临床研究 [J]. 现代药物与临床, 2021, 36(8): 1599-1603.
[30] 邹海艳, 杨亦龙, 屠蘅菁, 等. 解郁安神中药对抑郁模型大鼠神经递质及脑源性神经营养因子的影响 [J]. 北京中医药大学学报, 2015, 38(9): 611-618.
[31] Zhu J X, Hu W Q, Dong S Q,. Hippocampal BDNF signaling is required for the antidepressant effects of perillaldehyde [J]., 2019, 71(3): 430-437.
[32] 张继红, 李爱敏, 陈松, 等. 阻断TrkB-BDNF信号传导通路对神经母细胞瘤细胞生长及凋亡的影响 [J]. 中国当代儿科杂志, 2008, 10(1): 47-50.
[33] 屈红林, 谢军, 陈嘉勤, 等. 有氧运动激活BDNF/miR-195/Bcl-2信号通路抑制CUMS抑郁小鼠海马神经细胞凋亡 [J]. 天津体育学院学报, 2018, 33(2): 148-155.
[34] 甘世明, 金戈. BDNF信号通路调节学习记忆的研究进展 [J]. 中国老年学杂志, 2019, 39(13): 3325-3330.
Protective effect and mechanism of rehmannioside D on PC-12 cells injury induced by corticosterone
ZHANG Li1, LU Ren-rui1, WANG Hui-hui1, LI Meng1, FENG Wei-sheng1, 2, ZHENG Xiao-ke1, 2
1. School of Pharmacy, Henan University of Chinese Medicine, Zhengzhou 450046, China 2. Henan Engineering Technology Research Center for Chinese Medicine Development, Zhengzhou 450046, China
To study the protective effect and mechanism of rehmangoside D isolated fromon PC-12 cells induced by corticosterone.PC-12 cells were treated with 500 μmol/L corticosterone for 24 h to establish an injury model, fluoxetine and rehmangoside D were given for intervention at the same time. Cell viability was detected by MTT method; Intracellular apoptosis, reactive oxygen species (ROS) and mitochondrial membrane potential levels were determined by flow cytometry; In-Cell Western method was used to detect intracellular apoptosis-related protein cysteine-aspartate protease-3 (Caspase-3), cleaved Caspase-3, B-cell lymphoma 2 (Bcl-2) and Bcl-2 associated X protein (Bax) expressions; High-content cell imaging system was used to detect intracellular brain-derived neurotrophic factor (BDNF) protein expression.Rehmangoside D significantly increased the survival rate of PC-12 cells induced by corticosterone (< 0.05, 0.01), inhibited cell apoptosis and intracellular ROS level (< 0.01), increased mitochondrial membrane potential (< 0.01); Expression of Bax/Bcl-2 protein was down-regulated (< 0.05); BDNF protein expression was up-regulated (< 0.01). Tyrosine kinase receptor B (Trk B) antagonist K252a could antagonize the inhibitory effect of rehmangoside D on apoptosis of PC-12 cells.Rehmangoside D may protect PC-12 cells from corticosterone-induced injury by activating BDNF-Trk B pathway and inhibiting apoptosis pathway.
rehmannioside D; brain-derived neurotrophic factor-tyrosine kinase receptor B pathway; mitochondria dependent apoptotic pathway; corticosterone; depression
R285.5
A
0253 - 2670(2022)11 - 3385 - 09
10.7501/j.issn.0253-2670.2022.11.014
2022-02-17
国家重点研发计划项目(2017YFC1702800);河南省重大科技专项(171100310500);河南省高层次人才特殊支持“中原千人计划”项目(ZYQR201810080);河南省教育厅河南省科技攻关项目(212102311106);河南省中医药科学研究专项课题(20-21ZY2151);国家留学基金委访问学者项目(201908410093);河南中医药大学2018年度博士科研基金资助项目(BSJJ2018-04)
张 莉(1986—),女,博士,从事中药药效物质基础及作用机制研究。E-mail: sonny.fairy.love@163.com
冯卫生,男,教授,从事中药药效物质基础及作用机制研究。E-mail: fwsh@hactcm.edu.cn
郑晓珂,女,教授,从事中药活性及其作用机制研究。Tel: (0371)60190296 E-mail: zhengxk.2006@163.com
[责任编辑 李亚楠]
