基于系统药理学研究水飞蓟治疗肺癌的作用机制
2022-05-31张玉如田旭萍王永华
张玉如,田旭萍,肖 伟,王永华*
• 药理与临床•
基于系统药理学研究水飞蓟治疗肺癌的作用机制
张玉如1,田旭萍1,肖 伟2*,王永华1*
1. 石河子大学 新疆植物药资源利用教育部重点实验室,新疆 石河子 832002 2. 江苏康缘药业有限公司,江苏 连云港 222000
研究水飞蓟对肺癌的作用及其机制。利用中药系统药理学数据库(traditional Chinese medicine systems pharmacology,TCMSP)筛选水飞蓟的活性成分,并利用加权整体相似度法(weighted ensemble similarity,WES)和系统药物靶向工具(systematic drug targeting,SysDT)模型预测候选活性成分的靶点;进行基因本体论生物学过程(gene ontology biological process,GO BP)与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析揭示靶点所涉及BP以及通路。选取水飞蓟主要活性成分水飞蓟宾进行体内外实验验证,首先验证水飞蓟宾对人肺腺癌H1975细胞与小鼠肺癌LLC细胞的体外抑制率;其次用流式细胞术评估水飞蓟宾对肿瘤细胞系的促凋亡作用;随后在LLC肺癌动物模型进行体内抑瘤验证,并检测瘤内细胞毒性T淋巴细胞(cytotoxic T cell,CD8+T)的浸润量;最后通过Western blotting法检测凋亡相关蛋白表达。经过筛选得到12个活性成分与355个靶点,并构建了活性成分-靶点网络。CCK-8检测结果显示水飞蓟宾能够抑制肺癌细胞的增殖,且呈剂量相关性;体内外流式实验表明水飞蓟宾能通过促进瘤内CD8+T细胞的浸润从而促进癌细胞的凋亡来发挥抗肿瘤作用;水飞蓟宾能够上调肿瘤细胞和肿瘤组织p53蛋白表达水平(<0.001),下调B淋巴细胞瘤2(B-cell lymphoma 2,Bcl-2)蛋白表达水平(<0.05、0.001)。水飞蓟主要通过调控凋亡相关通路发挥抗肿瘤作用。
水飞蓟;水飞蓟宾;肺癌;系统药理学;凋亡;CD8+T细胞
恶性肿瘤属于世界性高发性疾病,不仅影响了人们的生活质量,甚至导致患者的直接死亡。在我国,随着人们的不良生活习惯增加,癌症的发病率和死亡率逐年攀升,并且已经逐步成为我国致死率最高的疾病之一。众多癌症中“肺癌”是目前世界公认的“癌中之王”[1]。据统计,2020年肺癌仍然是最常见的癌症,全年新增病例82万例,占新增人口的17.9%[2],全球因肺癌死亡人数为72万人,占全球死亡人数18.1%[3],仍是国内致死率最高的癌症。确诊患者中85%的肺癌患者被确诊为非小细胞肺癌(non-small cell lung cancer,NSCLC),并且超过半数的患者被确诊时已经处于中晚期,存活率普遍偏低[4]。目前临床常用的治疗方式包括手术、放疗、化疗以及靶向治疗等[5],这些治疗方式有一定的临床疗效,但在消灭癌细胞的同时也会对患者的机体造成很大的伤害,如5%~20%的肺癌患者接受放疗后出现肺损伤的情况,包括急性炎症(放疗后1~3个月)和慢性纤维化(放疗后6~24个月)[6];而化疗有广泛的细胞毒性,将会导致部分免疫细胞功能障碍等不良反应[7],这些不良反应会导致耐受力差的患者丧失性命,此外,高昂的治疗费用也会给患者家庭带来巨大的经济负担。因此,在治疗肺癌的研究中,需要探寻新的突破点。
水飞蓟(L.) Gaertn.属菊科,是1年生或2年生草本植物,具有2000多年的用药历史[8],其药用部位为成熟的果实,主要化学成分为黄酮类化合物及延胡索酸,是一种优良的护肝植物。除护肝作用外,水飞蓟还具有很强的抗氧化作用,并且能够调节多条信号通路从而抑制炎性介质产生[9]。水飞蓟素是从水飞蓟的种子中提取出的一种黄酮木质素类混合物,包括水飞蓟宾、异水飞蓟宾、水飞蓟宁等活性成分[10],水飞蓟宾在水飞蓟提取物中含量最高,约占60%~70%[11],为水飞蓟的主要活性成分。研究表明,水飞蓟宾具有抗炎、抗氧化、抗纤维化等药理作用[12-13]。除此之外,水飞蓟宾能够通过降低表皮鸟氨酸脱羧酶的表达从而抑制肿瘤的生长[14],因此,水飞蓟除了保肝作用外还有潜在的抗肿瘤作用[15]。
随着中医药的发展,中药被广泛用于治疗各种疾病,但由于中药具有多种活性成分以及多个作用靶点,并且不同活性成分与靶点间可能存在不同的对应关系,需要研究者深入探究。为了明确中药活性成分与靶点间的作用关系,一门通过计算机技术辅助的多学科结合的新兴技术——系统药理学[16]应运而生。该技术通过中药系统药理学分析平台(traditional Chinese medicine systems pharmacology,TCMSP)将吸收、分布、代谢和排泄(absorption,distribution,metabolism and excretion,ADME)建模技术、靶点预测及通路/网络分析进行整合,以阐明中药复杂成分与治疗靶点及通路之间的关系[17]。本研究首先通过系统药理学方法,从多靶点、多层次揭示水飞蓟潜在的抗肿瘤作用机制,其次通过体内及体外实验验证水飞蓟是否通过增加肿瘤微环境中细胞毒性T淋巴细胞(cytotoxic T cell,CD8+T)的浸润量而促进肿瘤细胞凋亡,从而发挥抗肿瘤作用,为水飞蓟发挥抗肿瘤作用提供理论基础,同时也为临床抗肿瘤研究提供新思路。
1 材料
1.1 细胞
人非小细胞肺癌细胞系H1975与小鼠肺癌细胞LLC购自中国科学院上海生命科学研究院细胞资源中心。
1.2 动物
SPF级雌性C57BL/6小鼠20只,体质量18~22 g,5~6周龄,购自斯贝福(北京)生物技术有限公司,合格证号NO.110324211102407337。动物于温度(25±1)℃、湿度(55±5)%的SPF级环境中,12 h光照/黑暗周期,适应性饲养1周。动物实验经北京大学实验动物福利伦理委员会批准(批准号2021051101)。
1.3 药品与试剂
水飞蓟宾(质量分数为98%,批号M17GB148678)、5-氟尿嘧啶(5-fluorouracil,5-Fu,质量分数为98%,批号C27N11Y131954)、分散酶II(批号D20J11H118950)、透明质酸酶(批号W11M11H109348)购自上海源叶生物有限公司;二甲基亚砜(批号161031768F)购自美国Sigma公司;DMEM培养基(批号8121510)、RPMI 1640培养基(批号8121327)、胎牛血清购自美国Gibco公司;CCK-8试剂盒(批号B1320111)购自上海贝博公司;Qproteome™Q哺乳动物蛋白提取试剂盒(批号169011710)购自德国Qiagen公司;BCA蛋白浓度测定试剂盒(批号082820201207)、DNA酶I(批号D7073-1)、RIPA强裂解液(批号P0013B)、红细胞裂解液(批号C3702)购自江苏碧云天公司;Annexin V-FITC/碘化丙啶(PI)细胞凋亡检测试剂盒(批号0027279)购自美国BD Pharmingen公司;Immun-Star TM WesternC TM化学发光试剂盒(批号102031555)购自美国Bio-Rad公司;胶原酶IV(批号2049898)购自美国Thermo Fisher Scientific公司;抗小鼠CD16/32 mAb抗体(批号20U092008212)、CD45-PE-Cy7抗体(批号B328900)、CD3e-APC抗体(批号25G091905112)、CD8a-PE抗体(批号13326019)购自美国BioLegend公司;p53抗体(批号00098490)购自美国Proteintech公司;B淋巴细胞瘤2(B-cell lymphoma 2,Bcl-2)抗体(批号GR3217999-13d)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号GR217575-65)、HRP标记的山羊抗兔IgG抗体(批号GR231489-7)购自美国Abcam公司。
1.4 仪器
3131型细胞培养箱、Invitrogen全自动细胞计数仪(美国赛默飞世尔科技公司);primo vert倒置显微镜(德国蔡司公司);TDZ4-WS型台式低速离心机(中佳科技有限公司);5418型小型高速离心机、高速冷冻离心机(德国Eppendorf公司);AUW120D型电子天平(日本岛津公司);组织匀浆机(上海达洛科学仪器有限公司);Flexstation 3多功能酶标仪(美国Molecular Devices公司);3208025型酶标板振荡器(德国IKA公司);垂直电泳系统、蛋白质小型转印槽、多功能凝胶成像分析系统(美国Bio-Rad公司);NovoCyte 3130型流式细胞仪(ACEA Biosciences公司);柜式冰箱(海尔股份有限公司);超纯水仪(默克密理博公司)。
2 方法
2.1 系统药理学
2.1.1 水飞蓟分子数据库的建立以及靶点预测 首先以“水飞蓟”“有效成分”等为主题词进行文献检索,通过TCMSP数据库收集水飞蓟的化学成分并构建分子集合,然后,根据本实验室构建的ADME系统计算候选分子的药动学参数,以口服生物利用度(oral bioavailability,OB)[18]≥30%以及类药性(drug-likeness,DL)[19]≥0.18作为阈值,筛选水飞蓟的潜在候选活性成分。
本研究采用的是本实验室自主研发的靶点预测工具:加权系综相似度模型[20](weighted ensemble similarity,WES)和系统药物靶向工具(systematic drug targeting,SysDT)[21]来预测水飞蓟活性成分的直接与间接靶点用于后续分析。
2.1.2 基因本体论生物学过程(gene ontology biological process,GO BP)富集分析 为了进一步研究水飞蓟的活性成分的潜在作用机制,利用DAVID数据库(https://david.ncifcrf.gov/)[22]对活性成分的靶点进行GO BP与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,以<0.01为筛选标准。
2.1.3 网络构建与分析 为了研究活性成分-靶点的相互作用关系以及靶点的功能对潜在的生物通路的调控作用,分别将筛选出的活性成分与靶点或靶点与通路导入Cytoscape 3.7.1软件[23]并构建活性成分-靶点、靶点-通路网络,同时对网络图进行网络拓扑参数分析,在网络图中,活性成分、靶点、通路由节点表示,2个节点间相互作用由边表示,相连的边越多则表明该节点在网络中越重要。
2.2 水飞蓟抗肿瘤实验验证
水飞蓟宾作为《中国药典》2020年版中水飞蓟的指标成分,也是水飞蓟的主要活性成分。因此,本研究选取水飞蓟宾进行后续的实验验证,来评估系统药理学预测的可靠性与准确性。
2.2.1 细胞培养 H1975细胞和LLC细胞分别用10%胎牛血清的RPMI 1640和DMEM培养基,于37 ℃、5% CO2的培养箱中培养。
2.2.2 细胞增殖检测 将处于对数生长期的H1975和LLC细胞以1×104个/孔接种于96孔板中,培养24 h,然后加入不同浓度(5、10、20、50、80、100、150、200 μmol/L)的水飞蓟宾培养48 h,对照组加入不含药物的培养基,空白组不接种细胞;加入CCK-8试剂,避光孵育1~4 h,采用酶标仪测定450 nm处的吸光度()值,计算药物对细胞的抑制率。
细胞抑制率=(对照-给药)/(对照-空白)
2.2.3 流式细胞术分析水飞蓟宾对H1975细胞的凋亡作用 将处于对数生长期的H1975细胞以5×105个/孔接种于6孔板,加入不同浓度(20、50、100 μmol/L)的水飞蓟宾处理24 h,对照组加入不含药物的培养基,收集细胞,使其重悬在100 μL的结合缓冲液中,加入5 μL FITC标记的Annexin V和PI,冰上避光孵育10 min,上机检测,使用FlowjoV10软件分析细胞凋亡率。
2.2.4 Western blotting检测水飞蓟宾对H1975细胞p53和Bcl-2蛋白表达的影响 将H1975细胞以1×106接种于60 mm培养皿中,待其贴壁后,加入不同浓度(20、50、100 μmol/L)水飞蓟宾处理24 h,对照组加入不含药物的培养基,收集细胞,加入裂解液裂解15 min,13 800 r/min离心15 min,取上清;按BCA蛋白定量试剂盒测定蛋白质量浓度,95 ℃加热10 min使蛋白变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%脱脂牛奶中室温封闭2~3 h;分别加入p53、Bcl-2和GAPDH抗体,4 ℃孵育过夜;加入HRP标记的山羊抗兔IgG抗体,室温孵育1.0~1.5 h;使用化学发光试剂盒对信号进行可视化,并用ChemiDoc™ XRS+成像系统进行条带分析。
2.2.5 动物抑瘤实验 将LLC细胞重悬于PBS中,并以5×105个接种于小鼠左上肢腋下皮下(第0天),将小鼠随机分为对照组、5-Fu(15 mg/kg)组和水飞蓟宾(5 mg/kg)组,每组6只。接种后第3天开始给药,对照组ip生理盐水,5-Fu组和水飞蓟宾组ig相应药物,当肿瘤达到5 mm时,每2天测量1次肿瘤体积,当肿瘤直径大于20 mm时判定小鼠死亡,接种后第20天对小鼠进行取材,称定质量,记录数据用于后续分析。
肿瘤体积=长×宽2×0.5
2.2.6 流式细胞术检测小鼠肿瘤组织中CD8+T细胞 取各组小鼠肿瘤组织,剪碎至泥状置于皿中,每个皿中加入2~3 mL消化液(1 mL HBSS缓冲液中含有1 μL的DNA酶I、20 μL的10%胶原酶IV、5 μL的10%透明质酸酶和10 μL的5%分散酶),于37 ℃消化30 min,每10分钟摇晃混匀1次,用4~6 mL培养基终止消化,过70 μm滤网并研磨组织,离心。加入5~8 mL红细胞裂解液裂解5~10 min,加入30 mL PBS终止裂解,过40 μm滤网,离心后清洗1~2遍至无血色,重悬并计数,使100 μL细胞悬液中含有1×106个细胞,加入1 μL抗小鼠CD16/32抗体,冰上孵育10 min,用PBS洗2遍,用100 μL的PBS重悬,用CD45-PE-Cy7、CD3e-APC、CD8a-PE抗体标记,室温孵育30 min,用PBS洗3遍后,用500 μL PBS重悬,上机检测。
2.2.7 Western blotting检测水飞蓟宾对荷瘤小鼠肿瘤组织p53和Bcl-2蛋白表达的影响 取各组小鼠肿瘤组织200~300 mg,加入磁珠与1 mL PBS进行组织匀浆,1500 r/min离心5 min,弃上清,加入红细胞裂解液匀浆,于冰上裂解10~15 min,离心后弃上清,用PBS洗涤至无血色并尽量去除上清,加入RIPA强裂解液-磷酸酶抑制剂-蛋白酶抑制剂(100∶10∶1),冰上震荡15 min,13 800 r/min离心15 min,取上清;按“2.2.4”项下方法制备蛋白样品,并进行Western blotting分析。
2.3 统计方法
采用Prism 8.0软件进行统计,所有数据均采用检验或方差分析(ANOVA)进行统计分析。
3 结果
3.1 系统药理学
3.1.1 水飞蓟分子库的构建及有效成分的筛选及活性成分-靶点网络的构建 首先,通过TCMSP数据库筛选出水飞蓟活性成分34个,根据ADME进行筛选,以OB≥30%以及DL≥0.18作为筛选条件,从34个活性成分中筛选得到11个潜在的活性成分;为了使结果更加全面,同时也能弥补理论筛选的不足,将药动学特性低但具有经典药理活性且含量较高的水飞蓟宾保留下来作为有效成分[24]。最后,12个成分作为有效活性成分集合(表1)。研究发现,二氢槲皮素(MOL5,OB=60.5%,DL=0.27)又称紫杉叶素,可以通过OCT4基因抑制肺癌干细胞的增殖与上皮间质转化[25]。槲皮素(MOL1,OB=46.4%,DL=0.28)在120 μmol/L时,能够明显促进人急性淋巴母细胞白血病细胞(MOLT-4)、淋巴瘤细胞(Raji)、小鼠结肠癌细胞(CT-26)、人前列腺癌细胞(LNCaP)等癌细胞的凋亡[26]。在前列腺癌中,水飞蓟宁(MOL9,OB=59.7%,DL=0.76)在60 μmol/L时能够促使前列腺癌细胞阻滞于G1期,即水飞蓟宁能够通过对癌细胞进行周期阻滞从而发挥抗肿瘤作用[27]。上述研究结果均表明水飞蓟具有抑制肿瘤生长、促进肿瘤细胞凋亡的作用,并且为系统药理学方法预测的有效性和合理性提供了数据支撑。
表1 水飞蓟活性成分
Table 1 Active ingredients of S. marianum
MOL ID活性成分类别OB/%DL MOL1槲皮素黄酮类46.40.28 MOL2豆甾醇甾醇类43.80.76 MOL3胆固醇甾醇类37.90.68 MOL4花生四烯酸不饱和脂肪酸类45.60.20 MOL5二氢槲皮素黄酮类60.50.27 MOL6生育酚脂溶性维生素32.30.69 MOL7禾本甾醇甾醇类44.20.75 MOL8水飞蓟宾黄酮类木质素0.90.93 MOL9水飞蓟宁黄酮类木质素59.70.76 MOL10水飞蓟素黄酮类木质素81.80.80 MOL11水飞蓟兰君黄酮类木质素64.10.94 MOL12异水飞蓟素黄酮类木质素30.30.40
接着通过WES和SysDT模型的计算共获得12个成分的941个靶点,将这些靶点映射至比较毒物基因组学数据库(comparative toxicogenomics database,CTD)数据库中,筛选出474个相关靶点,其中355个与癌症相关的靶点。为了使结果更加一目了然,构建了可视化的活性成分-靶点网络(图1)来进一步揭示活性化合物的靶点协同治疗作用。从图中可以发现许多靶点是临床上用于癌症检测与诊断的指标。例如,表皮生长因子受体(epidermal growth factor receptor,EGFR)在食管癌、乳腺癌等不同形式的癌症中高表达,并且其表达与癌症的不良预后呈正相关[28]。TP53作为抑癌基因,在正常细胞中低表达,而在恶性肿瘤中高表达,受多种应激源刺激而激活,从而调控细胞的增殖和衰老、DNA损伤修复及细胞死亡基因的表达[29]。除了上述2个癌症相关靶点,水飞蓟活性成分的很多靶点也是其他肿瘤相关的靶基因。因此,通过预测靶点分析,可以发现水飞蓟具有潜在的抗肿瘤作用。
3.1.2 GO BP富集分析 BP分析可以揭示候选靶点与生物学功能之间的关系,进一步分析靶点间潜在的互作关系。因此,为了探究水飞蓟靶点与肺癌之间的关联性,将所得的候选靶点映射到DAVID数据库中进行了GO富集分析(<0.01)。从图2可以看到,获得了14个与癌症密切相关的BP,其中凋亡过程、正向调节凋亡过程以及细胞增殖的负向调控等过程得到显著富集;而负向调节细胞增殖与正向调节凋亡表明该药物在抑制癌细胞增殖的同时也能够促进肿瘤细胞的凋亡,2个生物学过程形成了良好的协同作用。通过活性成分靶点的GO分析,发现水飞蓟可能是通过参与调控肿瘤细胞的凋亡过程从而发挥抗肿瘤作用。
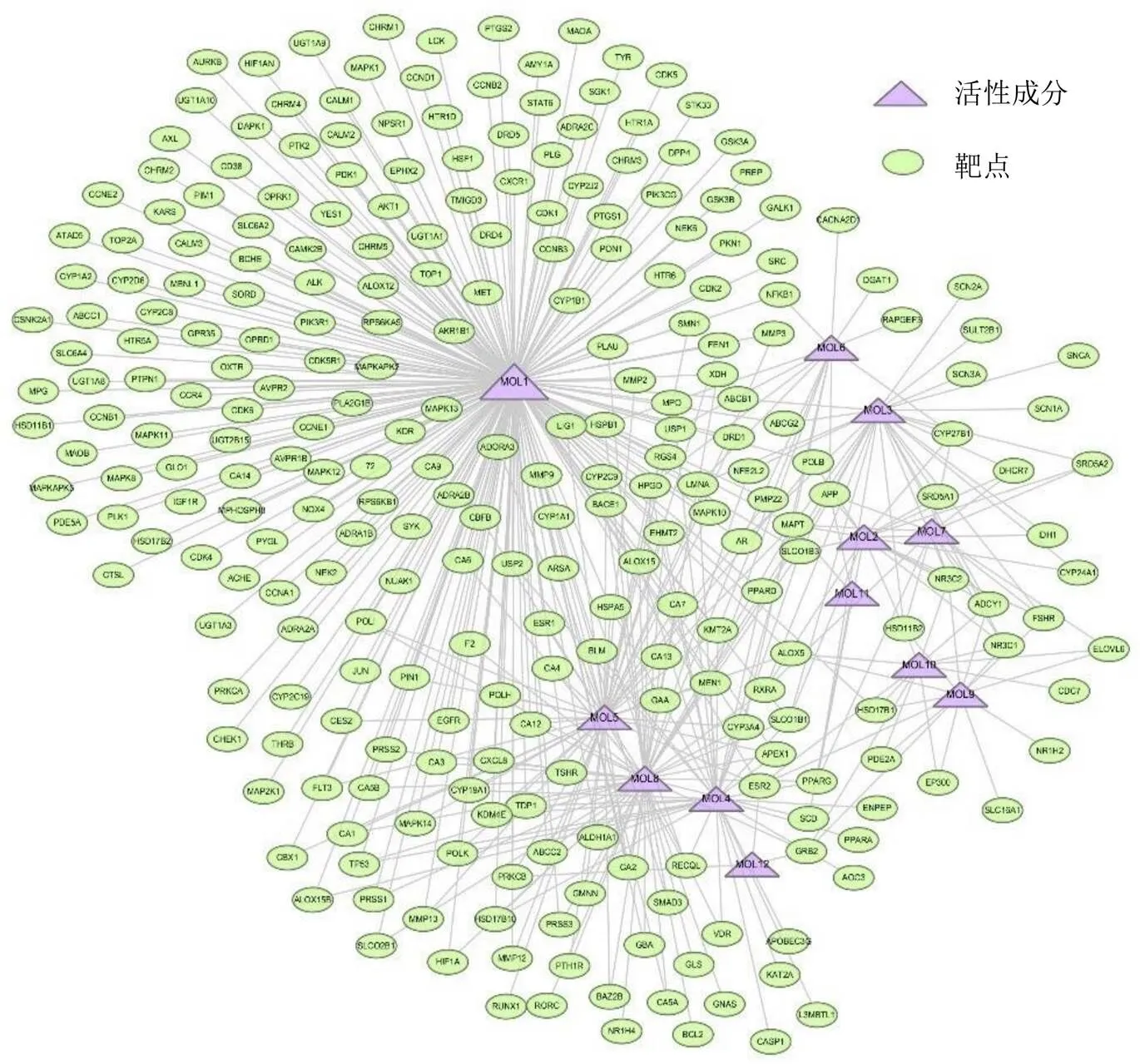
图1 活性成分-靶点网络
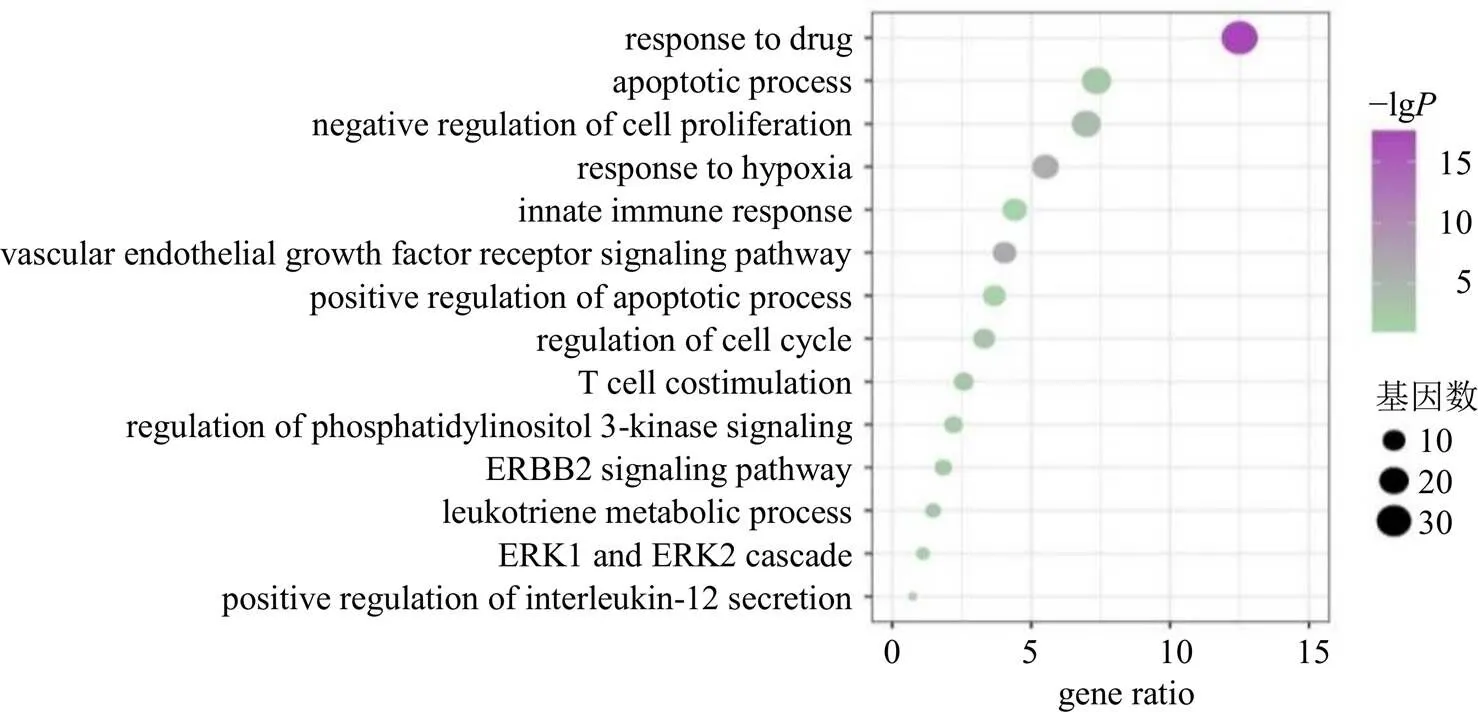
图2 靶点的GO BP富集分析
3.1.3 靶点-通路网络 为了探寻靶点和肺癌治疗相关通路间的互作关系,对水飞蓟的靶点进行了KEGG通路富集分析,将其关键靶点映射到KEGG数据库中,筛选出13条相关通路,并构建了可视化的靶点-通路网络(图3),通路包括癌症相关通路、非小细胞肺癌相关通路、小细胞肺癌通路、病毒致癌性相关通路、癌症中转录调节相关通路、凋亡相关通路、p53信号通路、核因子-κB(nuclear factor-κB,NF-κB)信号通路等。富集结果再次表明水飞蓟具有潜在的抗肿瘤作用,并且从图中可以看到,p53、Bcl-2、EGFR、生长因子受体结合蛋白2(growth factor receptor bound protein 2,GRB2)等绝大多数靶点处于非小细胞肺癌的通路中,其可能是治疗肺癌的关键靶点。上述靶点所映射到的通路有p53信号通路、凋亡通路、缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)信号通路等,这些通路可能是水飞蓟发挥抗肿瘤作用的关键通路。推测水飞蓟可能通过影响细胞的凋亡通路,从而达到抗肿瘤作用。目前已有研究指出,姜黄素[30]、木犀草素[31]、川楝素[32]等能够通过介导p53的变化诱导肿瘤细胞凋亡,从而发挥抗肿瘤作用。Bcl-2家族蛋白在肿瘤细胞凋亡和肿瘤形成中发挥重要作用[33],作为重要的凋亡调控因子,主要通过控制线粒体的完整性调控凋亡,并且在包括肺癌的多种癌症中高表达[34]。因此,推测水飞蓟可能是通过调节p53和Bcl-2的表达促进癌细胞的凋亡,从而发挥抗肿瘤作用。
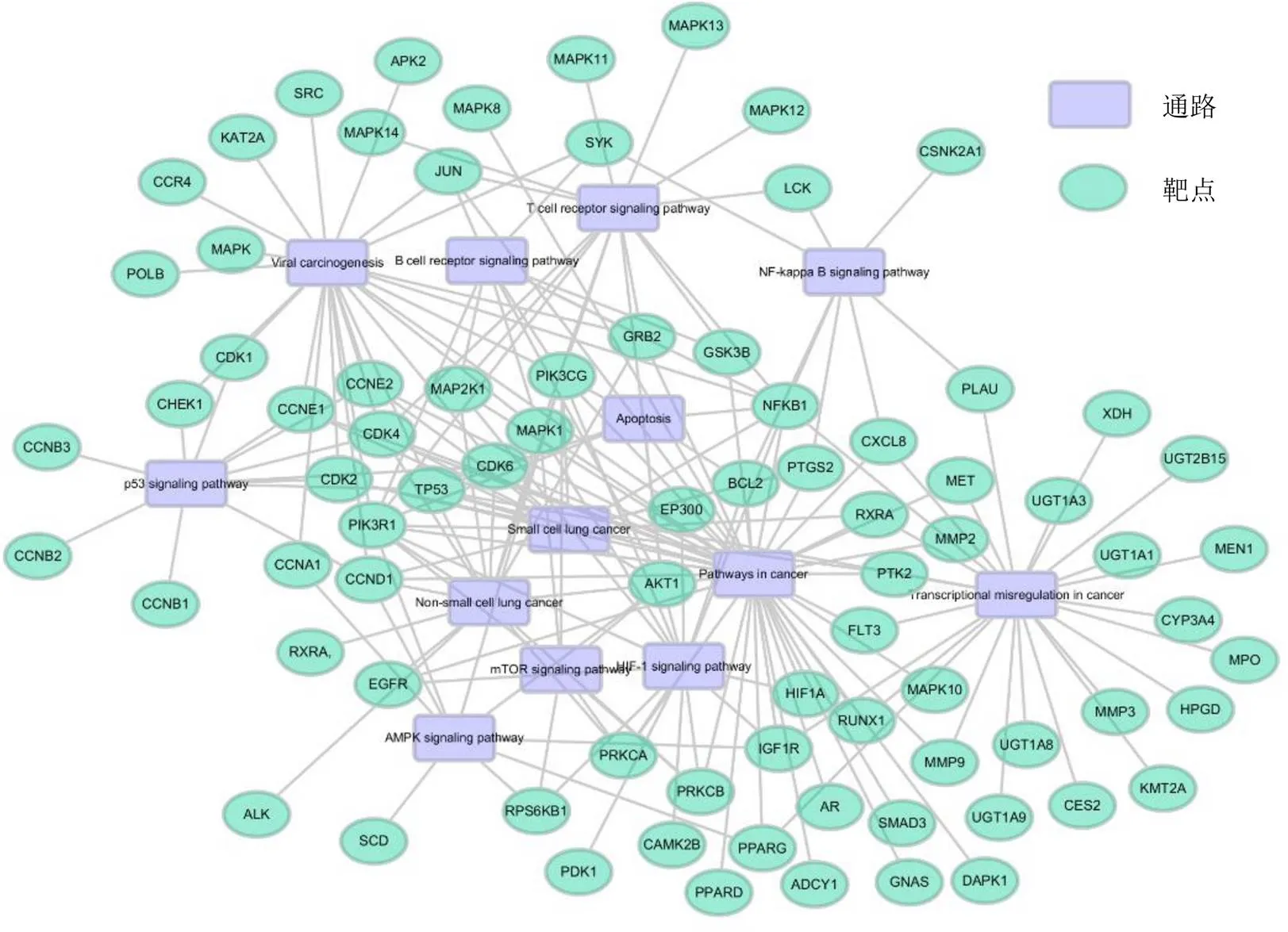
图3 靶点-通路网络图
3.2 实验验证
3.2.1 水飞蓟宾对H1975和LLC细胞存活率的影响 如图4所示,水飞蓟宾对H1975和LLC细胞的抑制作用均呈剂量相关性,即水飞蓟宾在体外能抑制肿瘤细胞的增殖,从而发挥抗肿瘤作用,水飞蓟宾对H1975细胞的半数抑制浓度(half inhibitory concentration,IC50)值为62.58 μmol/L,对LLC细胞的IC50值为61.44 μmol/L。
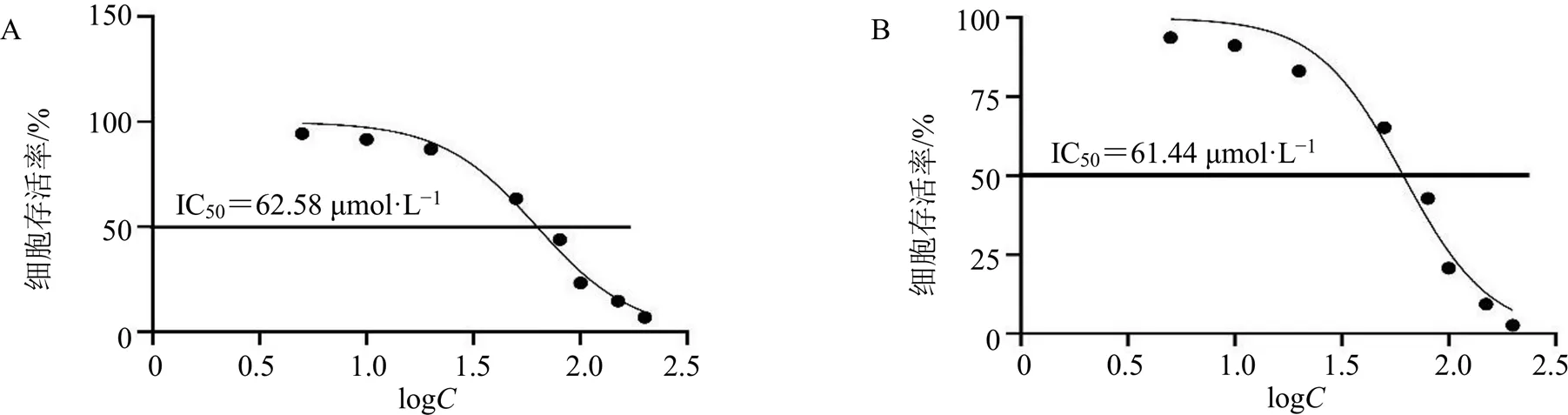
图4 水飞蓟宾对H1975细胞 (A) 和LLC细胞(B) 存活率的影响
3.2.2 凋亡模块验证 凋亡又名细胞程序性死亡,是细胞正常发育、应激和形态改变过程中调控死亡的主要途径[35]。该途径不仅可以清除体内多余的细胞,也能及时发现突变细胞防止其进一步癌变,进而确保机体内细胞数量的平衡与质量的稳定[36]。细胞凋亡也是癌症治疗的关键过程,受许多基因如抑癌基因p53、抗凋亡基因Bcl-2的调控[37]。故推测水飞蓟宾可能是通过促进癌细胞的凋亡从而发挥抗肿瘤作用。结合前期系统药理学靶点预测与富集分析结果,发现Bcl-2、p53等靶点以及凋亡过程、凋亡通路等凋亡相关的靶点、BP及通路得到了显著富集。因此,为了探究水飞蓟宾是否促进肿瘤细胞发生凋亡,采用Annexin V/PI双染对H1975细胞进行流式细胞术分析(图5-A),对照组细胞凋亡率为0,20、50、100 μmol/L的水飞蓟宾组细胞凋亡率分别为4.24%、10.2%和25.4%,表明水飞蓟宾能够促进肿瘤细胞的凋亡,且呈剂量相关性。如图5-B所示,与对照组比较,各给药组细胞p53蛋白表达水平显著升高(<0.001),Bcl-2蛋白表达水平显著降低(<0.05、0.001),表明水飞蓟宾能够通过调控p53和Bcl-2的表达进而诱导肿瘤细胞凋亡,从而抑制肿瘤细胞的生长和转移,与前期预测结果一致,也表明系统网络药理学预测的准确性与可靠性。

与对照组比较:*P<0.05 ***P<0.001,下图同
3.2.3 水飞蓟体内抗肿瘤作用 研究显示,CD8+T细胞在抗肿瘤免疫中发挥极大的作用,当T细胞被激活后,能够识别位于I类组织相容性复合体上的肿瘤相关抗原[38],主要通过2种方式诱导癌细胞凋亡:一种是通过分泌一些细胞因子(如穿孔素和颗粒酶)而促进癌细胞凋亡;另一种则通过死亡配体(如Fas配体或TNF相关凋亡配体)与死亡受体的结合而诱导癌细胞凋亡[39]。另外有研究表明,肿瘤内CD8+T细胞的浸润量与患者预后有着密不可分的关系,浸润量越高,预后效果越好[40]。为了探究水飞蓟宾的体内抗肿瘤作用,使用C57BL/6小鼠进行了LLC异种移植实验,给药20 d后,肿瘤体积(图6-A)和肿瘤质量(图6-B)显著降低,表明水飞蓟宾具有明显的抗肿瘤作用。如图6-C所示,与对照组比较,各给药组肿瘤组织p53和Bcl-2蛋白表达变化与体外实验中变化趋势一致。如图6-D所示,水飞蓟宾组肿瘤内CD8+T细胞的浸润量(9.78%)高于对照组肿瘤内CD8+T细胞的浸润量(5.27%)。综上所述,水飞蓟宾能够通过增加肿瘤内CD8+T细胞的浸润量从而促进癌细胞的凋亡而发挥抗肿瘤作用。
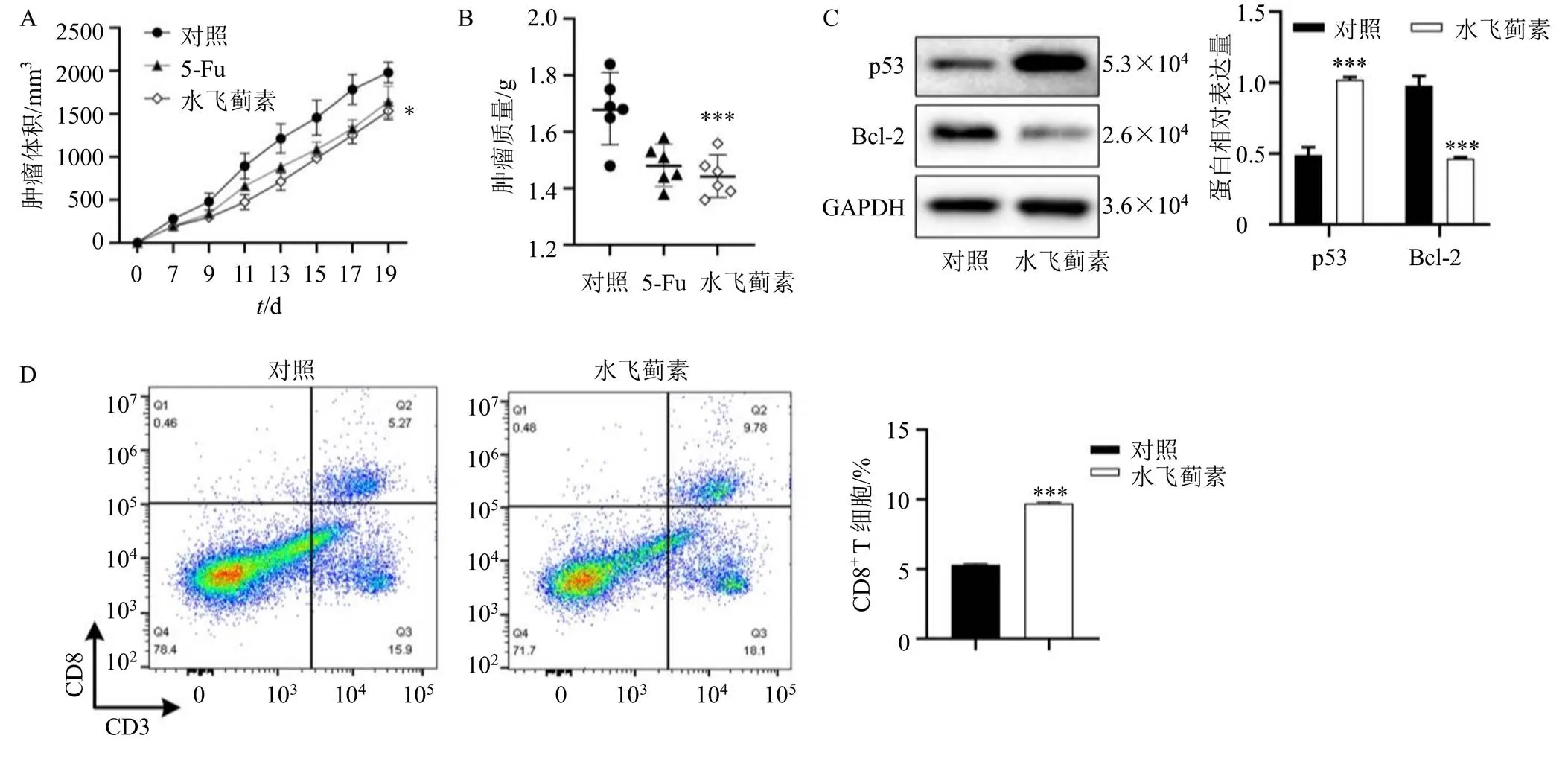
图6 水飞蓟素对荷瘤小鼠肿瘤体积 (A)、肿瘤质量 (B) 以及肿瘤组织p53、Bcl-2蛋白表达(C) 和CD8+ T细胞含量(D) 的影响(, n = 2)
4 讨论
近年来,肺癌已逐渐变成全球癌症相关死亡的最常见原因,占全球所有癌症死亡人数的18.4%[41]。由于癌症的复杂性及难治性,使得中药在发挥抗肿瘤作用的方面受到了广泛的关注与研究,高效低毒的特性使之极具研究与开发的潜力。
本研究通过建立水飞蓟活性成分-靶点、靶点相应的生物功能和通路网络探讨水飞蓟治疗肺癌的作用机制。首先,利用TCMSP数据库构建了含有34个活性成分的水飞蓟分子数据库,从数据库中通过OB、DL 2个参数进一步筛选得到12个活性成分,并构建了活性成分-靶点网络图;接着通过WES与SysDT模型预测得到12个活性成分与癌症相关的355个靶点,并通过GO BP与KEGG通路富集分析得到14个BP条目与13条相关通路,其中正向调控凋亡过程、p53信号通路、凋亡通路、T细胞受体信号通路说明水飞蓟可能是通过激活CD8+T细胞并促进癌细胞凋亡而发挥抗肿瘤作用。研究表明,CD8+T细胞抗肿瘤的主要作用机制是通过穿孔素/颗粒酶介导的死亡受体结合的杀伤和诱导癌细胞凋亡[42]。
整合实验结果发现,在体外实验中,水飞蓟宾能够抑制肺癌细胞H1975与LLC的增殖作用,并且能够促进肿瘤细胞的凋亡作用,同时也能够上调抑癌基因p53的表达,并且抑制Bcl-2的表达而发挥抗肿瘤作用。在体内实验中,水飞蓟宾能增加荷瘤小鼠肿瘤内CD8+T细胞浸润量,并且肿瘤组织p53与Bcl-2表达的变化与细胞水平一致,这表明水飞蓟宾是通过激活T细胞并促进肿瘤细胞的凋亡进而达到抗肿瘤作用[1]。
综上所述,本研究提供了一种基于系统药理学从分子、网络、通路等层面的来分析水飞蓟治疗肺癌的新方法,也解析了中药的多成分、多靶点、多通路协同治疗肺癌的机制,并进行了数据可视化分析,使得中药的复杂成分变得更加清晰明了。本研究表明水飞蓟宾主要通过促进癌细胞的凋亡而发挥抗肿瘤作用,证实了通过系统药理学所分析的相关靶点与通路的可靠性,并为深入探讨其作用机制奠定了坚实的理论基础,故今后可从凋亡途径入手,去探寻新的抗肿瘤药物或靶点从而更好地协助临床治疗。
利益冲突 所有作者均声明不存在利益冲突
[1] Schabath M B, Cote M L. Cancer progress and priorities: Lung cancer [J]., 2019, 28(10): 1563-1579.
[2] Cao W, Chen H D, Yu Y W,. Changing profiles of cancer burden worldwide and in China: A secondary analysis of the global cancer statistics 2020 [J]., 2021, 134(7): 783-791.
[3] Dela Cruz C S, Tanoue L T, Matthay R A. Lung cancer: Epidemiology, etiology, and prevention [J]., 2011, 32(4): 605-644.
[4] Goodspeed A, Jean A, Costello J C. A whole-genome CRISPR screen identifies a role of MSH2in cisplatin-mediated cell death in muscle-invasive bladder cancer [J]., 2019, 75(2): 242-250.
[5] Arbour K C, Riely G J. Systemic therapy for locally advanced and metastatic non-small cell lung cancer: A review [J]., 2019, 322(8): 764-774.
[6] Deng G D, Liang N, Xie J,. Pulmonary toxicity generated from radiotherapeutic treatment of thoracic malignancies [J]., 2017, 14(1): 501-511.
[7] Martínez-López J, Mateos M V, Encinas C,. Multiple myeloma and SARS-CoV-2 infection: Clinical characteristics and prognostic factors of inpatient mortality [J]., 2020, 10(10): 103.
[8] Abenavoli L, Izzo A A, Milić N,. Milk thistle (): A concise overview on its chemistry, pharmacological, and nutraceutical uses in liver diseases [J]., 2018, 32(11): 2202-2213.
[9] Federico A, Dallio M, Loguercio C. Silymarin/silybin and chronic liver disease: A marriage of many years [J]., 2017, 22(2): 191.
[10] Kroll D J, Shaw H S, Oberlies N H. Milk thistle nomenclature: Why it matters in cancer research and pharmacokinetic studies [J]., 2007, 6(2): 110-119.
[11] Yang G, Zhao Y P, Zhang Y T,. Enhanced oral bioavailability of silymarin using liposomes containing a bile salt: Preparation by supercritical fluid technology and evaluationand[J]., 2015, 10: 6633-6644.
[12] Esselun C, Bruns B, Hagl S,. Differential effects of silibinin A on mitochondrial function in neuronal PC12 and HepG2 liver cells [J]., 2019, 2019: 1652609.
[13] 张志鹏, 孟艳秋, 王趱. 水飞蓟宾及其衍生物生物活性及作用机制的研究进展[J]. 中草药, 2021, 52(12): 3717-3724.
[14] Prasad R R, Paudel S, Raina K,. Silibinin and non-melanoma skin cancers [J]., 2020, 10(3): 236-244.
[15] Bijak M. Flavonolignans-compounds not only for liver treatment [J]., 2017, 42(247): 34-37.
[16] Zheng C L, Guo Z H, Huang C,. Large-scale direct targeting for drug repositioning and discovery [J]., 2015, 5: 11970.
[17] Ru J L, Li P, Wang J N,. TCMSP: A database of systems pharmacology for drug discovery from herbal medicines [J]., 2014, 6: 13.
[18] 黄超. 药物口服生物利用度预测及在中药归经研究上的应用 [D]. 咸阳: 西北农林科技大学, 2015.
[19] 田盛, 李有勇, 侯廷军. 中草药化合物类药性的理论研究[A] // 中国化学会第28届学术年会第14分会场摘要集[C]. 成都: 中国化学会, 2012: 27.
[20] 郑春丽. 基于靶点网络的中药复方协同整合作用机制研究 [D]. 咸阳: 西北农林科技大学, 2017.
[21] Yu H, Chen J X, Xu X,. A systematic prediction of multiple drug-target interactions from chemical, genomic, and pharmacological data [J]., 2012, 7(5): e37608.
[22] Huang D W, Sherman B T, Tan Q N,. DAVID bioinformatics resources: Expanded annotation database and novel algorithms to better extract biology from large gene lists [J]., 2007, 35: W169-W175.
[23] Lopes C T, Franz M, Kazi F,. Cytoscape Web: An interactive web-based network browser [J]., 2010, 26(18): 2347-2348.
[24] Bijak M. Silybin, a major bioactive component of milk thistle (L. Gaernt.)-chemistry, bioavailability, and metabolism [J]., 2017, 22(11): 1942.
[25] Wang R H, Zhu X J, Wang Q,. The anti-tumor effect of taxifolin on lung cancer via suppressing stemness and epithelial-mesenchymal transitionand oncogenesis in nude mice [J]., 2020, 8(9): 590.
[26] Hashemzaei M, Delarami Far A, Yari A,. Anticancer and apoptosis‑inducing effects of quercetinand[J]., 2017, 38(2): 819-828.
[27] Deep G, Oberlies N H, Kroll D J,. Identifying the differential effects of silymarin constituents on cell growth and cell cycle regulatory molecules in human prostate cancer cells [J]., 2008, 123(1): 41-50.
[28] Talukdar S, Emdad L, Das S K,. EGFR: An essential receptor tyrosine kinase-regulator of cancer stem cells [J]., 2020, 147: 161-188.
[29] Lacroix M, Riscal R, Arena G,. Metabolic functions of the tumor suppressor p53: Implications in normal physiology, metabolic disorders, and cancer [J]., 2020, 33: 2-22.
[30] He Y C, He L, Khoshaba R,. Curcumin nicotinate selectively induces cancer cell apoptosis and cycle arrest through a P53-mediated mechanism [J], 2019, 24(22): 4179.
[31] Lin Y, Shi R X, Wang X,. Luteolin, a flavonoid with potential for cancer prevention and therapy [J]., 2008, 8(7): 634-646.
[32] Zhang S, Cao L, Wang Z R,. Anti-cancer effect of toosendanin and its underlying mechanisms [J]., 2019, 21(3): 270-283.
[33] Kontos C, Christodoulou M I, Scorilas A. Apoptosis-related BCL2-family members: Key players in chemotherapy [J]., 2014, 14(3): 353-374.
[34] Onel B, Carver M, Wu G H,. A new G-quadruplex with hairpin loop immediately upstream of the human BCL2 P1 promoter modulates transcription [J]., 2016, 138(8): 2563-2570.
[35] Xu X B, Lai Y Y, Hua Z C. Apoptosis and apoptotic body: Disease message and therapeutic target potentials [J]., 2019, 39(1): BSR20180992.
[36] Zehra B, Ahmed A, Sarwar R,. Apoptotic and antimetastatic activities of betulin isolated fromagainst non-small cell lung cancer cells [J]., 2019, 11: 1667-1683.
[37] Koch R, Christie A L, Crombie J L,. Biomarker-driven strategy for MCL1 inhibition in T-cell lymphomas [J]., 2019, 133(6): 566-575.
[38] Fu C M, Jiang A M. Dendritic cells and CD8 T cell immunity in tumor microenvironment [J]., 2018, 9: 3059.
[39] Nguyen A, Ramesh A, Kumar S,. Granzyme B nanoreporter for early monitoring of tumor response to immunotherapy [J]., 2020, 6(40): eabc2777.
[40] Reiser J, Banerjee A. Effector, memory, and dysfunctional CD8(+) T cell fates in the antitumor immune response [J]., 2016, 2016: 8941260.
[41] Si X Y, Wang J W, Cheng Y,. A phase III, randomized, double-blind, controlled trial of carboxyamidotriazole plus chemotherapy for the treatment of advanced non-small cell lung cancer [J]., 2020, 12: 175883592096584.
[42] Costantini A, Julie C, Dumenil C,. Predictive role of plasmatic biomarkers in advanced non-small cell lung cancer treated by nivolumab [J], 2018, 7(8): e1452581.
Mechanisms ofon lung cancer based on system-pharmacology dissection
ZHANG Yu-ru1, TIAN Xu-ping1, XIAO Wei2, WANG Yong-hua1
1. Key Laboratory of Xinjiang Phytomedicine Resource and Utilization, Ministry of Education, Shihezi University, Shihezi 832002, China 2. Jiangsu Kanion Pharmaceutical Co., Ltd., Lianyungang 222000, China
To study the effect and mechanism ofon lung cancer.Candidate active ingredients ofwere screened out by traditional Chinese medicine systems pharmacology (TCMSP), targets were baited through weighted ensemble similarity (WES) and systematic drug targeting (SysDT) models; Gene ontology biological process (GOBP) and Kyoto encyclopedia of genes and genomes (KEGG) pathways of obtained targets were then top enriched. Silybin, the main active compound of, was selected to testandexperiments. Firstly, inhibitory rate of silybin on human lung adenocarcinoma cell (H1975) and mouse lung cancer cell (LLC)was verified; Secondly, apoptosis of silybin was evaluated by flow cytometry; Tumor inhibitionwas validated in non-small cell lung cancer mouse model, infiltration of cytotoxic T cell (CD8+T) cells in tumor was detected; Finally, expressions of apoptosis-related proteins in tumor cells and tissues were verified by Western blotting.Twelve candidate active compounds and 355 targets were obtained, and compound-target network was constructed. The results of CCK-8 showed that silybin inhibited lung cancer cells in a dose-dependent manner, the data of flow cytometryandshowed that silybin could promote the apoptosis of cancer cells by promoting the infiltration of CD8+T cells in tumor cells; Silybin up-regulated p53 protein expression level in tumor cells and tumor tissues (< 0.001), and down-regulated B-cell lymphoma 2 (Bcl-2) protein expression level (< 0.05, 0.001).mainly exerts anti-tumor effects through regulating apoptosis-related pathways.
(L.) Gaertn.; silybin; lung cancer; systemic pharmacology; apoptosis; CD8+T cells
R285.5
A
0253 - 2670(2022)11 - 3357 - 10
10.7501/j.issn.0253-2670.2022.11.011
2022-02-15
国家自然科学基金资助项目(U1603285)
张玉如,女,硕士研究生,研究方向为药理学。E-mail: 641556987@qq.com
王永华,男,博士,教授,博士生导师,研究方向为中西医结合治疗肿瘤的基础研究。E-mail: dcpwyh@163.com
肖 伟,男,博士,教授,博士生导师,中国工程院院士,研究方向为中药药理与临床。E-mail: xw_kanion@163.com
[责任编辑 李亚楠]
