黄连解毒汤物质基准量值传递分析
2022-05-31李军鸽王永春孟珈同邱智东唐秋竹
李军鸽,赵 莹,王永春,孟珈同,邱智东,唐秋竹
黄连解毒汤物质基准量值传递分析
李军鸽,赵 莹,王永春,孟珈同,邱智东,唐秋竹*
长春中医药大学,吉林 长春 130117
阐明黄连解毒汤(Huanglian Jiedu Decoction,HJD)物质基准的关键质量属性,建立HJD物质基准指纹图谱并测定其中盐酸黄连碱、表小檗碱、盐酸巴马汀、盐酸小檗碱、盐酸药根碱、盐酸黄柏碱、黄芩苷、栀子苷含量及其转移率,为后期HJD的复方制剂研究奠定基础。按古代工艺制备15批物质基准,测定出膏率,建立物质基准的HPLC指纹图谱并进行相似度评价,确定共有峰,同法测定物质基准中8种成分的含量,进行饮片到物质基准量值传递分析。15批HJD物质基准平均出膏率为16.02%,指纹图谱共有18个共有峰,与对照指纹图谱的相似度均大于0.9;指认出8个色谱峰分别为盐酸黄连碱、表小檗碱、盐酸巴马汀、盐酸小檗碱、盐酸药根碱、盐酸黄柏碱、黄芩苷、栀子苷。各指标成分从饮片到物质基准的转移率分别为盐酸黄连碱0.61%~1.08%,表小檗碱0.14%~0.24%,盐酸巴马汀0.93%~1.52%,盐酸小檗碱4.09%~6.36%,盐酸药根碱0.81%~1.07%,盐酸黄柏碱0.78%~1.06%,黄芩苷7.45%~12.26%,栀子苷0.42%~2.82%。指纹图谱结合出膏率和多指标成分含量测定对HJD物质基准进行量值传递研究,为HJD物质基准的质量控制及复方制剂的开发提供科学依据。
黄连解毒汤;物质基准;指纹图谱;盐酸黄连碱;表小檗碱;盐酸巴马汀;盐酸小檗碱;盐酸药根碱;盐酸黄柏碱;黄芩苷;栀子苷;量值传递
黄连解毒汤(Huanglian Jiedu Decoction,HJD)是清热解毒的经典名方,主治三焦实热火毒证[1-2]。最早记载于东晋葛洪撰写的《肘后备急方》,后由唐代王焘在《外台秘要》中命名为黄连解毒汤[3-4],原文“黄连三两,黄芩,黄柏各二两,栀子十四枚擘,以水六升,煮取二升,分二服”。该方配伍精炼,四药均为清热解毒之要药,合用后苦寒直折。黄连清泻心火,为君药,黄芩清肺热,泻上焦之火,为臣药。黄柏泻下焦之火,栀子清泻三焦之火。HJD临床疗效显著,一直受历代医家广泛应用。现代研究报道,HJD主要含生物碱类和黄酮类化学成分[5],具有抗炎、抑菌、保护心血管、降血糖、免疫调节等作用[6-10]。目前,关于HJD质量控制研究和物质基准量值传递研究的文献报道极少,本研究经查阅文献对原文信息进行考证,通过确定遵古制备工艺的基础上,通过随机数表法组合制备15批HJD物质基准,并对其进行指纹图谱研究,结合表小檗碱、盐酸药根碱、盐酸黄连碱、盐酸小檗碱、盐酸黄柏碱、盐酸巴马汀、栀子苷、黄芩苷8种指标成分含量转移率范围,出膏率范围,进行饮片-物质基准的量值传递分析及整体质量研究。为HJD质量控制和制剂开发提供科学依据。
1 仪器与材料
1.1 仪器
LC2030型高效液相色谱仪,日本岛津公司;2-4 LS-Cplus型真空冷冻干燥机,德国Epsilon公司;KQ-250B型超声波清洗机,昆山市超声仪器有限公司;XS105DU十万分之一电子天平、德国ME204E万分之一电子天平,德国梅特勒-托利多公司;陶瓷煎药壶,潮州市潮安区龙湖镇神养电器厂。
1.2 试药与药材饮片
对照品盐酸小檗碱(批号111638-201907,质量分数85.9%)、盐酸黄连碱(批号112026-201802,质量分数94.0%)、盐酸巴马汀(批号110723- 201913,质量分数85.7%)、盐酸药根碱(批号110733-201609,质量分数93.5%)、盐酸黄柏碱(批号111895-201805,质量分数94.9%)、栀子苷(批号110749-201919,质量分数97.1%)、黄芩苷(批号110715-201318,质量分数93.3%),以上对照品均购于中国食品药品检定研究院;对照品表小檗碱,批号B20108,质量分数≥98%,购于源叶生物技术有限公司;甲醇,美国Fisher公司,色谱纯;水为超纯水;其他试剂均为分析纯。15批黄连、黄芩、黄柏和栀子饮片均购于吉林省北药药材加工有限公司,由长春中医药大学药学院中药鉴定与炮制教研室主任翁丽丽教授鉴定,黄连为毛茛科黄连属植物黄连Franch.的干燥根茎,黄芩为唇形科黄芩属植物黄芩Georgi的干燥根,黄柏为芸香科黄檗属植物黄皮树Schneid的干燥树皮,栀子为茜草科栀子属植物枙子Ellis的干燥果实种子[11]。HJD中各饮片信息和物质基准(S1~S15)组合信息见表1。
2 方法与结果
2.1 HJD物质基准制备
《外台秘要》记载“黄连三两,黄芩,黄柏各二两,栀子十四枚擘,以水六升,煮取二升,分二服”。唐代“一两”折合现代13.8 g,唐代“一升”折合现代200 mL[12-14],故折算后取黄连41.4 g,黄芩27.6 g,黄柏27.6 g,栀子15 g,加水1200 mL,武火(2200 W)加热至沸腾,后文火(800 W)煎煮40 min,立即用2层200目纱布趁热滤过,得药液400 mL,冷冻干燥72 h,得HJD物质基准冻干粉,按表1饮片对应制备15批HJD物质基准冻干粉(S1~S15)。同法制备各单味药饮片的单煎液冻干粉及缺黄连处方、缺黄芩处方、缺黄柏处方、缺栀子处方药材饮片的黄连阴性、黄芩阴性、黄柏阴性、栀子阴性溶液冻干粉。
2.2 HJD物质基准指纹图谱的建立
2.2.1 混合对照品溶液的制备 精密称取表小檗碱、盐酸药根碱、盐酸黄连碱、盐酸小檗碱、盐酸黄柏碱、盐酸巴马汀、栀子苷、黄芩苷对照品适量,加甲醇溶解制成质量浓度分别为1.9、9.8、11.3、11.2、15.5、14.7、19.3、19.9 μg/mL的混合对照品溶液。
2.2.2 供试品溶液的制备 精密称取冻干粉0.2 g,精密加甲醇50 mL,称定质量,超声处理30 min(250 W功率、70 Hz频率),称定质量,用甲醇补足减失的质量,滤纸滤过,取续滤液1 mL,加甲醇定容于10 mL量瓶中,摇匀,即得供试品溶液。
2.2.3 色谱条件 色谱柱为Sepax Bio-C18柱(250 mm×4.6 mm,5 μm),以0.05%磷酸水溶液-甲醇为流动相,梯度洗脱:0~25 min,20%~45%甲醇;25~50 min,45%~60%甲醇;50~70 min,60%~80%甲醇;70~71 min,80%~20%甲醇;71~85 min,20%甲醇;检测波长为238 nm;柱温为35 ℃;体积流量为0.6 mL/min;混合对照品溶液和供试品溶液进样量均为5 μL。理论塔板数()以保留时间(R)和峰宽()按=16(R/)2计算,各共有峰均不低于5000。
表1 HJD中各饮片来源信息及物质基准组合
Table 1 Source information and material benchmark combination table in HJD
编号黄连黄芩黄柏栀子 批号产地批号产地批号产地批号产地 S120210724四川乐山20200715河北承德20210427四川雅安20200915四川宜宾 S220200523重庆奉节20210507河北丰宁20201023四川沐川20201107四川广元 S320210614湖北利川20210628四川崇州20200905重庆奉节20201027河南南阳 S420210415重庆开县20210413山东临沂20210613湖南隆回20210423四川乐山 S520200718湖北来凤20201003河南卢氏20210405重庆南川20200817广西九江 S620210527陕西安康20200916陕西合阳20201103甘肃康县20210526福建宁德 S720200513四川峨眉20200825甘肃武山20210329湖北荆州20210407江西樟树 S820200803四川大邑20210524山西夏县20200804四川达州20210321福建福鼎 S920210705四川崇州20200926山西运城20210307吉林通化20200715重庆江津 S1020210511四川洪雅20201005四川乐山20200712内蒙古赤峰20201115内蒙古赤峰 S1120210417重庆开县20200829四川崇州20210322吉林白山20200521内蒙古赤峰 S1220210507四川洪雅20201005山西运城20200806四川沐川20200724四川广元 S1320200913四川大邑20200120甘肃武山20200506内蒙古赤峰20201009四川乐山 S1420210512四川崇州20201111山东临沂20201011四川达州20200921河南南阳 S1520200403重庆奉节20200725河北承德20200513四川雅安20201121四川宜宾
2.2.4 精密度试验 取编号S1物质基准样品,按“2.2.2”项下制备供试品溶液,按“2.2.3”项色谱条件连续测定6次,以盐酸小檗碱为参照(s),计算各共有峰的相对保留时间和相对峰面积。结果18个共有峰相对保留时间的RSD为0.05%~0.19%,相对峰面积的RSD为0.21%~2.07%,结果表明该方法精密度良好。
2.2.5 稳定性试验 取S1物质基准样品按“2.2.2”项下制备供试品溶液,按“2.2.3”项色谱条件分别于0、2、4、8、12、24 h进样测定,以盐酸小檗碱为参照(s),计算各共有峰的相对保留时间和相对峰面积。结果,18个共有峰相对保留时间的RSD为0.45%~0.58%,相对峰面积的RSD为1.17%~2.29%,表明供试品溶液在24 h内稳定性良好。
2.2.6 重复性试验 取S1物质基准样品按“2.2.2”项下制备供试品溶液,共6份,按“2.2.3”项下色谱条件进样测定,以盐酸小檗碱为参照(s),计算各共有峰的相对保留时间和相对峰面积。结果,18个共有峰相对保留时间的RSD为0.12%~1.26%,相对峰面积的RSD为0.95%~1.78%,表明该方法重复性良好。
2.2.7 指纹图谱的测定及饮片-物质基准指纹图谱的量值传递关系研究 取15批HJD物质基准样品(S1~S15)的供试品溶液,采用《中药色谱指纹图谱相似度评价系统(2012版)》软件,以S1为对照,生成HPLC叠加指纹图谱和对照指纹图谱,见图1。相似度结果为0.976~0.999,见表2,符合指纹图谱要求。15批HJD物质基准样品共有18个共有峰,与单味药饮片及其阴性比对见图2,其中峰1(黄柏碱)为黄柏专属峰;峰2、4(栀子苷)为栀子专属峰;3、5、6、12(盐酸小檗碱)为黄连和黄柏共有峰;峰7、9(表小檗碱)、10(盐酸黄连碱)、11(盐酸药根碱)、13(盐酸巴马汀)为黄连专属峰;峰8、峰14(黄芩苷)、15~18为黄芩专属峰。比较15批物质基准与其各单味药共有峰峰面积的均值,见表3,其中峰3、5、6、12单味药和物质基准的相对峰面积为黄连和黄柏2味药峰面积和。结果表明各单味药中共有峰与物质基准中对应共有峰峰面积虽存在差异,但是各单味药饮片主要物质群均完整传递到物质基准。说明HJD物质基准制备工艺未造成饮片主要物质群丢失。可见HJD物质基准主要成分从饮片-物质基准形成较为完整的传递,且归属关系清晰[15]。

图1 15批HJD物质基准的HPLC叠加指纹图谱和对照指纹图谱(R)
表2 HJD物质基准的相似度评价结果
Table 2 Similarity evaluation results of HJD material benchmark
样品相似度 S1S2S3S4S5S6S7S8S9S10S11S12S13S14S15R S11.0000.9940.9990.9940.9950.9840.9920.9810.9940.9960.9960.9960.9980.9990.9910.998 S20.9941.0000.9940.9970.9970.9720.9860.9690.9830.9840.9850.9870.9910.9940.9760.992 S30.9990.9941.0000.9950.9950.9850.9940.9810.9930.9960.9950.9970.9980.9990.9920.999 S40.9940.9970.9951.0000.9990.9760.9900.9660.9800.9860.9860.9900.9890.9940.9780.992 S50.9950.9970.9950.9991.0000.9780.9920.9680.9820.9880.9880.9920.9890.9950.9800.994 S60.9840.9720.9850.9760.9781.0000.9950.9930.9810.9910.9900.9920.9860.9870.9890.991 S70.9920.9860.9940.9900.9920.9951.0000.9870.9830.9930.9920.9970.9900.9930.9890.996 S80.9810.9690.9810.9660.9680.9930.9871.0000.9840.9850.9880.9850.9850.9810.9850.987 S90.9940.9830.9930.980.9820.9810.9830.9841.0000.9950.9970.9910.9970.9930.9940.994 S100.9960.9840.9960.9860.9880.9910.9930.9850.9951.0000.9990.9990.9980.9970.9990.998 S110.9960.9850.9950.9860.9880.9900.9920.9880.9970.9991.0000.9980.9970.9960.9970.998 S120.9960.9870.9970.9900.9920.9920.9970.9850.9910.9990.9981.0000.9960.9980.9960.999 S130.9980.9910.9980.9890.9890.9860.9900.9850.9970.9980.9970.9961.0000.9980.9950.998 S140.9990.9940.9990.9940.9950.9870.9930.9810.9930.9970.9960.9980.9981.0000.9930.999 S150.9910.9760.9920.9780.9800.9890.9890.9850.9940.9990.9970.9960.9950.9931.0000.995 R0.9980.9920.9990.9920.9940.9910.9960.9870.9940.9980.9980.9990.9980.9990.9951.000
2.3 15批HJD物质基准出膏率及出膏转移率考察
15批HJD物质基准冻干后记录质量,计算实际出膏率。取15批处方量的黄连、黄芩、黄柏、栀子饮片,按“2.1”项下方法分别制备15批HJD各单味饮片水煎液,冻干,记录质量。
实际出膏率=/
为冻干后质量,为各饮片取样量
方中黄连为41.40 g,黄芩为27.60 g,黄柏为27.60 g,栀子为15.00 g,全方共111.60 g。全方的理论出膏率应为各单味药折算[16],即理论出膏率=0.37×对应批次黄连饮片的出膏率+0.25×对应批次黄芩饮片的出膏率+0.25×对应批次黄柏饮片的出膏率+0.13×对应批次栀子饮片的出膏率。
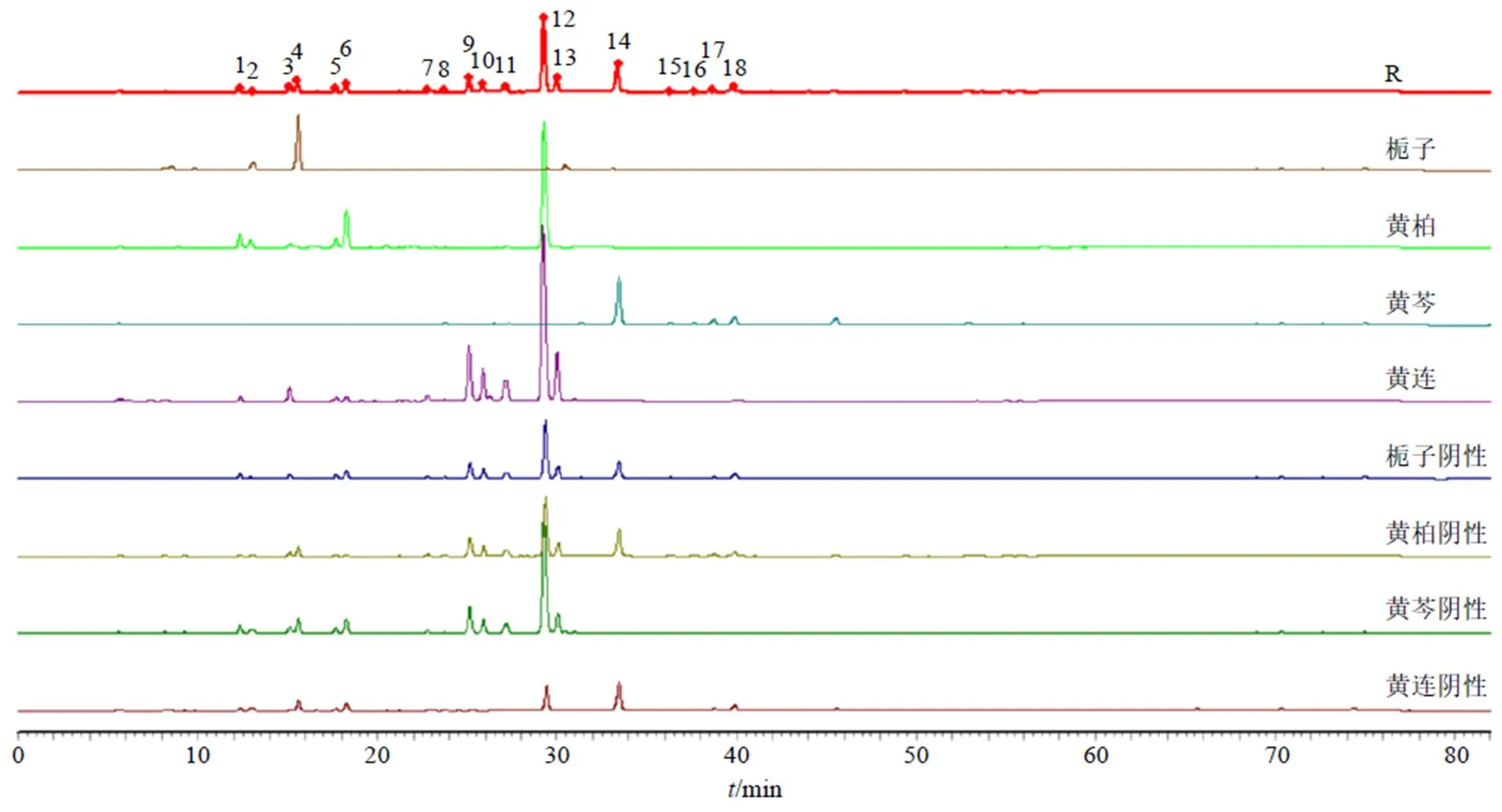
图2 各味药材饮片及阴性与物质基准对照图谱比较
表3 HJD物质基准与各药饮片中特征峰峰面积比值
Table 3 HJD material benchmark and each pill characteristic absorption band area ratio
峰号峰面积相对峰面积 黄连黄芩黄柏栀子物质基准各单味药材物质基准 1−−250 994−61 8200.110.22 2−−−172 80042 3900.180.19 3237 518−88 833−60 9760.050.05 4−−−951 243219 7721.001.00 583 181−163 421−55 8030.040.05 680 486−628 574−111 3400.120.10 798 033−−−42 1520.270.04 8−43 420−−44 9480.050.06 9951 202−−−283 6870.260.24 10539 067−−−156 8520.150.13 11512 156−−−165 5210.140.14 123 625 620−2 330 254−1 166 4191.001.00 13828 762−−−222 7810.230.19 14−941 975−−695 4771.001.00 15−45 369−−38 4540.050.06 16−34 205−−26 0120.040.04 17−104 891−−63 8400.110.09 18−202 736−−116 6220.220.17
出膏转移率=实际出膏率/理论出膏率
结果见表4,计算得到15批HJD物质基准出膏率为15.32%~17.01%,平均出膏率为16.02%,各批次出膏率都处于均值的70%~130%,整体理论出膏率高于实际出膏率,平均出膏率转移率为75.77%。
表4 HJD单味药和物质基准出膏率及转移率结果
Table 4 Results of benchmark paste yield rate and transfer rate of HJD
物质基准出膏率%转移率/%物质基准出膏率%转移率/% 黄连黄芩黄柏栀子理论实际黄连黄芩黄柏栀子理论实际 S129.4320.5716.687.7821.2116.2676.65S928.6018.7717.868.2820.8215.4874.37 S229.9619.4316.047.6620.9515.9476.09S1029.4019.8816.647.7621.0215.3272.88 S328.8521.0716.777.9521.1715.6874.07S1127.1520.5718.687.9820.9016.0576.81 S429.0520.5719.8210.3522.1917.0176.65S1229.9419.8518.087.5521.5415.6472.60 S530.1119.9316.278.1521.2516.2276.33S1328.5720.9417.116.9220.9815.9576.01 S628.5419.2117.949.7121.1115.8775.18S1427.9920.2116.887.5620.6116.2478.79 S726.4221.7516.518.1820.4015.7577.19S1528.8821.0316.427.8021.0616.1576.68 S830.4120.6617.208.9821.8916.6876.21
2.4 15批HJD物质基准中8种指标成分含量测定及量值传递研究
2.4.1 色谱条件 同“2.2.3”项。
2.4.2 混合对照品溶液制备 同“2.2.1”项。
2.4.3 供试品溶液制备 同“2.2.2”项。
2.4.4 系统适用性试验 取上述混合对照品溶液、供试品溶液、阴性对照品溶液,按“2.2.3”色谱条件进行测定,记录色谱图。结果各成分分离度均>1.5,符合《中国药典》2020年版要求,峰形较好,理论塔板数()以保留时间(R)和峰宽()按=16(R/)2计算均不低于15 000,样品阴性溶液无干扰,色谱图见图3。
2.4.5 线性关系考察 精密吸取6个不同质量浓度混合对照品溶液,按“2.2.3”项下色谱条件进样测定,记录峰面积。以进样量为横坐标()、峰面积为纵坐标(),绘制标准曲线,结果见表5。
2.4.6 精密度试验 取“2.2.1”项下混合对照品溶液,按“2.2.3”项下色谱条件连续进样测定6次,记录峰面积。结果盐酸黄连碱、表小檗碱、盐酸巴马汀、盐酸小檗碱、盐酸药根碱、盐酸黄连碱、黄芩苷、栀子苷8种成分峰面积的RSD分别为0.33%、0.24%、0.65%、0.21%、0.49%、0.12%、0.36%、0.45%,结果表明仪器精密度良好。
2.4.7 重复性试验 取S1物质基准样品按“2.2.2”项下制备供试品溶液6份,按“2.2.3”项下色谱条件进样测定,记录峰面积并计算含量。结果盐酸黄连碱、表小檗碱、盐酸巴马汀、盐酸小檗碱、盐酸药根碱、盐酸黄连碱、黄芩苷、栀子苷8种指标成分质量分数分别为8.56、2.10、10.66、50.62、9.77、8.99、105.19、27.86 mg/g,RSD分别为1.47%、1.69%、1.31%、1.24%、1.02%、0.98%、1.42%、1.25%,表明该方法重复性良好。
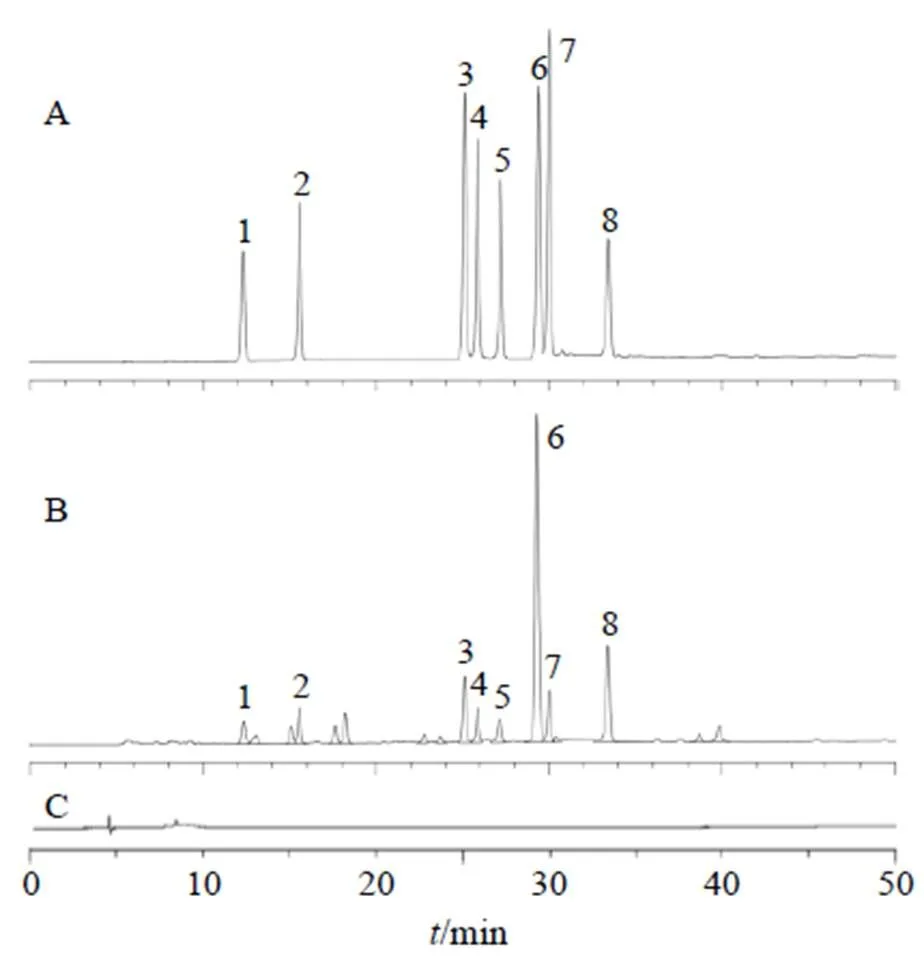
A-混合对照品 B-HJD样品 C-HJD样品阴性 1-盐酸黄柏碱 2-栀子苷 3-表小檗碱 4-盐酸黄连碱 5-盐酸药根碱 6-盐酸小檗碱 7-盐酸巴马汀 8-黄芩苷
2.4.8 稳定性试验 取S1物质基准供试品溶液,按“2.2.3”色谱条件分别于0、2、4、8、12、24 h进样测定,记录峰面积。结果盐酸黄连碱、表小檗碱、盐酸巴马汀、盐酸小檗碱、盐酸药根碱、盐酸黄柏碱、黄芩苷、栀子苷8种成分峰面积的RSD分别为1.39%、1.57%、1.21%、1.08%、1.17%、1.09%、1.88%、1.12%,结果表明供试品溶液在24 h内稳定性良好。
表5 HJD中8种成分标准曲线、回归方程和范围
Table 5 Standard curve, regression equation and range of eight components in HJD
指标成分回归方程r线性范围/μg 盐酸黄连碱y=5 848 129.70 x+12 029.550.999 30.01~0.34 表小檗碱y=43 002 564.04 x+19 482.450.999 70.02~0.76 盐酸巴马汀y=7 282 531.21 x-19 606.560.999 30.02~0.11 盐酸小檗碱y=8 167 656.04 x-46 442.020.999 30.05~0.34 盐酸药根碱y=5 499 245.55 x-2 005.650.999 60.02~0.39 盐酸黄柏碱y=2 403 258.82 x-11 317.460.999 40.02~0.62 黄芩苷y=2 281 938.23 x-13 534.190.999 60.09~0.45 栀子苷y=2 741 308.65 x-6 993.990.999 30.01~0.39
2.4.9 加样回收率试验 取6份已测定的HJD物质基准样品(编号S1)约0.15 g,精密称定,分别加入50 mL混合对照品溶液(盐酸黄连碱2.6 μg/mL、表小檗碱0.7 μg/mL、盐酸巴马汀3.2 μg/mL、盐酸小檗碱15.3 μg/mL、盐酸药根碱3.0 μg/mL、盐酸黄柏碱2.6 μg/mL、黄芩苷31.4 μg/mL、栀子苷8.2 μg/mL),按“2.2.2”项下制备供试品溶液,按“2.2.3”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果盐酸黄连碱、表小檗碱、盐酸巴马汀、盐酸小檗碱、盐酸药根碱、盐酸黄柏碱、黄芩苷、栀子苷的平均加样回收率分别为97.80%、98.88%、97.92%、98.68%、99.75%、98.90%、99.46%、101.29%,RSD分别为1.17%、2.33%、1.23%、1.23%、1.87%、1.75%、2.43%、1.16%。
2.4.10 含量测定及量值传递关系研究 饮片中指标成分含量按《中国药典》2020年版一部测定。
饮片-物质基准指标转移率=/
表示物质基准中指标性成分的含量,表示饮片中指标性成分的含量
15批HJD物质基准中指标性成分盐酸黄连碱为0.61%~1.08%,平均转移率为44.42%,表小檗碱为0.14%~0.24%,平均转移率为16.22%,盐酸巴马汀为0.93%~1.52%,平均转移率为69.54%,盐酸小檗碱为4.09%~6.36%,平均转移率为40.91%,盐酸药根碱为0.81%~1.07%,平均转移率为47.58%,盐酸黄柏碱为0.78%~1.06%,平均转移率为80.88%;黄芩苷为7.45%~12.26%,平均转移率为62.04%;栀子苷为0.42%~2.82%,平均转移率为44.19%。根据相关规定,不同批次物质基准的指标性成分质量分数及转移率应控制在其均值的70%~130%[17],结果见表6。15批HJD物质基准中除栀子苷外,其余化学成分的含量及转移率均在均值的70%~130%,因此,从盐酸黄连碱、表小檗碱、盐酸巴马汀、盐酸小檗碱、盐酸药根碱、盐酸黄连碱、黄芩苷、栀子苷的转移率进行分析,HJD物质基准的制备工艺稳定,不同批次物质基准的盐酸黄连碱、表小檗碱、盐酸巴马汀、盐酸小檗碱、盐酸药根碱、盐酸黄连碱、黄芩苷、栀子苷转移率符合要求,说明实验前期黄连、黄芩、黄柏的质量控制及物质基准制备工艺可以实现HJD中盐酸黄连碱、表小檗碱、盐酸巴马汀、盐酸小檗碱、盐酸药根碱、盐酸黄连碱、黄芩苷、栀子苷含量的稳定传递。HJD物质基准中栀子苷的质量分数未在其均值的70%~130%,可能不同批次指标性成分含量差异较大为主要原因,另外也可能因栀子饮片质脆,易碎,使取样不均匀,导致含量差异大,这提示在今后进行HJD物质基准制备时,考虑要制定饮片原料的质量标准范围,以确保物质基准质量的稳定。
3 讨论
3.1 HJD物质基准制备工艺研究
前期实验研究已对煎煮器具、煎煮火候与时间控制、过滤用纱布目数等工艺条件进行考察[18-19],最终确定HJD制备工艺为黄连41.40 g,黄芩27.60 g,黄柏27.60 g,栀子15.00 g于陶瓷煎药壶中,加水1200 mL,武火(2200 W)至沸腾,后文火(800 W)煎煮40 min,立即用2层200目纱布趁热过滤,得药液400 mL,冻干即得。在制备HJD物质基准程中,滤液放凉后,出现大量沉淀,精读原文未找到沉淀的处理方式,咨询有关专家建议沉淀不需要弃去,经检测沉淀中主要为盐酸小檗碱和黄芩苷成分,故考虑避免药效成分损失,滤过时需要趁热。
3.2 供试品制备方法考察
考虑从化学成分提取的充分性和提取方法的方便性出发,前期实验对供试品溶液的制备进行了不同提取方法(回流和超声)、提取时间(20、30、50 min),提取溶剂(50%、70%、100%甲醇),料液比(1∶100、1∶200)条件比较,最后确定采用超声提取30 min,甲醇为提取溶剂,料液比1∶200的效果最佳。
3.3 色谱条件优化
前期采用DAD检测器对HJD波长(345、277、238 nm)进行优选。确定238 nm波长下色谱峰较多,分离度和峰形较好。由于HJD物质基准中化学成分较多,故采用梯度洗脱,考察流动相(甲醇-水、甲醇-0.05%磷酸水溶液),结果采用甲醇-0.05%磷酸水溶液为流动相的色谱图中盐酸小檗碱等生物碱类成分峰型不易拖尾,峰形较好,同时考察柱温(30、35 ℃)和体积流量(0.6、0.8、1.0 mL/min)对色谱峰分离度的影响,结果柱温35 ℃,体积流量0.6 mL/min色谱条件最佳。
表6 HJD物质基准中指标成分含量及转移率结果
Table 6 Results of index composition content and transfer rate in material benchmark of HJD
样品盐酸黄柏碱/%转移率/%栀子苷/%转移率/%表小檗碱/%转移率/%盐酸黄连碱/%转移率/% 饮片物质基准饮片物质基准饮片物质基准饮片物质基准 S11.360.9066.185.422.7951.481.710.2112.281.820.8647.25 S21.101.0090.912.430.7330.041.280.2116.412.090.8038.28 S31.041.06101.922.050.5426.341.170.2420.512.131.0750.23 S41.120.9685.715.612.7448.841.160.1714.662.070.8340.10 S51.140.8675.445.722.8249.301.050.2220.951.770.9352.54 S60.980.7879.594.121.9948.300.970.1414.431.660.6136.75 S71.080.8679.634.552.0244.400.940.1819.152.060.7033.98 S81.160.8875.864.712.1946.501.730.2011.561.800.7943.89 S91.240.8064.524.902.1844.491.450.1812.411.660.6438.55 S100.961.00104.171.910.4221.991.200.2420.002.091.0851.67 S111.121.0089.294.952.1142.631.160.1512.932.080.9143.75 S121.060.9286.792.011.0652.741.010.2120.792.111.0549.76 S131.260.8869.843.872.0151.940.990.1616.161.920.8443.75 S141.100.8072.734.222.0348.100.980.1515.312.010.9245.77 S151.160.8270.693.551.9855.771.530.2415.691.980.9950.00 平均值1.130.9080.884.001.8444.191.220.1916.221.950.8744.42 范围0.96~1.360.78~1.0664.52~104.171.91~5.720.42~2.8221.99~55.770.94~1.530.14~0.2411.56~20.951.66~2.130.61~1.0833.98~52.54 样品盐酸药根碱/%转移率/%盐酸小檗碱/%转移率/%盐酸巴马汀/%转移率/%黄芩苷/%转移率/% 饮片物质基准饮片物质基准饮片物质基准饮片物质基准 S11.890.9851.8513.115.0638.601.601.0766.8815.2610.5268.94 S22.151.0247.4413.886.3645.821.721.3176.1616.8311.2366.73 S32.221.0748.2012.424.8038.652.611.5157.8516.439.3256.73 S42.080.8540.8713.404.1230.751.591.0767.3013.996.9549.68 S52.191.0347.0313.325.8944.221.581.1975.3216.0411.0769.01 S61.990.8341.7111.054.0937.011.561.0265.3814.887.4550.07 S71.650.9758.7911.215.6650.491.571.1371.9715.8910.4165.51 S82.160.8237.9613.664.6433.971.430.9365.0312.557.4759.52 S91.900.8946.8412.545.2141.551.450.9766.9013.128.3063.26 S102.131.0247.8911.216.0353.791.701.5289.4116.9112.2672.50 S112.111.0147.8712.554.8238.411.480.9966.8914.988.2154.81 S121.680.9858.3312.674.9639.152.381.4661.3415.559.9864.18 S131.881.0053.1913.084.9938.152.011.3667.6616.1111.0968.84 S142.030.9044.3311.325.4347.971.881.3370.7415.5610.3366.39 S151.960.8141.3312.984.5635.131.901.4174.2114.457.8754.46 平均值2.000.9547.5812.565.1140.911.761.2269.5415.249.5062.04 范围1.65~2.220.81~1.0737.96~58.7911.05~13.884.09~6.3630.75~53.791.43~2.610.93~1.5257.85~89.4112.55~16.917.45~12.2649.68~72.50
3.4 物质基准的量值传递分析
中药复方制剂成分复杂,本实验以出膏率、指纹图谱及指标性成分含量为指标,全面考察饮片-物质基准的相关性及关键质量属性的传递性。结果15批HJD物质基准出膏率、指标性成分含量和特征图谱可在饮片-物质基准中稳定传递。
15批物质基准中表小檗碱、盐酸黄连碱、盐酸小檗碱、盐酸巴马汀、黄芩苷含量较高,盐酸药根碱、盐酸黄柏碱、栀子苷成分含量相对较低,各批样品中各成分含量有所差异,可能与单味药材饮片成分含量有关。栀子在方中用量较其他3味药用量少,且因其饮片质地脆,取样时细粉较多,使批次间取样不均匀,煎煮时成分溶出不均一,故可以考虑制备工艺前对栀子饮片统一处理,使化学成分稳定传递。因此为了控制饮片的质量波动,减少批次间的质量差异,除了控制饮片的含量限度范围外,还可以通过对不同批次饮片混合后投料生产的方法[20],以保证不同批次物质基准的质量相对稳定。后期课题组还会对HJD制剂进行深入研究,因此全面考察饮片–物质基准质量属性的量子传递,是保证HJD临床疗效的首要途径,对HJD制剂研究具有重要意义。
利益冲突 所有作者均声明不存在利益冲突
[1] 张綦慧, 张丽, 刘晶, 等. 黄连解毒汤系列制剂临床应用研究 [J]. 吉林中医药, 2016, 36(11): 1181-1184.
[2] 张婷, 宋厚盼, 林也, 等. 黄连解毒汤之“清热解毒”药效与作用机制研究进展 [J]. 中华中医药学刊, 2020, 38(11): 135-139.
[3] 梅全喜. 黄连解毒汤源出《肘后备急方》考辨 [J]. 时珍国医国药, 2013, 24(11): 2730-2731.
[4] 张海鹏. 黄连解毒汤源出小考 [J]. 中华医史杂志, 2017, 47(4): 207.
[5] 李军鸽, 王永春, 孟珈同, 等. 黄连解毒汤中盐酸小檗碱、黄芩苷、黄柏碱、栀子苷的含量测定 [J]. 人参研究, 2021, 33(5): 19-24.
[6] 刘雨浓, 张晓敏, 崔晓英, 等. 黄连解毒汤有效组分通过激活Caspase-11靶点抗脓毒症的研究 [J]. 现代药物与临床, 2020, 35(1): 7-11.
[7] 秦高凤, 王蓬文. 黄连解毒汤对糖尿病脑病和阿尔茨海默病的作用 [J]. 中华中医药学刊, 2020, 38(7): 84-88.
[8] 客蕊, 王卓溪, 张彩凤, 等. 黄连解毒汤介导的FGF21脂代谢调控机制与抗动脉粥样硬化的研究进展 [J]. 时珍国医国药, 2020, 31(5): 1215-1218.
[9] 韦燕妮, 黄启辉. 黄连解毒汤治疗心血管系统疾病的药理研究进展 [J]. 中西医结合心脑血管病杂志, 2017, 15(5): 562-565.
[10] 刘卫霞, 尤凯, 孙燕. 黄连解毒汤化学成分及临床应用的研究进展 [J]. 沈阳医学院学报, 2015, 17(2): 121-124.
[11] 中国药典[S]. 一部. 2020: 259, 314, 316, 318.
[12] 杨琳, 傅延龄, 倪胜楼, 等. 《外台秘要》汤剂全方量的研究 [J]. 北京中医药大学学报, 2013, 36(11): 725-728.
[13] 杨琳. 经方常用50味药物在《外台秘要》中的用量规律研究 [D].北京:北京中医药大学, 2012.
[14] 司南, 杨阳, 王巍, 等. 黄连解毒汤来源及用药剂量换算的考证 [J]. 中国现代中药, 2012, 14(2): 31-33.
[15] 徐男, 王平, 王淑玲, 等. 基于UPLC特征图谱和Q-Marker量值传递评价经典名方半夏白术天麻汤颗粒剂的关键生产工艺 [J]. 中草药, 2021, 52(24): 7455-7463.
[16] 彭梅梅, 郭爽, 王璐, 等. 经典名方黄连汤的物质基准量值传递分析 [J]. 中国中药杂志, 2022, 47(2): 313-323.
[17] 许金国, 梅茜, 夏金鑫, 等. 经典名方当归四逆汤物质基准量值传递分析 [J]. 中草药, 2021, 52(21): 6501-6509.
[18] 蒋斌, 张星海, 唐樑, 等. 正交试验优选黄连解毒汤的机器煎煮工艺 [J]. 中国实验方剂学杂志, 2013, 19(23): 32-35.
[19] 王升菊, 郑雨, 段赟, 等. 基于组方药味古今炮制工艺的经典名方桃红四物汤质量差异性研究 [J]. 中草药, 2021, 52(14): 4201-4209.
[20] 杨平, 林丹, 宋菊, 等. 日本汉方制剂及其特点与中药新药研究的思考 [J]. 中草药, 2018, 49(9): 1985-1989.
Analysis on quality value transmitting of material benchmark of Huanglian Jiedu Decoction
LI Jun-ge, ZHAO Ying, WANG Yong-chun, MENG Jia-tong, QIU Zhi-dong, TANG Qiu-zhu
Changchun University of Traditional Chinese Medicine, Changchun 130117, China
Clarify the key quality attributes of Huanglian Jiedu Decoction (HJD, 黄连解毒汤) material benchmark (MB), establish the fingerprint of HJD MB and determine the content of coptisine chloride, epiberberine, palmatine chloride, berberine, jatrorrhizine hydrochloride, phellodendrine chloride, baicalin, geniposide components and their transfer rate, and lay the foundation for the research of compound preparation of HJD in the later stage.Fifteen batches of material benchmarks were prepared according to the ancient technology, the paste rate was determined, the HPLC fingerprint of the material benchmark was established and the similarity evaluation was conducted, and the common peaks were determined. The content of eight components in the material benchmark was determined by the same method, and the transfer value of drinking slices to the material benchmark was analyzed.The average paste rate was 16.02%, with 18 common peaks, and the similarity to the control fingerprint was more than 0.9; The eight peaks were coptisine chloride, epiberberine, palmatine chloride, berberine, jatrorrhizine hydrochloride, phellodendrine chloride, baicalin, geniposide. The transfer rate of each index component from drinking sheet to material benchmark was coptisine chloride 0.61%—1.08%, epiberberine 0.14%—0.24%, palmatine chloride 0.93%—1.52%, berberine 4.09%—6.36%, jatrorrhizine hydrochloride 0.81%—1.07%, phellodendrine chloride 0.78%—1.06%, baicalin 7.45%—12.26%, and geniposide 0.42%—2.82%.By using the combination of ointment yield and multi-index composition content determination, this method is scientific and reasonable, and provides a scientific basis for the quality control of the material benchmark and the development of compound preparation.
Huanglian Jiedu Dcoction; material benchmark; fingerprint; coptisine chloride; epiberberine; palmatine chloride; berberine; jatrorrhizine hydrochloride; phellodendrine chloride; baicalin; geniposide; quality value transmitting
R283.6
A
0253 - 2670(2022)11 - 3348 - 09
10.7501/j.issn.0253-2670.2022.11.010
2021-12-10
中医药事业传承发展资金支持项目《重大疫情防治中药方剂储备库建设项目》(吉中医药发[2021]11号)
李军鸽,硕士,助理实验师,从事中药制剂与新药研究。Tel: (0431)86763972 E-mail: 407332695@qq.com
唐秋竹,学士,主任药师,从事中药制剂与中药质量控制研究。Tel: (0431)86763972 E-mail: 497903433@qq.com
[责任编辑 郑礼胜]
