Girdin蛋白与胃癌侵袭转移的关系
2022-05-30翟丽丽陈文静刘惠銘
翟丽丽 陈文静 刘惠銘

【摘要】目的:探讨Girdin在胃癌组织中的表达及其与胃癌血管生成、侵袭及转移的关系。方法:通过免疫组织化学方法检测Girdin蛋白在人胃癌组织中的表达情况,分析其和胃癌血管生成及患者临床病理特征的关系及临床意义。结果:胃癌组织中,Girdin表达和微血管密度(MVD)均显著高于正常胃黏膜(P <0.05)。胃癌组织中,Girdin蛋白阳性产物主要定位于细胞核和(或)细胞质,且与胃癌的分化程度、临床分期、Lauren分型及淋巴结转移显著相关(P <0.05)。胃癌组织中的 MVD与分化程度、临床分期、Lauren 分型及淋巴结转移显著相关(P <0.05)。胃癌组织中,Girdin表达与微血管壁周细胞覆盖率(MPI)呈反比(P <0.01),且随着Girdin表达的增高,MVD逐渐增加,而 MPI则逐渐减少。结论:Girdin在胃癌侵袭和转移过程中起重要作用。同时,Girdin的表达与胃癌的血管生成关系密切,而这种血管为不成熟血管,周细胞覆盖率减低,其成为胃癌患者预后差的重要因素。
【关键词】Girdin;胃癌;侵袭;转移
【中图分类号】R735.2【文献标识码】A 【文章编号】2096-5249(2022)15-0189-05
胃癌的高死亡率与其侵袭和转移关系密切,研究表明,肿瘤的血管生成在肿瘤的侵袭和转移中起重要作用,肿瘤细胞通过新生血管提供氧气及营养物质来促进自身的增殖并侵入血管实现远处转移。Girdin蛋白是一种能被 Akt/蛋白激酶B激活的肌动蛋白结合蛋白,在重塑肌动蛋白细胞骨架和肿瘤进展中发挥重要作用,包括肿瘤的迁移、侵袭、转移和血管生成[1]。
本研究通过免疫组化方法检测Girdin蛋白在人胃癌组织中的表达情况,分析其和胃癌血管生成及患者临床病理特征的关系。
1 资料与方法
1.1 一般资料
选取齐齐哈尔市第一医院病理科2015年01月至2017年08月病理诊断为胃癌的石蜡标本60例,其中男性44例,女性16例,年龄35~76岁,中位年龄60岁。按第5版世界卫生组织消化系统肿瘤分类标准[2],组织学分级为高、中分化者41例,低分化和未分化者19例;临床分期Ⅰ~Ⅱ期37例,Ⅲ~Ⅳ期23例;淋巴结转移者37例,无转移者23例。按1965年 Lauren 分型,肠型34例,弥漫型26例。同时收集20例相应的癌旁正常胃黏膜组织(距肿瘤边缘>2 cm)作为对照组。所有病例术前均未行放、化疗。
1.2 方法
标本均经4%中性福尔马林固定,石蜡包埋,4μm 厚连续切片,免疫组化采用EliVision法染Girdin蛋白及DouSPTM免疫组化双染试剂盒染血管内皮细胞及血管周细胞,一抗分别为兔抗人Girdin多克隆抗体(稀释度1∶200),购自于美国 Santa Cruz 公司,即用型鼠抗人 CD34单克隆抗体(克隆号:QB End/10)标记血管内皮细胞,即用型鼠抗人α-SMA 单克隆抗体(克隆号:1A4)标记血管周细胞,上述两种试剂购自福州迈新生物技术开发公司。操作步骤严格按照试剂盒说明书进行。所有指标的结果均由两位高年资病理医师经双盲法判定。
1.3 结果判定
(1) Girdin阳性产物主要定位于胃癌细胞核和(或细胞质,采用半定量积分法,根据阳性细胞数和着色强度判断结果。阳性细胞所占百分比:0分为≤5%,1分为6%~25%,2分为26%~50%,3分为51%~75%,4分为>75%;染色深度:0分为无色,1分为淡黄色,2分为棕黄色,3分为棕褐色,两者相乘:≤4分为阴性,>4分为阳性;(2)微血管密度(MVD)的判定标准参照 Weidner 等的方法,微血管计数以 CD34标记的内皮细胞形成一独立管腔即为一血管,只要结构不相连,其分支结构也计作1个血管;(3)高倍镜下计数相应血管数及周细胞覆盖血管数,并求其平均值,统计微血管壁周细胞覆盖率(MPI)。
1.4 统计学分析
应用 SPSS 29.0软件进行统计分析。计数资料采用χ2检验,以[ n (%)]表示,计量资料采用 t 检验,MVD以( x(—)± s )表示,Girdin与 MVD、MPI 的相关性分析采用Mann-Whitney U 检验。以 P<0.05为差异有统计学意义。
2 结果
2.1 Girdin表达
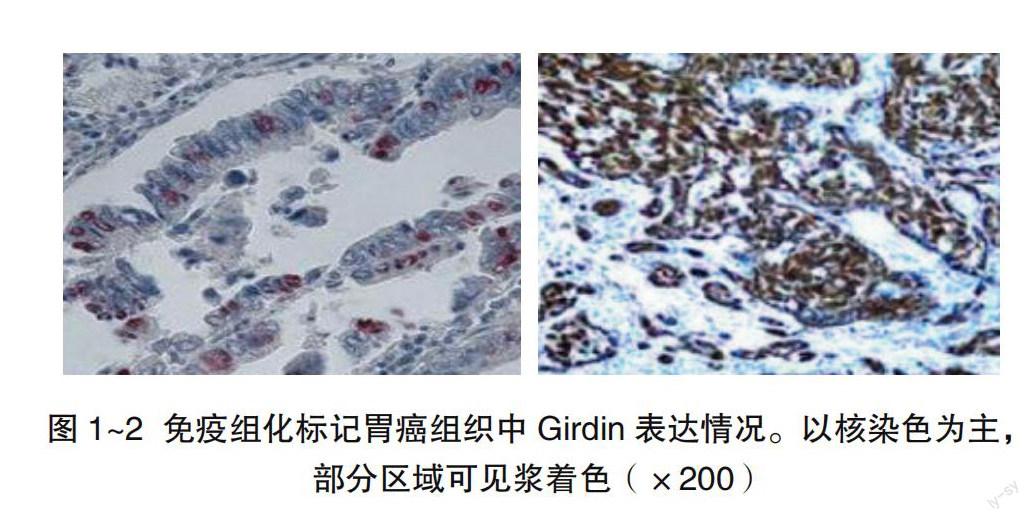
Girdin在20例癌旁正常胃黏膜中仅有5例阳性,且均為弱阳性;而在60例胃癌组织中42例阳性,二者差异显著(P<0.01),见表1。Girdin主要表达于胃癌细胞核和(或)细胞质(图1~2),尤其是肿瘤浸润的最前缘。应用抗α-SMA、CD34两个第一抗体分别标记同一张切片上的周细胞与内皮细胞,其中内皮细胞胞浆及胞膜染成深红色,周细胞胞浆出现紫黑色颗粒沉积(图3~4),有些血管的管壁只由一层内皮细胞覆盖,而无周细胞;而有些血管有两层细胞:周细胞在内皮细胞外侧,紧贴内皮细胞,在癌巢及其周围的间质中均有较丰富血管分布,尤其在肿瘤浸润的前缘最为密集。60例胃癌中 MVD 平均值是(46.8±9.97)个/HPF,而20例癌旁正常胃黏膜中 MVD 平均值是(24.82±4.45)个/HPF,差异显著(P<0.01),见表1。
2.2 胃癌中Girdin、MVD、MPI及临床各病理参数
Girdin及 MVD 随着胃癌分化程度的降低、临床分期的升高而增加(表2)。 MPI 与胃癌的分化程度呈正相关(P <0.01),与脉管内是否有癌栓呈负相关(P <0.01),与其他特征无关(P >0.05)。在60例胃癌组织中,42例Girdin阳性患者的 MVD 平均值为(54.23±10.95)个/HPF,而18例阴性患者的 MVD 平均值为(42.53±5.84)个/HPF,二者差异显著( P <0.01),且随着Girdin表达的增多,MVD 亦逐渐增多。在60例胃癌组织中,Girdin阳性者的 MPI 平均值为(39.35±9.84)%,而阴性者的 MPI 平均值为(46.78±4.83)%,二者具有显著的相关性(P<0.01),且随着Girdin在胃癌组织中的表达增加,肿瘤间质不成熟血管增多。但MVD与MPI之间不存在相关性(P>0.05,见图5)。
3 讨论
胃癌是全球范围内发病率最高的肿瘤之一,而我国是胃癌的高发区,年患病率和死亡率均是世界平均水平的2倍多。近30%患者在初诊时已是晚期,40%局灶肿瘤患者在术后出现复发与转移,10%~20%晚期胃癌患者对化疗药物如顺铂耐药,且其他患者在化疗6~15个月逐渐产生耐药,从而导致肿瘤进展,预后极差[2-3]。胃癌发生、发展是一个多因素、多步骤参与的复杂过程,具有明显的侵袭性。为了提高胃癌患者的生存质量,改善胃癌患者的预后,我们应寻找胃癌新的治疗靶点。磷脂酰肌醇3-激酶/Akt 丝氨酸/苏氨酸激酶系统通过大量下游底物的磷酸化调节多种细胞过程,现已被公认为癌症侵袭和转移的重要信号通路,但关于 Akt 在细胞迁移中的作用的信息相对较少,这是与癌症侵袭和转移直接相关的关键过程。Akt 结合蛋白Girdin(肌动蛋白丝束),也称为 Akt 磷酸化增强剂、 Gα相互作用囊泡相关蛋白和 Hook 相关蛋白1,其由位于2号染色体上的Girdin基因表达,在哺乳动物细胞中普遍表达,其蛋白质产物由1870个氨基酸组成,相对分子质量为2.2×105~2.5×105[4]。Girdin蛋白由3个结构域构成:氨基末端、卷曲螺旋区域和羧基末端。氨基末端与 HOOK 蛋白家族分子结构类似并能够与细胞内微管、Dynamin 以及 GISC1蛋白相结合,调节肌动蛋白结构的形成,参与细胞骨架的构建,对细胞的结构的完整以及运动起到至关重要的作用[5];中间为螺旋卷曲区域,其参与形成二聚体蛋白;羧基末端包括含质膜结合位点以及 AKT 磷酸化位点的 CT1结构域和含有肌动蛋白结合区、膜结合区以及 AKT磷酸化位点的CT2结构域,具有特异性结合多种配体的功能[6]。研究发现,Girdin蛋白通过自身的结构特征发挥生物学作用,影响微环境的变化,尤其对肿瘤的侵袭及转移起到促进作用。通过下调 MEG3降低Girdin的水平,从而减少其与血管内皮细胞的作用,降低内皮细胞的破坏,使血管的完整性得以保存,从而抑制肿瘤细胞侵及脉管,降低肿瘤血道及淋巴道的转移[7],可见Girdin在肿瘤的淋巴及远处转移方面起到了一个正向推动作用;肿瘤的增殖需要持续的营养输送,那么这就需要大量的新生血管运送养料,Lan 等[8]发现Girdin蛋白及其磷酸化产物能够抑制血管内皮细胞衰老及促进新生血管的形成,对于这一发现,让我们更加深入的了解了Girdin对肿瘤细胞增殖的促进作用。我们实验发现Girdin蛋白高表达区域,MVD 密度增加,MPI 值降低,即Girdin蛋白与胃癌背景中的不成熟的血管的数量呈正相关,而这种不成熟血管的形成既利于肿瘤细胞的增殖,又利于肿瘤的侵袭与转移。随着胃癌分化程度的降低,侵袭能力的增加,Girdin蛋白表达率却随之增高,这可能与Girdin蛋白特殊的分子结构有关,其与胃癌细胞的某些结构发生相互作用,影响胃癌的分化,并通过改变胃癌细胞的结构域,影响其侵袭能力。众所周知,细胞的运动离不开细胞内的微管系统,肿瘤细胞所进行的阿米巴运动,与肿瘤细胞内微管系统蛋白的表达密切相关,通过实验建立3D 微胶原轨道模型,Girdin的敲低导致3D 胶原微轨迹迁移过程中的细胞速度降低。Girdin的缺失也会导致细胞形态和细胞方向的改变。此外,Girdin消耗会损害肌动蛋白组织和应力纤维形成,这可以通过上调 GTPase RhoA来恢复。RhoA的激活诱导肌动蛋白应力纤维形成,在没有Girdin的情况下恢复3D 胶原微轨道中拉长的迁移细胞形状和部分细胞迁移,以此证实肿瘤内Girdin蛋白通过自身的结构域直接与细胞极性蛋白 Par-3(Partitioning defective-3)相互作用参与细胞的极化,从而促进肿瘤细胞的迁移[9]。目前研究发现,肿瘤的迁移不仅仅是单个细胞的行为,而是以群体的形势侵袭周围基质,并且与周围基质相互作用产生适合肿瘤细胞生存的微环境,在器官类型培养模型中,Girdin对于皮肤癌细胞系 A431在胶原凝胶上的集体迁移以及基质成纤维细胞领导的集体入侵是必不可少的[10]。肿瘤的增殖及迁移是个连续、复杂的过程,肿瘤通过增生及侵袭两方面实现对机体的破坏,肿瘤细胞的不断增生是肿瘤细胞浸润的前提。肿瘤细胞通过促进血管的增生提供自身所需的营养,通过不成熟的血管形成及自身增生导致肿瘤组织内部压力增高,趋向于向周围基质浸润及远处转移的发生,而在此过程中,Girdin对前缘肌动蛋白的重塑起至关重要的作用,磷酸化的Girdin在迁移细胞的前沿增多,而细胞内的丝氨酸被丙氨酸所取代,從而使细胞拉长变形,形成伪足,表现出迁移能力的增加[11]。为了证实Girdin在前沿肌动蛋白重塑中很重要,通过将 siRNA 引入细胞来抑制内源性Girdin表达。Girdin蛋白水平被Girdin siRNA 的转染有效抑制,Girdin siRNA 的转染导致具有粗糙皮质肌动蛋白丝的细胞数量增加,这表明Girdin可能对重塑外周肌动蛋白丝或细胞外基质粘连起关键作用。此外,当用 IGF-I 刺激细胞时,在Girdin siRNA 转染的细胞中,前缘片状伪足的广泛延伸显著减弱,进一步表明Girdin在迁移细胞外周片状伪足中对肌动蛋白动力学的作用。Chen C[12]在紫外线诱导的 DNA 损伤作为放射治疗的模型中,发现Girdin增加癌细胞对 UVC 介导的 DNA 损伤的敏感性,推测Girdin有可能干预肿瘤细胞周期,据报道,Girdin的消耗导致 DNA 合成减少,进而导致细胞凋亡增加[13]。现陆续证实Girdin在胰腺癌[14]、结肠癌[15]、乳腺癌[16]、肾母细胞瘤[17]等肿瘤当中所起的作用,我们实验也印证了Girdin促进胃癌血管生成、癌细胞的侵袭及转移。相信,通过后续的实验研究,Girdin有可能成为胃癌治疗新靶点。
参考文献
[1] Enomoto A,Ping J,Takahashi M. Girdin,a novel actin-binding protein,and its family of proteins possess versatile functions in the AKT and Wnt signaling pathways[J]. AnnN Y Acad Sci,2006,1086(1):169-184.
[2] 葉大胜,梁明琴,梁文勇,等.血清胃蛋白酶原检测用于胃癌及其癌前病变筛查中的意义探讨[J].医学食疗与健康,2022,20(3):45-47.
[3] 黄琳.外泌体 MicroRNA-301在胃癌患者血清中的表达及临床意义[J].医学食疗与健康,2019(22):18-19.
[4] 王静,谷峰,马勇杰.Girdin蛋白与肿瘤转移相关性的研究进展[J].中华肿瘤防治杂志,2010,17(3):233-236.
[5] Ha A,Polyanovsky A,Avidor-Reiss T. Drosophila hook-related protein (girdin) is essential for sensory endrite formation[J].Genetics,2015,200(4):1149-1159.
[6] 尹秀花,曲晓媛,姜平.Girdin蛋白在肿瘤中的作用[J].医学综述,2012,18(6):873-875.
[7] Lan Y,Li YJ,Li DJ,et al. Long non-coding RNA MEG3prevents vascular endothelial cell senescence by impairing miR-128-dependent Girdin down-regulation[J].Am J Physiol Cell Physiol,2018,316(6):C830-C843.
[8] Lan Y,Li Y,Li D,et al.Engulfment of platelets delaysendothelial cell aging via girdin and its phosphorylation[J]. Int J Mol Med,2018,42(2):988-997,2018.
[9] Rahman-Zaman A,Shan S,Reinhart-King CA . CellMigration in Microfabricated 3D Collagen Microtracks is Mediated through the Prometastatic Protein Girdin[J]. Cell Mol Bioeng 2018,11(1):1-10.
[10] Wang X,Enomoto A,Weng L,et al. Girdin/GIV regulatescollective cancer cell migration by controlling cell adhesion and cytoskeletal organization[J]. Cancer Sci,2018,109(11):3643-3656.
[11] Enomoto A,Murakami H,Asai N,et al. Akt/PKB regulatesactin organization and cell motility via Girdin/APE[J]. Dev Cell,2005,9:389-402.
[12] Chen C,Atsushi E,Liang W,et al. Complex roles of theactin-binding protein Girdin/GIV in DNA damage-induced apoptosis of cancer cells[J].Cancer science,2020,111(11):4303-4317.
[13] Anai M,Shojima N,Katagiri H,et al. A novel proteinkinase B ( PKB )/AKT-binding protein enhances PKB kinase activity and regulates DNA synthesis. J Biol Chem,2005(280):18525-18535.
[14] Wang S,Lei Y,Cai Z,et al . Girdin regulates theproliferation and apoptosis of pancreatic cancer cells via the PI3K/Akt signalling pathway[J]. Oncol Rep,2018,40(2):599-608.
[15] Lu J,Zhang L,Zhou H,et al . Silencing of Girdinsuppresses the malignant behavior of colorectal carcinoma cells[J]. Oncol Rep,2018,40(2):887-894.
