吉西他滨联合环磷酰胺、吡柔比星、长春新碱及强的松一线治疗T细胞性非霍奇金淋巴瘤的初步探索
2022-05-30周颖
周颖
【关键词】吉西他滨;环磷酰胺;吡柔比星;长春新碱;强的松;非霍奇金淋巴瘤
非霍奇金淋巴瘤(NHL)为国内常见肿瘤之一,患者病变主要集中在淋巴结、脾脏、胸腺等器官上,且病情可蔓延至淋巴造血系统中,对患者身体健康、免疫功能均有明显影响[1-2]。NHL是具有很强异质性的一组独立疾病,主要发生在淋巴结、脾脏、胸腺等淋巴器官,也可发生在淋巴结外的淋巴组织和器官的淋巴造血系统。依据细胞来源将其分为三种基本类型:B细胞、T细胞和NK/T细胞NHL,临床大多数NHL为B细胞型,占总数70%~85%。T细胞性非霍奇金淋巴瘤(T-NHL)是NHL的一种类型,相较于B细胞淋巴瘤T-NHL发病率低,为延长患者生存周期需在确诊后及时展开治疗[3-4]。T-NHL是高度异质性的淋巴系统高侵袭性恶性肿瘤,其发病率相对较低,根据流行病学调查显示在欧美国家中,约占淋巴瘤的5%~10%,但是在中国等亚洲地区国家,其发病率较欧美国家高,各地报道不一,占NHL的20%~30%,可能与EB病毒感染及人类Ⅰ型T淋巴细胞白血病病毒(HTLV-1)感染率较高有关。目前T-NHL中除ALK+ 淋巴瘤外,对以蒽环类为主的联合化疗方案如CHOP疗效欠佳,缓解期短,极易复发进展,预后较B细胞NHL明显较差,目前无统一的标准治疗方案[5]。CHOP方案为治疗NHL的标准方案,但其整体疗效不理想,因此需寻求更理想的治疗方案,达到提高疗效的目的。国内外有吉西他滨治疗T-NHL的相关报道,但具体治疗方案及价值有待进一步探索,故本文遴选T细胞性NHL患者24 例(2018 年5 月~2020年5 月)进行对比研究,报道如下。
1 对象与方法
1.1 研究对象
选择2018 年5 月至2020 年5 月入江门市中心医院进行治疗的24 例T细胞性NHL患者均自,按“随机抽样法”分为两组,每组12 例。观察组中男8 例、女4 例,年龄20~64岁(41.02±10.31)岁;Ann arbor 分期:Ⅱ期3例,Ⅲ期7 例,Ⅳ期2 例;疾病类型:9 例复发性,3 例难治性;病理类型:6 例滤泡性,6 例套细胞性;原发病灶部位:6例胃肠道,4例鼻腔,2例皮肤;体质量指数(BMI)在23~30(26.52±1.44)kg/m2。对照组中男7 例,女5例,年龄21~65(41.08±10.28)岁;Ann arbor 分期:Ⅱ期4 例,Ⅲ期6 例,Ⅳ期2 例;疾病类型:8 例复发性,4 例难治性;病理类型:7 例滤泡性,5 例套细胞性;原发病灶部位:4 例胃肠道,5 例鼻腔,3 例皮肤;BMI为23~29(26.63±1.38)kg/m2。两组上述一般资料比较差异无统计学意义(P>0.05)。
纳入标准:(1)经病理、免疫组化等多项检查确诊者[6],NHL根据组织细胞形态特点,结合免疫表型和细胞遗传学特征可以明确病理类型;(2)可以收集到患者完整的检查和相关病史资料;(3)满足用药指征者;(4)年龄20~65岁者;(5)预期生存期≥3 个月者;(6)自愿入组并签署知情同意书者;(7)血常规及肝肾功能检查正常者;(8)至少有1 处可测量病灶者。
排除标准:(1)中枢神经侵犯系统者,或者其他严重影响本文疾病者;(2)对研究药物过敏者,或者产生不适者;(3)无法定期随访者;(4)严重基础性疾病者[包括一种降压药物仍控制不理想的高血压患者(收缩压≥150 mmHg,舒张压≥100 mmHg);患有一级以上心肌缺血或心肌梗塞、恶性心律失常及≥2级充血性心功能衰竭;活动性或未能控制的严重感染;肝硬化、失代偿性肝病;有免疫缺陷病史,包括HIV阳性或患有其他获得性、先天性免疫缺陷疾病,或有器官移植病史者;糖尿病控制不佳(空腹血糖>10 mmol/L);具有癫痫发作并需要治疗的患者];(5)精神及心理疾病者,或无法有效配合研究者;(6)孕妇、哺乳期妇女;(7)不依从、不配合及拒绝参加研究者;(8)入组前接受过对症治疗者;(9)同期参与其他研究者;(10)卡氏评分(KPS评分)<50分。
1.2 方法
对照组采用CHOP方案治疗:环磷酰胺(国药准字H21022189,沈阳药大药业有限责任公司,规格0.2 g)600 mg/m2,第1 天;长春新碱(国药准字H20065857,广东岭南制药有限公司,规格1 mg)2 mg/m2,第1 天(总量不超过2 mg);吡柔比星(国药准字H20045983,海正辉瑞制药有限公司,规格10 mg)50 mg/m2,第1 天;强的松(国药准字H33021207,浙江仙琚制药股份有限公司,规格5 mg)60 mg/m2,第1~5天。
观察组在对照组基础上联合吉西他滨治疗,吉西他滨[国药准字H20113285,齐鲁制药有限公司,规格0.2 g(按吉西他滨计)]800 mg/m2,第1、8 天。
两组患者治疗期间每2 个疗程复查CT或PET/CT评价疗效,如治疗过程中无疾病进展及不可耐受毒副作用,计划共化疗6~8 个疗程。所有患者化疗结束后再次行CT或PET/CT复查,评价疗效,如肿瘤残留局限,给予局部放疗。每疗程化疗后,患者需定期复查血常规,如前一次化疗后出现Ⅳ度骨髓抑制,下一程化疗的化疗药物剂量减少25%。化疗结束后定期随访复查,第1~2年,每3 个月复查1 次。
1.3 观察指标
(1)按照NHL國际疗效判断标准及Deauville五分量表评价疗效,完全缓解(CR)指患者治疗后肿瘤病灶消失;部分缓解(PR)指患者治疗后肿瘤明显缩小;疾病稳定(SD)指患者病灶幅度较治疗前缩小≥50%;进展(PD)指患者病灶较治疗前增大或出现新的病灶。有效率指完全缓解(CR)与部分缓解(PR)的加和。(2)血清β2~ 微球蛋白(β2~MG)、乳酸脱氢酶(LDH)、肿瘤坏死因子-α(TNF-α):抽取患者5 mL 空腹静脉血,以3000 r/min离心速率、10 cm离心半径,离心处理10 min,将上层清液分离并置于-72℃环境待检,以ELISA法检测以上指标,试剂盒均由武汉菲恩生物科技有限公司提供,一切操作谨遵相关说明书完成。(3)根据1 年内生存率、2 年内生存率及生存时间判定远期生存情况。(4)参考世界卫生组织制定不良反应标准分为0~Ⅳ度。
1.4 统计学方法
数据以SPSS 26.0 软件整理分许数据。计数资料采用[ n(%)]表示,组间比较采用χ 2 检验或Fisher 检验;计量资料用(x—± s)表示,采用t 检验。若P<0.05显示有统计差异。
2 结果
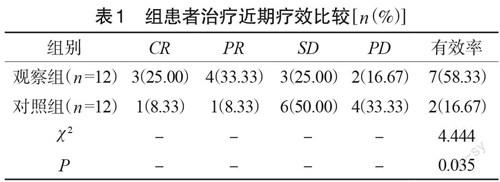
2.1 两组患者治疗近期疗效比较
观察组患者的治疗有效率为58.33%(7/12),对照组治疗有效率为16.67%(2/12),观察组患者的治疗有效率高于对照组患者治疗有效率,差异具有统计学意义(P<0.05),见表1。
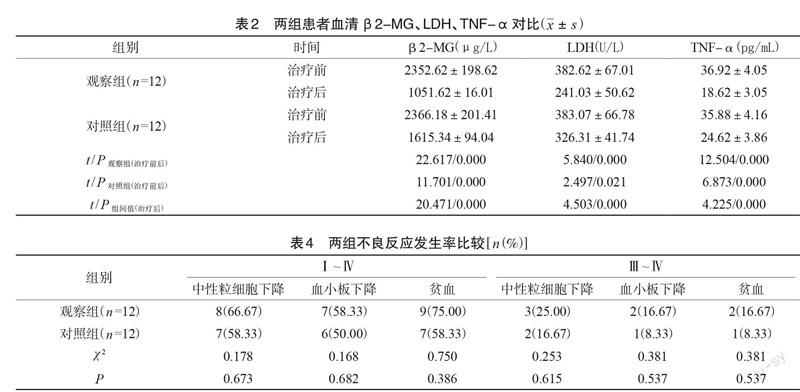
2.2 两组患者血清β2-MG、LDH、TNF-α对比
观察组治疗前血清β2~MG、LDH、TNF-α 与对照组比较,P>0.05;观察组治疗后均低于对照组,差异具有统计学意义(P<0.05),见表2。
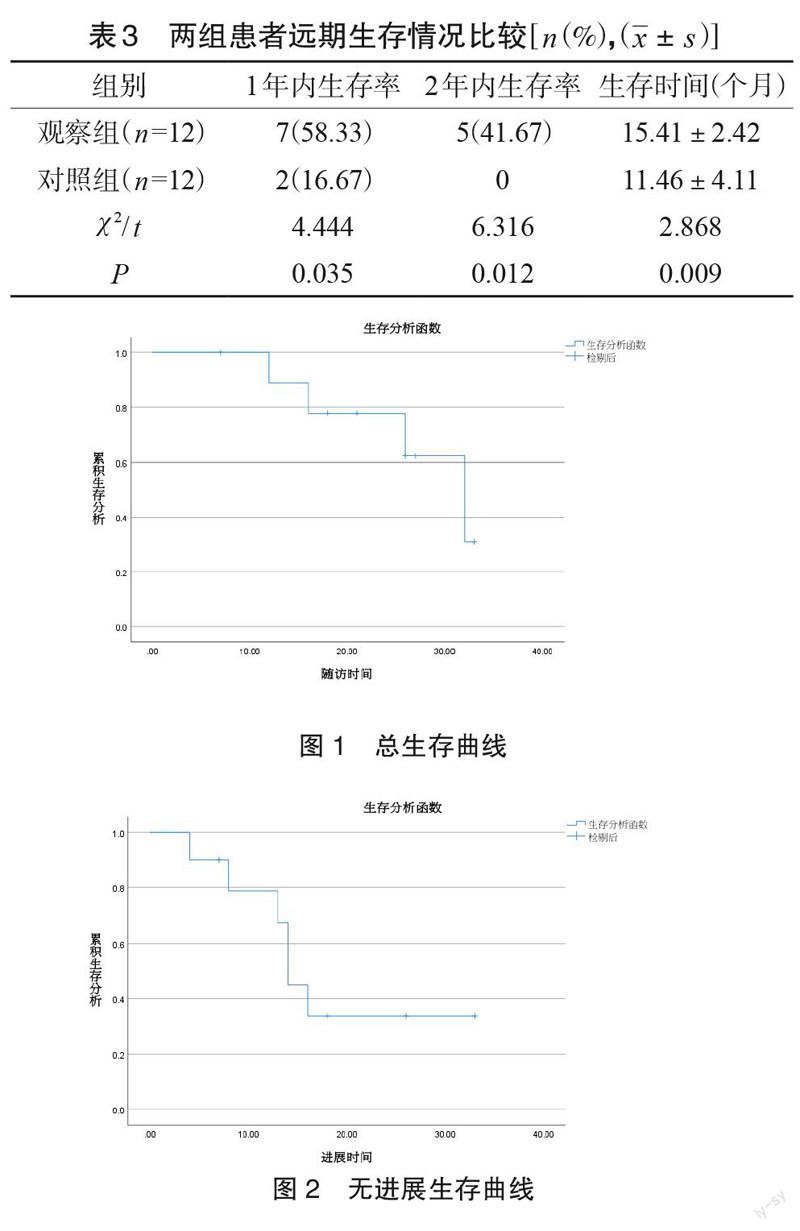
2.3 两组患者远期生存情况比较
观察组患者的1 年内生存率、2 年内生存率分别为58.33%(7/12),41.67%(5/12),均分别高于对照组的16.67%(2/12)、0.00%,差异均具有统计学意义(P<0.05);观察组患者的生存时间为(15.41±2.42)月、对照组患者生存时间为(11.46±4.11)月,差異具有统计学意义(P <0.05),见表3。患者的总生存曲线和无进展生存曲线见图1、2。
2.4 两组不良反应发生率比较
两组患者的主要不良反应为中性粒细胞下降、血小板下降、贫血,其中中性粒细胞下降、血小板下降在两组间差异无统计学意义(P>0.05),见表4。
3 讨论
T-NHL并非临床常见病,发病初期患者临床症状缺乏特异性,容易被患者忽视,漏诊率、误诊率较高,且T-NHL具有疾病进展速度快、侵袭性高、死亡率高、预后差等特点。T-NHL临床认为其与B细胞淋巴瘤相比治疗有效药物少、治疗效率低,导致整体预后效果不理想,目前临床多应用CHOP方案对疾病进行治疗,但临床获得疗效有限,对延长患者生存周期无理想价值[7-8]。
目前维布妥昔单抗(BV)联合CHP方案被推荐用于CD30阳性T细胞淋巴瘤的一线及后线治疗[9],美国和欧洲开展的一项BV+CHP方案一线治疗CD30阳性的PTCL的研究,共26 例患者其ORR达100%,CR为88%,5 年无进展生存及5 年总生存分别为52%和80%,随后关于BV+CHP与CHOP随机对照的全球多中心随机对照研究ECHELON-2,共纳入452 例初诊CD30阳性PTCL患者,中位随访35.2 个月,其结果显示:两组PFS分别为48.2 个月比20.8 个月,BV+CHP组的总生存也有获益趋势。两组ORR分别为83.00%比72.00%,CR分别为68.00% 比56.00%,其差异均具有统计学意义。所以,BV在美国被优先批准用于联合CHP一线治疗CD30 阳性PTCL。BV作为CD30 阳性T细胞NHL一线及二线治疗的重要药物,为PTCL的治疗带来了新的方向和希望,结束了T细胞淋巴瘤缺乏有效的靶向治疗的历史,但其在各亚组的疗效及BV联合化疗方面还需要更进一步的探索。特别是对于CD30
吉西他滨作为嘧啶类抗肿瘤药物,其作用机制与阿糖胞苷相同,主要代谢物在细胞内掺入DNA,并作用于G1/S期,有研究指出:吉西他滨可对处于S期的淋巴样细胞产生影响,且直接促进淋巴样细胞凋亡,该机制可指导吉西他滨对淋巴样细胞肿瘤治疗的研究。但不同的是双氟脱氧胞苷除了掺入DNA以外,还可抑制核苷酸还原酶,继而减少细胞内脱氧核苷三磷酸酯;其次该药物具有自我增效的作用;而且,该药物还可诱导相关凋亡基因以及蛋白的激活,在诱导细胞凋亡过程中,对内源性神经酰胺进行激活,触发caspases3 激活,诱导bcl-x、caspases9 的剪接变化,明显上调Bax、caspases9以及caspases3等基因的表达,且下调bcl-x表达,吉西他滨所介导的细胞凋亡同bcl-2在细胞中表达程度存在一定关系,其表达程度同吉西他滨的细胞毒性相关,bcl-2 过表达可导致吉西他滨诱导凋亡的半数致死剂量明显的提高。在bcl-2 甲组中,Mcl-l抗凋亡蛋白是细胞凋亡和生存重要的靶机关之一,吉西他滨可明显下调Mcl-l 在NHL细胞株中的表达,而对于细胞杀伤毒性明显提高。在临床可应用在多种实体瘤治疗中,已有研究证实吉西他滨治疗NHL的有效性,但含有吉西他滨的治疗方案值得进一步探索[10]。本研究结果显示,观察组近期疗效(58.33%)高于对照组(16.67%),观察组治疗后血清β2~MG、LDH、TNF-α均低于对照组,1 年内生存率、2 年内生存率及生存时间高于对照组,且不良反应发生率与对照组相比无差异,由此证实,在CHOP方案的基础上加用吉西他滨可延长患者整体生存周期,但查阅资料发现吉西他滨最主要不良反应为骨髓移植(以血小板、中性粒细胞减少为特点)[11-12]。因此在实施治疗过程中需密切观察患者血常规结果,必要时可指导患者使用促血小板生成类药物,达到减少骨髓抑制等不良反应发生率的目的,但若治疗期间患者出现恶心、呕吐等症状需及时进行药物缓解,必要时可停止治疗,同时在吉西他滨联合CHOP治疗过程中,医务人员需根据患者病情合理控制药物剂量,达到确保治疗安全性及有效性的目的。
本实验有些不足之处,维布妥昔单抗是CD30阳性T细胞淋巴瘤的治疗首选,由于本实验入组时间较早、以及患者经济原因,未能将维布妥昔单抗应用于本研究之中,对研究结果影响较大。另外,本研究样本病例数较小、病例均来源于同一地域、研究时限较短,对结果的一般性、普遍性、有效性有所影响,故仍旧需临床扩大样本病例数、增加不同地域T-NHL患者、延长研究时限,为评估吉西他滨联合CHOP方案在T-NHL治疗中的近远期疗效提供更多可靠参考依据。
综上所述,在CHOP方案的基础上加用吉西他滨可提高其1年、2年内生存率,抑制血清β2~MG、LDH、TNF-α释放,亦可延长患者生存周期,值得借鉴。
