基于真实情境的深度学习与思维发展
2022-05-30王长艳李伏刚陈瑞雪
王长艳 李伏刚 陈瑞雪


摘要:基于对化学深度学习的研究,在模拟侯氏制碱的情境中思考、分析碳酸钠工业制备的原料、原理问题,建立认识物质和分析转化的学科视角;实验探究碳酸钠和碳酸氢钠的性质差异,思维有序地从定性和定量的角度分析混合物,提升真实情境下综合复杂问题的解决能力,发展学生化学学科核心素养。
关键词:制备Na2CO3;深度学习;思维发展
文章编号:1008-0546(2022)08-0047-05 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2022.08.010
化学深度学习的内涵为:“在教师引领下,学生围绕具有挑战性的学习主题,开展以化学实验为主的多种探究活动,从宏微结合、变化守恒的视角,运用证据推理与模型认知的思维方式,解决综合复杂问题,获得结构化的化学核心知识,建立运用化学学科思想解决问题的思路方法,培养学生的创新精神和实践能力,促进学生核心素养的发展。[1]”化学深度学习的根本目标是改变学生的学习方式,促进化学学科核心素养发展。基于对化学深度学习的研究,在进行元素化合物内容教学时,恰当选取真实生产生活情境,课堂中以具体知识为载体,以带有驱动性的问题引领学生进行驱动思考、深度探究,将问题“情境化”,促使学生基于问题深度参与课堂学习,提升真实情境下综合复杂问题的解决能力,发展学生化学学科核心素养。
一、课程标准要求和教学内容分析
《普通高中化学课程标准(2017年版2020年修订)》对碳酸钠和碳酸氢钠内容的教学要求是:结合真实情境中的应用实例或通过实验探究,了解钠及其重要化合物的主要性质,了解这些物质在生产、生活中的应用[2]。教材内容安排主线为展示碳酸鈉和碳酸氢钠的主要用途→实验比较碳酸钠和碳酸氢钠的溶解性→介绍碳酸钠和碳酸氢钠的主要物理性质→实验对比碳酸钠和碳酸氢钠的热稳定性→科学史话介绍侯德榜和侯氏制碱法。教材内容的编排给出了研究碳酸钠和碳酸氢钠性质的基本方法——对比法,也给实际教学提供了丰富的情境素材,既可以从生活实际应用入手进行学习,又可以从实验探究进入学习,还可以借助侯氏制碱法并结合工业生产深入学习。基于学生在初中学习过部分碳酸钠和碳酸氢钠的性质,在本节前一部分运用对比法学习了氧化钠与过氧化钠的性质,碳酸钠和碳酸氢钠这部分教学内容可以在深入了解两种盐各自性质的基础上进一步开放思维,以哪些物质之间的反应可以生成Na2CO3引发思考,从元素找寻物质,多角度分析实际工业生产的需求;以测定实验室制备出的产品碳酸钠含量引发师生间、生生间思维的碰撞,梳理出对于混合物进行定性、定量分析的思路。
二、教学目标和教学流程
(1)通过思考、分析碳酸钠工业制备的原料、原理问题,进一步建立认识物质、分析转化的学科视角。
(2)通过实验探究碳酸钠和碳酸氢钠的性质差异,进而思维有序地从定性、定量的角度分析混合物,促进科学探究与创新意识的化学学科核心素养的发展。
(3)通过对纯碱工业的发展史和侯德榜个人事迹的介绍,感悟“实干兴邦”的重要意义,落实科学态度和社会责任的化学学科核心素养。
本节课的情境线、问题线、学生认识发展线设置如图1所示。
三、教学过程
1.探秘侯氏制碱法
【展示】碳酸钠和碳酸氢钠的主要用途。
【提问】哪些物质之间的反应可以生成Na2CO3?
【回答】Na2O、Na2O2、NaOH都可以与CO2反应生成 Na2CO3。
【思路外显总结】(见图2)
【追问】依据哪些因素思考图2所示反应是否能够应用于工业生产中?
【思考】从原料来源、成本、生产工艺、安全性等选择NaOH与CO2反应制备Na2CO3。
【展示】NaOH、Na2CO3成本价格。
【师】需要找到更加廉价易得的Na源。
【生】NaCl。
【提问】NaCl + NH3+ CO2+ H2O = NaHCO3↓+ NH4Cl此反应能发生的原因是什么?
NaHCO3→ Na2CO3转化可以实现吗?
【思考回答】反应能发生的原因是NaHCO3溶解度小,NaHCO3受热质量减少,预测NaHCO3受热能分解,产物可以用澄清石灰水鉴别。
设计意图:从物质所含核心元素的角度寻找实现制备碳酸钠的诸多反应,进而分析Na2CO3工业制备的原料、原理问题,建立认识物质、分析转化的学科视角,提升证据意识、科学探究意识。
【师】很好,以上我们分析的反应原理就是侯氏制碱法的主要制备原理。
【展示】侯氏制碱法原理。
【师】侯氏制碱法又称联合制碱法,是我国化学工程专家侯德榜先生于1943年创立的。侯氏制碱法的创举在于不仅可以获得产品Na2CO3,还可以获得产品 NH4Cl。
设计意图:感悟侯氏制碱法的精妙,落实科学态度和社会责任的化学学科核心素养。
2.模拟侯氏制碱法制备Na2CO3
【展示】碳酸钠实验室制备过程。(见图3)
反应原理:NH4HCO3+NaCl=NaHCO3↓+NH4Cl 2NaHCO3 Na2CO3+H2O+CO2↑
【提问】产品中碳酸钠的含量是多少呢?产品可能存在哪些杂质?
【回答】产品中可能存在没有分解完全的 NaHCO3,还可能有NaCl、NH4Cl。
【继续思考】依据资料NH4Cl溶解度大,受热易分解,产品中可能有NaHCO3和NaCl。
设计意图:从制备原理出发分析产品中可能存在的杂质,结合已有证据作出合理推断。
【提问】如何知道产品中是否还存在NaCl 呢?
【回答】可以利用 AgNO3溶液鉴别产品中是否含有NaCl。
【展示说明】产品经硝酸酸化后滴加 AgNO3溶液后产生白色沉淀,产品中存在NaCl。
【追问】如何知道产品中是否还存在没有分解的 NaHCO3呢?
【回答】还可以继续受热分解检测分解产物。
设计意图:基于已有认知、物质性质提出恰当的检验方法。
【师】还有没有其他方法呢?我们再多了解一些 Na2CO3、NaHCO3的性质。
【展示】碳酸钠和碳酸氢钠溶解性的比较实验。
【分组实验】Na2CO3溶液、NaHCO3溶液分别与稀盐酸、Ba(OH)2溶液的反应。
【说明】学生在分组实验中发现,起始向Na2CO3溶液滴加稀盐酸无明显现象,继续滴加产生气泡,向 NaHCO3溶液滴加稀盐酸即有气泡产生;向 Na2CO3溶液、NaHCO3溶液中滴加 Ba(OH)2溶液均有白色沉淀生成。
【实验原理分析】
Na2CO3+2HCl=2NaCl + H2O + CO2↑
Na2CO3+ Ba(OH)2=BaCO3↓+2NaOH
NaHCO3+ HCl=NaCl + H2O + CO2↑
NaHCO3+ Ba(OH)2=BaCO3↓+ NaOH + H2O
设计意图:通过教师演示、学生预测、分组实验进一步认识碳酸钠、碳酸氢钠的化学性质,发展科学探究核心素养。
3.产品成分鉴定
【师】现在我们对于Na2CO3和NaHCO3又多了一些认识。
【提问】如果产品质量是m克,如何知道其中是否还存在没有分解的NaHCO3呢?
【分组思考】
【思考、分析】如果能知道产品中盐酸反应产生 CO2的量是不是可以确定出是否含有NaHCO3呢?
【回答】应该可以。如果产品中含 NaHCO3,与盐酸反应释放出 CO2气体的质量应该与纯净的 Na2CO3不相等。
【追问】但是产品中有NaCl,NaCl 的质量可以知道吗?
【回答】杂质 NaCl 的质量可以通过产品与AgNO3溶液沉淀获得AgCl 的质量确定下来。
【追问】还有其他方法吗?
【回答】利用与Ba(OH)2溶液反应获得沉淀BaCO3的质量也可以确定。
【师】我们想知道产品中是否还存在没有分解的 NaHCO3,刚才大家的想法实际上一直在进行比较,是与什么进行对照的呢?
【回答】與纯净的Na2CO3进行比较。
【师】物理性质可以帮助我们确定产品中是否还存在没有分解的NaHCO3吗?
【回答】如果产品中杂质少利用颜色、状态、溶解性不易判断。
设计意图:基于碳酸钠和碳酸氢钠的物理性质、化学性质提出完成对混合物进行定性说明NaHCO3存在、定量确定 Na2CO3含量的可行性,并在分析过程中完善认识思路。
【思路外显和总结】(见图4)
【师】通过上面的分析我们可以感受到以上的鉴别方法在实际操作中也都存在操作复杂的问题,且杂质如果含量不高不易获得准确结果,那么还有其他方法吗?
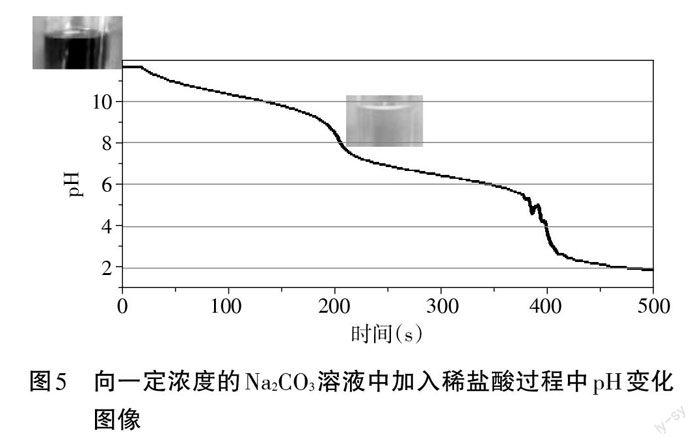
【展示】向一定浓度的 Na2CO3溶液中加入稀盐酸过程中pH变化图像(见图5)。
【提问】依据 pH 的图形走势,Na2CO3溶液与稀盐酸是怎样进行反应的?
【倾听、思考、分析】Na2CO3溶液与稀盐酸反应是分段进行的。
【展示】向产品溶液中加入稀盐酸 pH 变化图像(见图6)。
【提问】依据pH的图形走势,若产品中含有NaHCO3则在滴入稀盐酸发生反应的两个阶段耗用盐酸的体积大小关系是什么?
【分析、回答】若产品中不含有NaHCO3则分段所用稀盐酸体积应是一样大的,若含有NaHCO3,第二阶段用的稀盐酸会更多。
设计意图:以向一定浓度的Na2CO3溶液中加入稀盐酸后pH 变化的图像为证据,分析Na2CO3溶液与稀盐酸反应的过程,进而分析滴定法应用于Na2CO3含量测定的可操作性。
【师】我们也有一些现代仪器分析方法可以帮助我们确定产品中是否含有NaHCO3。
【展示】利用红外光谱仪、X-射线衍射仪测定产品中是否含有NaHCO3的方法。
【说明】NaHCO3结构中独有的氧氢结构会在红外光的入射下特定的位置产生吸收峰,据此可知是否含有NaHCO3(见图7);每一种晶体物质都具有特定的晶体结构,用X射线照射试样,试样中的物质受激发后会在特定的位置出现吸收峰,通过样品和纯品的比对,就可以知道其中是否含有NaHCO3(见图8)。
【提问】依据今天所学找出能够实现 Na2CO3、 NaHCO3转化的方法。
【回答】向 Na2CO3溶液中加入少量盐酸可以生成 NaHCO3。NaHCO3固体受热分解得到Na2CO3。NaHCO3与NaOH溶液反应可以生成Na2CO3。
【师】还有其他方法吗?
【展示】向饱和Na2CO3溶液中通入CO2。(见图9)
【生】向饱和 Na2CO3溶液中通入 CO2也会生成 NaHCO3。NaHCO3溶解度小会在溶液中以固体形式析出。
设计意图:从组成、性质认识 Na2CO3、NaHCO3相互转化的方法,正盐与酸式盐相互转化的一般规律。
四、教学效果及反思
碳酸钠和碳酸氢钠的学习基于教材内容,在真实情境中设计符合学生认知发展规律的递进问题,开展了有效的基于问题的驱动思考、深度探究,促进了学科深度学习与学生思维发展。整节课思路清晰,具备以下特点:
1.重视情境创设,体现学科价值
“碳酸钠和碳酸氢钠”是继“氧化钠和过氧化钠”之后学生需要掌握的另外两种重要的钠的化合物。本次学习以哪些物质之间的反应可以生成 Na2CO3引发思考,从元素找寻物质,多角度分析实际工业生产的需求;以测定实验室制备出的产品Na2CO3含量引发师生间、生生间思维的碰撞,梳理出对于混合物进行定性、定量分析的思路。学生在教师创设的具有探究性、启发性、生动性的情境中激发学习兴趣,步步深入探究,凸显了核心知识的应用价值。
2.关注问题解决,构建认识思路
本次学习从物质所含核心元素的角度寻找实现制备Na2CO3的诸多反应,进而分析Na2CO3工业制备的原料、原理问题,建立认识物质、分析转化的学科视角;基于Na2CO3和NaHCO3的物理性质、化学性质提出完成对混合物中NaHCO3是否存在的证明。学生的认识思路在寻找性质差异、对比纯净 Na2CO3、思索证据是否充分中逐步完善形成,在进一步认识 Na2CO3和 NaHCO3的相关性质基础上,建立了科学探究的思维模式。
3.致敬侯氏制碱,培植社会责任
本次学习的情境取自在实验室模拟侯氏制碱法制备Na2CO3。在教学过程中适时将侯氏制碱法、侯德榜先生的事迹介绍给学生,学生在课堂学习中感受中国化学化工专家为国家发展所作出的贡献,深悟自己身上承担的社会责任,让学科德育落地生根。
参考文献
[1]胡久华,罗滨,陈颖.深度学习:走向核心素养[M].北京:教育科学出版社,2019,2-3.
[2]中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[S].北京:人民教育出版社,2020:33-35.
[3]商建波,杨玉琴.基于真实情境的深度学习——以人教版九年级化学“溶液的形成”为例[J].化学教学,2020(12):35-40.
