PCR技术对发酵食品中 微生物检测的效果分析
2022-05-30支晓洁
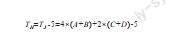
食品中微生物含量的检测主要包括菌落总数、大肠杆菌群落以及病原微生物三个方面的检测。检测人员需要先对食品进行特殊的处理,在相对特定的环境下进行培养,然后检测相关重要指标。除了益生菌之外,其他细菌群落的数量越多,就代表着食品中因为微生物导致的污染越严重,最终导致食品的安全性能较差。传统的显微镜镜检法主要是利用微生物的形态以及数量来进行检测,虽然灵敏度相对比较高,但是检测的流程较为复杂,检测的时间也很长,效率不高。再加上部分食品的保质期相对较短,传统检测方法的局限性就很容易影响食品在市场上的流通。为此,在发酵食品的微生物检测中探求一种准确且快速的检测方法,对于预防食品安全问题的发生具有十分重要的意义。
一、检测与方法
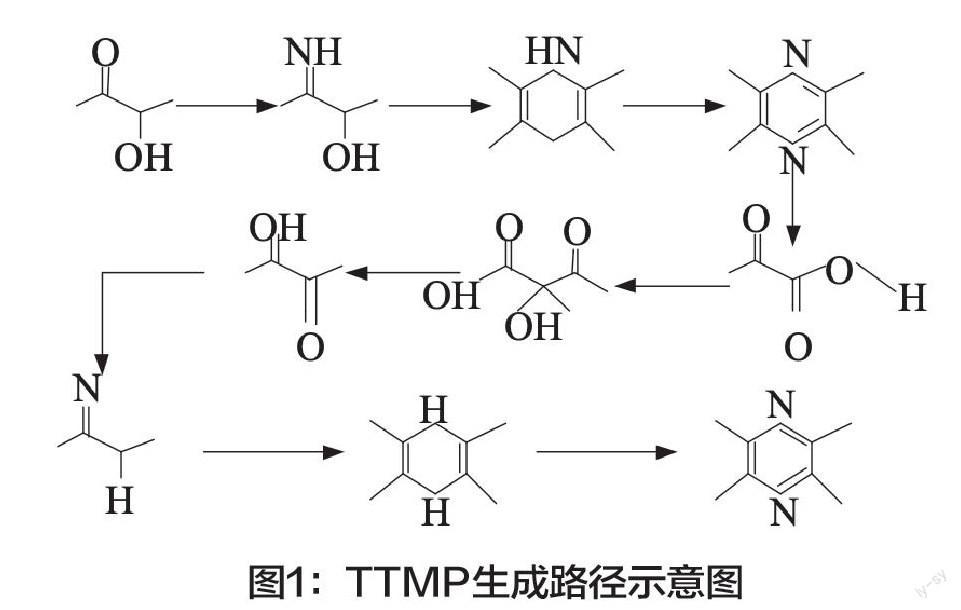
1.样品前处理及核酸提取。四甲基吡嗪(TTMP)是一种含氮的杂环化合物,天然存在于水果、坚果、豆制品、乳制品以及各种酒类等发酵食品中。因为发酵食品中TTMP的含量相对较低,而且相对于其他组成成分来说较为复杂,所以要想对发酵食品中微生物的含量进行检测,必须首先对发酵食品进行前处理,去除一些干扰物质,并且增加TTMP的含量。前处理最常使用的是溶剂萃取技术、分散液相微萃取技术以及固相微萃取技术中的顶空萃取方法。
(1)溶剂萃取技术。在溶剂萃取方法中,常用有机溶剂进行萃取,通过三氯甲烷来萃取食品中的TTMP,再使用0.5mol/L的盐酸溶液将TTMP萃取到由金属离子组成的水溶液状态,然后使用高效液相色谱来进行检测,回收率高达85%以上。另一种萃取方法就是使用重蒸溶液对饱和状态下的氯化钠溶液进行萃取,通过调节氢离子的浓度可以将其逐渐分成酸性、碱性以及中性三个部分,将其干燥之后再使用气相色谱来进行检测。
(2)分散液相微萃取技术。分散液相微萃取技术能够减少有机溶剂的使用,并且提高检测效率,在样品的前处理工作中应用广泛。通过分散液相微萃取技术也可以提取发酵食品中TTMP的含量,先用400μmol/L的二氯甲烷来进行萃取,再用4mL的乙醇溶剂来进行分散,回收率可高达97%以上。为了减少萃取所用的时间,还可以利用超声以及涡旋的方式来进行辅助,通过60s的超声或者是涡旋可以使萃取的过程达到平衡状态。
(3)固相微萃取技术中的顶空萃取方法。固相微萃取技术中的顶空萃取方法无须使用溶剂,检测成本较低,检测速度相对较快,因此被广泛应用在低分子或者低沸点的化合物检测中。
通过上述方法可以得知TTMP生成的路径,具体如图1所示。因为很多食品中微生物的浓度相对较低,所以在对样品进行前处理之后要使其浓度达到一定标准,而且样品前处理之后的反应很难使其中的分子灵敏度达到极限状态,还容易出现细菌数量损失的情况,因此需要将其内部核酸显露出来,这样才可以准确地对其进行检测。处理的方法大多是对其进行加热、重复地冻融以及利用化学试剂来进行裂解,当直接使用化学试剂来进行细菌裂解时,需要注意细菌中的蛋白质可能会压抑Taq酶的活性。只要细菌浓度不超过150cfu/μL,细菌裂解之后的核酸就不需要再进一步纯化。使用FHLP和FGLP两种膜进行水样过滤之后,经过多次的冻融以及在不移走过滤膜的前提下,可以对其进行核酸提取。
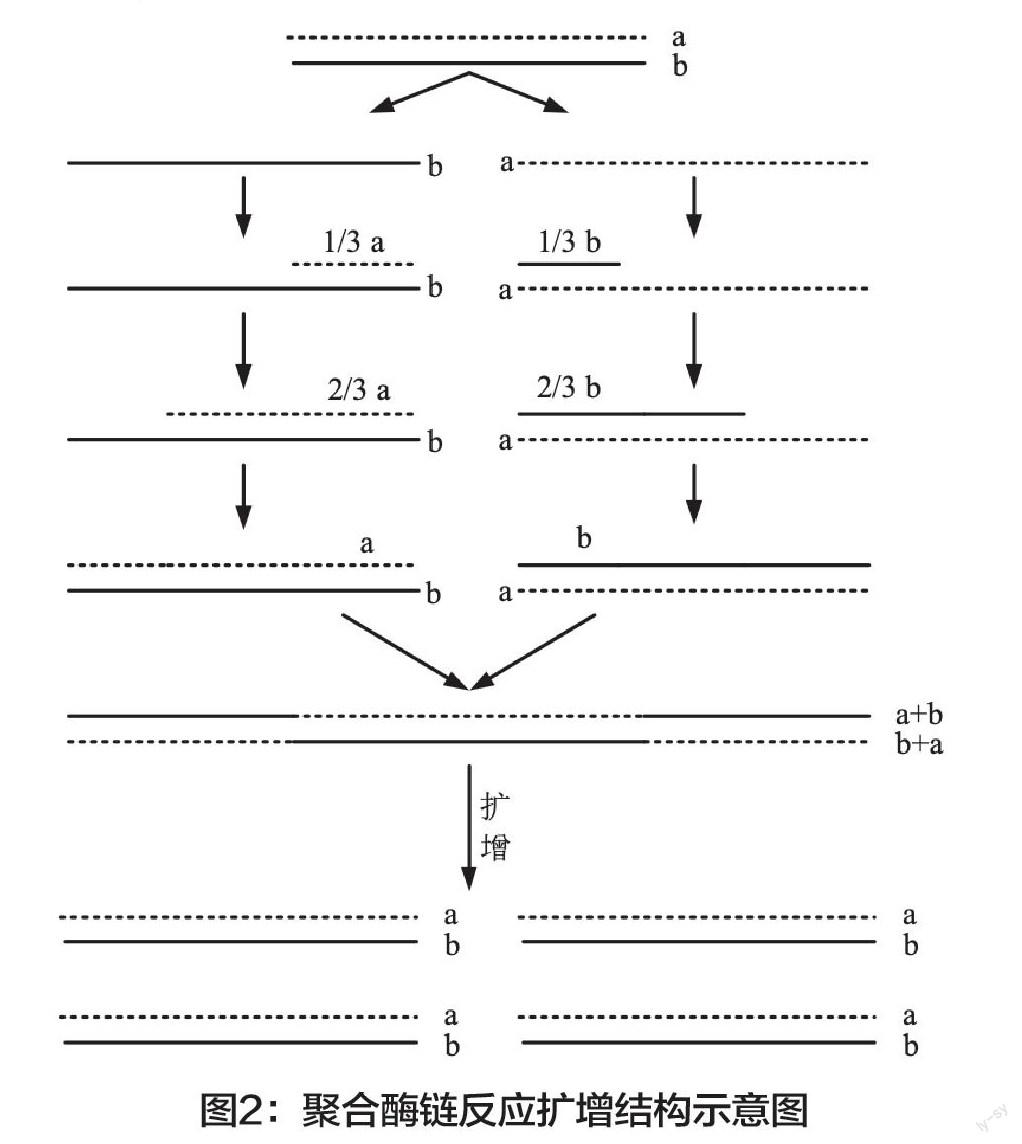
2.PCR扩增与合成检测。聚合酶链式反应(简称PCR)是一种可以快速对DNA进行扩增的方法,可以使某一特定序列上的微量DNA片段在非常短的时间内快速扩增。聚合酶链式反应对DNA进行扩增通常是由20-40个聚合酶链反应组合而成,并且每一个反应都是由高温变性、低温退火、适温延伸这三个步骤组合而成。在经过高温的过程中,DNA性质发生改变,氢键被打开之后,双链就可以转变为单链,这一步骤就可以作为扩增过程中的模板;在经过低温的过程中,左端和右端的引物可以与扩增模板中的两条单链进行互补,这一过程称为退火;在达到适合温度的状态时,利用DNA中的聚合酶可以将四种脱氧核苷的三磷酸酯按照碱基互补的方式来进行配对,将其增加到引物的末端位置并按照一定方向延伸到新的DNA中,将单链模式变为双链模式,然后将双链模式下的DNA重复上述的过程,可以使引物的DNA数量成倍增加。
通常情况下,聚合酶链式反应在进行变性过程中,温度应该维持在95℃,如果还没进行扩增区域内的聚合酶所占比例过高,就可以适当提高温度。退火状态下的温度跟DNA碱基中聚合酶的含量存在一定关系,具体如下式所示:
TH=TJ -5=4×(A+B)+2×(C+D)-5
在上式中,TJ表示解链的温度,A和B表示DNA碱基中聚合酶的数量,C和D表示相应碱基的个数。通过在TH的附近进行测试,确定退火状态下最佳的温度形态。如果延伸的温度在75℃时,DNA中聚合酶的速度为1500(碱基)/min,那么聚合酶链式反应就是将DNA扩增模板、左右端引物、聚合酶、混合液、混冲液、双蒸水以及镁离子等混合至微型管子中,并在仪器上完成。其中,镁离子为聚合酶中活力因子所需要的金属离子,浓度通常为2-3.5mol/L。因为引物的DNA数量是成倍增加的,所以可以得到聚合酶链反应扩增结构,如图2所示。
使用聚合酶链式反应来进行微生物含量检测,就是需要对DNA进行扩增。从理论上来说,就是在微生物含量高的区域设置左右端引物,这样就可以将微生物利用片段扩散而出。如果在微生物含量属特异性区域内设置左右端引物,那么只有本属状态下的微生物才可以被扩散;如果在微生物含量种特异性區域内设置左右端引物,那么就只有特定区域内的微生物才可以被扩散。最终可以根据已了解的微生物信息,设计出一种特定的左右端引物,来进行聚合酶链式反应。一旦扩增的产物达到一定长度,就说明扩增的模板为该微生物的DNA,表示待测微生物存在一定的数量。聚合酶链式反应的时间较短,可以将传统检测方法所需的数天缩短至几小时。
例如,用琼脂糖凝胶电泳法可以准确检测出发酵食品中的微生物含量,由于凝胶电泳法中的琼脂糖质量在1%-2.5%,并且质量分数会根据片段大小而决定,因此等待分离状态下的片段中分子含量越小,就代表琼脂糖质量越大。使用凝胶电泳法之后还需要使用溴化乙锭进行染色,将其插入到DNA的碱基中,经过紫外线放射后呈现出荧光,这样就可以准确地识别出发酵食品中的微生物及其含量大小。
二、应用与分析
为了验证本研究提出的微生物含量检测方法的可靠程度和实际应用效果,本次检验主要对发酵食品样品中最主要的三种微生物进行检测,分别为酵母菌、霉菌以及细菌,并对其结果进行分析,以此判定该发酵食品样品的安全性。
实验所需要的主要材料是蛋白胨、琼脂、酵母浸膏以及蒸馏水,在进行检测之前还需要对发酵食品中的微生物进行培养,具体培养方法如下:一是原始溶液制作。从送检的发酵食品中取出2份质量相同(均为12g)的样品装入烧杯中,加入1500mL的生理盐水,其中蛋白胨的含量在1%左右,混合之后将其搅拌3-5h;在无菌的条件下,使用洗脱液进行过滤处理,混合均匀即可。二是微生物培养。取5mL的原始溶液,放置在80℃的水中静置10min,再取1mL静置之后的原始溶液、1mL的十进制稀释液以及15mL的琼脂混合均匀,待其凝固之后,使用5mL相同的培养基对其表层进行覆盖,并将平皿倒置在厌氧罐中,最后在恒温培养箱中对其进行24-96h的培养。
在准备好所需要的材料之后,对微生物的培养分别设置24h、48h、72h、96h这4个不同的时间梯度,并且在搅拌温度、搅拌速度以及搅拌时间均相同的情况下,分别使用两种不同方法进行检测,所得到的结果对比如图3所示。
由图3可知,培养时间从0h增加到24h时,传统方法检测出的微生物含量为2×105cfu·g-1,生物化学方法检测出的微生物含量则为6×105cfu·g-1;培养时间从24h增加到72h时,虽然微生物含量的发展状况是趋于平缓的状态,但是两种方法检测出的微生物含量还是存在一定差距,传统方法检测出的微生物含量为2×105-4×105cfu·g-1,生物化学方法检测出的微生物含量则为6×105-8×105cfu·g-1;培养时间从72h增加到96h时,生物化学方法检测出的微生物含量明显增多,具体结果为10×105cfu·g-1,而传统方法检测出的微生物含量只有5×105cfu·g-1。
此次研究的微生物含量检测方法是在传统方法的基础上,结合核酸提取以及PCR扩增技术来提高检测结果的准确度以及有效缩短检测时间,为有效预防食品安全问题的发生以及完善食品微生物检测体系提供了更加完整的理论基础。由于此方法也有一定的局限性,對实验操作过程要求较高,因此今后可以进一步探索高效且准确度高的技术手段,从而更加准确地检测出食品中微生物的含量,以此达到有效预防食物中毒的效果。
作者简介:支晓洁(1984-),女,陕西咸阳人,工程师,硕士研究生,研究方向为食品检验检测。
