前列安通片质量评价研究
2022-05-30胥思彤朱旭江王兰霞刘竞叶青高嘉雯张迈娜
胥思彤 朱旭江 王兰霞 刘竞 叶青 高嘉雯 张迈娜


【摘 要】 目的:建立前列安通片薄层鉴别和多成分含量测定的方法。方法:采用薄层色谱法(Thin Layer chromatography,TLC)对关黄柏、赤芍、丹参、白芷进行定性鉴别;采用超高效液相色谱法(Ultra Performance Liquid Chromatography,UPLC)同时测定盐酸黄柏碱、木兰花碱、芍药内酯苷、芍药苷、盐酸小檗碱、盐酸巴马汀和丹酚酸B 7 种成分的含量,并进行聚类分析和主成分分析。结果:TLC 鉴别方法专属性强,能够有效鉴别4味药材;7 种成分在各自范围内线性关系良好(r≥0.9997),平均加样回收率96.00%~100.99%,RSD<3.0%;批次间各成分含量RSD均>10.0%,其差异性主要来源于关黄柏。结论:本研究建立的质量控制方法稳定可行,为前列安通片质量标准提高提供参考,并提示厂家在生产的制剂的过程中要进一步加强对关黄柏药材的质量控制。
【关键词】 前列安通片;含量测定;质量评价;聚类分析;主成分分析
【中图分类号】R284.1 【文献标志码】 A【文章编号】1007-8517(2022)14-0071-07
Quality Evaluation of Qianlie Antong Tablets
XU Sitong1ZHU Xujiang2WANG Lanxia1*LIU Jing1YE Qing1GAO Jiawen1ZHANG Maina1
1.Gansu University of Chinese Medicine,Lanzhou 730000 China;
2. Gansu Institute for Drug Control,Lanzhou 730000,China
Abstract:Objective To establish a methods for chromatographic identification and quantitative determination in Qianlie Antong Tablets. Methods phellodendri Amuiensis Cortex, Paeoniae Rubra, Salviae Miltiorrhizae Radix et Rhizoma and Angelicae Dahuricae Radix in Qianlie Antong Tablets were identified by TLC; UPLC was applied to simultaneously determine phellodendrine hydrochloride, magnoflorine, alibiflorin, paeoniflorin, berberine hydrochloride, palmatine hydrochloride and salvianolic acid B, and cluster analysis and principal component analysis were carried out. Results TLC identification method was specific, which could effectively identify the four herbs;Seven constituents showed good linear relationship within their own ranges (r≥0.9997), whose average recoveries were 96.00%~100.99% with the RSDs of less than 3.0%.respectively(RSD<3.0%). The RSD of each component content was more than 10.0%, and the differences were mainly derived from phellodendri Amuiensis Cortex. Conclusion The established quality control method is stable and feasible, which can provide reference for improving the quality of Qianlie Antong Tablets. It is suggested that the quality control of phellodendri Amuiensis Cortex should be further strengthened in the process of producing preparations.
Key words:Qianlie Antong Tablets; Content Determination; Quality evaluation; Cluster Analysis; Principal Component Analysis
前列安通片是由關黄柏、赤芍、丹参、桃仁、泽兰、乌药、王不留行和白芷组成的复方制剂,具有清热利湿、活血化淤之功效,用于治疗湿热淤阻证,症见尿频、尿急、排尿不畅、小腹胀痛等,常用于治疗前列腺炎类疾病[1-3]。其中君药关黄柏中生物碱类成分、臣药赤芍和丹参中芍药苷、芍药内酯苷和丹酚酸B具有抗炎、抗菌、镇痛、降压、抗氧化、抗肿瘤等作用[4-6]。目前,前列安通片的质量标准中只包含关黄柏和赤芍的鉴别项目和盐酸小檗碱的含量测定项目,缺少对其他有效成分的检测,不能全面反映其质量。本实验通过TLC法和UPLC法对前列安通片中各成分进行定性鉴别及定量检测,并结合化学计量学分析方法综合评价制剂质量,分析批次间的差异,以期为更为全面、合理地评控前列安通片的质量提供参考。
1 仪器与材料
1.1 仪器 自动薄层点样仪及成像仪(瑞士CAMAG公司);ME 204(0.1 mg)、MS205(0.01 mg)、XPE26(0.001 mg)电子天平(瑞士METTLER公司);KQ-500DE超声清洗仪(昆山市超声仪器有限公司);硅胶G薄层板(德国Merck公司、青岛海洋化工有限公司);Agilent 1290 UPLC色谱仪(美国安捷伦公司)。
1.2 材料 前列安通片(批号:2001086001、2003086303、2004086001、2004088301、2004090301、2005086301、2005088301、2005087001、2005088301、2006086001)由甘肃独一味生物制药股份有限公司提供。关黄柏、丹参、赤芍、白芷对照药材(批号分别为:120937-201408、120923-201816、12093-201303、120945-2201510)均购自中国食品药品检定研究院。原儿茶醛(批号:110810-201608,纯度:99.3%)、芍药苷(批号:110736-201943,纯度:95.1%)、盐酸小檗碱(批号:110713-201814,纯度:86.7%)、盐酸黄柏碱(批号:11895-201805,纯度:94.9%)、盐酸巴马汀(批号:110732-201913,纯度:85.7%)、丹酚酸B(批号:11562-201716,纯度:94.1%)对照品均购自中国食品药品检定研究院;木兰花碱(批号:wkq20031310,纯度:98%)、芍药内酯苷(批号:wkq20040106,纯度:98%)对照品均购自四川省维克奇生物科技有限公司。乙腈为色谱纯,购自德国Merck公司;其余试剂均为分析纯,购自国药集团化学试剂有限公司;水为超纯水。
2 方法与结果
2.1 TLC鉴别
2.1.1 关黄柏鉴别 取1.0 g样品粉末、0.2 g关黄柏对照药材和1.0 g缺关黄柏阴性样品,加乙酸乙酯20 mL,超声30 min,过滤,蒸至1.5 mL,即得供试品液、关黄柏对照药材液和阴性样品液。将8 μL的上述3种溶液点于同一硅胶G薄层板上,以石油醚(60~90 ℃)-乙酸乙酯(1∶1)展开,喷以10%硫酸乙醇溶液,在105℃加热至显色,显出与关黄柏对照药材相同颜色的主斑点,阴性无干扰。如图1 A所示。
2.1.2 赤芍鑒别 取1.0 g样品粉末、0.1 g赤芍对照药材和1.0 g缺赤芍阴性样品,加无水乙醇25 mL,超声20 min,过滤,蒸至1.5 mL,即得供试品液、赤芍对照药材液和阴性样品液。取芍药苷对照品适量,加甲醇制成0.5 mg/mL的对照品液。将4 μL对照药材液及8 μL其余3种溶液点于同一硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲醇-甲酸(40∶5∶12∶0.2)展开,喷以5%香草醛硫酸溶液,在105 ℃加热至显色,显出与赤芍对照药材、芍药苷对照品相同颜色的主斑点,阴性无干扰。如图1 B所示。
2.1.3 丹参鉴别 取6.0 g样品粉末、1.0 g丹参对照药材和6.0 g缺赤芍阴性样品,加水100 mL,加热煮30 min,离心,取上清液,用乙酸乙酯提取2次,每次30 mL,合并乙酸乙酯液,蒸干,残渣加甲醇1 mL,即得供试品液、丹参对照药材液和阴性样品液。取原儿茶醛对照品适量,加甲醇制成0.2 mg/mL的对照品液。将10 μL上述4种溶液点于同一硅胶G薄层板上,以三氯甲烷-丙酮-甲酸(10∶1∶1)展开,喷以3%三氯化铁乙醇溶液显色,显出与丹参对照药材、原儿茶醛对照品相同颜色的主斑点,阴性无干扰。如图1 C所示。
2.1.4 白芷鉴别 取3.0 g样品粉末、1.0 g白芷对照药材和3.0 g缺赤芍阴性样品,加水100 mL,加热煮30 min,离心,取上清液,用盐酸调节pH值至2~3,二氯甲烷提取2次,每次20 mL,合并二氯甲烷液,蒸干,残渣加甲醇1 mL,即得供试品液、白芷对照药材液和阴性样品液。将5 μL上述3种溶液点于同一硅胶G薄层板上,以二氯甲烷-甲醇(20∶1)展开,置紫外灯光(365 nm)下检视,显出与白芷对照药材相同颜色的荧光主斑点,阴性无干扰。如图1 D所示。
2.2 含量测定
2.2.1 色谱条件 色谱柱:ACQUITY UPLC CSH-C18色谱柱(2.1 mm×100 mm,1.7μm);流动相:乙腈(A)-0.1%磷酸(B),梯度洗脱(0~5 min,5%~10%A;5~8 min,10%A;8~10 min,10%~12%A;10~14 min,12%~17%A;14~16 min,17%~21%A;16~18 min,21%A;18~23 min,21%~60%A);流速:0.4 mL/min;检测波长:230 nm(木兰花碱、芍药内酯苷、芍药苷)、286 nm(盐酸黄柏碱)、345 nm(盐酸小檗碱、盐酸巴马汀、丹酚酸B);柱温:40 ℃;进样量:2 μL。
2.2.2 对照品溶液 分别称取盐酸黄柏碱、木兰花碱、芍药内酯苷、芍药苷、盐酸小檗碱、盐酸巴马汀、丹酚酸B的对照品适量,精密称定,加50%甲醇制成浓度分别为5.504 μg/mL、29.831 μg/mL、21.599 μg/mL、22.862 μg/mL、36.726 μg/mL、11.038 μg/mL、24.428 μg/mL的混合对照品溶液。
2.2.3 样品溶液 取适量去包衣样品粉末,精密称定0.2 g,置具塞锥形瓶中,精密加入50%甲醇25 mL,称定重量,超声30 min,冷却后再称定重量,用50%甲醇补足损失重量,摇匀,过滤,取续滤液,即得。
2.2.4 阴性样品溶液 按质量标准中处方的比例及制法,分别制为缺关黄柏、赤芍、丹参的阴性样品,按上述方法制备成阴性样品溶液。
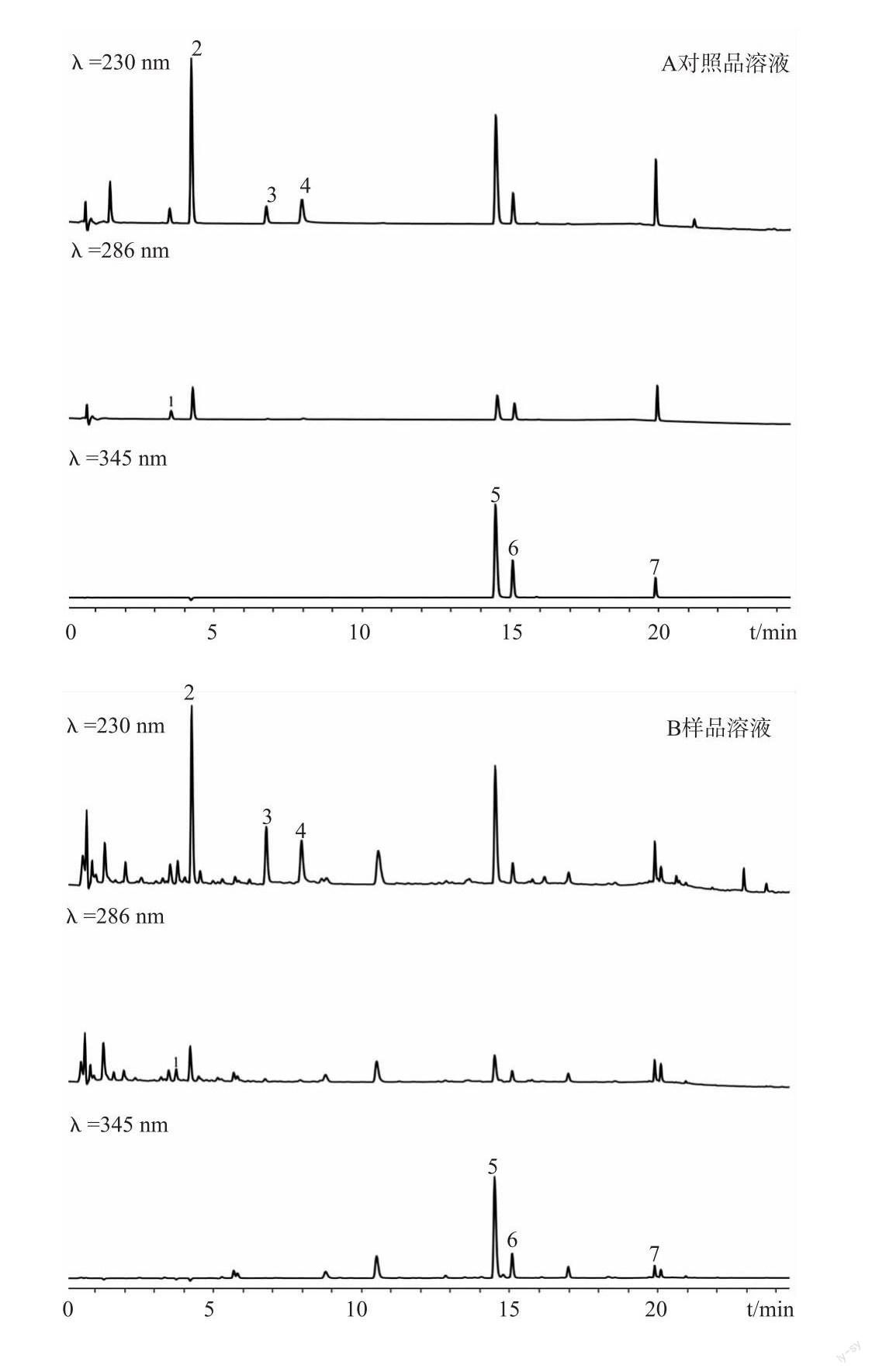
2.2.5 系统适应性试验取“2.2.2、2.2.3、2.2.4”项下溶液,按上述方法进样测定。结果如图2所示。由图2可知,7种成分与相邻组分均达到基线分离,分离度均大于1.5,理论塔板数均不低于10000,样品溶液中的7个指标成分的色谱峰与对照品溶液相对应,缺关黄柏阴性在盐酸黄柏碱、木兰花碱、盐酸小檗碱、盐酸巴马汀色谱峰处无检出、缺赤芍阴性在芍药内酯苷、芍药苷色谱峰处无检出、缺丹参阴性在丹酚酸B色谱峰处无检出。
2.2.6 线性关系考察 精密称取盐酸黄柏碱、木兰花碱、芍药内酯苷、芍药苷、盐酸小檗碱、盐酸巴马汀、丹酚酸B的对照品 2.90 mg、7.61 mg、5.51 mg、6.01 mg、10.59 mg、3.22 mg、6.49 mg,置于50 mL容量瓶中,加50%甲醇制成对照品储备液。将对照品储备液加50%甲醇分别稀释成2、5、10、25倍的稀释液。按上述方法进样测定5种不同浓度的对照品溶液,以峰面积为纵轴,对照品浓度为横轴,进行线性回归。结果见表1。
2.2.7 精密度试验 取混合对照品适量,按上述方法制备,连续6次测定,测得盐酸黄柏碱、木兰花碱、芍药内酯苷、芍药苷、盐酸小檗碱、盐酸巴马汀、丹酚酸B的峰面积RSD(n=6)分别为0.80%、1.32%、1.85%、0.27%、0.83%、1.05%、0.52%,仪器的精密度良好。
2.2.8 重复性考察 取样品(批号:2006086001)适量,按上述方法制备6份供试品溶液,进样测定,测得盐酸黄柏碱、木兰花碱、芍药内酯苷、芍药苷、盐酸小檗碱、盐酸巴马汀、丹酚酸B的含量RSD(n=6)分别为1.57%、1.96%、1.33%、1.63%、2.78%、2.63%、1.40%,该方法的重复性良好。
2.2.9 稳定性试验 取“2.2.7”项下供试品溶液,分别在0 h、4 h、8 h、12 h、16 h、20 h、24 h测定,测得盐酸黄柏碱、木兰花碱、芍药内酯苷、芍药苷、盐酸小檗碱、盐酸巴马汀、丹酚酸B的峰面积RSD(n=7)分别为1.33%、1.14%、1.80%、1.44%、0.66%、1.04%、1.10%,样品溶液24h内稳定。
2.2.10 加样回收率试验 分别精密称9份样品(批号:2001086001)0.1 g,加入相当于已知含量的50%、100%、150%对照品储备液,各3份。按上述方法制备,进样测定,计算回收率和RSD。结果见表2。
2.2.11 样品含量测定 取10批前列安通片样品,按上述方法制备并进样测定,计算含量。结果见表3。
2.2.12 化學计量学分析 将10批前列安通片测得的7种成分的两次平行实验数据含量测定结果作为变量,运用SPSS 19.0进行聚类分析。结果如图3所示;运用SIMCA 14.1处理,并采用主成分分析法得到10批样品得分图和7种成分的载荷贡献图。如图4、图5所示。图3显示,可将10批前列安通片分为2类,其中批次2004086001、2004087301、2004090301、2005086301、2006086001为第一类;2001086001、2003086303、2004088301、2005087001、2005088301为第二类。图4显示,10批前列安通片可分为与聚类分析结果一致的2类。分析图5发现,木兰花碱、盐酸巴马汀、盐酸小檗碱、盐酸黄柏碱4种成分的权重占比较高,表明其对上述分类间的质量差异性有关键影响,4种成分均系关黄柏的特征成分。
3 讨论
3.1 TLC鉴别 本实验对前列安通片中关黄柏、赤芍、丹参、白芷4味药材的TLC鉴别条件进行了考察和优化。为鉴定黄柏与关黄柏的混用情况,选择可以鉴别关黄柏特有成分黄柏酮成分的方法[7-8]。此方法参考2020版《中国药典》的关黄柏[鉴别]项下方法[7],使关黄柏的鉴别更具专属性。原标准中赤芍的TLC鉴别中使用乙醇提取,阴性对照品色谱中干扰较多,故选择无水乙醇为提取溶液,且添加了赤芍对照药材。白芷方法参考2020版《中国药典》中川芎茶调丸[鉴别](3)项下方法[7],同时比较了提取溶液二氯甲烷及三氯甲烷,提取pH值2~3及pH值10~12,最终确定此方法。
由于制作工艺需长时间高温煎煮,有效成分易进行转化,如在考察桃仁时出现斑点位置相同,颜色不一致的情况,故其余4味药材TLC鉴别还需进一步研究。
3.2 含量测定
3.2.1 提取方法的选择 本实验考察了提取溶剂:(100%、70%、50%)甲醇、50%乙醇和水及超声时间:15 min、30 min、45 min,发现为50%甲醇及超声30 min时,对7种成分的提取值较高。
3.2.2 色谱条件的选择 本实验考察了流动相A:甲醇、乙腈,流动相B:0.1%、0.4%磷酸及0.1%甲酸;柱温:30 ℃、35 ℃、40 ℃及体积流量:0.8 mL/min、1.0 mL/min、1.2 mL/min,并调整梯度条件[9-11];在波长190~400 nm间进行光谱扫描,结合相关文献[7,12-13],综合考虑各成分的分离度与峰型,最终建立的色谱条件如“2.2.1”项中所述,其中盐酸黄柏碱在样品中230 nm时分离度小于1.2,故选择在286 nm检测。比较同品牌规格为2.1 mm×100 mm,1.7 μm的CSH-C18和BEH-C18色谱柱,结果表明CSH-C18色谱柱对各成分的分离更好。
3.2.3 样品分析 由表3可看出,不同批次样品各成分含量的RSD均大于10%,说明各批次间均一性较差。结合主成分分析及聚类分析,发现批次间含量差异来源于关黄柏,说明其原因可能来自于投料时关黄柏的质量差异。查阅文献[14-16]后发现,关黄柏药材中生物碱类成分受种质、生长年限和产地的影响较大。同时也可能因厂家投料比例不精准及生产工艺的影响,对制剂质量产生影响。所以为提高不同批次间前列安通片质量的一致性,厂家在生产检验中应增加木兰花碱、盐酸巴马汀、盐酸小檗碱、盐酸黄柏碱作为其指标成分,这样更能够准确控制前列安通片的质量并确保药物的有效性。
为了提高前列安通片的一致性,厂家对采购的药材,除了对关黄柏质量的把控,严格以药典的品质标准进行,也应尽量规定其种质、产地及生长年限,即通过对药源的限制从而控制前列安通片的質量。在加工生产中,注意不同批次间的投料比,并优化生产工艺,提高不同批次间制剂质量的均一性。在质控中增加对关键成分木兰花碱、盐酸巴马汀、盐酸小檗碱、盐酸黄柏碱的检测项目,通过网络化实时监测,实现高效、有针对性地对前列安通片进行质量一致性评价。本实验所建立的关黄柏、赤芍、丹参、白芷的TLC法及同时测定前列安通片中7种成分含量的UPLC法科学、准确,可为更为全面的评控前列安通片的质量提供参考价值。
参考文献
[1]杨志兵. 前列安通片辅助阿奇霉素对慢性前列腺炎患者的临床疗效与安全性及其对前列腺功能的影响[J]. 抗感染药学, 2019, 16(10):1821-1823.
[2]谭云鹤,翟宇强,石硕文. 前列安通片联合甲磺酸多沙唑嗪控释片治疗良性前列腺增生术后尿道炎的临床效果[J]. 临床医学研究与实践, 2018, 3(36):50-51.
[3]国家药品监督管理局. 国家中成药标准汇编(外科妇科分册) [M]. 北京:国家药品监督管理局,2002:101-102.
[4]李先宽,冯杉,郑艳超,等. 黄柏与关黄柏的化学成分及生物活性研究进展[J]. 药物评价研究, 2019, 42(5):1033-1037.
[5]刘玉峰,孙珊珊,朱丽君,等. 赤芍中芍药苷和芍药内酯苷的代谢及药动学研究进展[J]. 辽宁大学学报(自然科学版), 2018, 45(4):296-303.
[6]任正肖,张颖颖. 丹酚酸B的化学成分及药理作用的研究进展[J]. 山东化工, 2019, 48(13):74-75, 82.
[7]国家药典委员会.中华人民共和国药典(一部) [M].北京:中国医药科技出版社,2020:78,153,166,542.
[8]单会娇,段立爽,齐歆,等. 对三版《中国药典》一部含黄柏或关黄柏制剂质量控制的探讨[J]. 中国药事, 2016, 30(11):1136-1142.
[9]胡小祥,张霞,何艳. HPLC可变波长法测定前列安通胶囊中的芍药苷、盐酸小檗碱和丹酚酸B[J]. 华西药学杂志, 2020, 35(2):198-200.
[10]李妍,王丽,李雅. HPLC法同时测定乙肝益气解郁颗粒中的11种成分[J]. 中草药, 2019, 50(18):4346-4351.
[11]刘敏彦,赵韶华,王玉峰,等. 超高效液相色谱法同时测定参松养心胶囊中8种活性成分的含量[J]. 中国医院药学杂志, 2014, 34(6):435-438.
[12]罗婷,王佳琪,江宇勤,等. 一测多评法测定不同产地黄柏炭中4种生物碱含量[J].天然产物研究与开发, 2019, 31(8):1357-1364.
[13]田斌,瞿孝兰,林义平,等. 基于多波长切换的HPLC法测定黄柏-蛇床子药对成分含量[J]. 中药材, 2020(8):1954-1957.
[14]陈瑶,张志鹏,张昭,等. 土壤因子对关黄柏10种化学成分含量的影响[J]. 植物科学学报, 2019, 37(6):797-807.
[15]朱志明,赖潇潇,苏慕霞. 不同产地黄柏及关黄柏有效成分的含量测定[J]. 临床医学工程, 2011, 18(1):106-108.
[16]贺秀霞,戴灵超,张晓玲,等. 不同种质及生长年限关黄柏中生物碱含量变化规律的研究[J]. 中国农学通报, 2010, 26(13):114-117.
(收稿日期:2021-11-23 编辑:黄丽君)
