探究氢氧化钠与二氧化碳发生反应的一体化实验设计
2022-05-30林丹周文荣
林丹 周文荣


摘要:通过对比分析不同版本教材中对氢氧化钠与二氧化碳反应不同的处理方式,寻找一线教师留下的实验设计发展空间,创新设计了一体化的实验装置,从压强变化、碱性强弱、温度变化、产物检验四个视角证明反应的发生。该装置有对比明显、整合性强、定量视角、节约药品等特点,有利于发展学生的科学探究能力和证据推理的意识。
关键词:氢氧化钠与二氧化碳反应;无明显现象反应;一体化实验;创新实验
文章编号:1008-0546(2022)12-0089-04
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2022.12.022
一、装置设计缘起
1.教材内容分析
氢氧化钠能与二氧化碳反应,是碱的一条重要的化学性质,不同版本的教材处理略有不同。沪教版和人教版仅给出了NaOH和CO2反应的化学方程式,没有具体的实验。鲁教版则提供了在塑料瓶里完成反应的实验。教材对没有明显现象反应的发生没有作深入的探究,给一线教师的研究留下了一定的空间。
2.一线教师研究现状
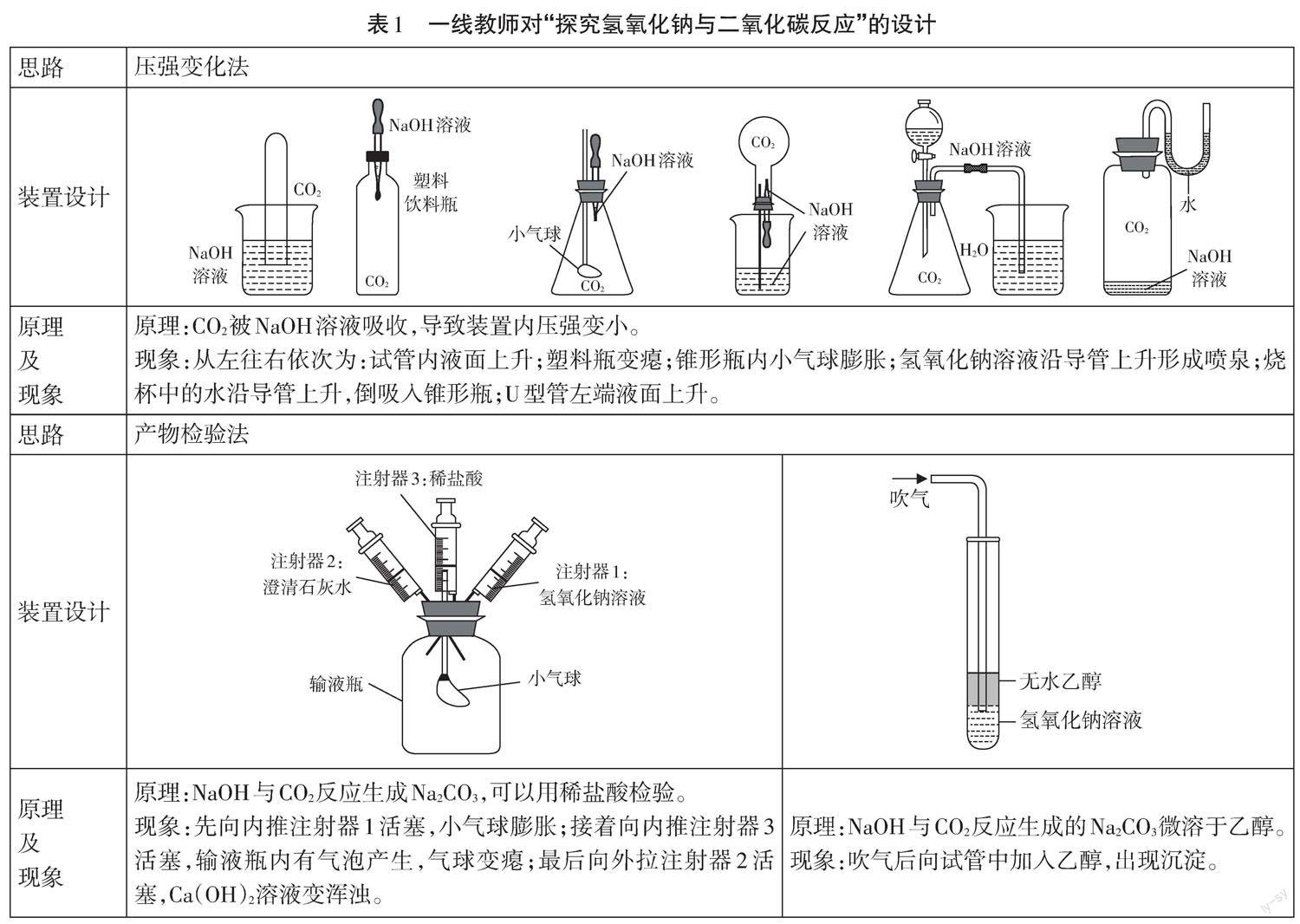
许多一线教师积极思考,不断探索,从不同角度出发,设计了不同的原理来探究氢氧化钠与二氧化碳的反应(见表1)。[1-5]
3.装置设计的发展空间
梳理以上实验设计,教师们主要是从三个角度证明NaOH能与CO2反应:压强变化的角度、检验产物碳酸盐的角度、定量角度。现有成果给教师们后续研究提供了宝贵的思路和方法,给进一步研究留下了发展空间。
(1)从压强角度设计实验证明氢氧化钠与二氧化碳的反应需要排除二氧化碳溶于水造成的干扰,可以用等体积的水代替氢氧化钠溶液进行实验,作为对照。可以将对照实验与定量实验结合起来,定量地对比等体积氢氧化钠溶液与等体积水吸收二氧化碳的差异。
(2)现有实验一般是从二氧化碳减少的角度证明反应的发生,也可以从氢氧化钠减少的角度设计实验。虽然反應产物碳酸钠溶于水也是碱性,但碱性相对而言已经减弱,可寻找合适的酸碱指示剂证明氢氧化钠被消耗。
(3)氢氧化钠与二氧化碳反应放热,可以从能量的角度证明反应的发生,利用生活中的电子温度计可以实时测量温度的变化。
(4)以上装置仅仅是从一个或两个角度设计,可以将实验进行有机整合,利用一套实验从多角度证明反应的发生,实现实验的一体化。
二、一体化实验装置和药品
1.实验用到的仪器药品
实验所需的仪器有:医用输液袋1个(实测体积260 mL)、20 mL注射器5个、三通阀2个、电子温度计1个。
实验所需的药品有:二氧化碳、2 mol/L氢氧化钠溶液、2 mol/L盐酸、蒸馏水、达旦黄指示剂。
选择达旦黄作指示剂出于以下思考与实践:输液袋的体积为260 mL,除去与水作用的10 mL气体外,与氢氧化钠反应的二氧化碳为250 mL,物质的量约为0.01 mol。10 mL 2 moVL的氢氧化钠溶液能与二氧化碳恰好完全反应,生成的碳酸钠溶液的pH约为12。经资料查阅,找到两种潜在可行的酸碱指示剂:孔雀绿和达旦黄。孔雀绿变色的pH范围为11.5(蓝绿)-13.2(无色),达旦黄变色的pH范围为12.0(黄)-13.0(红)。经过实验,发现孔雀绿在反应前后溶液均为无色;而达旦黄在反应中随着碱性的减弱,溶液由红色变为浅黄,能作为该反应的指示剂,指示氢氧化钠被消耗。
2.装置的制作
“探究氢氧化钠与二氧化碳的反应”一体化装置如图1所示。将输液袋两端多余的塑料软管裁去,保留两端的输液阀。在两端塑料管上分别连接一个三通阀,三通阀的另外两个出口分别与两个20 mL的注射器相连。用泡沫胶水将电子温度计的数字显示屏粘在输液袋上,将温度探头用透明胶固定在输液袋边。
三、利用装置进行系列实验的步骤与现象
在检查好装置的气密性后,在袋中收集满二氧化碳(约260 mL),关闭输液袋两端的输液阀。注射器1和注射器4中分别抽取10 mL滴有达旦黄的氢氧化钠溶液或10 mL水,注射器2和注射器3的活塞推至最高处,排尽其中的空气,如图1所示将装置连接好。观察到达旦黄溶液呈红色,电子温度计读数为24.0℃。
实验1:从定量角度证明
如图2所示,转动三通阀A至输液袋与注射器2相通,打开输液袋左端输液阀,向外拉注射器2的活塞,抽取10 mL二氧化碳,关闭左端输液阀。用相同的方法在注射器3中抽取10 mL_氧化碳。旋转三通阀A至注射器1、2相通,推动注射器1的活塞,将10mL滴有达旦黄的氢氧化钠溶液注入注射器2中,与二氧化碳充分接触。旋转三通阀B至注射器3、4相通,推动注射器3的活塞,将10 mL水注入注射器3中,与二氧化碳充分接触。半分钟后观察到注射器2的活塞移动至11.0 mL刻度处,注射器3的活塞移动至17.6 mL刻度处,装NaOH溶液的注射器活塞移动距离更大,说明等体积氢氧化钠溶液比水吸收更多二氧化碳,证明氢氧化钠能与二氧化碳反应。
实验2:从反应物减少、能量角度证明
旋转三通阀A至输液袋与注射器2相通,打开左端输液阀,将氢氧化钠溶液全部注入输液袋,关闭输液阀,将输液袋与三通阀分离,振荡。从侧面观察,与实验前相比(见图3-a),注入NaOH溶液后,输液袋明显变瘪(见图3-b),溶液由红色转为黄色,电子温度计示数从24.0℃上升至28.1℃。反应物二氧化碳、氢氧化钠减少,过程温度上升,均能证明氢氧化钠与二氧化碳反应。
实验3:从生成物角度证明
如图4所示,在注射器5中吸取10 mL 2 mol/L盐酸,注入输液袋中,观察到有气泡产生,输液袋重新膨胀。说明反应后有碳酸盐产生,证明氢氧化钠能与二氧化碳反应。
反应结束后,向外拉注射器5的活塞,将袋中的液体抽去,重新得到一袋二氧化碳气体,便于连续教学,循环利用物质。
四、一体化装置的优点
1.对比明显,清晰可视。反应过程现象丰富,产生了四处对比现象:两端注射器读数、输液袋前后体积、达旦黄前后颜色、电子温度计前后读数。将原本无明显现象的反应可视化,便于学生更深刻地体会反应过程中压强、酸碱性、温度的变化,加深对反应特征的理解。通过对实验的细致观察,借助直观的现象,获得丰富的感性认识,以此为基础,证明反应的发生,让化学实验成为学生“证据推理”意识与思维逻辑性培养的最主要途径。[6]
2.整合性强,发展思维。利用一体化实验装置实现了从四个角度证明反应发生:压强变化、碱性强弱、温度变化、产物检验,操作连贯,一气呵成。在实验过程中学生既对NaOH能与CO2反应有了深刻的认识,还能构建验证无明显现象的反应确实发生的一般模型:新物质生成、反应物减少,能量变化,可以指导他们后续的学习。
3.定量视角,方法指导。相同体积的NaOH溶液和水,接触等体积的CO2,通过活塞移动的刻度定量指示NaOH与CO2反应。排除了二氧化碳溶于水使压强变小的干扰,进一步加深了对比实验控制单一变量的方法指导。 4.节约药品,循环利用。需要使用的药品的量很少,仅260 mL二氧化碳、10 mL水、10 mL氢氧化钠溶液、10 mL稀鹽酸。而且反应结束后通过将输液袋中剩余液体抽去,实现二氧化碳的循环使用,便于班级间连续上课。所用的仪器均为塑料制品,轻便易携带。
参考文献
[1]顾呜英,让实验现象从“无”到“有”的初中化学对比实验教学设计[J].化学教学,2017(2):74-78.
[2] 么宏业.二氧化碳和氢氧化钠溶液反应实验的改进[J].中学化学教学参考,2013(3):29.
[3]杨永俊.基于3P学习的项目式学习在初中化学教学中的实践——以二氧化碳与氢氧化钠反应的可视化研究为例[J].化学教与学,2020(7):82-86.
[4] 朱红杰,李德前.探究“氢氧化钠溶液和二氧化碳气体反应”的定量趣味实验[J].教育与装备研究,2016,32(11):65-67.
[5] 陈立铭,李德前.基于量的角度设计“氢氧化钠溶液与二氧化碳反应”的实验[J].化学教育,2014,35(23):50-51.
[6] 朱玉林.培养学生证据意识与思维逻辑性的有效途径[J].中学化学教学参考,2021(12):14-16.
