蒲公英甾醇治疗大鼠膝关节骨关节炎的作用机制初步探索
2022-05-30谢子康史铭钰蒋阳王斌沈鹏飞郑冲杨晓峰
谢子康,史铭钰,蒋阳,王斌,沈鹏飞,郑冲,杨晓峰
(常州市中医医院骨一科,江苏 常州 213000)
膝关节骨关节炎(knee osteoarthritis,KOA)是一种以关节软骨及关节周围组织慢性、退行性改变的疾病。有研究发现,在骨关节炎的发生及发展过程中,炎性因子亦扮演着重要角色,即炎性介质的过度表达伴随着组织的逐渐退化[1]。蒲公英是菊科植物蒲公英的干燥全草,现代药理研究表明,蒲公英还具有抗氧化、抗菌、抗炎等多种作用[2];蒲公英甾醇是蒲公英的主要有效成分之一;动物及细胞试验显示,蒲公英甾醇可抑制白细胞介素(interleukin,IL)-1β诱导的类风湿关节炎成纤维样滑膜细胞的炎症和类风湿关节炎的进展,其作用机制可能包括抑制炎性因子水平、抑制基质金属蛋白酶(matrix metalloproteinase,MMP)、调控TLR4/NF-κB信号通路等[3-4];因此,蒲公英甾醇的抗炎、抗氧化作用亦有望应用于骨关节炎的治疗中。然而,目前国内外研究尚无针对蒲公英甾醇治疗KOA的探讨,为弥补这一空白,此次研究拟通过动物试验对蒲公英甾醇治疗KOA大鼠的作用机制进行初步了解,从而为后续研究提供参考依据,也为KOA的治疗提供新的思路。
1 材料与方法
1.1 实验动物 SPF级健康4周龄SD雄性大鼠50只,每只大鼠重量240~260 g。由常州卡文斯实验动物有限公司提供,动物合格证号SCXK(苏)2019-0004。
1.2 试药与仪器 蒲公英甾醇由成都瑞芬思生物科技有限公司提供(CAS:1059-14-9);木瓜蛋白酶、半胱氨酸由江苏佰耀生物科技有限公司提供;酶联免疫吸附试验试剂盒由北京博奥派克生物科技有限公司提供;全自动蛋白质印迹定量分析系统由晶檀生物科技(上海)有限公司提供;实时荧光定量聚合酶链式反应(real time-quantitative polymerase chain reaction,RT-qPCR)仪由美国 Bio-rad iCycler iQ 伯乐公司提供,各种聚合酶链式反应(polymerase chain reaction,PCR)抗体、试剂盒、引物均由宝日医生物技术(北京)有限公司提供;酶标仪由上海赛默科技生物发展有限公司提供;-80℃超低温冰箱MDF-C8V由SANYO三洋电机提供;光学显微镜由日本奥林巴斯提供;台式高速冷冻离心机H2050R由湖南湘仪实验室仪器开发有限公司提供。
1.3 KOA大鼠模型的建立及分组给药方式 参照文献[5]方案建立KOA大鼠模型:大鼠称重后置于实验操作台上,按3 mL/kg剂量给予腹腔注射水合氯醛麻醉,无菌条件下行大鼠左侧膝关节腔穿刺,自髌骨外下方进针,确定进入关节腔后向关节腔内注射0.2 mL浓度预制好的4%木瓜蛋白酶溶液+0.03 mmol/L半胱氨酸混合液,隔日注射1次,持续2周。每日定时驱赶强迫大鼠活动30 min,增加其活动量以促进骨关节炎模型建立;每日观察大鼠肢体活动情况及关节有无感染、肿胀等。假手术组造模术中左侧膝关节腔穿刺后注射生理盐水0.2 mL,其余操作与前述相同。研究组建模成功后,分为低剂量组、中剂量组、高剂量组、模型组、假手术组,各10只;每日上午9~10时分别给予蒲公英甾醇2.5 mg/kg、5 mg/kg、10 mg/kg及生理盐水灌胃,每日1次,持续4周。
1.4 观察指标
1.4.1 血清生化指标的检测 抽取各组大鼠心尖处血液样本,2 000 r/min的条件下离心15 min,获取血清;采用酶联免疫吸附法测定血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-1β、IL-6、MMP-1、MMP-3、半胱氨酸蛋白酶-1(cysteine aspartic acid protease,Capase-1)水平。
1.4.2 RT-qPCR法测定关节软骨组织中微小RNA(microRNA,miRNA)-140、miRNA-146a表达水平 用颈椎脱位法处死全部大鼠,打开每只大鼠左膝关节腔,取左膝关节软骨组织,用Trizol试剂提取总RNA,用Prime Script RT试剂盒将每个样本的2 μg总RNA反转录为cDNA。反转录条件:37℃条件下15 min,5℃条件下5 s,4℃条件下30 min。以β-actin为内参。引物序列见表1。

表1 引物序列表
1.4.3 Western blot法测定关节软骨组织中相关蛋白表达水平 采用 Western blot法测定关节软骨组织中核因子κB抑制因子(inhibitor of NF-κB,IκB)、IκB激酶β(inhibitor κB kinase β,IKKβ)、核因子κB(nuclear factor-κB,NF-κB)、转化生长因子β活化激酶1(transforming growth factor-β-activated kinase 1,TAK1)、NOD样受体家族3(NOD-like receptors 3,NLRP3)、凋亡相关微粒蛋白(apoptosis-associated speck-like protein containing CARD,ASC)的表达水平。取各组大鼠左膝关节软骨组织,加入缓冲液提取蛋白,湿式电泳仪转膜300 mA、60 min;5%脱脂牛奶室温下封闭 1 h;Ⅰ抗和内参照抗体 4 ℃孵育16 h;加入稀释好的二抗(抗兔 IgG),在室温下孵育1 h,使用电化学发光显影,并使用ChemiDoc XRS(BioRad)显色,lphaEase FC软件取值,分析目标带与内参带的灰度值比值。
1.4.4 关节软骨组织的病理观察 制备各组大鼠膝关节软骨组织石蜡切片,充分剥离皮肤肌肉之后置于4%多聚甲醛溶液中固定24 h,10%稀盐酸脱钙2~4 d,梯度脱水后石蜡包埋,行额状面切片(沿膝关节矢状面将胫骨内侧平台软骨下松质骨和股骨内侧髁软骨下松质骨沿下肢纵轴方向切片,厚度约5 mm)、HE染色,常规脱水、透明、封片处理。参照Mankin法行软骨组织评分,包括结构(0~6分)、细胞(0~3分)、基质染色(0~4分)、潮线完整性(0~1分)4个部分;总评分为各部分评分之和(0~14分),评分越高表示关节软骨组织性质越差。
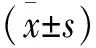
2 结 果
2.1 5组血清TNF-α、IL-1β、IL-6、MMP-1、MMP-3、Capase-1水平的比较 高剂量组、中剂量组、低剂量组及模型组的血清TNF-α、IL-1β、IL-6、MMP-1、MMP-3、Capase-1水平均明显高于假手术组(P<0.05),高剂量组、中剂量组及低剂量组的血清TNF-α、IL-1β、IL-6、MMP-1、MMP-3、Capase-1水平均明显低于模型组(P<0.05),高剂量组均明显低于中剂量组及低剂量组(P<0.05),中剂量组均明显低于低剂量组(P<0.05,见表2)。
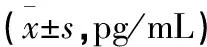
表2 5组血清TNF-α、IL-1β、IL-6、MMP-1、MMP-3、Capase-1水平的比较
2.2 5组关节软骨组织中miRNA-140、miRNA-146a表达水平的比较 高剂量组、中剂量组、低剂量组及模型组的关节软骨组织中miRNA-140、miRNA-146a表达水平均明显低于假手术组(P<0.05),高剂量组、中剂量组及低剂量组的关节软骨组织中miRNA-140、miRNA-146a表达水平均明显高于模型组(P<0.05),高剂量组均明显高于中剂量组及低剂量组(P<0.05),中剂量组均明显高于低剂量组(P<0.05,见表3)。
2.3 5组关节软骨组织中IκB、IKKβ、NF-κB、TAK1、NLRP3、ASC蛋白表达水平的比较 高剂量组、中剂量组、低剂量组及模型组的关节软骨组织中IκB、IKKβ、NF-κB、TAK1、NLRP3、ASC蛋白表达水平均明显高于假手术组(P<0.05),高剂量组、中剂量组及低剂量组的关节软骨组织中IκB、IKKβ、NF-κB、TAK1、NLRP3、ASC蛋白表达水平均明显低于模型组(P<0.05),高剂量组均明显低于中剂量组及低剂量组(P<0.05),中剂量组均明显低于低剂量组(P<0.05,见表4、图1)。

表3 5组关节软骨组织中miRNA-140、miRNA-146a表达水平的比较

表4 5组关节软骨组织中IκB、IKKβ、NF-κB、TAK1、NLRP3、ASC蛋白表达水平的比较
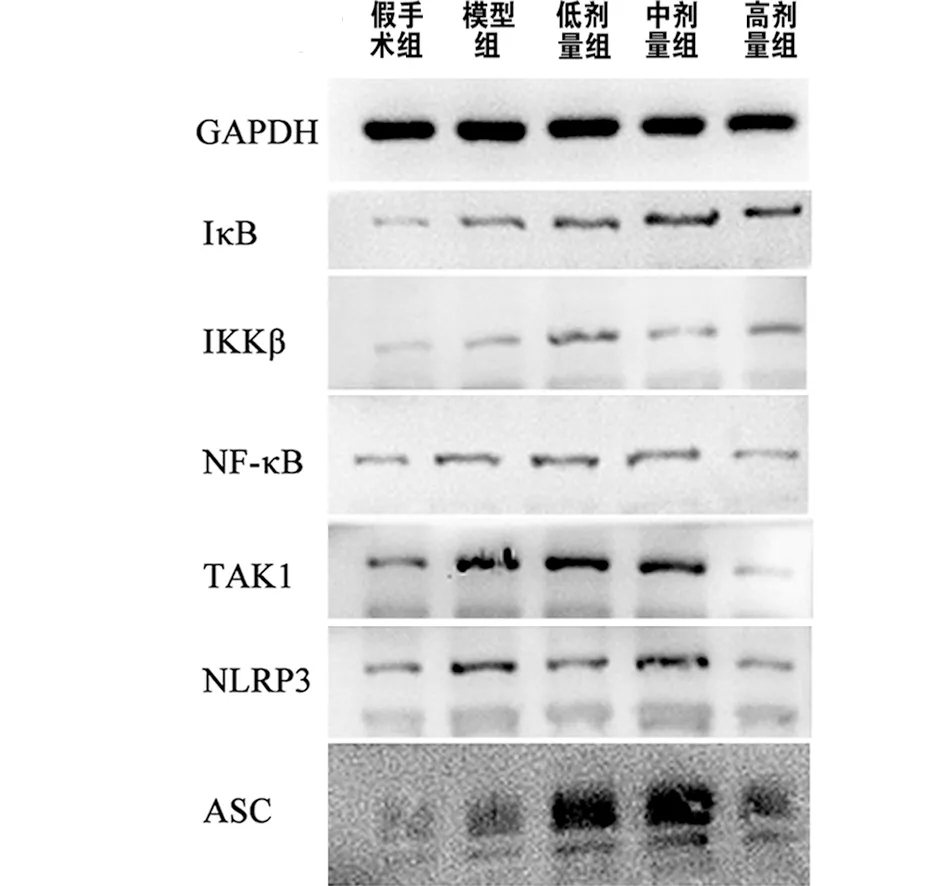
图1 5组关节软骨组织中IκB、IKKβ、NF-κB、TAK1、NLRP3、ASC蛋白表达的Western blot法检测图
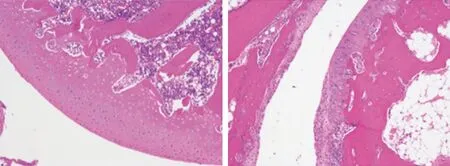
a 假手术组 b 模型组
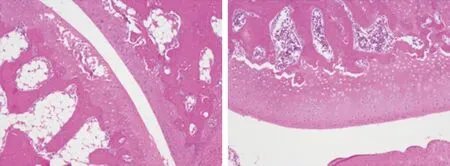
c 低剂量组 d 中剂量组
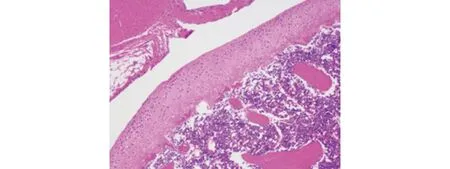
e 高剂量组
2.4 5组关节软骨组织病理情况的比较 KOA大鼠关节软骨组织病理情况:假手术组关节软骨表面平整光滑,无裂缝或缺损,软骨细胞形态正常、排列整齐,潮线完整,软骨基质染色均匀;模型组关节软骨表面不平整,有缺损及裂缝,节软骨细胞形态异常、排列紊乱,潮线缺损,软骨基质染色不均匀;低剂量组:关节软骨表面比较光滑,软骨细胞形态异常,排列紊乱,潮线缺损,软骨基质染色不均匀;中剂量组与高剂量组关节软骨表面平整,软骨细胞排列较为整齐,潮线基本完整,关节软骨染色均匀(见图2)。
高剂量组、中剂量组、低剂量组及模型组的关节软骨组织Mankin评分均明显高于假手术组(P<0.05),高剂量组、中剂量组及低剂量组的关节软骨组织Mankin评分均明显低于模型组(P<0.05),高剂量组均明显低于中剂量组及低剂量组(P<0.05),中剂量组均明显低于低剂量组(P<0.05,见表5)。
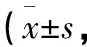
表5 5组关节软骨组织Mankin评分的比较分)
3 讨 论
3.1 蒲公英甾醇对KOA大鼠炎性细胞因子的影响 KOA的发病机制比较复杂,KOA的关节软骨及周围骨质会发生病理性改变,在关节软骨的破坏过程中会产生大量的基质降解产物及炎症介质,炎症(特别是滑膜炎症)在KOA的发生及发展中扮演着重要角色[6]。TNF-α与IL-6能促进关节软骨细胞外基质蛋白发生降解,加速关节软骨的破坏;IL-6基因敲除可导致小鼠发生KOA,提示IL-6是KOA关节软骨破坏的关键炎症介质[7]。MMP是一类结构相似的蛋白酶,可诱导关节软骨发生降解,引起胶原纤维变薄,加速胶原成分的裂解,胶原排列出现松散,造成软骨基质发生肿胀,促进关节软骨发生变性,从而导致KOA[8]。IL-1β是一种强效促炎细胞因子,能诱导关节软骨细胞和滑膜细胞合成MMP,在KOA关节软骨的退变过程中发挥着重要作用[9]。Caspase-1是IL-1β的转化酶,能对IL-1β前体进行加工,成为IL-1β活性形式,是对IL-1β进行激活的重要环节,Caspase-1在KOA动物模型关节软骨组织中高表达[10]。本研究中,与假手术组比较,药物组与模型组的以上各项炎性因子水平均明显增高,进一步说明了KOA的发生及发展与炎性因子存在密切关系;而与模型组比较,KOA大鼠蒲公英甾醇灌胃4周后以上各项炎性因子水平均明显降低,随着给药剂量的增加而明显降低,提示蒲公英甾醇能够降低KOA大鼠的血清炎性因子水平,且呈剂量依赖性。
3.2 蒲公英甾醇对KOA大鼠关节软骨组织中miRNA-140、miRNA-146a表达水平的影响 KOA的发生及发展受到表观遗传调控的影响,miRNA是KOA基因调节的关键因子。有研究[11]显示,9种miRNA在KOA关节软骨组织中的表达水平上调,7种miRNA的表达水平下调。miRNA-140、miRNA-146a主要在软骨组织中表达,在关节软骨的生长发育、稳态维持及损伤修复中发挥着重要作用[12]。在大鼠胚胎骨发育过程中,miRNA-140在软骨组织中的表达水平特异性增高;miRNA-140对蛋白聚糖酶-5的表达具有调控作用,对大鼠miRNA-140基因进行敲除后发现,增龄性KOA关节软骨退变的发生率增高,而关节软骨组织中miR-140的高表达对手术诱发的KOA具有对抗作用[13-14]。以往研究[15]显示,miRNA-146a能对蛋白聚糖酶及MMP在软骨组织中的表达进行抑制,可能与NF-κB等信号通路活化受阻有关;miRNA-146a能对MMP-13及胰岛素样生长因子结合蛋白-5的合成进行间接调控,参与膝关节内稳态的维持。临床研究[16-17]显示,相对于非KOA患者,KOA患者关节滑液中miRNA-140、miRNA-146a的表达水平明显降低。本研究中,与假手术组比较,药物组与模型组的miRNA-140、miRNA-146a表达水平均明显降低,提示当miRNA-140、miRNA-146a高表达时,KOA关节软骨退变得到抑制,即miRNA-140、miRNA-146a是KOA的保护因素;蒲公英甾醇治疗4周后miRNA-140、miRNA-146a的表达水平明显高于模型组,随着给药剂量增加而明显增高,分析原因可能是蒲公英甾醇治疗后TNF-α、IL-6、IL-1β等炎性因子水平降低,滑膜细胞凋亡减少,miRNA-140、miRNA-146a的降解减少。
3.3 蒲公英甾醇对KOA大鼠关节软骨组织中IκB、IKKβ、NF-κB、TAK1、NLRP3、ASC蛋白表达水平的影响 KOA的发生及发展中存在炎性细胞因子、蛋白与信号通路的相互调控,能导致关节软骨细胞的合成-分解代谢发生紊乱,导致关节软骨结构功能发生改变[18]。NF-κB蛋白家族可以选择性的结合在B细胞κ-轻链增强子上调控许多基因的表达;动物及细胞实验[19-20]均表明,NF-κB信号通路在KOA中被过度激活;NF-κB对Ⅱ型胶原的表达起到抑制作用,对TNF-α、IL-6、IL-1β等炎性因子的表达起到促进作用,从而促进炎性反应的发生;NF-κB还能对NO的产生起到调节作用,促进软骨细胞的凋亡,而对NF-κB信号通路的病理性激活进行抑制,能促进KOA关节软骨病变的修复。IκB是NF-κB的抑制蛋白,IKKβ是IκB激酶的一种亚单位,IκB与IKKβ在NF-κB信号通路的激活过程中起到支柱性作用;NF-κB信号通路通过促分裂原活化蛋白激酶激酶激酶(mitogen-activated protein kinase kinase kinase,MAPKKK)或细胞膜受体级联激活,导致NF-kB诱导激酶(NF-kB-inducing kinase,NIK)激活,进而活化IKKβ,磷酸化IκB,最终导致KOA软骨组织降解及发生关节损伤[21]。TAK1是促分裂原活化蛋白-3kinase(mitogen-activated protein-3 kinase,MAP3K)家族的成员之一,是促分裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)信号通路与NF-κB信号通路上游的重要激酶,能被多种促炎性细胞因子激活[22];临床研究[23]显示,骨关节炎患者软骨组织中的TAK1的表达水平明显上调,对TAK1基因及蛋白的表达进行抑制,能降低下游炎性因子及MMP等相关蛋白酶的表达。NLRP3炎性小体含有ASC、Caspase蛋白酶,能调节Caspase-1的活化,促进前体pro-IL-1β、pro-TNF-α等炎性细胞因子的成熟和分泌,诱导细胞炎性反应[24];以往研究[25]显示,NLRP3在兔KOA模型软骨细胞中的表达水平显著增高;体外细胞实验结果显示TNF-α可以促进类风湿关节炎患者成纤维样滑膜细胞中NLRP3的蛋白表达[26];临床研究[27]显示类风湿关节炎患者外周血单个核细胞中NLRP3、ASC mRNA相对表达量显著升高。本研究中,与假手术组比较,药物组与模型组的IκB、IKKβ、NF-κB、TAK1、NLRP3、ASC蛋白表达水平均明显增高,提示TAK1/NF-κB、NLRP3信号通路过度激活是KOA的发生及发展的机制之一;蒲公英甾醇治疗4周后的以上指标的蛋白表达水平明显低于模型组,随着给药剂量的增加而明显降低,提示对TAK1/NF-Κb、NLRP3信号通路病理性激活进行抑制是蒲公英甾醇治疗KOA大鼠的作用机制,且呈剂量依赖性。同时本研究还观察到蒲公英甾醇能明显减轻KOA大鼠关节软骨组织的Mankin评分,随着给药剂量的增加,效果明显增加,原因是蒲公英甾醇抑制了KOA大鼠的炎性反应。
3.4 小结 蒲公英甾醇对大鼠KOA具有保护作用,能减轻关节软骨组织的病理学改变,且呈剂量依赖性,炎症抑制、miRNA表达上调及TAK1/NF-κB、NLRP3信号通路活化受阻可能是其作用机制。下一步将对炎性细胞因子、miRNA及相关信号通路之间的关系,TAK1/NF-κB、NLRP3信号通路上下游的传导机制等进行深入研究,为蒲公英甾醇治疗KOA的新药开发及临床治疗提供坚实的基础。
