外泌体在骨关节炎免疫调控中的作用研究进展
2022-05-30蒋环宇周炎
蒋环宇,周炎
(武汉大学人民医院骨科,湖北 武汉 430060)
骨关节炎(osteoarthritis,OA)是现如今最常见的老年病、慢性病之一,65岁以上的人群OA总体患病率高达50%以上,且随着人类预期寿命的增长,可以预见其患病率将呈现上升趋势[1]。外泌体是一种活细胞内具有分泌功能的囊性小泡,直径为30~200 nm,能携带蛋白质、脂质和遗传物质,在体内进行生物信息传输,具备多种生物活性[2]。外泌体所建立的细胞间囊泡交流途径在人类健康与疾病的许多方面都发挥了重要的作用[3],涵盖人体的生长发育[4]、免疫组化[5]、细胞稳态[6]、癌症[7]等方面。
由于OA发病率及致残率高,对于人们运动功能和生活质量的影响与日俱增,还会导致高额的医疗保健和社会成本,为个人与社会带来沉重的经济负担。随着社会人口老龄化加重,可以预见该问题造成的严重影响。膝骨关节炎目前已经成为我国50岁以上男性丧失劳动能力的第二大疾病[8]。外泌体作为近年来备受瞩目的分子信号转导载体,其在病理生理调控方面发挥着重要作用,对于OA的治疗有着不容小觑的价值[9]。本文将对外泌体在OA免疫调控过程中发挥作用的研究进展作一综述。
1 外泌体的特性
由于来源细胞、环境、发育阶段、表观遗传修饰和精细的生物发生机制等因素造成的差异,外泌体的分子组成各不相同,但其在许多特性上仍有相通之处。
1.1 外泌体的结构 通常而言,外泌体是由包裹在外部的“壳”和内部携带的“货物”组成的。外泌体膜的表面有胆固醇、鞘磷脂和神经酰胺等物质构成的涂层,该涂层有利于外泌体在细胞质中的运输。外泌体的“壳”呈现出脂筏的特征[10]。此外,外泌体表面还含有多种类型的蛋白标记物,例如CD9、CD63、CD82、CD81、热休克蛋白、主要组织相容性复合体(major histocompatibility complex,MHC)等[11],其中TSG101蛋白还能与泛素化的货物蛋白相结合,成为细胞对外泌体进行分选和检测的标志物之一。
在研究的早期阶段,外泌体中的内容物被认为是无用的细胞代谢废物,后来随着分离提纯技术的进步和研究的深入,人们逐渐意识到外泌体携带着丰富的蛋白质、脂质和遗传物质,包括信使RNA(messenger RNA,mRNA)、微小RNA(microRNA,miRNA)和较长的非编码RNA,它们在细胞间通信和细胞免疫调控中扮演着非常重要的角色。
1.2 外泌体的生物发生和释放 外泌体的生物发生和释放是一个复杂的过程。外泌体主要来源于内体,而内体又源于细胞质膜的内吞作用,即先由细胞质膜限制性向内出芽构成外泌体的雏形,随后经过一系列生物分子的加工才形成完整的外泌体。这些分子主要包括内吞体分选转运复合体(endosomal sorting complex required for transport,ESCRT)、Alix(也称为重组人程序性细胞死亡6互作蛋白,programmed cell death 6-interacting protein,PDCD6IP)、磷脂酶、液泡分选蛋白4(vacuolar protein sorting 4,Vps4)、Rab GTPase激活蛋白(RabGTPase-activating proteins,RabGAPs)、鞘磷脂酶和神经酰胺[12]。在大多数细胞中,ESCRT是外泌体生成和释放的核心机制,若人为阻断该复合体的组成,外泌体的生成及释放便会受到影响。ESCRT由许多胞质蛋白组成,这些蛋白被称为ESCRT-0、ESCRT-Ⅰ、ESCRT-Ⅱ和ESCRT-Ⅲ,前三者负责识别内体上泛素化的膜蛋白,ESCRT-Ⅲ则参与外泌体囊泡的萌发和分离。但在某些细胞中,外泌体的形成不需要借助该机制,而是依赖于鞘磷脂酶(一种产生神经酰胺的酶)。
外泌体的释放主要有三种方式(见图1)[2,13]:(1)经由囊泡萌发成的多囊体可含有许多外泌体,与细胞质膜融合时将其释放;(2)细胞质膜可直接出芽立即释放外泌体;(3)外泌体可储存在细胞内与细胞质膜连接的区室中(intracellular plasma membrane-connected compartments,IPMCs),通过解除IPMC的出口限制便能达到延迟释放外泌体的效果。而一些在细胞和动物模型上进行的研究发现,外泌体的释放可以经持续激活雷帕霉素靶蛋白复合体1(mechanistic target of rapamycin complex 1,mTORC1)进行抑制,而与之相对地抑制mTORC1也会促进外泌体的释放,这两个过程都会伴随细胞的自噬[14]。
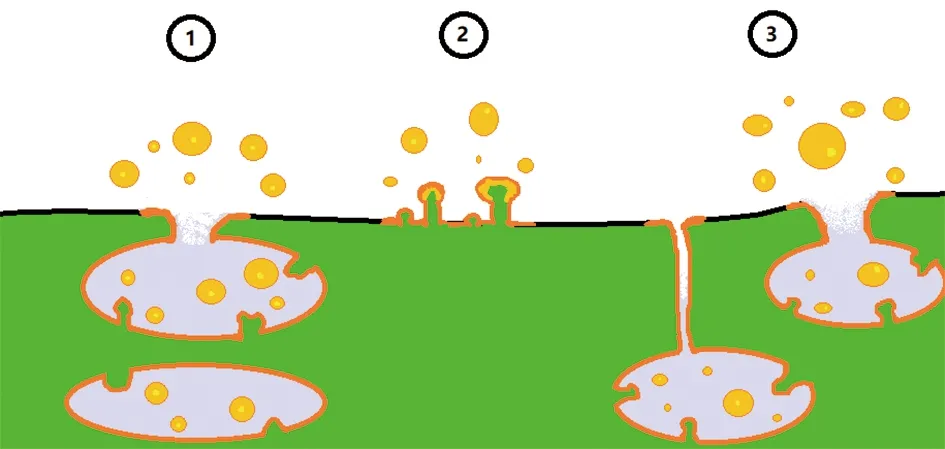
图1 外泌体释放的三种方式
1.3 外泌体与免疫调控 在1996年免疫学家初次发现,经EB病毒(epstein-barr virus,EBv)转化的B淋巴细胞能够通过多囊体与细胞质膜融合的方式来释放外泌体。在之后的研究里,许多免疫和非免疫细胞都被发现具有释放外泌体的功能,包括T细胞、B细胞、树突状细胞(dendritic cell,DC)和巨噬细胞,这些细胞释放的外泌体已被证明可以介导免疫刺激或免疫调控[15]。外泌体的免疫活性可影响先天免疫和获得性免疫的许多环节,包括抗原提呈、T细胞激活、T细胞极化为调节性T细胞、免疫抑制和抗炎作用等。
经由外泌体呈递的抗原在刺激和增强免疫反应方面起着重要作用。其中,专业抗原提呈细胞[(antigen presenting cell,APC),包括单核-巨噬细胞、B淋巴细胞、DC]分泌的外泌体富含MHC-I、Ⅱ类复合物和共刺激分子,它们具有的抗原肽在免疫调控的过程中功不可没[16]。
2 骨关节炎
OA是一种多因素引起的退行性骨关节疾病,OA的特征表现为进行性关节软骨退变,伴发疼痛,最终导致患者关节功能受损[17]。传统的观点认为,OA是由异常的关节负荷和力学作用共同导致的病理反应,即一种“磨损”的生物力学过程。随着研究的深入,越来越多的证据表明,轻度的滑膜炎症反应是OA发生及进展的重要促发因素。
正常关节滑膜分为两层,为血管层(内膜下层)和细胞层(内腔层),其功能是在关节内产生滑液,减少关节软骨的摩擦系数。通常内膜下层较厚,是由致密的纤维组织、Ⅰ型胶原及脂肪组织组成,包含淋巴管、神经纤维和微血管。而内腔层较薄,包含有滑膜成纤维细胞、滑膜巨噬细胞。在OA发展的过程中,滑膜的主要病理改变有内腔层增生、间质纤维化和新生血管形成,并伴有巨噬细胞、T细胞、肥大细胞、B细胞、浆细胞及自然杀伤细胞(natural killer cell,NK)浸润[18]。也有研究表明,在OA的早期阶段,发现滑膜中巨噬细胞已经大量浸润[19]。总之,这些研究均提示OA发生及发展过程中存在许多免疫相关因素,包括关节软骨的局部损伤,血管生成的增加,刺激巨噬细胞活化的损伤相关分子模式(damage associated molecular patterns,DAMPs)释放,导致内膜中巨噬细胞和淋巴细胞大量浸润,增加了促炎细胞因子和趋化因子的释放,以及软骨细胞异常分泌金属蛋白酶、促炎细胞因子和前列腺素,这些因素加剧了关节软骨的破坏[20]。
3 外泌体在OA免疫调控中发挥的作用
无论是外泌体还是OA,都与人体的免疫调控关系密切,通过这条纽带,外泌体的功能便可以加以利用,在OA治疗过程中发挥作用。不同的外泌体被靶细胞摄入后,往往能发挥出不同的功能。外泌体既可以直接参与抗原的提呈从而与人体的免疫系统相互作用,又可以通过自身携带的miRNA引起细胞功能的变化,从而影响人体的免疫调控功能[21]。APC中的外泌体与OA的关系见图2。除此之外,外泌体还能够与摄入细胞的内体相融合,从而自我降解或者重新被释放到细胞外。

图2 APC中的外泌体与OA关系图
3.1 APC中的外泌体与OA
3.1.1 DC来源的外泌体与OA 针对外泌体免疫调控功能的研究,大部分都是从DC产生的外泌体开始的。时至今日,人们对于这种类型的外泌体已经有了较为广泛而深入的认识。成熟DC来源外泌体携带有MHC-Ⅱ类分子和共刺激分子,如B7-2和细胞间黏附分子1(intercellular adhesion molecular,ICAM-1)[16],可以直接与T细胞相互作用,从而激活免疫系统。另一方面,未成熟DC来源外泌体不是通过直接激活T细胞,它们调节免疫功能的方式是通过将抗原分配给其他的APCs,来协助其进行抗原递呈[22],或者将MHC/抗原复合物递呈给DC上的受体来间接诱导T细胞的激活,这种类型的外泌体也有助于Tc1 CD8+T细胞的极化。
与此同时,外泌体也和免疫抑制有关。未成熟DC分泌的外泌体相较于成熟DC,其表达的共刺激分子配体与黏附分子配体明显减少,还会额外表达免疫抑制配体,如肿瘤转化生长因子(transforming growth factor,TGF)-b、NKG2D(natural killer group 2D)和半乳糖凝集素9(Galectin-9)以及死亡配体,如CD95L(CD95 ligand),可参与介导T细胞凋亡,降低T细胞免疫功能[23],因此,未成熟DC来源的外泌体具有免疫抑制功能。在OA发生及发展的过程中,两种DC的外泌体都可以诱导T细胞的激活,促进炎症反应,但未成熟DC细胞的外泌体在某种程度上还可以减轻软骨关节炎症细胞的浸润,从而延缓软骨退变[24]。
3.1.2 B淋巴细胞来源的外泌体与OA 相较于DC来源外泌体,学者对B淋巴细胞来源的外泌体研究尚不够透彻。由外泌体介导的细胞间信号通讯,很多都发生在免疫调控系统中。其中,来源于B淋巴细胞的外泌体具有激活APC的功能,这种影响在抗原注射后的早期便可以观察到,这个时间点甚至早于DC来源的外泌体。B淋巴细胞是最早被发现能够分泌囊泡的免疫细胞类型,这些囊泡携带有丰富的MHC-Ⅰ和Ⅱ类分子、B7-1(CD80)和B7-2(CD86)共刺激分子以及ICAM-1(CD54)黏附分子,因而可以参与抗原递呈过程,激活CD4+T淋巴细胞[22]。B细胞来源的外泌体同样能表达出MHC分子、共刺激分子和黏附分子,并能诱导抗原特异性MHC-Ⅱ类限制性T淋巴细胞反应[25]。在OA发生的早期,滑膜炎症反应是由B淋巴细胞来源的外泌体诱导产生的[26-27]。
除此之外,通过检测外泌体与细胞外基质(extracellular matrix,ECM)成分之间,以及与经细胞因子处理后的成纤维细胞之间的黏附作用,来探究B细胞来源外泌体表达的整合素的功能。结果显示,这类外泌体表达的整合素能够介导ECM和细胞表面黏附分子的黏附作用,这可能是炎症过程中机体远距离传输黏附信号的一种新途径。B淋巴细胞释放的外泌体还可以使得C3片段沉积、T细胞反应增强,这些作用都使得滑膜炎症反应加剧,成为OA病情进展的基础[28]。
3.1.3 单核-巨噬细胞来源的外泌体与OA 针对细菌感染后巨噬细胞所分泌的外泌体的研究发现,这种外泌体通常对幼稚巨噬细胞具有促炎作用,还可诱导DC成熟,并激活CD4+和CD8+T细胞。此类外泌体可以呈递细菌抗原,如糖肽脂(glycopeptidolipids,GPLs)和免疫原性蛋白,从而诱导DC成熟,刺激促炎细胞因子的分泌[22]。虽然来源于巨噬细胞的外泌体,主要作用于机体感染后的免疫系统,但这种抗原呈递和免疫激活的过程,实际上是免疫细胞之间一种新的通讯方式。随着关节软骨的破坏,骨骼上会渐渐形成新的突起,称为“骨赘”或“骨刺”,从而使局部处于一种长期慢性的炎症状态,经由这种细胞通讯方式介导的免疫同样会作用于此种炎症状态[29]。
另一项研究提取OA患者滑膜液中的外泌体,他们发现这些外泌体可以激活促炎性M1巨噬细胞,并使其分泌促炎细胞因子[例如白细胞介素(interleukin,IL)-1β和IL-16]、趋化因子[C-C趋化因子配体(C-C motif chemokine ligand,CCL)20、CCL15和C-X-C趋化因子配体(C-X-C motif chemokine ligand,CXCL1)]以及基质金属蛋白酶[(matrix metalloproteinases,MMP)12和MMP7)][30],这些都是OA病理过程中促进炎症和导致软骨退变的关键分子。
3.1.4 T淋巴细胞来源的外泌体与OA Okoye等[31]的研究表明,在T细胞受体激活后,小鼠的CD4+CD25+Foxp3+调节性T细胞(T regulatory cells,Tregs)会释放出外泌体。另一项研究表明,Tregs中含有miRNA的外泌体可以通过介导非自主基因沉默来抑制Th1细胞的反应[32]。除了CD4+CD25+Foxp3+T细胞外,其他具有调节功能的小鼠T细胞被激活后也可以释放外泌体。CD8+CD25+Foxp3+T细胞来源的外泌体具有抑制由DC诱导的CD8+CTL细胞活性的能力。这可能是免疫系统一种自我调节的表现,T细胞来源的外泌体被用于抑制其他T细胞的活性,来避免机体的过度炎症反应。该机制在OA中表现为滑膜炎的缓慢发展,即使受到APC来源外泌体的多重诱导激活,T细胞也不会因此过度反应使得炎症快速进展[33]。
3.2 外泌体中的“货物”与OA 外泌体所携带的“货物”与OA的免疫调控密切相关。在OA发生及发展的过程中,miRNA抑制、组蛋白修饰、DNA甲基化等表观遗传变化会影响到多个转录过程和用于调节合成-分解代谢平衡的蛋白酶因子的合成,如Runt相关转录因子2(Runt related transcription factor 2,RUNX2)、MMP-13以及血小板结合蛋白基序的解聚蛋白样金属蛋白酶-5(a disintegrin and metalloproteinase with thrombospondin motifs 5,ADAMTS-5)。其中以miRNAs对OA造成的影响备受关注[21]。
在关节中,miRNAs主要参与MMPs、ADAMTS、RUNX、Ⅱ型胶原等多种细胞因子的调节。目前研究表明,miR-140在OA和经IL-1β刺激的软骨细胞中表达降低,证实其对关节软骨的保护作用[34]。miR-140缺乏的小鼠会出现蛋白聚糖的丢失和软骨纤颤的症状,而miR-140高度表达的小鼠则对关节炎具有抵抗力[35]。在人体OA组织中,miR-140表达减少往往伴随MMP-13和ADAMTS-5表达增加,进而促进OA疾病的进展。而其他类型的miRNA,如miR-139和miR-9,也会引发OA合成-分解代谢过程的失衡,从而导致软骨ECM破裂,软骨细胞受损[36]。
外泌体中miRNA的含量在OA患者及正常人中存在差异[37]。根据miRNA图谱显示,OA患者关节滑液提取的外泌体中miR-200-c含量相较于健康受试者增加了2.5倍,这种变化影响了ZEB1基因的表达,因而减少Ⅱ型胶原的形成[38]。IL-1β刺激正常关节滑膜的成纤维细胞,与未经IL-1β处理的细胞相比,这些细胞里会有340个不同的miRNAs表达上调,24个不同的miRNAs表达下调。与正常软骨细胞相比,OA软骨细胞分泌的外泌体中有22个miRNAs表达上调,29个miRNAs表达下调[39]。这些研究证实,在OA患者中关节腔组织细胞分泌的外泌体所表达的miRNA无论是种类还是数量均发生了较大的变化。一方面是关节内微环境发生了改变,另一方面也是机体对关节腔微环境免疫调控的结果。同时,这种变化会反作用于机体对OA的调控过程,如miR-140表达增加时,细胞释放炎症因子的减少会使得局部的免疫反应有所缓解[40],外泌体在OA免疫调控中发挥的作用由此可见一斑。
4 外泌体与OA的其他联系
除了免疫调控之外,外泌体与许多OA发生及发展的其他因素有关,例如滑膜中新生血管的形成。有研究指出,滑膜成纤维细胞来源的外泌体会导致血管内皮生长因子(vascular endothelial growth factor,VEGF)分泌增加,刺激了血管的形成,从而促进OA的病理发展。若将人脐静脉内皮细胞在含该外泌体的培养液中进行培养,其细胞迁移和通道建立的效率会显著提高,血管生成活性也由此得到增强。另外,软骨细胞来源的外泌体也与OA的骨赘形成有关[41]。研究人员发现,在软骨和骨骼新生物之中存在着一种大小为20~200nm的球形小泡,这些小泡具有许多与外泌体相似的特征,其中含有骨形态发生蛋白(bone morphogenetic protein,BMP)等介质,这是新生物钙化形成骨赘所必须的物质。
此外,外泌体还可以对软骨细胞的代谢产生影响。经MitoTracker Green FM染色检测发现,人OA软骨细胞线粒体质量明显低于人正常软骨细胞,线粒体SOX红染色显示细胞内活性氧(reactive oxygen species,ROS)水平升高,即OA软骨细胞内同时存在线粒体受损和ROS聚集[42]。而经过外泌体治疗后,OA软骨细胞内的线粒体可以恢复正常,表现为胞内三磷酸腺苷(adenosine triphosphate,ATP)浓度升高和MitoTracker Green FM染色增强,ROS水平也有相应的下降。因此,通过关节内给予外泌体治疗,可以有效延缓OA的病情发展。
5 结 语
传统的OA治疗手段主要是通过非甾体类抗炎药(non-steroidal anti-inflammatory drugs,NSAIDs)和止痛药来缓解OA的症状[43],同时鼓励患者加强锻炼,控制饮食和体重。这些方法对OA治疗效果相对有限,药物的副作用也使其难以长期有效地维持。而骨科中常用的关节置换术和截骨术也由于手术器具的不成熟和术后并发症等多种因素,对OA的临床疗效难以取得令人满意的结果[44]。为此寻找新的治疗策略显得很有必要。如今,针对外泌体的研究启发了我们前进的方向。本文重点介绍外泌体在OA免疫调控作用的研究进展,可以更进一步地探索如何有效地利用外泌体进行抗炎,减少炎症反应对关节腔内组织的损伤,减轻炎症细胞的浸润,无论是长期慢性的炎症控制,还是在急性发作期的症状缓解,外泌体都能有所作为。此外,利用间充质干细胞(mesenchymal stem cells,MSCs)来源的外泌体对受损的软骨和骨骼进行修复已被证实[45-46]。但无论是哪种途径,利用外泌体对OA进行治疗的方法还不够成熟,仍需要研究人员更加深入的探索,证明该方法的有效性和可行性。
