缢蛏混养对三疣梭子蟹-日本囊对虾综合养殖系统理化环境和小型底栖动物的影响*
2022-05-30柴欣如许文军张东旭刘慧玲
柴欣如 许文军 张东旭① 何 杰 刘慧玲
(1. 浙江海洋大学水产学院 浙江舟山 316022; 2. 浙江省海洋水产研究所 浙江省海水增养殖重点实验室 浙江舟山 316021)
对养殖系统而言, 养殖环境(包括水环境和底质环境)是养殖生物赖以生存的基础, 对养殖生物的健康和养殖的成败至关重要(李越蜀, 2014)。养殖过程中, 残饵、养殖生物粪便等养殖废物在系统中不断积累, 往往超过了养殖系统本身的自净能力。这些养殖废物随着生物地球化学过程在系统中迁移、转化, 影响着养殖系统的结构和功能(赵亚波等, 2018)。利用生态学原理, 将具有不同生态位的生物混养在同一系统中, 不仅能提高养殖系统的物质利用率, 同时也能改善、修复养殖环境, 增加系统的稳定性(Zhanget al, 2016)。
滤食性贝类在生态系统中具有明显的生态学效应, 被称作“生态系统工程师”(Nicholauset al, 2020),其能通过自身生理活动促进系统的物质循环和能量流动, 进而影响养殖环境。贝类通过摄食和生物沉积作用, 将滤食的颗粒有机物以粪便和假粪的形式输送到系统底部, 这一过程使得水生生态系统水体和底质耦合起来, 提高了有机营养物质的沉积速率(Manjuet al, 2016)。而沉积的有机营养物质在微生物作用下可分解转化为无机营养物质重新进入水体中(张凯等, 2015)。有研究表明, 贝类养殖区营养物质的再生速率在某种程度上高于非养殖区, 即使在自然沉积作用很高、沉积物中有机物含量丰富的区域, 贝类的养殖活动依然能够促进无机营养物质从底质中释放出来(范士亮, 2007; 姜磊等, 2009)。
蟹-虾-贝(蛤、蛏、蚶)混养模式是沿海地区重要的池塘养殖模式(张凯等, 2015)。然而, 目前针对海水养殖池塘中滤食性贝类养殖对养殖环境尤其是养殖底质环境影响的研究仍十分有限。因此, 本研究建立了4 组实验生态系统, 通过在三疣梭子蟹-日本囊对虾养殖系统中混养不同密度缢蛏, 旨在探究缢蛏对养殖系统底质理化特征及小型底栖动物群落的影响,以期为梭子蟹综合养殖模式的优化提供数据和参考。
1 材料与方法
1.1 试验设计
试验于浙江省舟山市长白岛(30°10′N, 122°02′E)开展, 试验所用池塘大小均为1.33×104m2, 其中三个池塘放养三疣梭子蟹(Portunus trituberculatus)、日本囊对虾(Marsupenaeus japonicus)和缢蛏(Sinonovacula constricta), 对照池塘(PM)放养三疣梭子蟹和日本囊对虾。缢蛏放养时间为4 月初, 梭子蟹放养时间为6月初, 日本囊对虾放养时间为7 月初, 三疣梭子蟹和日本囊对虾的放养密度为31.2×104、22.5×104ind./hm2,缢蛏在对虾养殖系统PMB1、PMB2和PMB3的放养密度为11.6×104、23.1×104、34.7×104ind./hm2。三疣梭子蟹、日本囊对虾和缢蛏的初始平均个体重量分别为0.024 0、0.008 7 和0.324 0 g。养殖期间, 投喂杂鱼作为主要饲料, 每日早晚各投喂一次。在大潮期间, 通过进排水口对池塘进行换水, 不同养殖池塘换水量一致。
1.2 样品采集与处理
于2020 年4~12 月采集各池塘底泥样品, 初始样采集时间为4 月初, 其余各月底泥样品均在中旬采集完毕。每个池塘沿对角线选取3 个采样点, 用底泥柱状采样器(直径: 10 cm)在每个采样点采集4 管底泥样品作为每个采样点的平行样。用底泥pH/ORP 计现场测定底泥温度、pH 和氧化还原电位(ORP)(3 cm 深度;IQ150, Spectrum), 样品置于保温箱中带回实验室进行其他参数测定。有机质含量的测定方法: 冷冻干燥机冻干后, 用研钵将泥样研磨成粉末状, 过100 目筛,去除大颗粒不能磨碎的杂质, 450 °C 下灼烧5 h, 前后重量差视为沉积物中的有机物含量, 用失重的百分率(%)表示。
取40 mL 表层5 cm 泥样与10%福尔马林溶液等体积混合固定, 用于检测小型底栖动物。丰度和生物量的测定方法: 1‰的虎红(Rose Bengal)染液对小型底栖动物标本和残渣进行染色, 静置24 h 后进行粗分, 用42 μm 孔径套筛过滤后, 转入Ludox-HS40 硅胶液中悬浮离心, 然后在解剖镜下按类群分选计数,分类记数后的标本用滤纸吸干固定液称重(Holmeet al, 1984; 于婷婷, 2014), 计算小型底栖动物的丰度(ind./cm3)和生物量(μg/cm3)。
1.3 数据处理与分析
数据统计时, 以4 个平行样均值作为每个采样点的测定值。数据分析采用SPSS 22.0 软件。试验期间,不同养殖系统底质理化指标与生物指标的差异采用重复测量方差分析, 小型底栖动物与理化性质之间的相关性采用Pearson 相关性分析。
2 结果与分析
2.1 养殖生物收获情况
各养殖系统养殖生物收获情况见表1。总体来看,缢蛏产量随放养密度增大而增大, 梭子蟹和对虾产量以PMB1为最高。
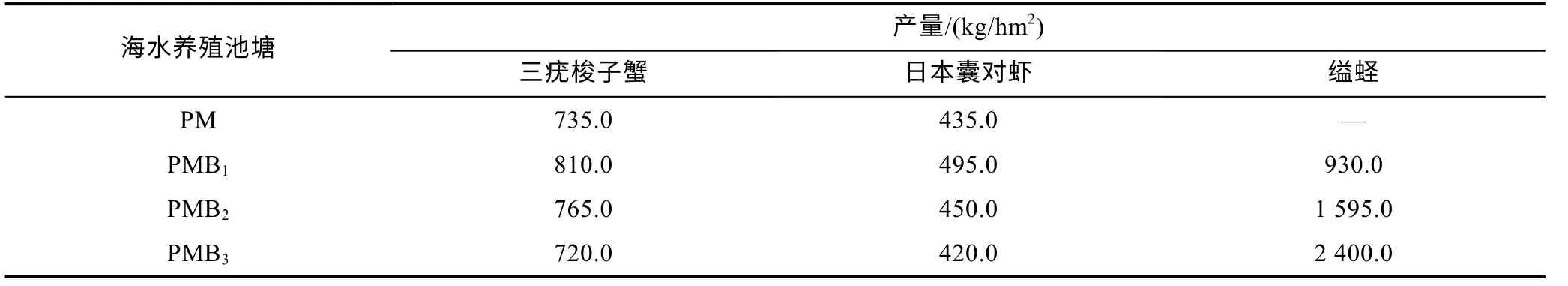
表1 不同养殖系统的产量情况Tab.1 The yield of different aquaculture systems
2.2 沉积物理化特性变化
试验期间, 不同养殖系统底质温度、pH、ORP及有机物含量变化如图1 所示。总体而言, 试验期间,不同养殖系统底质温度均呈先升后降的趋势, 8月温度最高, 平均值为(21.33±6.35) °C (图1a), 差异性分析结果显示, 3 种处理组和对照组之间温度无显著差异。
如图1b 所示, 试验期间, PM、PMB1、PMB2和PMB3底泥pH 平均值分别为7.55±0.09、7.58±0.09、7.56±0.10 和7.65±0.07。差异性分析结果显示, PMB3底泥pH 值显著高于其他处理组(P<0.05), 而PM、PMB1、PMB2之间则无显著差异(P>0.05)。
总体来看, 试验期间不同养殖系统底质氧化还原电位ORP 均呈先降后升趋势(图1c), PM、PMB1、PMB2和PMB3中ORP 平均值分别为(-153.85±25.34)、(-147.15±26.93)、(-141.11±21.68)和(-141.19±17.82) mV。差异性分析结果显示, PMB2和PMB3氧化还原电位显著高于PM 和PMB1(P<0.05), 而PMB2和PMB3、PM和PMB1之间ORP 则无显著差异(P>0.05)。
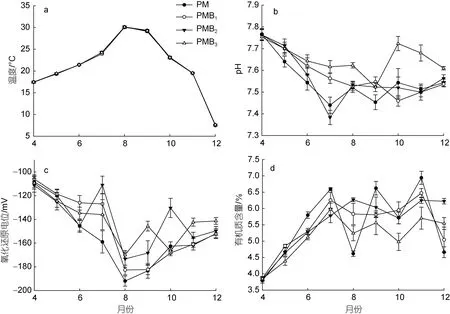
图1 试验期间各处理沉积物中4 个理化指标的变化Fig.1 Variations of four physicochemical indexes in sediment during the experiment
如图1d 所示, 试验期间, PM、PMB1、PMB2、PMB3有机质含量平均值分别为5.5%±1.0%、5.5%±0.8%、5.6%±0.8%、5.2%±0.6%。差异性分析结果显示, PMB3有机质含量显著低于其他处理组(P<0.05),而PM、PMB1、PMB2之间无显著差异(P>0.05)。
2.3 小型底栖动物的丰度与生物量变化
2.3.1 养殖过程中丰度变化 试验期间, 不同养殖系统底质小型底栖动物的丰度变化如图2 所示。总体来看, 不同养殖系统主要优势类群均为线虫类(Nematodes), 分别占总丰度的36.1% (PM)、35.9%(PMB1)、42.6% (PMB2)、42.7% (PMB3); 桡足类(Copepods)和介形类(Ostracoda)次之, 桡足类分别占总丰度的32.8% (PM)、33.0% (PMB1)、26.6% (PMB2)、25.8% (PMB3), 介形类分别占总丰度的23.9% (PM)、24.1% (PMB1)、21.6% (PMB2)、25.2% (PMB3); 多毛类(Polychaete)丰度在各养殖系统中占比最小, 分别为7.2% (PM)、7.0% (PMB1)、9.2% (PMB2)、6.3%(PMB3)。差异性分析结果显示, 线虫类丰度以PMB3最大, 为3.71 ind./cm3, 显著高于其他处理组(P<0.05);PMB2(2.51 ind./cm3)次之, 显著高于 PM 与 PMB1(P<0.05); 而PM (1.64 ind./cm3)和PMB1(1.61 ind./cm3)之间线虫类丰度差异不显著(P>0.05)。试验期间,PMB3桡足类(2.25 ind./cm3)和介形类(2.19 ind./cm3)丰度显著高于其他处理组(P<0.05), PM、PMB1、PMB2之间桡足类和介形类丰度差异不显著(P>0.05)。
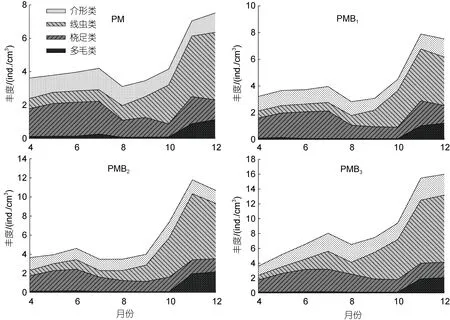
图2 试验期间小型底栖动物丰度变化Fig.2 Variations of small benthos abundance during the experiment
2.3.2 养殖过程中生物量变化 试验期间, 共检获4 种小型底栖动物主要类群(图3)。其中, 介形类生物量在不同养殖系统中均最大, 分别占总生物量的77.9% (PM)、78.2% (PMB1)、74.2% (PMB2)、81.1%(PMB3); 其次为多毛类, 分别为12.6% (PM)、12.3%(PMB1)、17.0% (PMB2)、10.9% (PMB3); 桡足类和线虫类生物量在各养殖系统中占比均较小。差异性分析结果显示, 试验期间, 介形类生物量在PMB3中最大, 为228.00 μg/cm3, 显著高于其他处理组(P<0.05); PMB2、PMB1和PM 之间介形类生物量差异不显著(P>0.05)。试验期间, 多毛类生物量以 PMB2(30.35 μg/cm3)和PMB3(30.52 μg/cm3)为最大, 显著高于PM (18.30 μg/cm3)和PMB1(17.71 μg/cm3) (P<0.05), 而PMB2与PMB3, 及PM 与PMB1间均无显著差异(P>0.05)。
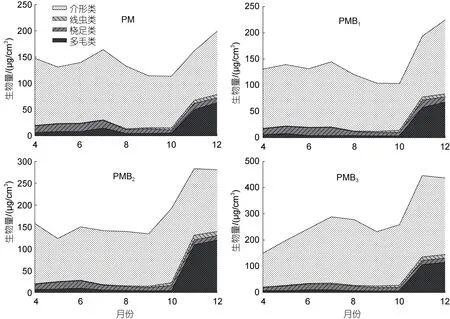
图3 试验期间小型底栖动物生物量变化Fig.3 Variations in biomass of meiofauna during the experiment
2.4 小型底栖动物与理化性质的相关性
小型底栖动物主要类群的丰度与沉积物理化因素的Pearson 相关系数见表2。从表可见, 在四个养殖系统中, 多毛类与温度呈显著负相关, 桡足类在PMB1系统中与氧化还原电位ORP 呈显著正相关, 介形类在PMB1与温度呈显著负相关, 在PMB3与有机质OM 呈极显著正相关, 其他理化因素和丰度的关系均未达到显著水平(表2)。在PM、PMB1处理中, 温度与总丰度和总生物量均呈显著负相关(表3)。
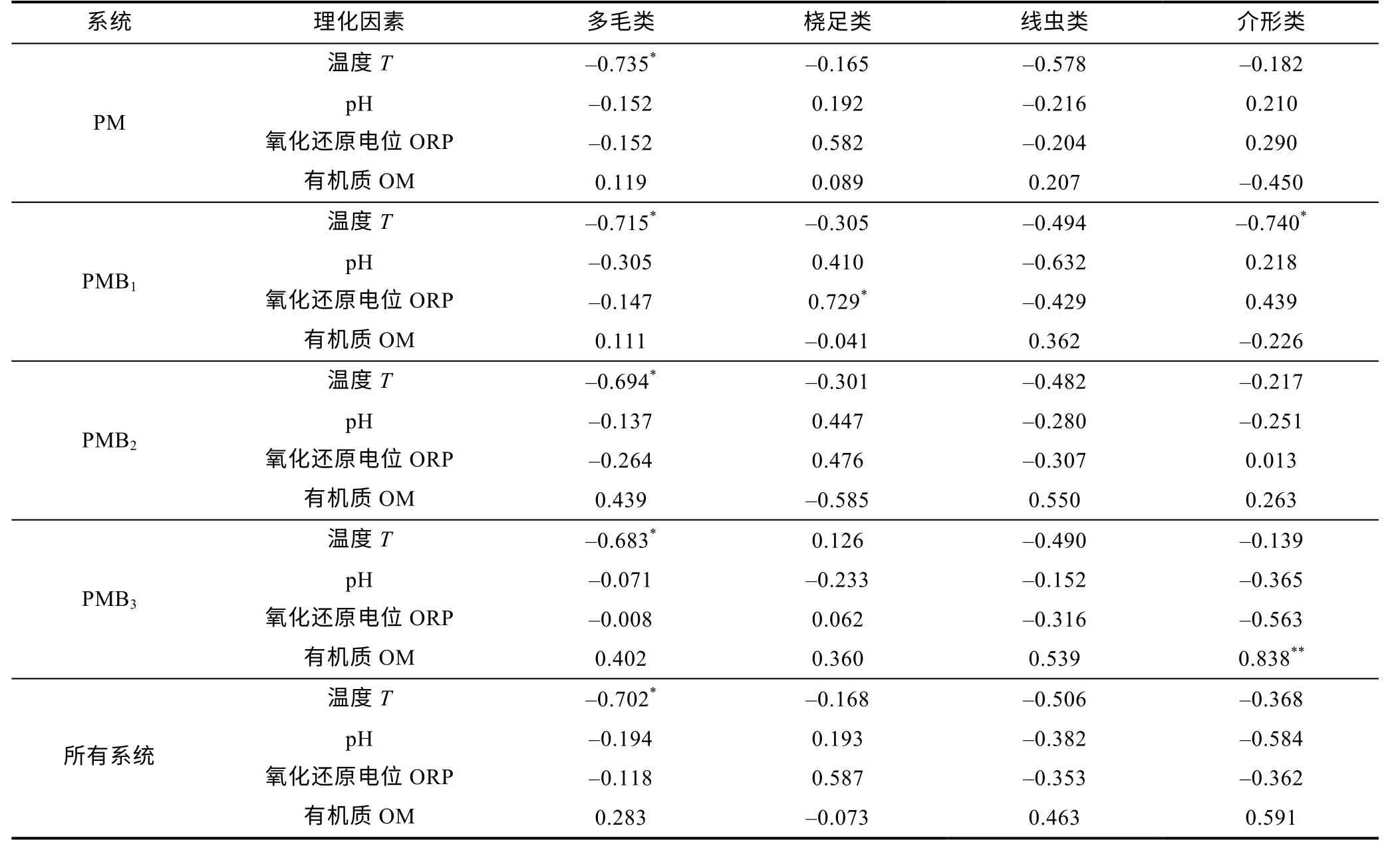
表2 4 种小型底栖动物类群的丰度与沉积物理化因素的Pearson 相关系数Tab.2 The Pearson correlation coefficient between abundance of four benthic groups and sedimentary physicochemical factors
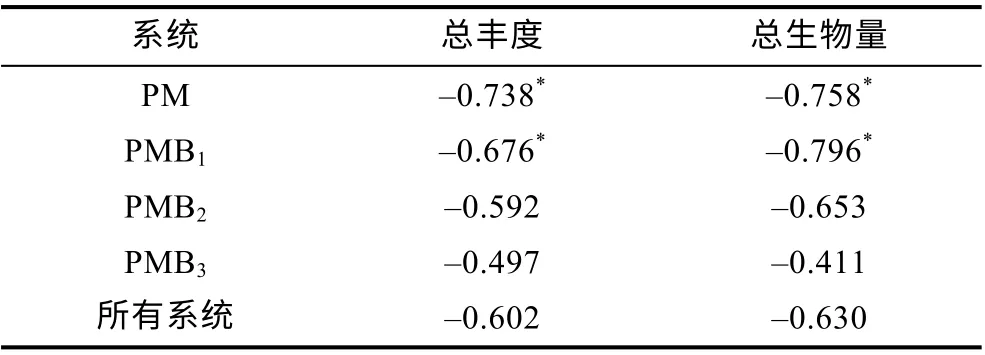
表3 温度与小型底栖动物总丰度和总生物量的Pearson相关系数Tab.3 The Pearson correlation coefficient of temperature with total abundance and total biomass of small benthos
3 讨论
3.1 不同系统底质理化性质的变化
在养殖系统中, 养殖动物的粪便、残饵和死亡生物通过厌氧分解产生大量有机酸, 从而降低pH 值(陈爱华, 2015)。本研究中, 试验期间PMB3底泥pH 均值为7.65, 显著高于PM (7.55)、PMB1(7.58)和PMB2(7.56) (P<0.05), 而PM、PMB1和PMB2之间差异不显著(P>0.05)。这可能是因为, 较高混养密度下, 缢蛏较强的滤食作用能大量滤食系统中的残饵、粪便等有机废物, 一定程度上减少了养殖系统中有机物质在底泥中的积累及其分解作用可能产生的pH 变化, 进而缓解了底泥pH 的降低。
氧化还原电位ORP 是沉积物中各种氧化物与还原物发生氧化还原反应的结果, 是检验沉积物状态的一项综合性指标(崔君等, 2018)。本研究中, 试验期间PMB3底泥氧化还原电位最高, 显著高于对照组和缢蛏低密度混养系统。这表明, 缢蛏较高密度混养能减缓养殖系统底泥氧化还原电位降低的速度。先前有研究表明, 溶解氧是控制氧化还原电位的主要因素之一, 其数值与溶解氧含量的对数呈线性关系(唐晓等, 2004)。在养殖系统中, 底泥中积累的有机质分解会消耗大量氧气(申玉春等, 2010; 吴金浩等, 2012),造成底泥溶氧不足, 导致ORP 值降低, 不利于养殖生物的生长(赵夕旦等, 2000; 刘爱东等, 2021)。而混养较高密度缢蛏后, 粪便、残饵和水体中的颗粒有机物等被大量滤食, 减缓了有机物在底泥中的积累以及对溶氧的消耗, 从而使底质ORP 值升高。
在规模化贝类养殖区, 生物沉降作用十分显著,Hatcher(1994)在加拿大的Upper South Cove 贻贝养殖区对其生物沉降作用进行了测定, 对比邻近非养殖区, 发现前者沉降速度是后者的2 倍多。本研究中,试验期间PMB3有机质含量最低, 显著低于对照组和缢蛏低密度混养系统, 表明贝类高密度养殖减少了养殖系统底质有机质积累, 这一结果与海区的研究结果相反, 推测可能与不同养殖系统的特点有关。在近海贝类养殖区, 水体中颗粒有机物是贝类主要的食物来源, 吊养的贝类通过滤食和生物沉积作用将水体中的有机物质转移到系统底部, 造成有机质沉降加速, 这种作用往往大大超过了水体颗粒有机物的自然沉降速度。而在池塘养殖系统中, 残饵、粪便及浮游生物等悬浮颗粒有机物是底泥有机质的主要来源, 较高的缢蛏混养密度下, 贝类会通过滤食作用不断利用这些有机物进行同化作用, 使得底泥有机物积累显著减少。
上述分析结果表明, 高密度缢蛏混养时, 贝类能通过大量滤食养殖环境中残饵等有机物, 减少有机物质在底质的积累, 使得pH 值、ORP 值和有机质含量处于较优的状态, 底泥环境优于其他处理。
3.2 小型底栖动物丰度和生物量反映底质环境变化
在天然的水生生态系统中, 小型底栖动物多在春季繁殖, 故多为幼体或低龄个体, 而夏秋季基本长大成熟(李永强等, 2013; 季相星等, 2020), 因而小型底栖动物在夏秋季丰度、生物量均较高(王航俊等,2020), 王昱等(2020)对黑河小型底栖动物群落变化的研究表明, 在适宜的生存温度范围内温度升高可加快小型底栖动物的生长。而本研究中, 温度与小型底栖动物的丰度和生物量呈显著负相关。这可能是因为黑河是一个天然的水生生态系统, 温度等物理因素在小型底栖动物群落结构变化中扮演主导角色;而本研究实验系统为养殖生态系统, 温度升高时, 虾蟹活动旺盛, 摄食强烈, 尤其养殖前期对虾会以小型底栖动物为食, 使小型底栖动物的丰度和生物量显著降低。在养殖生态系统中, 不同温度下养殖生物生理活动强度对小型底栖动物的影响可能强于温度对小型底栖动物的直接影响。
一般情况下, 小型底栖动物丰度和生物量在有机质含量高的沉积物中更高, 因为有机质能为小型底栖动物提供大量的食物(任朝亮, 2013; 杨艳云等,2018)。而本实验中, PMB3的总丰度和总生物量最高,即缢蛏密度高的混养系统, 小型底栖动物的丰度和生物量越高, 与先前研究结果相反。这可能是因为,缢蛏密度提高改善了底质的理化性质(本研究中,PMB3系统pH 值和ORP 值最高)。在有机质较为充足的情况下, 相对更优的底质理化环境促进了小型底栖动物的生长繁殖, 使得小型底栖动物的生物量和丰度增加。这与蔡立哲(2010)对深圳湾小型底栖动物的研究一致, 有机质含量与小型底栖动物丰度呈显著负相关, 有机质含量越高, 底质含氧量越低, 含氧量过低可能导致小型底栖动物丰度和生物量降低。
从以上分析可以看出, 养殖系统中养殖生物(虾、蟹、贝类)和小型底栖动物在养殖系统中是相互制约、相互促进的有机关系。虾蟹某些生长阶段会摄食小型底栖动物, 对其生物量造成影响; 贝类能影响底质环境, 进而对小型底栖动物生物量及其他养殖生物的生长产生影响(张继红等, 2013)。从本试验结果看, 在缢蛏放养密度为34.7×104ind./hm2的PMB3系统中,pH、ORP 和小型底栖动物的丰度和生物量高于其他处理组, 有较好的环境效益和养殖效益, 但要获得最佳的综合效益, 仍需结合其他养殖系统优化结果(如系统营养要素收支等)进一步确定。此外, 由于实验条件的限制, 本实验在生产实践的基础上只设置了3 个缢蛏密度, 实验结果并未表明缢蛏混养密度对综合养殖系统底质环境的影响是否存在拐点。因此, 缢蛏密度进一步增加对养殖系统底质环境的影响值得进一步探索。
4 结论
本实验通过对不同养殖系统底泥理化性质和小型底栖动物丰度、生物量的分析比较, 结果发现在缢蛏放养密度为34.7×104ind./hm2的PMB3系统中, pH、ORP 和小型底栖动物的丰度和生物量高于其他处理组, 有机质含量OM 低于其他处理组。因此, 本实验条件下, 基于养殖系统底质环境变化特征, PMB3为最优养殖系统。
