茎柔鱼(Dosidicus gigas)脂肪积累对其4 个组织能量积累贡献的研究*
2022-05-30冯艺璇林东明
冯艺璇 宋 维 林东明,2,3,4①
(1. 上海海洋大学海洋科学学院 上海 201306; 2. 大洋渔业资源可持续开发省部共建教育部重点实验室 上海 201306;3. 国家远洋渔业工程技术研究中心 上海 201306; 4. 农业农村部大洋渔业开发重点实验室 上海 201306)
头足类肌肉组织和消化腺是主要的能量存储组织(Castroet al, 1992; Ibáñezet al, 2015; 林东明等,2017), 其中的脂肪是重要的能量储备形式和代谢物质(Navarroet al, 2014)。头足类体内存储的脂肪在生活史早期和生殖发育阶段起着重要的能量供给作用(Pethybridgeet al, 2014); 并且在饥饿或者能量需求较大时, 储备的脂肪是代谢利用的主要营养物质, 能量贡献度可高达57% (Zamoraet al, 2004; Morillo-Velardeet al, 2013)。然而, 头足类体内的脂肪储存和使用会因生长发育、组织器官等不同而存在差异(Rodrigueset al, 2013), 在个体生长和生殖发育之间的投入分配也存在繁殖策略特殊性(Rochaet al, 2001;林东明等, 2017)。
茎柔鱼(Dosidicus gigas)是重要的大洋性经济头足类, 具有生长速度快(Markaidaet al, 2004)、生命周期短(Keylet al, 2011)等生活史特征, 在繁殖期间营多次产卵策略(Laptikhovskyet al, 2019)。类似于其他头足类, 茎柔鱼的性腺组织发育滞后于个体生长, 但是在性腺发育开始之后生长迅速, 生殖能量积累显著, 在功能性成熟期(性腺成熟度Ⅵ期)生殖能量积累达到最大值(韩飞等, 2019, 2020)。已有研究表明, 茎柔鱼的生殖投入策略为收入-资本混合型(mixed income-capital breeding), 生殖能量主要来源于现场食物摄食的吸收转化, 在生殖能量需求较大时会转化部分肌肉组织存储的能量以供给生殖发育所需(Chenet al, 2020)。同时, 茎柔鱼的卵子为卵黄型, 卵巢发育过程中需要不断积累脂质能量物质(Hernández-Muñozet al, 2016)。然而, 茎柔鱼生殖发育过程中的脂肪积累变化过程及在组织能量积累中的贡献度尚不清楚。为此, 本研究将基于我国远洋鱿钓渔业作业渔船获得的茎柔鱼样本, 利用组织能量密度技术和组织脂肪萃取技术, 探索分析茎柔鱼性腺、肌肉和消化腺等组织的脂肪积累及其能量贡献随性腺发育的变化过程, 为深入认知该种类的组织能量积累及其途径策略研究提供资料参考。
1 材料与方法
1.1 样本来源
茎柔鱼样本来自中国远洋鱿钓渔业作业渔船的渔获物, 采集时间为2017 年2~4 月、8 月, 2018 年1月、5~8 月, 2019 年1~4 月、10~11 月和2020 年5~7月; 采样海域为东太平洋赤道海域(7°25′N~4°21′S,106°19′~120°31′W)和秘鲁专属经济区以外的公海海域(15°24′~20°52′S, 80°29′~87°35′W)。根据作业渔船相对流动的作业特点, 进行每个作业站点随机采集,样本采集后经-20 °C 冷冻保藏运回实验室进行分析。
1.2 生物学测定
实验室解冻后, 对每尾茎柔鱼样本进行生物学测定。本实验测定的生物学内容包括胴长(mantle length, ML)、体重(body weight, BW)、肌肉组织重(胴体+头腕+尾鳍, soma weight, SW)、消化腺重(digestive gland weight, DW)、卵巢重(ovary weight, OvaW)、输卵管卵子重(oviduct eggs weight, OEW)、性腺成熟度(maturity stage, MAT), 以及胃饱满度(stomach fullness degree, FD)。胴长测定精确至1 mm, 体重和肌肉组织重精确至 1 g, 性腺组织重量测定精准至0.001 g。
性腺成熟度划分以Arkhipkin(1992)和ICES(2010)的划分标准为参考, 结合具体实验观察将茎柔鱼生殖系统发育情况进行Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ和Ⅷ等8 个时期的划分。其中, Ⅰ期为未发育, Ⅱ期为开始发育期, Ⅲ期为生理性发育期, Ⅳ~Ⅴ期为生理性成熟期, Ⅵ期为功能性成熟期, Ⅶ期为繁殖产卵期, Ⅷ期为繁殖后期。实验样本中未见有繁殖后期个体。胃饱满度划分, 参考Zuev 等(1985)的划分等级, 根据实验样本具体情况, 划分为0~5 级共6 个等级。其中, 0级为空胃, 1 级为可见零星食物, 2 级为胃含物体积不超过胃腔1/2, 3 级为胃含物体积超过胃腔1/2, 4 级为满胃但不膨胀, 5 级为饱满且胃壁膨胀凸出。
本实验共选取分析了 Ⅲ~Ⅶ期的雌性茎柔鱼样本共105 条(表1), 71%的实验样本来自采样年份的下半年(6~11 月)。每尾实验样本完成生物学内容测定后,剪取胴体腹部肌肉组织约12 g, 摘取整个消化腺组织和性腺组织, 置于塑料密封袋后在-40 °C 冷冻保存。
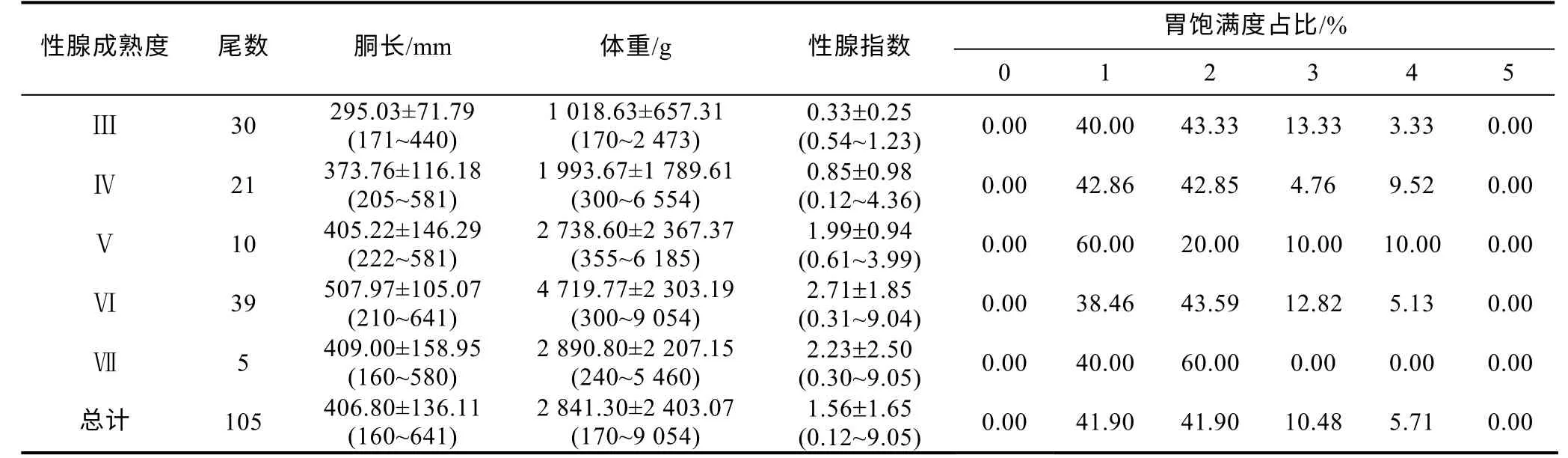
表1 茎柔鱼雌性个体的生物学数据Tab.1 The biological information of female D. gigas
1.3 组织能量密度测定及单位脂肪含量计算
茎柔鱼的卵巢、输卵管卵子、肌肉、消化腺等组织样品经-40 °C 冷冻保存24~36 h 之后, 置入冷冻干燥机(Scientz-10N)在-50 °C 下冷冻干燥24~36 h。冷冻干燥后, 称取各组织样品干重(dry weight, DW),精确至 0.001 g。随后, 各组织样品置于研磨机(Scientz-48)中研磨粉碎。研磨粉碎后均分成两份, 第一份直接置于氧弹热量仪(Calorimeter Parr6400, Parr Instrument Company, Moline, IL, USA)中测定组织能量密度(energy density including lipid content, EDlipid,单位: kJ/g)。第二份称量重量后, 利用二氯甲烷:甲醇:蒸馏水混合液(5∶10∶4, 体积分数)萃取组织脂肪,脂肪含量测定之后, 利用氧弹热量仪测定组织能量密度(energy density after lipid extraction, EDlipidfree, 单位: kJ/g)。组织脂肪含量表示为质量分数, 即每克干燥组织中的脂肪毫克质量, 单位为mg/g。
卵巢、输卵管卵子、肌肉、消化腺等组织样品的能量密度均单独测定。其中, 输卵管卵子的能量密度测定时期自Ⅳ期开始。
1.4 数据处理分析
参考Villegas(2001)方法计算茎柔鱼的性腺指数(gonadosomatic index, GSI), 即卵巢重与体重的比值×100。实验组织的脂肪能量计算为脱脂前后组织能量密度之差与组织总脂肪的乘积, 其中组织总脂肪计算为组织脂肪含量(mg/g)与组织干湿比、组织总质量的乘积。实验组织的脂肪能量占比计算为脂肪能量与实验组织能量积累的比值×100%, 其中实验组织能量积累的计算参见Villegas-Ríos 等(2014)和Lin 等(2017)。
利用单样本Kolmogorov-Smirnoff 分析检验性腺指数、组织能量密度、单位质量脂肪含量、脂肪能量及脂肪能量占比等数据的正态性, 若符合正态分布则利用单因素方差分析(ANOVA)检验分析各数据随性腺发育的差异性, 并进行Tukey HSD随后检验; 若不符合正态分布则利用Kruskall-Wallis 非参数检验分析各数据随性腺发育的差异性, 并利用Games- Howell HSD 进行随后的显著性检验。数据的差异性显著水平为0.05。所有数据以均值±标准差表示, 应用Origin2018 和SPSS25.0等统计分析软件进行数据的分析处理。
2 结果
本次实验采用的茎柔鱼雌性样本的胴长为160~641 mm, 平均胴长为(406.80±136.11) mm; 体重为170~905 4 g, 平均体重为(2 841.30±2 403.07) g; 性腺指数为0.12%~9.05%, 随着性腺发育增加显著(F=13.30,P<0.05), 在功能性成熟期(Ⅵ期)达到最大值, 为2.71%±1.85%。实验样本中未见胃饱满度0 级和5 级个体, 以胃饱满度1~2 级样本为主, 在 Ⅲ~Ⅶ期每个时期样本中的占比分别为83.33%、85.71%、80.00%、82.05%和100% (表1)。
2.1 肌肉、性腺、消化腺的能量密度值
分析显示, 脱脂前, 茎柔鱼雌性个体卵巢、输卵管卵子、肌肉、消化腺等组织间的能量密度值差异性显著(P<0.05), 各组织的能量密度值分别为(22.31±0.73)、(23.84±0.24)、(20.02±0.19)和(27.34±0.85) kJ/g。不同性腺成熟度之间, 输卵管卵子、肌肉、消化腺的能量密度值不存在显著性差异(输卵管卵子:F=1.24,P=0.31; 肌肉:F=1.50,P=0.21; 消化腺:F=1.87,P=0.13); 卵巢的能量密度值随着性腺发育增加显著(F=23.76,P<0.05), 并在繁殖产卵期达到最大值(图1)。
脱脂后, 卵巢、输卵管卵子、肌肉、消化腺等的组织能量密度值分别为(19.03±0.65)、(20.01±0.56)、(17.88±0.47)和(18.51±1.30) kJ/g。与脱脂前相比较,各组织脱脂后的能量密度值均下降显著(卵巢:F=80.26,P<0.05; 输卵管卵子:F=44.26,P<0.05; 肌肉:F=60.76,P<0.05; 消化腺:F=83.26,P<0.05), 其中卵巢能量密度值下降14.59%±3.91%, 输卵管卵子能量密度值下降16.73%±2.65%, 肌肉组织能量密度值下降 10.99%±3.79%, 消化腺能量密度值下降31.64%±6.11%。各组织之间的能量密度值仍存在显著性差异(P<0.05), 以输卵管卵子的最大, 卵巢的次之。然而, 不同性腺成熟度之间, 各组织的能量密度值均没有显著性差异(卵巢:F=2.24,P=0.08; 输卵管卵子:F=1.90,P=0.59; 肌肉:F=0.97,P=0.44; 消化腺:F=1.91,P=0.12) (图1)。

图1 茎柔鱼雌性个体卵巢、输卵管卵子、肌肉和消化腺的组织能量密度分布Fig.1 The distribution of tissue energy density of ovary, oviduct eggs, soma, and digestive gland in female D. gigas in different maturity stages
2.2 肌肉、性腺、消化腺的单位质量脂肪含量
分析显示, 茎柔鱼雌性个体卵巢、输卵管卵子、肌肉、消化腺等组织间的单位质量脂肪含量存在显著性差异(P<0.05), 以消化腺单位质量脂肪含量最大,为247.66~663.03 mg/g, 平均值为(413.83±96.81) mg/g;次之为输卵管卵子, 单位质量脂肪含量为 228.65~396.68 mg/g, 平均值为(309.51±44.36) mg/g; 卵巢单位质量脂肪含量为 65.46~232.82 mg/g, 平均值为(150.64±46.65) mg/g。肌肉组织单位质量脂肪含量最少, 为59.05~257.67 mg/g, 平均值为(120.52±36.07) mg/g(图2)。
卵巢的单位质量脂肪含量自生理性发育期(Ⅲ期)至生理性成熟前期(Ⅳ期)增加显著(P<0.05), 在Ⅳ期时单位质量脂肪含量为(166.68±56.67) mg/g, 随后维持稳定水平(P>0.05) (图2)。随着性腺发育, 输卵管卵子的单位质量脂肪含量稳定, 不同性腺成熟度之间没有显著性差异(F=0.04,P=0.99)。肌肉组织的单位质量脂肪含量自生殖性成熟前期(Ⅳ期)呈下降趋势但不显著(χ2=14.23,P=0.29), 在繁殖产卵期(Ⅶ期)为最小值, 为(104.04±43.91) mg/g。消化腺的单位质量脂肪含量在生理性发育期(Ⅲ期)最低, 平均值为(379.59±99.31) mg/g, 随着性腺发育呈上升趋势但不显著(F=1.41,P=0.36) (图2)。

图2 茎柔鱼雌性个体卵巢、输卵管卵子、肌肉和消化腺的单位质量脂肪含量分布Fig.2 The distribution of lipid content per gram of ovary, oviduct eggs, soma and digestive gland in female D. gigas in different maturity stages
2.3 肌肉、性腺、消化腺的脂肪能量
卵巢、输卵管卵子、肌肉、消化腺的脂肪能量分别为 1.14~319.81、1.16~495.66、81.84~2 134.66、19.72~1 812.52 kJ, 平均值分别为(50.20±57.29)、(90.04±110.09)、(663.13±563.15)、(412.47±344.90) kJ。随着性腺发育, 卵巢、输卵管卵子、消化腺的脂肪能量增加显著(卵巢,F=6.21,P<0.05; 输卵管卵子,F=2.77,P<0.05; 消化腺,F=8.10,P<0.05), 且均在功能性成熟期(Ⅵ期)时脂肪能量达到最大值, 分别为(87.23±64.65)、(134.57±128.74)、(642.57±424.20) kJ;在繁殖产卵期(Ⅶ期), 卵巢和消化腺组织的脂肪能量有所下降但不显著(Tukey HSD: 卵巢P>0.05, 消化腺P>0.05), 输卵管卵子脂肪能量下降显著(Tukey HSD:P<0.05)。肌肉的脂肪能量在Ⅲ~Ⅴ期有所下降,Ⅴ期时最低, 为(556.51±438.63) kJ; 随后有所增加,并在Ⅶ期时达到最大值, 为(981.16±849.75) kJ; 但是,不同性腺发育时期的脂肪能量没有显著性差异(F=0.78,P=0.54) (图3)。
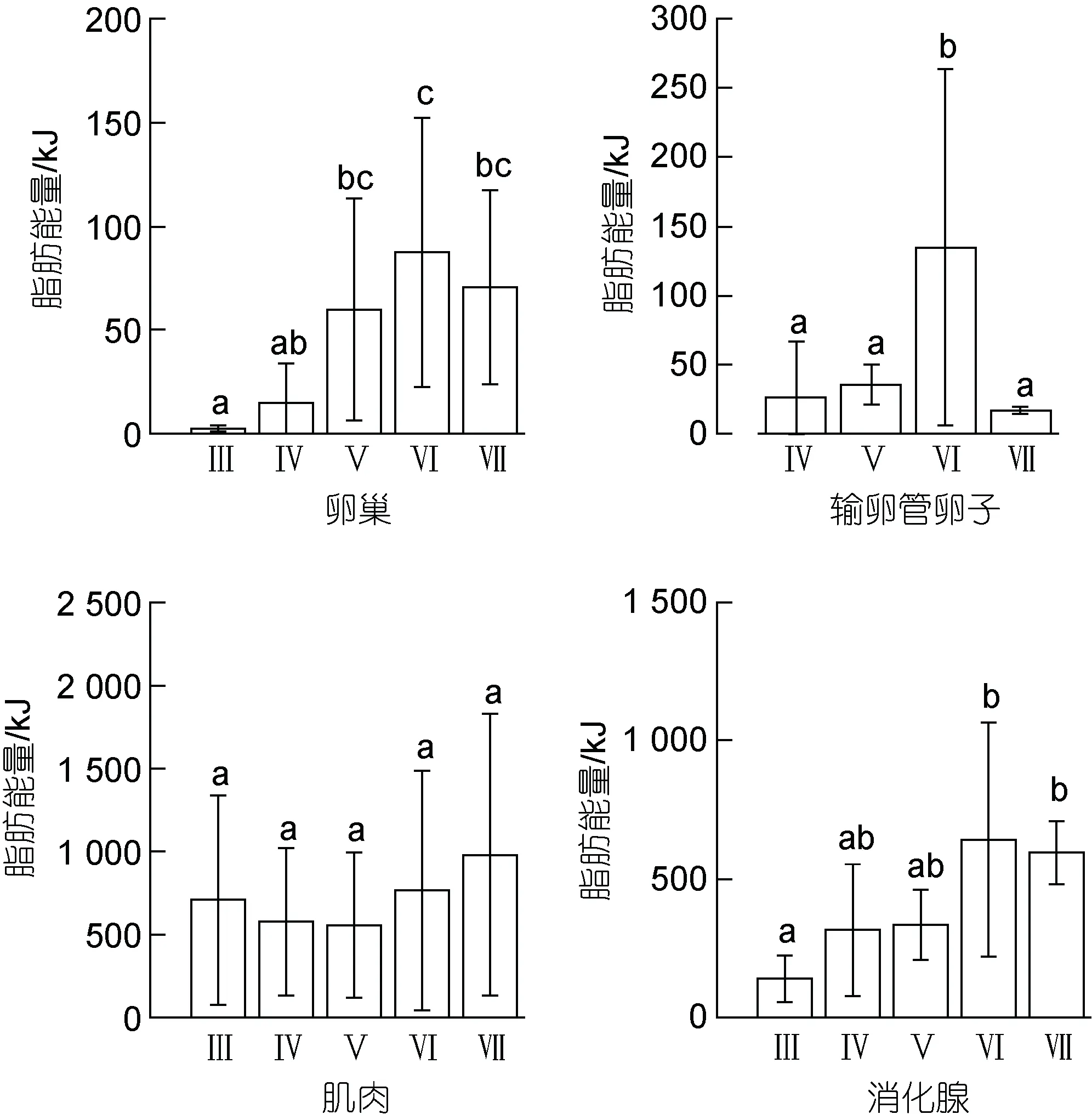
图3 茎柔鱼雌性个体卵巢、输卵管卵子、肌肉和消化腺的脂肪能量分布Fig.3 The distribution of lipid energy of ovary, oviduct eggs,soma, and digestive gland of female D. gigas in different maturity stages
2.4 肌肉、性腺、消化腺的脂肪能量占比
茎柔鱼雌性个体的卵巢、输卵管卵子、肌肉和消化腺 4 个组织间的脂肪能量占比存在显著性差异(P<0.05), 以消化腺的脂肪能量占比最高, 为19.26%~42.58% (32.19%±5.70%); 次之为输卵管卵子和卵巢,两者的脂肪能量占比分别为13.11%~19.68% (16.98%±1.86%)和7.37%~20.46% (14.75%±3.01%); 肌肉的脂肪能量占比最低, 为4.85%~16.79% (10.94%±3.23%)。
随着性腺发育, 卵巢脂肪能量占比显著增加(F=3.67,P=0.01), 在繁殖产卵期时达到最大值, 为17.80%±0.80% (图4)。输卵管卵子和消化腺的脂肪能量占比在不同性腺成熟度之间均没有显著差异(卵子:F=0.04,P=0.98; 消化腺:F=0.15,P=0.96), 保持稳定水平。肌肉组织脂肪能量占比在Ⅲ期至Ⅴ期时下降显著(F=3.59,P<0.05), Ⅴ期时最低, 为8.70%±2.55%;但是, 在繁殖产卵期时, 脂肪能量占比有所增加, 为11.76%±1.23%。
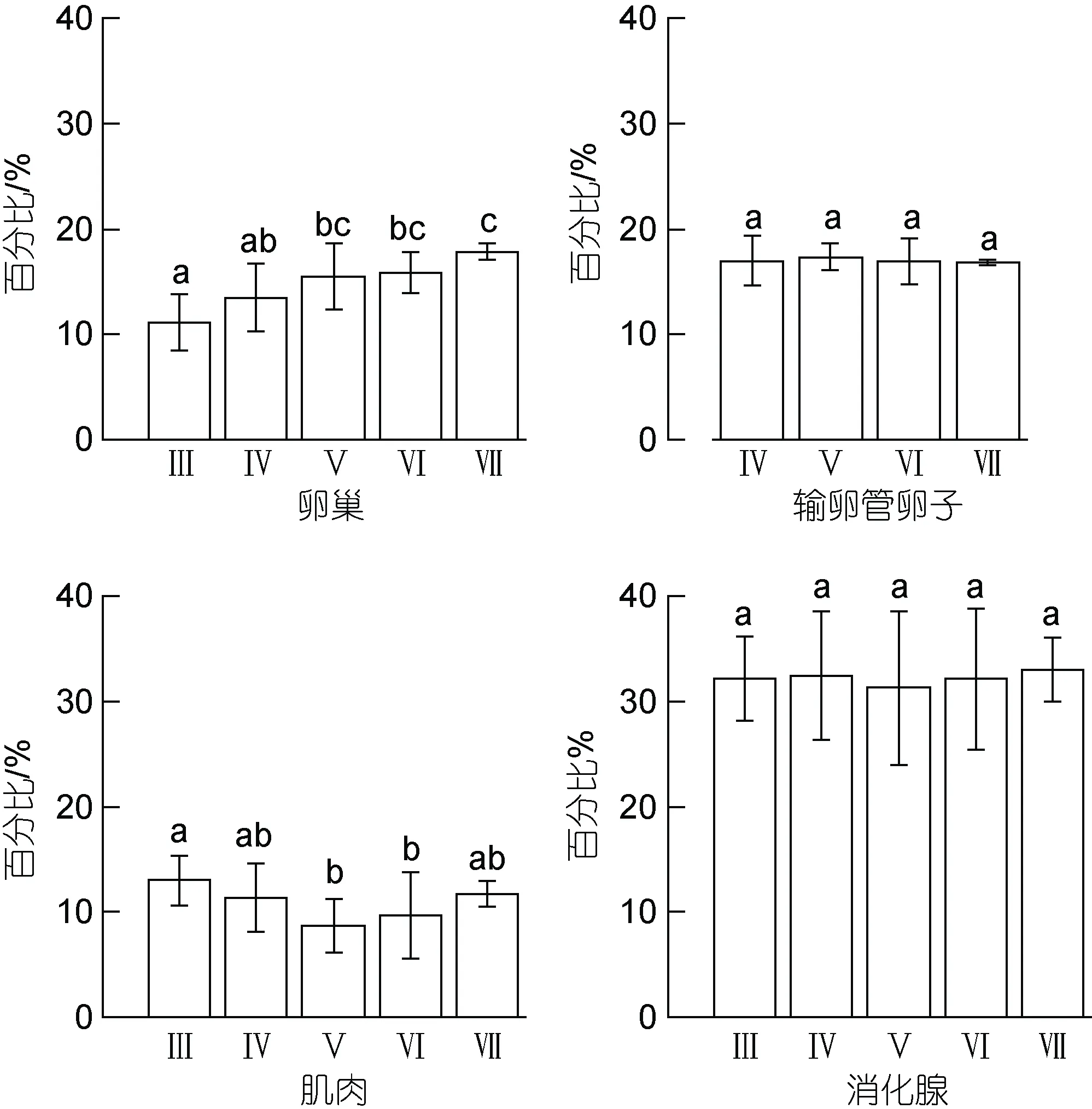
图4 茎柔鱼雌性个体卵巢、输卵管卵子、肌肉和消化腺的组织脂肪能量占比Fig.4 The percentage of lipid energy of ovary, oviduct eggs,soma, and digestive gland of female D. gigas in different maturity stages
3 讨论
头足类的繁殖产卵期短, 仅占生命周期10%~20%(Rochaet al, 2001; Boyleet al, 2005)。在性腺发育开始之后, 这些种类所摄食或积累能量将大部分地投入生殖发育, 生殖系统较快速地生长并发育配子(Moltschaniwskyjet al, 2000; McGrathet al, 2002)。本研究发现, 茎柔鱼雌性成熟个体的性腺指数较低, 在功能性成熟期(Ⅵ期)达到最大值, 该时期的性腺指数平均值约为2.70%, 与智利外海(刘必林等, 2010)和哥斯达黎加外海(李纲等, 2011)的雌性成熟个体的性腺指数相近。同时, 胃饱满度分析显示茎柔鱼雌性成熟个体和繁殖产卵个体的空胃率均为0。这些结果说明茎柔鱼雌性个体的生殖投入较低, 性腺成熟至繁殖产卵期继续保持摄食行为, 可能与其外源性为主的生殖投入类型(Chenet al, 2020)和多次产卵的繁殖特性(Nigmatullinet al, 2001)密切相关。在头足类中, 营多次产卵策略的鸢乌贼(Sthenoteuthis oualaniensis)(Harmanet al, 1989)和澳洲双柔鱼(Nototodarus gouldi)(McGrathet al, 2002)等种类也表现出相类似的特点,即生殖投入水平低、繁殖产卵期间正常摄食。通常,较低的生殖投入水平且繁殖期间保持正常摄食行为,可以有效地实现生物个体生殖价值的最大化(McBrideet al, 2015)。因此, 头足类中营多次产卵的种类可能具有相同的生殖投入类型, 具体情况仍需后续研究的佐证。
组织能量密度是生物体同化和异化作用的共同结果, 是组织中各类营养物质能量存储的共同体现(Villegas-Ríoset al, 2014)。通常, 头足类被认为是以蛋白质为代谢基础的海洋软体动物(Hayashiet al,1987)。然而, 脂肪具有较大的能值, 是相同当量葡萄糖产出能量的2.5 倍(Azcona, 2013; Pethybridgeet al,2013), 比蛋白质或者碳水化合物的能值高出近1/3(Parrish, 2013); 而且, 在饥饿或者能量需求突然增大时, 脂肪是优先代谢的营养物质(Speers-Roeschet al,2016)。本研究发现, 茎柔鱼卵巢、输卵管卵子、肌肉和消化腺等组织在脱脂之前具有较高的组织能量密度值, 均在20 kJ/g 以上; 脱脂后各组织的能量密度值均下降显著, 尤以消化腺的能量密度值下降最大,达31%, 次之为输卵管卵子和卵巢, 分别下降17%和15%。此外, 各组织的脂肪能量平均占比均在10%及以上, 消化腺的脂肪能量占比甚至高达43%。这些结果说明在热量存储水平上, 脂肪是茎柔鱼能量存储的重要营养与能量物质, 也一定地说明了脂肪在头足类能量积累过程中起着重要的作用。
同时, 茎柔鱼卵巢、输卵管卵子、肌肉和消化腺等组织的能量密度值均存在显著的组织差异性。在脱脂前, 消化腺组织能量密度值最高, 次之为输卵管卵子和卵巢, 肌肉组织的能量密度值最低; 脱脂之后,组织能量密度值以输卵管卵子和卵巢的最高, 其次为消化腺, 肌肉组织的能量密度值仍为最低。与此相对应, 消化腺组织具有最大的单位质量脂肪含量, 平均单位质量脂肪含量约为400 mg/g; 次之为输卵管卵子和卵巢, 两者的平均单位质量脂肪含量分别约为309 mg/g 和150 mg/g; 肌肉组织的单位质量脂肪含量相对较低, 平均单位质量脂肪含量为120 mg/g,这些结果与Quispe-Machaca 等(2021)和Saito 等(2014)的研究结果相一致。在其他头足类种类中也曾被报道相似的研究成果, 比如贝乌贼(Berryteuthis magister)消化腺的脂肪含量为组织质量的 22.4%~56.9%(Hayashiet al, 2002), 太平洋褶柔鱼(Todarodes pacificus)消化腺的脂肪含量为组织质量的 36.2%~37.8% (Igarashiet al, 2001)、肌肉组织脂肪含量仅为组织质量的4.93% (赵艳秋等, 2008), 阿根廷滑柔鱼(Illex argentinus)消化腺脂肪含量平均值为组织质量的37%、卵巢和肌肉等组织脂肪含量平均值分别为组织质量的23%和14% (Linet al, 2019)。根据其他学者的研究, 头足类肌肉中最丰富的脂质成分是磷脂(Phillipset al, 2002; Hayashiet al, 2004), 主要作为细胞膜结构发挥作用(Blanchieret al, 1984); 消化腺具有较高的脂质含量和脂肪酶活性(Moltschaniwskyjet al, 2006), 脂质结构中甘油三酯含量较高, 是氧化产生三磷酸腺苷以及合成的脂肪酸的重要来源(Sargentet al, 1995)。结合卵巢、输卵管卵子、肌肉和消化腺脱脂后的组织能量密度值显著下降的结果, 可见茎柔鱼能量密度值的组织差异性与各组织单位质量脂肪含量密切相关。
此外, 茎柔鱼卵巢组织脱脂前的能量密度值随着性腺发育增大显著, 脱脂后的能量密度值则没有显著的差异性。这表明在性腺发育过程中, 卵巢组织不断积累脂肪, 而其他生化组成(蛋白质、碳水化合物等)处于相对稳定水平。这也可以从脂肪能量及其能量占比的结果中得到印证, 茎柔鱼卵巢积累的脂肪能量及其能量占比均随着性腺发育显著增加, 前者在功能性成熟期达到最大值, 为(87.23±64.65) kJ; 后者则在繁殖产卵期达到最大值, 约为18%。值得注意的是, 卵巢组织的单位质量脂肪含量在生理性成熟前期增加显著, 随后维持稳定水平, 与输卵管卵子的单位质量脂肪含量及其脂肪能量占比自生理性成熟期之后均处于稳定水平相一致。实际上, 在生理性成熟之后, 茎柔鱼便批次成熟卵母细胞, 并不断排入输卵管(Nigmatullinet al, 2009)。为此, 这些结果一方面说明了在生理性成熟之后, 茎柔鱼卵巢组织较大量地积累脂肪以发育卵巢卵母细胞; 另一方面则说明了茎柔鱼对成熟卵子投入分配的脂肪及其含量相对恒定, 以保证卵子质量(Bachanet al, 2012)。
与卵巢组织不同, 茎柔鱼输卵管卵子、肌肉和消化腺等三组织脱脂前后的能量密度值均没有显著的性腺发育差异性。同时, 3 个组织的单位质量脂肪含量在不同性腺发育时期也处于稳定水平, 并且输卵管卵子和消化腺的脂肪能量占比较高, 分别维持在17%和32%的水平上。这些结果说明了在性腺发育过程中, 茎柔鱼输卵管卵子、肌肉和消化腺等组织生化组成中的单位质量脂肪含量处于相对稳定状态。然而,输卵管卵子和消化腺的脂肪能量均随着性腺发育不断增加。其中, 输卵管卵子的脂肪能量在功能性成熟期达到最大值, 为(134.57±128.74) kJ, 在繁殖产卵期则下降显著, 这种变化过程与输卵管不断积累成熟卵子、繁殖产卵期批次排出的过程相关(Nigmatullinet al, 2009)。消化腺的脂肪能量也在功能性成熟期达到最大值, 为(642.57±424.20) kJ, 并且在繁殖产卵期没有显著下降。结合消化腺稳定的脂肪能量占比, 可进一步说明茎柔鱼的消化腺在繁殖产卵期间具有稳定的脂肪积累水平。一般地, 头足类消化腺是主要的食性脂肪存储器官, 脂肪积累与其摄食行为关系紧密(Castroet al, 1992; Clarkeet al, 1994; Swiftet al,2005)。本研究的茎柔鱼繁殖产卵个体中未发现空胃样本, 可见其消化腺稳定的脂肪积累水平应该是持续的摄食行为与食物消化吸收所致(Ruiz-Cooleyet al,2006; Trasviña-Carrilloet al, 2018; 胡贯宇等, 2018;Sanchezet al, 2020; Brunoet al, 2021)。
4 结论
本研究通过组织能量密度测定技术和组织脂肪萃取技术, 初步阐明了脂肪积累是茎柔鱼卵巢、输卵管卵子、肌肉和消化腺等组织能量积累过程中的重要营养与能量物质。消化腺组织具有最高的单位质量脂肪含量, 卵巢和输卵管卵子的单位质量脂肪含量次之, 肌肉组织的单位质量脂肪含量最低。在生理性发育成熟之后, 卵巢组织较大量地积累脂肪以发育卵巢卵母细胞, 而输卵管卵子、肌肉和消化腺等组织则维持相对稳定的脂肪积累水平。值得注意的是, 茎柔鱼的脂肪积累水平与摄食行为密切相关, 后者对栖息海域的环境波动变化敏感性高(Boyleet al, 2005)。因此, 后续研究中需要结合栖息海域环境因子, 探索分析茎柔鱼脂肪积累的环境效应关系, 为更深入地认知该种类的组织能量积累及其途径策略提供资料参考。
