神经毒素BMAA 对球等鞭金藻(Isochrysis galbana)的生长抑制作用研究*
2022-05-30李爱峰刘建伟付艺蕾邱江兵
李爱峰 刘建伟 胡 杨 付艺蕾 邱江兵
(1. 中国海洋大学环境科学与工程学院 山东青岛 266100; 2. 海洋环境与生态教育部重点实验室 中国海洋大学 山东青岛 266100)
二十世纪五六十年代, 在西太平洋关岛地区当地土著居民查莫罗人群中流行一种地方病——肌萎缩侧索硬化-帕金森痴呆综合症(ALS-PDC), 其发病率是其他地区平均水平的50~100 倍。但该疾病的发病率在移居到其他地区的查莫罗人的后代人群中明显降低, 说明某些环境因素可能诱导该疾病的发生(李爱峰等, 2009; 牛琦等, 2012)。科学家推测关岛地区高发的ALS-PDC 疾病可能与查莫罗人食谱中的苏铁(Cycasmicronesica)种子和果蝠(Pteropusmariannus)有关, 其中含有一种神经毒性的非蛋白氨基酸——β-N-甲氨基-L-丙氨酸(β-N-methylamino-L-alanine, BMAA),其沿食物链具有显著的生物放大作用(Coxetal, 2003;Murchetal, 2004a)。随后人们在死于阿尔茨海默症的2 名加拿大患者和12 名美国患者及死于ALS 疾病的13 名美国患者的脑组织中也检出了BMAA, 说明环境中分布的BMAA 可能与全球散发的这类神经退行性疾病有关(Murchetal, 2004b; Pabloetal, 2009)。我国学者在中国近海尤其是北方沿海采集的多种贝类软体动物样品中普遍检出 BMAA (Lietal, 2016,2018), 且发现BMAA 在胶州湾生态系统中也具有明显的生物放大作用(Wangetal, 2021)。由于BMAA 分子在生物体内既能以游离态形式存在, 也可与低分子量的多肽结合, 或直接嵌入蛋白质分子中以蛋白结合态存在(Rosénetal, 2016), 通常生物样品中游离态BMAA 与蛋白结合态BMAA 含量的比值范围为1∶60~1∶120 (Inceet al, 2005)。因此, 目前研究工作中通常将BMAA 划分为三种形态定量描述: 经三氯乙酸等极性溶剂提取离心后, 溶解于上清液中的“游离态BMAA”; 在上清液中与多肽或小分子蛋白结合,经盐酸水解后释放出来的“溶解结合态BMAA”; 在沉淀中与大分子蛋白结合, 经盐酸水解后释放出来的“沉淀结合态BMAA”(Lanceetal, 2018)。
目前有关人神经退行性疾病的发病机制尚无定论, 但有关BMAA 对神经元的毒性作用已得到普遍认同。离体实验结果表明, BMAA 可通过多种途径导致运动神经元的损伤, 主要包括: (1) BMAA 能够与碳酸氢盐结合生成与谷氨酸相似结构的β-氨基甲酸盐(Weissetal, 1988), 能够竞争性地与神经细胞膜上的离子型和促代谢型谷氨酸受体结合(Cucchiaroniet al, 2010), 导致神经细胞内Na+和Ca2+浓度升高, K+浓度降低, 从而破坏了细胞稳态; (2) 细胞内Ca2+浓度的升高破坏线粒体功能, 导致活性氧的释放, 造成氧化损伤(Raoetal, 2006); (3)谷氨酸受体的激活导致神经细胞去极化, 使得神经细胞膜的通透性增加, 并释放去甲肾上腺素, 造成兴奋性中毒(Lindströmetal,1990; Nedeljkovetal, 2005); (4) BMAA 还能抑制神经细胞膜上的半胱氨酸/谷氨酸反转运系统(cystine/glutamate antiporter system, Xc-), 抑制抗氧化剂谷胱甘肽的合成(Liuetal, 2009)。近年的活体实验表明,长期喂食含有BMAA 的水果导致绿猴(Chlorocebus sabaeus)脑组织中形成与ALS-PDC 患者脑组织中相似的神经元纤维缠结和β-淀粉样蛋白(Coxetal, 2016);BMAA 暴露(≥50 mg/kg)也会导致成年大鼠出现轻度短期行为改变和海马神经元丢失, 并出现β-淀粉样蛋白沉积(Scottet al, 2019)。这些发现进一步证实了BMAA 毒素对人神经退行性疾病的诱导作用。
毒理学研究表明, BMAA 对多种微藻、高等水生植物、水生动物等水生生物也具有一定的毒害作用。研究发现, 4.2 µmol/L 的外源 BMAA 对集胞藻Synechocystissp. PCC6803 的生长和光合作用能力具有明显的抑制作用(Downingetal, 2012); 20 µmol/L外源BMAA 导致固氮念珠藻Nodulariasp. PCC7120生长停滞和细胞内糖原的积累(Berntzonetal, 2013),也可抑制鱼腥藻Anabaenasp. PCC7120 细胞分化过程相关的hetR基因和hepA基因的表达和固氮酶活性(Popovaetal, 2018); 0.5 µmol/L 的BMAA 可导致三角褐指藻(Phaeodactylumtricornutum)和威氏海链藻(Thalassiosiraweissflogii)细胞内叶绿素a的含量降低,且干扰藻细胞内氮的代谢过程(Lageetal, 2016)。有关BMAA 与水生植物的暴露实验表明, BMAA 能够引起罗蔓藤蕨(Lomariopsislineata)、水藓(Fontinalis antipyretica)、鹿角苔(Ricciafluitans)、爪哇莫丝(Taxiphyllumbarbieri) 和金鱼藻(Ceratophyllum demersum)等水生植物组织中抗氧化酶活性降低, 且在短时间内不能恢复(Esterhuizen-Londtet al, 2011;Contardo-Jaraet al, 2013)。另外, BMAA 可影响大型蚤(Daphniamagna)的存活、运动和繁殖能力(Lürlinget al, 2011); 导致斑马鱼(Daniorerio)胚胎心率减慢、心包水肿、脊髓轴异常和痉挛惊厥等症状(Purdieet al,2009; Wang, 2015); 抑制海胆(Lytechinuspictus)胚胎的受精和发育, 出现细胞分裂异常和畸形发育(Liet al, 2020)。由此来看, BMAA 毒素对多种水生生物具有普遍的毒性作用, 威胁海洋生物的健康和生态系统的结构与功能。
海洋微藻作为海洋生态系统最主要的初级生产者, 对海洋生态系统的物质循环和能量流动起着重要作用。海洋硅藻作为BMAA 毒素的重要来源, 在正常生长代谢或细胞死亡后会将水溶性的BMAA 毒素释放到胞外, 直接与海洋生物暴露接触, 并可通过化学生态学作用影响海洋生态系统的演化。然而目前有关BMAA 对海洋微藻毒性效应的研究较少, 对其致毒机理的认识也很有限, 有关外源BMAA 跨膜进入微藻细胞的过程及环境中氨基酸的影响尚不清楚。本研究选择我国近海分布的典型饵料藻——球等鞭金藻(Isochrysisgalbana)为研究对象, 对其在BMAA暴露条件下的生长状况和吸收毒素的情况进行了分析, 并比较分析了不同氨基酸单独及其与BMAA 联合暴露条件下对球等鞭金藻的影响, 以期揭示BMAA 对海洋浮游植物的化学生态学作用。
1 材料与方法
1.1 实验材料
球等鞭金藻(3011)由中国海洋大学水产学院藻种库提供。BMAA 标准物质(L-BMAA hydrochloride,B107-10 mg)和DAB 标准物质(DL-2,4-diaminobutyric acid dihydrochloride, D3758-1 g)购自美国Sigma 公司,AEG 标准物质[N-(2-aminoethyl) glycine, A608975-1 g]购自加拿大TRC 公司。氨基酸标准物质和优级纯盐酸购自国药集团化学试剂有限公司。分析纯三氯乙酸和色谱纯乙腈购自德国Merck 公司, 色谱纯甲酸购自美国Sigma 公司。新鲜海水取自青岛市崂山区流清河附近海域。超纯水是由Direct-Q®8 UV-R 纯水系统(美国 Millipore)制备。毒素分析用色谱柱 TSK-Gel Amide-80®(250 mm × 2 mm, 5 µm)购自日本Tosoh 生物科技有限公司。
1.2 BMAA 单独暴露条件下球等鞭金藻的生长状况
1.2.1 球等鞭金藻的室内培养 将新鲜海水经0.45 µm 混合纤维滤膜过滤, 按照不含硅的f/2 培养基配方(Guillardet al, 1993)添加氮磷营养液, 然后在高压灭菌锅中进行高温灭菌(121 °C, 20 min), 待冷却至室温后添加维生素和微量元素, 用于球等鞭金藻的批次培养。选用250 mL锥形瓶, 培养体系100 mL, 在无菌环境中接种藻液, 初始密度为3×105cells/mL 左右, 接种后立刻添加相应的BMAA 毒素。根据BMAA暴露对球等鞭金藻的预实验结果, 分别设置空白对照组和200、250、300、350、400 μg/L BMAA·HCl染毒组进行毒理学实验, 每组设置3 个平行。将培养液放置在光照培养箱(HDL HPG-280BX, 哈尔滨东联电子技术开发有限公司)内, 设置温度18 °C, 光照强度6 000 lx, 光暗比12 h∶12 h, 每天分3 次定时轻轻摇匀微藻培养液, 并随机更换培养箱中藻液的位置。
1.2.2 球等鞭金藻的生长曲线及96 h 半效应浓度(96 h-EC50)的计算 染毒培养实验开始后每天取1 mL 藻液, 使用血球计数板在倒置显微镜(CKX53,日本Olympus)下计数, 每瓶藻液摇匀后重复计数3 次,取平均值记录藻细胞的生长密度并绘制生长曲线。在96 h 后, 根据《化学品: 藻类生长抑制试验(GB/T 21805—2008)》中的相关计算方法计算比生长率和抑制率, 以体系中BMAA·HCl 浓度的对数值为横坐标,以抑制率为纵坐标, 绘制剂量—效应曲线, 采用直线内插法确定BMAA·HCl 对球等鞭金藻的96 h-EC50值。比生长率按照下列公式计算:
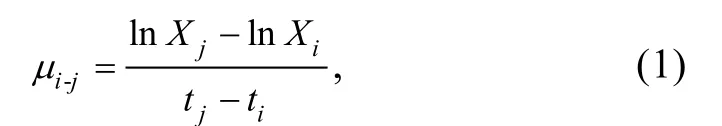
式中,µi-j: 从i时刻到j时刻的比生长率, 单位: d-1;Xi:i时刻的藻细胞密度;Xj:j时刻的藻细胞密度。
抑制率按照下列公式计算:
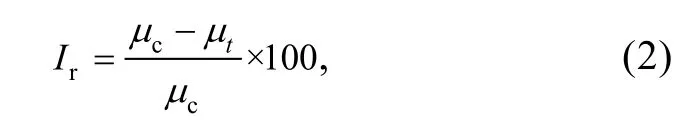
式中,Ir: 以比生长率为基础的抑制率, 单位: %;µc:对照组中各平行处理的比生长率的平均值;µt: 染毒组中各平行处理的比生长率的平均值。
1.3 球等鞭金藻对外源BMAA 的吸收及其氨基酸含量的测定
1.3.1 球等鞭金藻的室内培养与藻细胞的收集 采用1.2.1 部分相同的方法准备微藻培养液, 选用1 L锥形瓶, 培养体系500 mL, 接种的初始密度为5×105cells/mL 左右, 设置空白对照组和100、300、700 μg/L BMAA·HCl 染毒组共4 组, 每组3 个平行。在温度18 °C, 光照强度6 000 lx, 光暗比12 h∶12 h条件下培养, 每天分3 次定时摇匀藻液, 并随机更换藻液的位置, 降低光照条件的影响。采用1.2.1 部分相同的方法计数微藻的细胞密度。在球等鞭金藻染毒培养96 h 后, 充分摇匀藻液, 每组取100 mL 于4 °C下以8 000 r/min 转速离心10 min 收集藻细胞, 用于测定藻细胞中BMAA 的含量。另取空白对照组和300 μg/L BMAA·HCl 组每瓶藻液各400 mL, 于4 °C下以8 000 r/min 转速离心10 min 收集藻细胞, 尽量去除上清液, 记录藻泥湿重, 用于测定藻细胞中氨基酸的含量。将收集到的藻泥置于-20 °C 冰箱中保存待测。
1.3.2 藻细胞中BMAA 的提取 向含有藻泥的离心管中加入3 mL 0.1 mol/L 的三氯乙酸, 涡旋混匀,于冰浴中超声破碎10 min, 最后在4 °C 条件下以8 000 r/min 转速离心5 min。取离心后的上清液1 mL,经0.22 μm 水系滤膜过滤至1.5 mL 进样瓶, 得到的游离态BMAA 提取液置于-20 °C 冰箱中保存。取离心后的上清液1 mL 转移至4 mL 进样瓶中, 在55 °C 条件下氮吹, 吹干后加入1 mL 6 mol/L 盐酸溶解, 涡旋混匀后在110 °C 下水解24 h, 冷却至室温后再次氮吹, 吹干后加入1 mL 20 mmol/L 盐酸重新溶解, 经0.22 μm 水系滤膜过滤至1.5 mL 进样瓶中, 得到的总溶解态BMAA 提取液置于-20 °C 冰箱中保存。移除上清液后, 向沉淀中加入2 mL 6 mol/L 盐酸, 涡旋混匀后转移至4 mL 进样瓶中, 在110 °C 条件下水解24 h, 冷却至室温后在55 °C 条件下氮吹, 吹干后加入1 mL 20 mmol/L 盐酸重新溶解, 经0.22 μm 水系滤膜过滤至1.5 mL 进样瓶中, 将得到的沉淀结合态BMAA 提取液置于-20 °C 冰箱中保存。
1.3.3 藻细胞中氨基酸的提取 参考《食品中氨基酸的测定(GB/T 5009.124—2016)》, 稍作修改。向含有藻泥的离心管中加入5 mL 6 mol/L HCl, 涡旋混匀,转移至10 mL 消解管中, 充入高纯氮气, 在110 °C 条件下水解22 h。水解结束后冷却至室温, 将水解液用滤纸过滤到25 mL 容量瓶中, 用超纯水多次冲洗水解管, 经滤纸过滤后合并转移至25 mL 容量瓶内, 用超纯水定容, 混匀。取2 mL 定容后的溶液至4 mL 样品瓶中, 55 °C 条件下用氮气吹干, 然后加入 1 mL 20 mmol/L 盐酸重新溶解, 经0.22 μm 水系滤膜过滤至1.5 mL 进样瓶中, 得到的氨基酸提取液置于-20 °C 冰箱中保存。
1.3.4 BMAA 毒素分析 使用Agilent 1290 高效液相色谱串联Agilent 6430 三重四极杆质谱仪系统(美国Agilent 公司), 不经衍生直接测定BMAA 的含量, 具体参数如下:
色谱柱为 TSK-Gel Amide-80®HILIC 色谱柱(250 mm × 2 mm, 5 µm), 柱温40 °C, 进样体积5 µL,流速 350 µL/min, 采用梯度洗脱, 流动相A 为含有50 mmol/L 甲酸的水溶液, 流动相B 为含有50 mmol/L甲酸的乙腈溶液。在0~15 min 内, 流动相A 由10%升高至40%, 保持4 min 后, 在19.01 min 切换为45%并保持至27 min, 在27.01 min 切换到10%并保持至30 min。
质谱联接接口为电喷雾离子源, 雾化器压力40 psi,毛细管电压4 000 V, 电喷雾电压5 500 V, 雾化气为N2, 雾化温度450 °C, 干燥气体温度350 °C, 干燥气体流速10 L/min。根据毒素的保留时间和质谱参数,采用多反应监测模式进行定性和定量分析。使用的变迁离子为119→102、119→101、119→88、119→56和119→44, 碎裂电压60 V, 碰撞能分别为8、5、8、15 和20 V。在使用的5 个变迁离子中, BMAA、DAB和AEG 分别缺少119→101、119→88 和119→88, 均具有4 个不同的变迁离子用于定性分析。在定量计算BMAA、DAB 和AEG 浓度时, 分别采用变迁离子119→88、119→101 和119→102 的峰面积进行计算。
1.3.5 藻细胞中氨基酸的分析 应用 Hitachi L-8800 氨基酸自动分析仪测定藻细胞中天冬氨酸、苏氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、赖氨酸、组氨酸、精氨酸和脯氨酸共16 种氨基酸的含量。参照《食品中氨基酸的测定(GB/T5009.124-2016)》中的要求, 色谱柱选用磺酸型阳离子树脂, 柱温50 °C, 反应器温度135 °C, 进样量20 µL, 泵1 流速0.40 mL/min, 泵2 流速0.35 mL/min, 检测波长570和440 nm, 采用外标法通过峰面积计算样品测定溶液中氨基酸的浓度。
样品中氨基酸含量Xi(%)按照下列公式计算:

式中,Ci: 标准氨基酸浓度(nmol/mL);Mi: 氨基酸分子量;Sis: 标准品的峰面积;Sti: 样品的峰面积;V:样品水解液转移定容的体积(mL);m: 样品湿重(g)。
1.4 BMAA 与氨基酸联合作用对球等鞭金藻生长状况的影响
1.4.1 球等鞭金藻的室内培养及96 h 抑制率的计算采用1.2.1 部分相同的方法配制微藻培养液, 选用250 mL 锥形瓶, 培养体系150 mL, 接种的初始密度在5×105cells/mL 左右。参考前面的研究结果, 选取BMAA 对球等鞭金藻的96 h-EC50值(2 μmol/L)为暴露浓度, 设置空白对照组、2 μmol/L 单一氨基酸组(20种氨基酸对应20 组)、2 µmol/L 20 种氨基酸组、2 μmol/L BMAA 组、2 μmol/L (BMAA+单一氨基酸)组(20 种氨基酸对应20 组)、2 µmol/L (BMAA+20 种氨基酸)组共44 组, 每组3 个平行。设置光照培养箱温度18 °C, 光照强度6 000 lx, 光暗比12 h∶12 h,每天分3 次定时摇匀藻液, 并随机更换藻液的位置。采用1.2.2 部分相同的方法, 计数藻细胞密度, 并计算比生长率和抑制率。
1.4.2 藻细胞中BMAA 的提取和分析 球等鞭金藻染毒培养96 h 后, 充分摇匀藻液, 选取空白对照组、2 µmol/L BMAA 组、2 µmol/L (BMAA+色氨酸)组、2 µmol/L (BMAA+谷氨酰胺)组、2 µmol/L(BMAA+蛋氨酸)组、2 µmol/L (BMAA+精氨酸)组、2 µmol/L (BMAA+丝氨酸)组共 7 组, 每瓶藻液取100 mL 于4 °C 条件下以8 000 r/min 转速离心10 min收集藻细胞, 离心后的上清液用于提取总溶解态BMAA。BMAA 毒素提取和分析方法分别见1.3.2 和1.3.4 部分。
1.5 数据统计分析
全部数据采用SPSS 20.0 软件进行分析, 在P<0.05 水平下通过单因素方差分析(One way ANOVA)对不同处理组的数据进行两两比较, 用不同的字母表示两组数据间具有显著性差异。
2 结果与讨论
2.1 BMAA 对球等鞭金藻生长的抑制效应
不同浓度的BMAA 与球等鞭金藻暴露接触96 h后微藻的生长曲线如图1 所示。从图中可以看出, 球等鞭金藻与不同浓度的BMAA 暴露接触24 h 后即表现出生长密度的差异, 随着培养时间的延长这种差异越来越明显。在96 h 内, BMAA 对球等鞭金藻生长的抑制效应与培养体系中BMAA 的浓度呈正相关关系。暴露接触 96 h 后, 与对照组相比, 200 μg/L BMAA·HCl 对球等鞭金藻的生长抑制率仅为5%, 表现为轻微抑制; 而当浓度增加至250 μg/L 时, 生长抑制率迅速提高至36%; 在最高暴露浓度400 μg/L 时,生长抑制率达到88%, 球等鞭金藻的生长几乎被完全抑制。需要指出的是, 在前期实验中已经验证了毒素溶剂中2 mmol/L HCl 对球等鞭金藻的生长未见影响, 因此可以确定外源BMAA 对球等鞭金藻的比生长率产生了抑制效应。
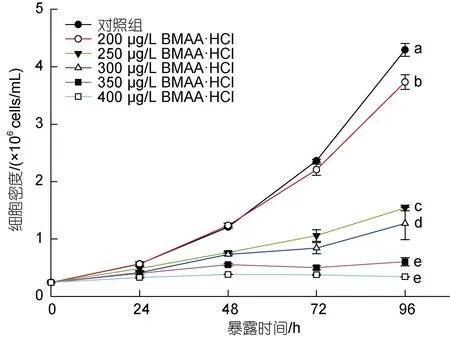
图1 不同浓度BMAA 暴露条件下球等鞭金藻的生长曲线Fig.1 Growth curves of Isochrysis galbana (3011) under different concentrations of BMAA during 96-hours exposure period
参考《化学品: 藻类生长抑制试验(GB/T 21805—2008)》中绘制受试微藻剂量-效应曲线的方法, 使用染毒96 h 后不同浓度BMAA 实验组中微藻的抑制率和对应的BMAA 毒素浓度的对数值做相关性分析,得到拟合曲线Y=2.638 6X-6.023 8,R2=0.970 1, 说明剂量-效应曲线的线性关系良好。最后计算得BMAA毒素对球等鞭金藻的 96 h-EC50值为 297 μg/L BMAA·HCl, 约为2 μmol/L BMAA。
本研究首次发现了外源BMAA 毒素对球等鞭金藻生长的抑制效应, 这种毒性效应与前期报道的蓝藻藻株的 BMAA 毒素暴露实验的结果相似。在向BG11 培养基中加入 4.2 µmol/L (约合 649 μg/L BMAA·HCl) 和 42 µmol/L ( 约 合 6 493 μg/L BMAA·HCl)的外源BMAA 后, 48 h 内BMAA 对集胞藻PCC6803 的生长具有明显的抑制作用, 染毒组藻液颜色明显浅于对照组, 表现出萎黄病的症状, 平均比生长率也始终低于对照组(高浓度染毒组的平均比生长率甚至为负数, 呈现负增长), 在192 h 内无法恢复至对照组的藻细胞密度(Downingetal, 2012)。另一项研究表明, 20 µmol/L 外源BMAA (约合3 092 μg/L BMAA·HCl)能够造成固氮念珠藻PCC7120 在48 h 内生长完全停滞, 并出现类似萎黄病的症状, 但这种抑制效应在染毒7 d 后逐渐消失, 表明蓝藻细胞内的BMAA 能够被代谢或降解(Berntzonetal, 2013)。此外,20 µmol/L 外源BMAA 在48 h 内显著抑制鱼腥藻PCC7120 的生长, 当毒素浓度增加至50 µmol/L 和100 µmol/L 时受试藻细胞生长完全停滞, 并出现了细胞裂解的现象(Popovaetal, 2018)。本研究中使用的BMAA 暴露浓度远低于这些毒性实验中使用的剂量,但在暴露浓度400 μg/L BMAA·HCl 时, 球等鞭金藻的比生长率的抑制率已高达88%, 说明球等鞭金藻对BMAA 的毒性效应相对蓝藻而言更敏感。本研究中各实验组的藻液颜色在染毒8 d 后也逐渐加深, 表明BMAA 对球等鞭金藻的抑制效应随时间延长逐渐减弱。
2.2 球等鞭金藻对外源BMAA 的吸收及其氨基酸含量分析
2.2.1 球等鞭金藻对外源BMAA 的吸收 本研究采用LC-MS/MS 方法分析了球等鞭金藻与BMAA 毒素暴露培养96 h 后藻细胞内的BMAA 及其同分异构体DAB 和AEG 的含量, 色谱图如图2 所示。从图中可以看出, 空白对照组培养的球等鞭金藻细胞内未检出BMAA 和AEG, 但含有少量的DAB 毒素, 而在与BMAA 暴露培养96 h 后的球等鞭金藻细胞内检出BMAA, 说明外源BMAA 可以进入藻细胞内抑制球等鞭金藻的有丝分裂过程。关于DAB 的检出并不意外, 已有大量研究报道蓝藻、硅藻、贝类及其他水生动物样品中检出DAB, 且未见明显的种间差异, 总体含量较低(Réveillonetal, 2014; Fanetal, 2015; Lietal, 2018; Wangetal, 2021)。该毒素不是本研究的重点, 在此不作详细讨论。
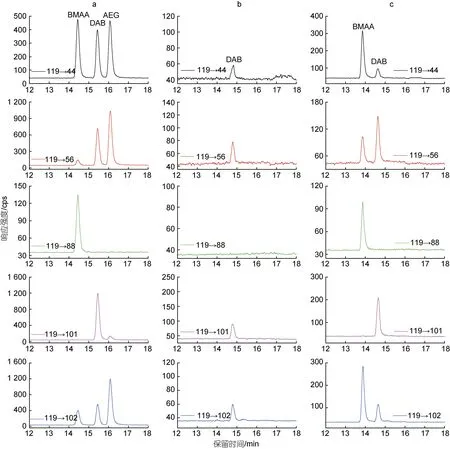
图2 LC-MS/MS 分析BMAA、DAB 和AEG 的色谱图Fig.2 LC-MS/MS chromatograms of (a) BMAA, DAB and AEG mixed standards, (b) total soluble bound extract of Isochrysis galbana(3011) from the control group, and (c) total soluble bound extract of I. galbana (3011) after 96-hours exposure to 300 µg/L BMAA·HCl
染毒96 h 后球等鞭金藻单位细胞中BMAA 和DAB 含量如图3 所示。从图中可以看出, 染毒后细胞中BMAA 主要以总溶解态形式(>99%)存在, 沉淀结合态BMAA 的含量很低; 在总溶解态BMAA 中, 约有36%~51%的BMAA 是以游离态形式存在, 并且单位细胞内游离态和总溶解态BMAA 的含量与体系中外源BMAA 的加入量呈正相关, 进一步说明细胞内的BMAA 来自于培养基中的外源毒素。球等鞭金藻细胞中DAB 的本底值为0.12 fg/cell, DAB 在球等鞭金藻细胞中主要以溶解结合态为主, 几乎不含沉淀结合态形式; 仅在浓度最高的700 µg/L BMAA·HCl实验组中检出游离态DAB。虽然所有实验组中球等鞭金藻细胞中DAB 含量普遍较低(<6 fg/cell), 但单位细胞内DAB 含量也随着BMAA 暴露浓度的增加而升高, 与体系中外源BMAA 的加入量呈正相关。目前尚无法解释这种现象, 推测可能是球等鞭金藻在吸收外源BMAA 的过程中, 转化产生了少量的DAB,也可能是由于球等鞭金藻受到BMAA 毒素的抑制胁迫后, 使得DAB 的合成量升高。
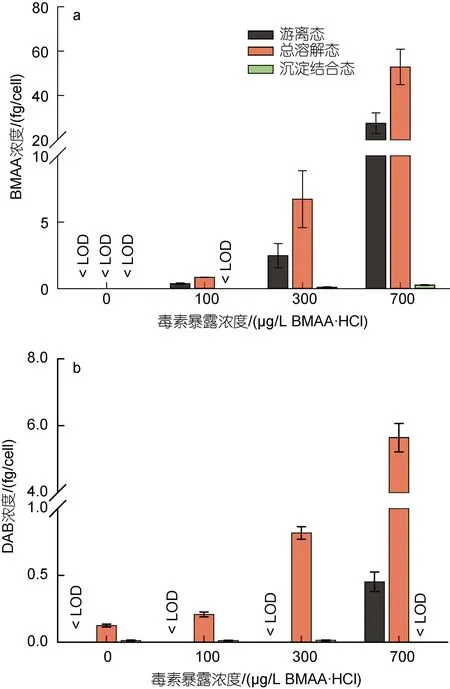
图3 BMAA 暴露接触96 h 后球等鞭金藻单位细胞中BMAA (a) 和DAB (b) 的含量Fig.3 Concentrations of BMAA (a) and DAB (b) detected in Isochrysis galbana (3011) after 96-hours exposure to BMAA
据报道, 集胞藻PCC6803 在含有0.5 和5 µmol/L的BMAA 培养基中暴露接触10 min 后, 单位细胞内游离态和沉淀结合态BMAA 含量明显上升, 且表现出明显的浓度依赖性, 但在24 h 后单位细胞中游离态和蛋白结合态BMAA 含量逐渐下降, 蛋白结合态BMAA 在72 h 时已无法检出, 表明蓝藻能够迅速吸收体系中的BMAA 并逐渐将其代谢排出或转化为其他物质(Downingetal, 2012)。念珠藻PCC7120 在1 min 内也能够迅速吸收体系中的10 µmol/L 外源14C-BMAA, 且单位细胞内14C-BMAA 在30 min 内持续增加(Berntzonetal, 2013)。海洋硅藻三角褐指藻和威氏海链藻在添加0.05 µmol/L 外源BMAA 的培养体系中, 单位细胞内游离态和蛋白结合态BMAA 的含量在96 h 内呈现先升高后降低的趋势(Lageetal,2016)。另外在细菌与外源 BMAA 的暴露实验中(100 µM BMAA), 发 现Escherichiacoli、Staphylococcusepidermis、Lactobacilluscasei、Bacillus subtilis、Pseudomonasaeruginosa和Micrococcus luteus6 种细菌均检出游离态和沉淀结合态BMAA(van Onselenetal, 2015)。但这些研究中均未检测BMAA 的其他同系物成分。
2.2.2 球等鞭金藻与BMAA 暴露接触后细胞内氨基酸含量的变化 球等鞭金藻与BMAA 暴露接触96 h 后细胞中16 种氨基酸含量与空白对照组的对比如图4 所示。需要指出的是, 本研究采用盐酸水解法提取球等鞭金藻细胞内的氨基酸, 由于色氨酸和半胱氨酸在水解过程中被破坏, 天冬酰胺和谷氨酰胺在水解过程中转化为天冬氨酸和谷氨酸, 因此本方法只能检测其他16 种氨基酸的含量。从图4 可以看出, 除缬氨酸(Val)外, 其余15 种氨基酸在球等鞭金藻细胞中均被检出, 对照组和 2 µmol/L BMAA(300 µg/L BMAA·HCl)组中含量最高的氨基酸均为丝氨酸, 分别占藻细胞氨基酸总量的74.2%和54.7%。早期人们对球等鞭金藻主要营养成分的分析结果显示, 氨基酸总量占藻细胞干重的33.74%, 必需氨基酸总量占藻细胞干重的16.26% (陈椒芬等, 1987)。鄢朝(2012)对球等鞭金藻的测定结果显示, 谷氨酸的含量最高, 占细胞干重的5.09%, 氨基酸总量占细胞干重的32.15%, 必需氨基酸总量占细胞干重的13.41%。假定离心收集后的藻细胞含水率在80%左右, 换算后本研究中对照组球等鞭金藻氨基酸总量占藻细胞干重的26.15%, 基本与上述研究结果一致。此外, 与对照组相比, 300 µg/L BMAA·HCl 未显著影响球等鞭金藻细胞内氨基酸的种类和组成比例(P>0.05), 但除组氨酸(His)外, 其余14 种氨基酸的含量均明显降低(P<0.05), 其中以酪氨酸(Tyr)、丙氨酸(Ala)和丝氨酸(Ser)最为明显, 分别降低了36%、34%和26%, 表明BMAA 在抑制球等鞭金藻细胞分裂的过程中也降低了细胞内的氨基酸合成。
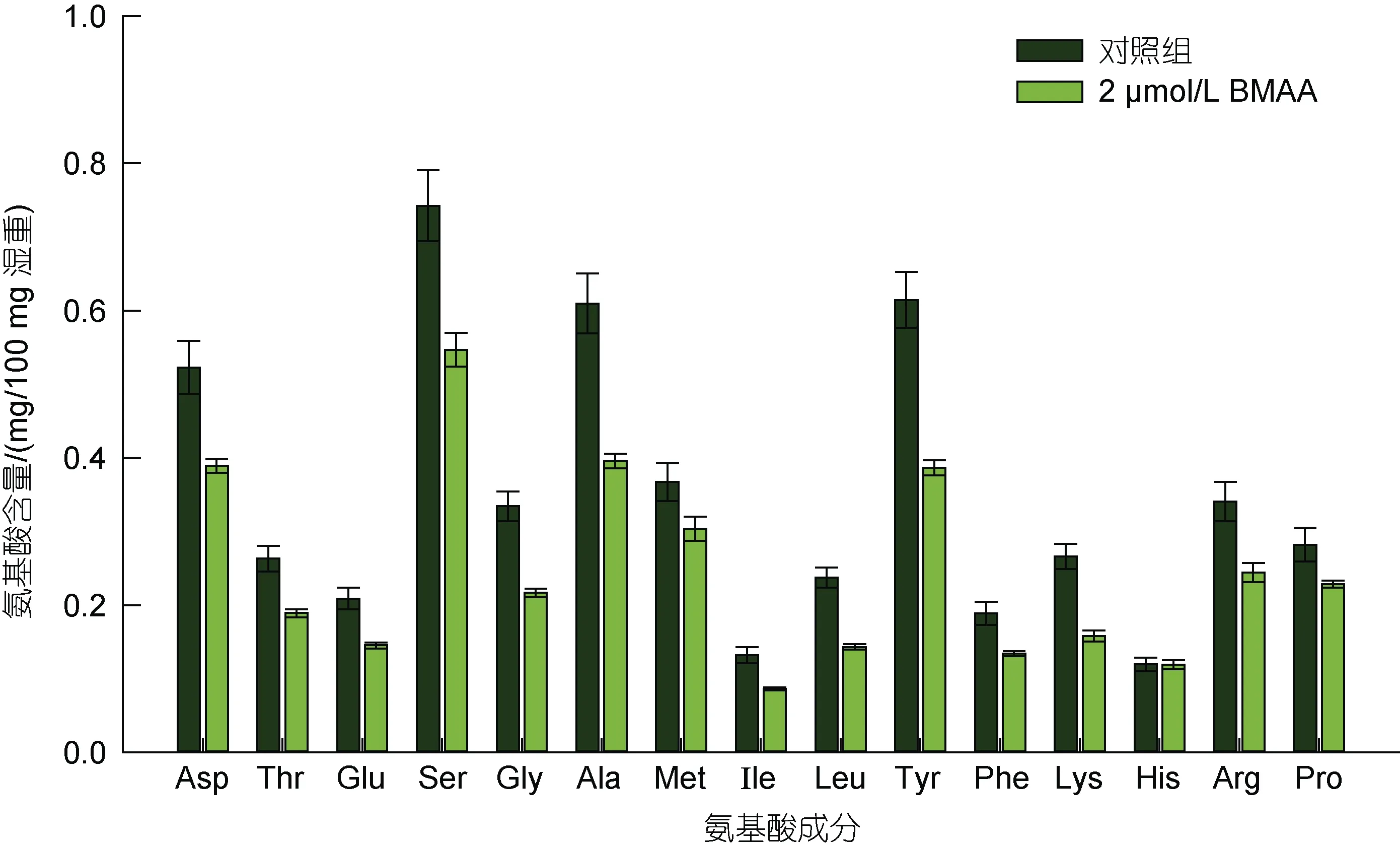
图4 BMAA 暴露接触96 h 实验组与对照组中球等鞭金藻细胞中氨基酸含量的对比(mg/100 mg 湿重)Fig.4 Comparison in the content of amino acids (mg/100 mg wet weight) in Isochrysis galbana (3011) after 96-hours exposure to BMAA and control groups
2.3 氨基酸和BMAA 联合作用对球等鞭金藻生长状况的影响
2.3.1 氨基酸可促进BMAA 对球等鞭金藻生长的抑制效应 氨基酸单独或与BMAA 联合作用于球等鞭金藻96 h 后的生长抑制率如表1 所示。从表中可以看出, 20 种氨基酸单独作用于球等鞭金藻的生长抑制率均在±3%以内, 表明外加2 µmol/L 的氨基酸对球等鞭金藻的生长没有明显的影响。除溶解性无机氮(dissolved inorganic nitrogen, DIN)外, 溶解性有机氮(dissolved organic nitrogen, DON)也是海洋微藻的重要氮源, 其中溶解性游离态氨基酸(dissolved free amino acid, DFAA)在海洋中的浓度通常低于5 µmol/L (徐宁等, 2013)。部分海洋微藻在DIN 含量不足的情况下能够通过多种方式利用环境中的DFAA, 如通过细胞膜上的氨基酸转运系统, 将与Na+形成络合物的DFAA和Na+一起转运进入细胞, 同时将K+排出细胞, 从而吸收环境中部分带有电荷的特定DFAA (Johnet al,1999)。此外, 部分微藻能够与细菌相互作用, 利用细菌产生的多肽水解酶将海洋环境中的多肽分解为DFAA, 同时释放L-氨基酸氧化酶, 将DFAA 氧化为铵盐, 从而间接利用DFAA(Mulhollandetal, 2003)。氨基酸在藻细胞生命活动中起着重要作用, 通常不会对微藻产生毒害作用, 有时微藻吸收利用环境中DFAA 的量甚至达到总氮吸收量的50%以上(徐宁等,2013)。前期研究发现, 4.2 和42 µmol/L 的外源精氨酸、天冬酰胺、谷氨酸和甘氨酸在192 h 内未对集胞藻 PCC6803 的生长产生抑制作用(Downingetal,2012); 羊角月牙藻(Selenastrumcarpricornutum)能够直接吸收利用培养体系中10 µmol/L 的游离态丝氨酸、天冬氨酸、谷氨酸、甘氨酸、丙氨酸和精氨酸作为唯一氮源进行快速生长(翟天恩等, 2017); 铜绿微囊藻(Microcystisaeruginosa)能够利用100 µmol/L 精氨酸、丙氨酸和亮氨酸作为氮源进行生长, 而谷氨酸、天冬氨酸和赖氨酸虽然不能被细胞利用, 但对藻细胞也未表现出毒害作用(Daietal, 2009)。本研究中添加的20 种外源氨基酸对球等鞭金藻的生长均没有明显的促进作用, 这可能是因为培养体系中含有较充足的DIN, 球等鞭金藻尚未启动利用DFAA 的机制。
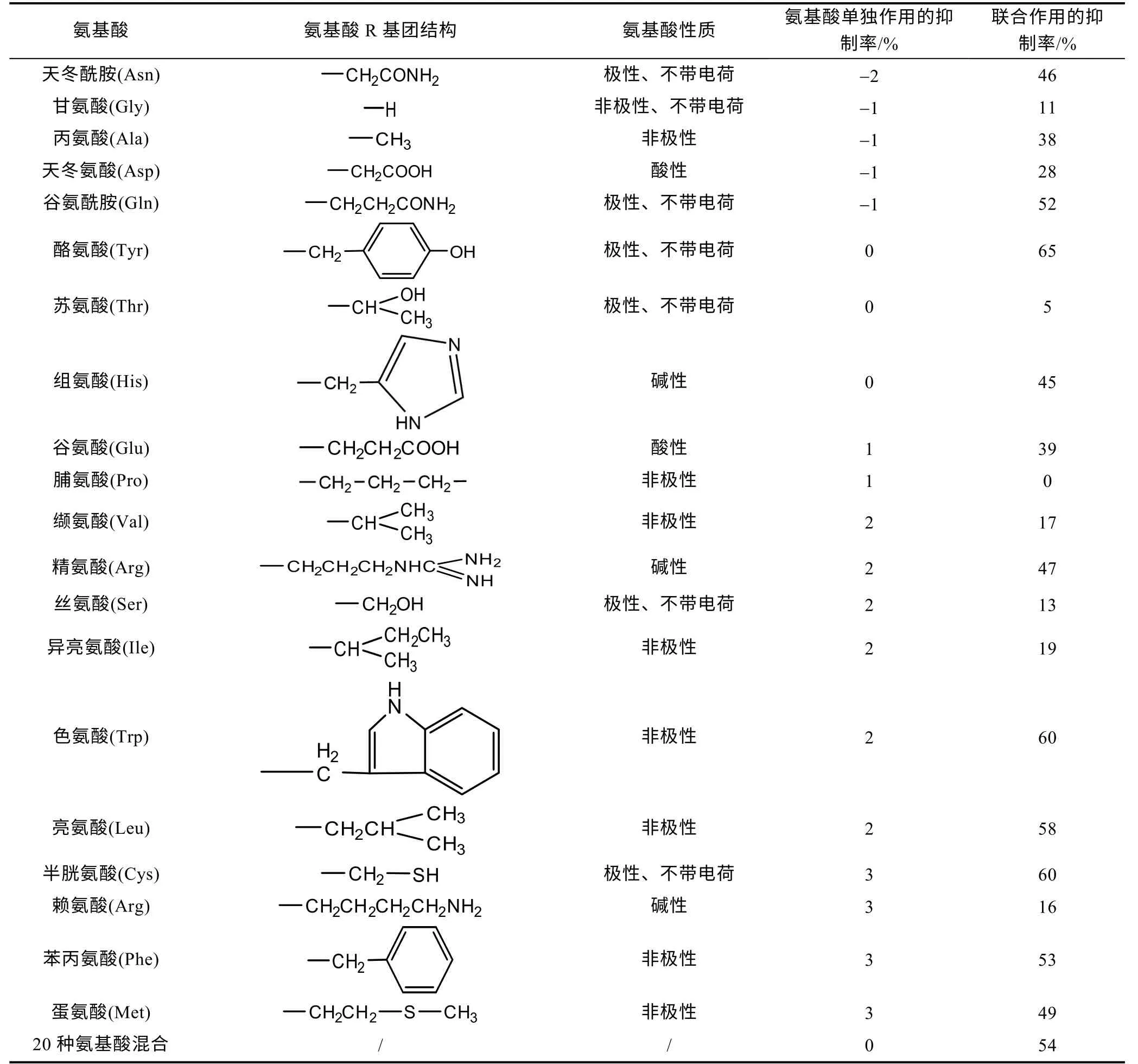
表1 氨基酸单独作用(2 µmol/L)及其与BMAA 联合作用(2 µmol/L BMAA+2 µmol/L 氨基酸) 96 h 后球等鞭金藻生长的抑制率Tab.1 The inhibition rates of Isochrysis galbana (3011) after 96-hours exposure to 2 µmol/L amino acids and mixed solution of 2µmol/L amino acids and 2 µmol/L BMAA
但本研究发现大部分氨基酸与BMAA 联合作用时对球等鞭金藻的生长产生了明显的抑制效应, 除2 µmol/L (BMAA+脯氨酸)组、2 µmol/L (BMAA+苏氨酸)组和2 µmol/L (BMAA+甘氨酸)组, 其余18 个实验组的96 h 生长抑制率均高于BMAA 单独作用组(11%), 其中 2 µmol/L (BMAA+半胱氨酸)组、2 µmol/L (BMAA+色氨酸)组和2 µmol/L (BMAA+酪氨酸)组的96 h 生长抑制率高达60%。从氨基酸R 基的结构来看, 联合毒性作用下96 h 生长抑制率超过50%的氨基酸均为非极性氨基酸和极性、不带电荷的氨基酸, 而酸性氨基酸与碱性氨基酸的96 h 生长抑制率均未超过50%, 似乎表明非极性氨基酸和极性、不带电荷的氨基酸与BMAA 联合作用时对生长的抑制作用更强。需要指出的是, 在这批联合毒性实验中2 µmol/L BMAA 组的96 h 生长抑制率并没有达到预期的50% (2.1 部分), 这可能与此次实验所用的天然海水或者藻细胞初始生长状况等因素有关。目前有关BMAA 与其他污染物对微藻联合毒性作用的研究较少。据报道, 80 µg/L 的BMAA 与20 µg/L 的微囊藻毒素(MC-LR)联合作用于一种淡水绿藻——毯藻Aegagropilalinnaei, 发现两种毒素单独作用下的抗氧化酶活性在染毒1 和7 d 后没有明显变化(P>0.05),联合作用下也只有过氧化氢酶的活性明显升高(P<0.001), 表明这两种毒素的联合作用毒性较弱(Contardo-Jaraetal, 2015)。
2.3.2 氨基酸和BMAA 联合作用下球等鞭金藻对BMAA 的吸收情况 本研究2.2 部分已表明球等鞭金藻细胞中BMAA 和DAB 主要以总溶解态的形式存在, 因此该部分实验中只分析了部分实验组染毒96 h后单位细胞中总溶解态BMAA 和DAB 的含量, 结果如图 5 所示。结果表明, 联合毒性作用较强的2 µmol/L (BMAA+色氨酸)组、2 µmol/L (BMAA+谷氨酰胺)组、2 µmol/L (BMAA+蛋氨酸)组和2 µmol/L(BMAA+精氨酸)组中单位细胞内总溶解态BMAA 和DAB 的含量均明显高于对照组和2 µmol/L BMAA 单独作用组(P<0.05), 而联合毒性作用较弱的2 µmol/L(BMAA+丝氨酸)组(96 h 生长抑制率为13%)中单位细胞内总溶解态BMAA 和DAB 的含量与2 µmol/L BMAA 单独作用组(96 h 生长抑制率为11%)相近, 表明单位细胞内总溶解态BMAA 和DAB 含量与96 h生长抑制率之间具有一定的正相关性。由此来看, 氨基酸与BMAA 联合暴露的过程中, 氨基酸促进了球等鞭金藻对外源BMAA 毒素的吸收, 从而使得联合作用实验组中球等鞭金藻的96 h 抑制率明显升高。这可能是因为当培养基中额外添加氨基酸时, 球等鞭金藻细胞上更多的氨基酸通道被打开, 使得更多的BMAA 分子通过这些氨基酸通道进入细胞内。但有关BMAA 抑制球等鞭金藻细胞分裂的机制尚不清楚, 有待深入研究。
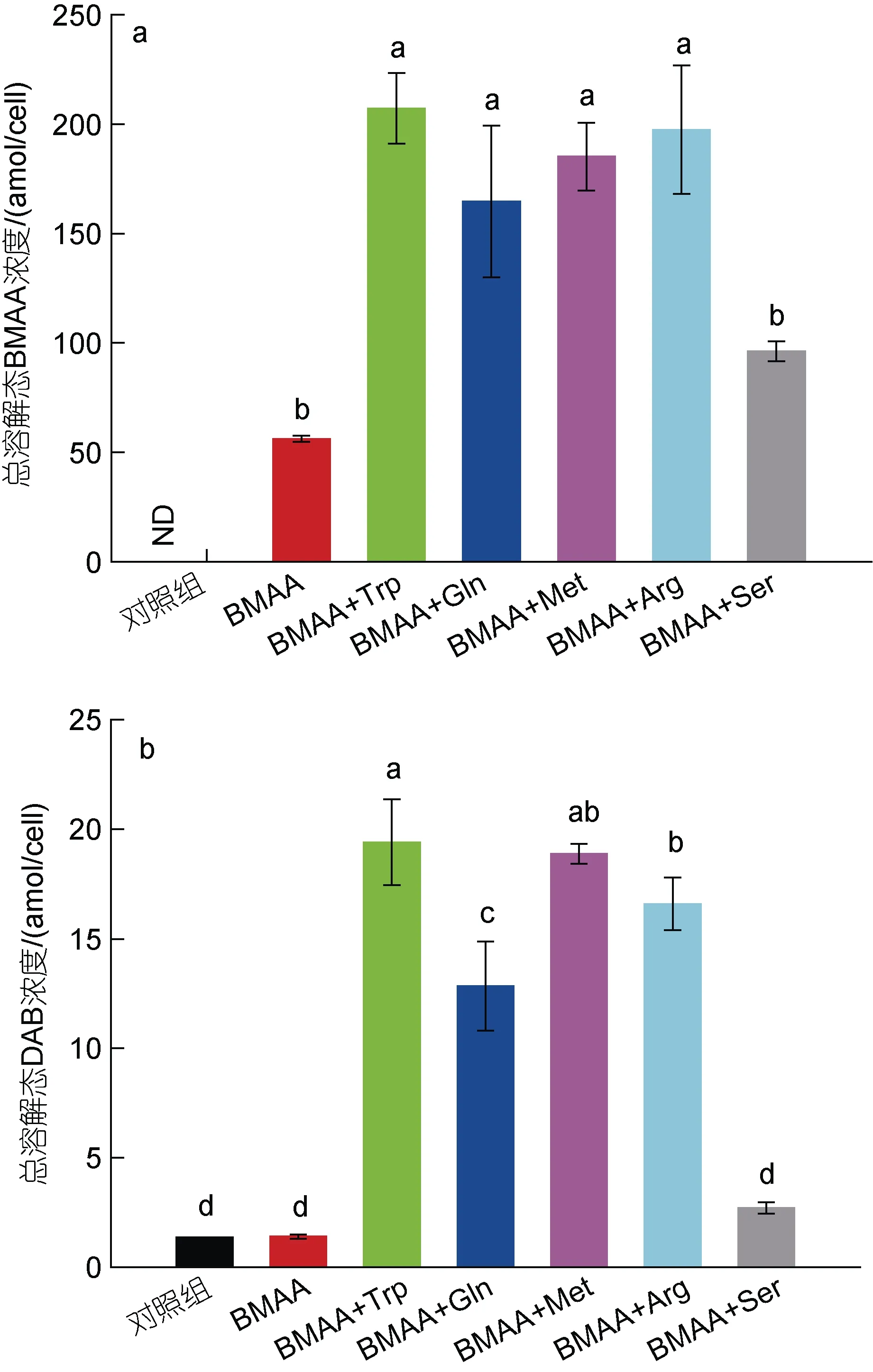
图5 染毒96 h 后球等鞭金藻单位细胞总溶解态BMAA (a)和DAB (b)的含量Fig.5 Contents of total soluble BMAA (a) and DAB (b) in Isochrysis galbana (3011) after 96-hours exposure
3 结论
本研究首次探究了神经毒素BMAA 对海洋球等鞭金藻的毒性作用, 其对球等鞭金藻比生长率的抑制效应浓度96 h-EC50约为2 µmol/L。球等鞭金藻能够吸收培养体系中的外源BMAA 毒素, 且吸收量与BMAA 的添加浓度呈正相关; 进入藻细胞内的BMAA 毒素多半以溶解结合态的形式存在, 且DAB的含量也随着 BMAA 暴露浓度的增加而升高; 在BMAA 毒素暴露实验组中, 球等鞭金藻细胞中除缬氨酸外, 所测的其他15 种氨基酸的合成量明显降低。大多数氨基酸在与BMAA 联合作用的过程中, 促进了球等鞭金藻对外源BMAA 的吸收, 增强了BMAA对球等鞭金藻生长的抑制效应。
