近海养殖水体溶解性有机质的荧光特征及环境指示意义*
2022-05-30宋秀贤池连宝王文涛俞志明
吴 峰 宋秀贤① 池连宝 王文涛 俞志明
(1. 中国科学院海洋研究所 海洋生态与环境科学重点实验室 山东青岛 266071; 2. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室 山东青岛 266237; 3. 中国科学院大学 北京 100049; 4. 中国科学院海洋大科学研究中心山东青岛 266071)
溶解性有机质(dissolved organic matter, DOM)主要包含氨基酸、富里酸、腐殖酸等, 属于结构和组分复杂的有机混合物, 其中某些组分可以产生荧光特性。DOM 中含有丰富的氮、磷等生源要素, 可通过分解或直接被生物吸收利用, 在水体物质循环过程中扮演重要角色, 在赤潮等海洋生态灾害暴发过程中具有重要的作用(吴丰昌等, 2008), 一直是国际生物地球化学领域的研究热点和难点之一(Yaoet al, 2011)。
三维荧光光谱技术(three-dimensional excitationemission matrix fluorescence spectra, EEMs)作为一种可准确识别水体中DOM 荧光峰的个数及荧光强度等信息的手段, 以其样品用量少、灵敏度高、不破坏样品结构等优势, 近年来被广泛应用于各种天然水体中DOM 的光降解(赵紫凡等, 2019)、来源识别(黄昌春等, 2010; Yaoet al, 2011; 胡素征等, 2015)与空间动态变化(Yanet al, 2012; Zhanget al, 2013; Liet al,2015)等研究中, 该技术可以较好地揭示DOM 的性质、来源与关键循环过程。
自1970 年起, 随着世界人口对水产品需求量的剧增, 水产养殖业以每年8.7%的递增高速增长, 成为农业经济的重要组成部分(Williamset al, 2010)。我国是水产养殖大国, 水产养殖产量约占世界总产量的70% (李成军, 2019), 其中海水养殖产量约占全国水产养殖产量的 62% (农业部渔业渔政管理局,2016)。近海池塘养殖作为一种人为干预的水生生态系统, 在养殖过程中受高密度、集约化养殖方式的影响, 养殖生物残留的饵料、排泄物、生物残骸等导致养殖水体DOM 含量持续增加, 继而DOM 分解产生过量的氨氮、亚硝酸盐与硫化氢等有害物质(Schmittet al, 1998; 李中虎等, 2021), 引发水体富营养化现象, 严重影响水质环境与养殖生物安全(贾瑞胜等,2021)。迄今, 关于近海池塘养殖水体中DOM 的组成及来源的研究报道较少, 相关资料是制定科学养殖策略, 从而提升养殖效率、优化养殖水体环境的重要支撑。基于上述需求, 本研究利用三维荧光光谱技术(EEMs)结合平行因子分析法(parallel factor analysis,PARAFAC), 对山东省东营市近海凡纳滨对虾池塘养殖水体DOM 的三维荧光光谱特性进行分析, 探究了DOM 的主要组分及来源属性, 为了解养殖水体DOM 的组成特征和环境指示意义提供科学依据。
1 材料与方法
1.1 研究区域
本文选择山东省东营市近海的凡纳滨对虾养殖池塘(118°55′E, 37°27′N)为研究区域, 该区域位于渤海莱州湾附近沿海地区, 区域内遍布滩涂水产养殖池塘。选择2 个具有代表性的陆基人工池塘进行实验,其中一个池塘设为养殖池, 养殖生物为凡纳滨对虾,放苗量为5.0×104尾。在养殖过程中科学投喂饵料, 前期投喂饵料和功能性饵料, 后期增投大卤虫等活体饵料, 根据天气(如降雨、降温等)、对虾摄食(根据料台上的残余残饵量判断摄食量)、蜕壳(观察养殖过程中对虾的蜕壳情况)等相关情况对投饵量进行调节,合理控制饵料的投入量。养殖过程中为了保持水体环境的稳定、避免对虾造成应激, 根据水位、水色变化等养殖水质条件对养殖池进行适当补水外, 没有与外界水体发生明显交换, 并根据情况适量加入益生菌、增氧剂等制品。另一个池塘设为对照池, 池内无养殖生物。每个养殖池面积大约为700 m2, 水深平均为1.5 m, 池底铺聚乙烯塑料薄膜防渗, 配备1 台叶轮式增氧机, 养殖用水均源于莱州湾近岸海水。
1.2 实验设计
本实验于2020 年9 月14 日至10 月17 日(该时期为对虾养殖末期)在东营市近海凡纳滨对虾养殖池和对照池多次采集表层水样, 采样时间间隔、采样位置和采样深度等尽量保持一致, 采样过程中严格按照操作规范进行, 水样采集后立即装入干净的聚乙烯塑料桶内, 对其进行避光处理, 并迅速运回实验室。本实验设计为野外现场实验, 受现场养殖环境条件等限制未设置平行处理。在实验室, 水样用经450 °C灼烧过的GF/F 膜过滤, 收集过滤一定体积水样的滤膜保存在液氮中, 用于叶绿素测定; 过滤后的水样收集至聚乙烯瓶中在-20 °C 保存, 用于硝酸盐(NO3-)、亚硝酸盐(NO-2)和磷酸盐( PO34-)营养盐测定; 同时,收集滤液于总有机碳(total organic carbon, TOC)样品瓶中在-20 °C 保存, 用于溶解有机碳(dissolved organic carbon, DOC)含量的测定; 收集未过滤水样于TOC 样品瓶中在-20 °C 保存, 用于TOC 含量的测定; 另外,收集过滤水样于 TOC 瓶中在-20 °C 保存, 用于DOM 三维荧光光谱测定分析。
1.3 参数的测定及分析
1.3.1 水质参数的分析测定 DOM 三维荧光光谱测定通过F-98 荧光分光光度计(上海棱光技术有限公司)(1 cm 石英荧光样品池)分析测定。使用氙弧灯为激发光源(150 W); 增益(PMT 电压)设为650 V; 信噪比大于 110; 响应时间自动匹配; 扫描波长范围:Ex=250~450 nm, Em=250~600 nm; 激发采样间隔为5 nm; 激发和发射带宽均为 10 nm; 扫描速度设为1 000 nm/min; 测定过程进行内过滤效应校正; 扫描光谱进行仪器自动校正; 以1 nm 间隔得到荧光光谱。利用Milli-Q 超纯水的拉曼光谱强度监控荧光仪的稳定性, 同时利用0.01 mg/L 硫酸奎宁进行荧光定标(Heet al, 2013)。使用差减法扣除样品EEMs 中拉曼散射和瑞利散射的影响(Zhanget al, 2009, 2011)。以Ex=350 nm 时超纯水的拉曼峰积分面积对样品的荧光强度进行校正, 荧光强度表示为拉曼单位(Raman Μnits, R.Μ.)(Lawaetzet al, 2009)。
营养盐(氮、磷营养盐为主)测定分析利用SKALAR营养盐自动分析仪(Skalar Ltd., Netherland)进行测定(NO3-、NO2-和PO34-分别通过铜镉柱还原法、重氮-偶氮法和抗坏血酸还原磷钼蓝法进行测定分析), 在样品测定过程中, 使用国家海洋局第二海洋研究所标准物质中心生产的标准品对数据进行校正。
叶绿素(chla)测定在避光、低温的环境条件下,通过体积分数为80%的丙酮提取叶绿素24 h, 由于萃取液受蓝光激发后产生红色荧光, 通过Trilogy 荧光计(Turner Design Ltd., USA)测定上清液酸化前、后的荧光值, 依照Parsons 等(1984)的公式计算样品中chla的浓度:
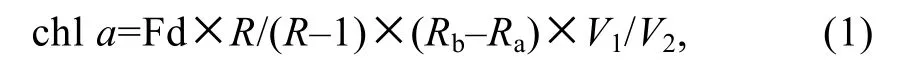
式中, chla为叶绿素a的浓度, 单位为μg/L; Fd 为测量时所用量程换算因子(随仪器而异);R为纯叶绿素a的酸化因子;Rb、Ra分别为样品酸化前、后的荧光值;V1、V2分别为丙酮提取液体积、海水样品体积。
TOC 和DOC 样品利用总有机碳分析仪(Multi N/C 2100S, Analytik jena, Germany)进行测定。
1.3.2 荧光指数(FI、BIX、HIX) 荧光指数(FI)、自生源指标(BIX)、腐殖化指数(HIX)等常被用来定量分析不同水体DOM 来源及不同来源对DOM 的贡献。荧光指数(FI)是指Ex=370 nm 时, Em 在450 nm 和500 nm 处的荧光强度比值(Jafféet al, 2004; Coryet al,2005), 常用来表征DOM 的来源信息(陆源高等植物碎屑或微生物等), 能反映芳香或非芳香组分的相对贡献。FI>1.9 时主要源于水体自身微生物活动, 自生源特征明显; FI<1.4 时, 以外源输入为主, 水体自身生产力贡献相对较低。自生源指标(BIX)是指Ex=310 nm 时,Em 在380 nm 和430 nm 处的荧光强度比值, BIX 反映DOM 自生源的相对贡献, 其范围在0.6~0.8 之间指示自生源贡献较少, 在0.8~1.0 之间指示具有较强自生源特征, 而大于1.0 时说明有机质降解程度较高, 为生物细菌活动产生, 自生源组分特征明显(Huguetet al, 2009)。腐殖化指数(HIX)是指Ex=254 nm 时, Em在435~480 nm 的荧光峰面积比300~345nm 的荧光峰面积, HIX<4 表示以自生源为主, 在4~6 之间表示较弱腐殖质特征和较强自生源特征, 当大于6 时, 表示强腐殖质特征, 陆源贡献较大(Ohno, 2002)。
1.4 数据处理及分析
在MatlabR2014b 软件中使用DOMFluor 工具箱运行PARAFAC 法模型对样品的三维荧光光谱数据进行分析(Yamashitaet al, 2008; Singhet al, 2010; 姚昕等, 2014), 初步确定荧光组分数并且通过利用残差分析和对半分析来检验结果的可靠性; 养殖池水体中DOM 的荧光特征与水质参数间相关性分析采用SPSS22.0 软件中Pearson 进行分析, 显著水平设置为0.05, 极显著水平设置为0.01; 采用Origin 2018 绘图软件进行相关数据的绘图。
2 结果
2.1 养殖水体DOM 三维荧光光谱特征
通过PARAFAC 对对照池和养殖池水体的DOM三维荧光样品(样品数分别为23 和13 个)进行分析,剔除差异较大的个别数据, 最终所得组分均通过残差分析和对半分析检验。结果显示, 对照池DOM 共得到3 种荧光组分(C1~C3), 各组分均具有一个激发峰和发射峰。组分C1、C2、C3 的最大荧光峰分别位于360 nm/436 nm (Ex/Em)、305 nm/402 nm (Ex/Em)和400 nm/487 nm( Ex/Em)处(表1)。养殖池水体DOM共得到4 种荧光组分(C1~C4), 组分C1、C2、C3 均具有一个激发峰和发射峰, 组分C4 具有一个激发峰、一个强发射峰和一个弱发射峰(300 nm/475 nm), 本文主要以强发射峰处荧光物质对C4 组分进行分析。组分C1、C2、C3、C4 的最大荧光峰分别位于340 nm/416 nm (Ex/Em)、365 nm/457 nm (Ex/Em)、415 nm/497 nm (Ex/Em)和300 nm/365 nm (Ex/Em)处(表1)。基于前人的研究结果(Coryet al, 2005; Stedmonet al,2005; Murphyet al, 2006), 对照池和养殖池中DOM组分C1、C2 与C3 分别为类腐殖酸、类富里酸与类腐殖酸, 均属于类腐殖质; 养殖池中DOM 组分C4 主要为可见区类色氨酸, 属于类蛋白质。
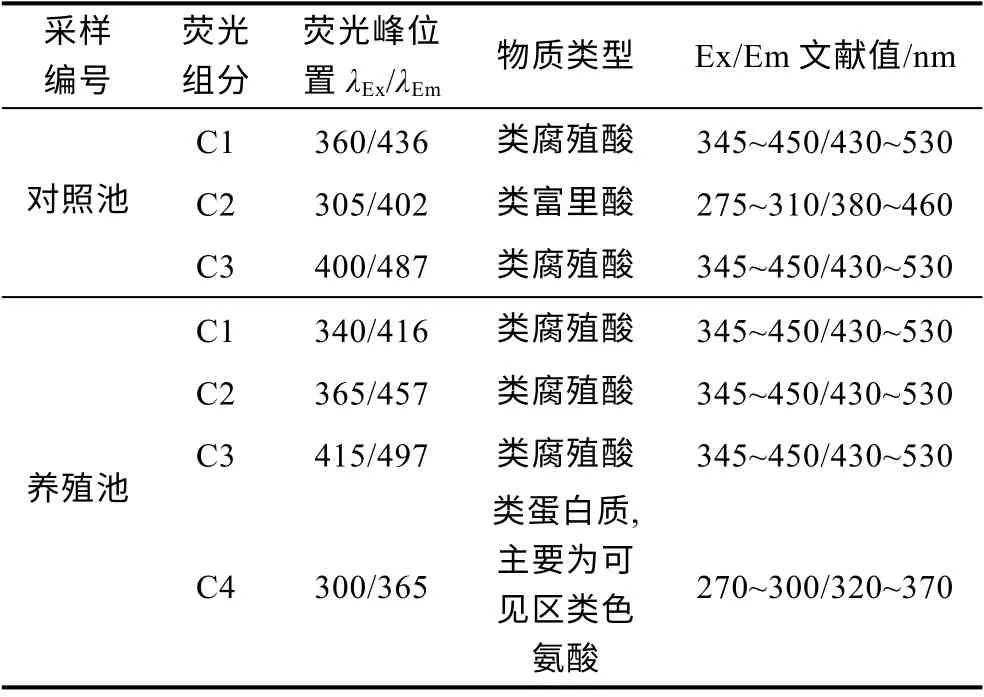
表1 DOM 的主要荧光峰及相应位置Tab.1 Main flμorescence peaks and corresponding positions of dissolved organic matter (DOM)
进一步分析了对照池和养殖池水体DOM 的荧光组分随时间的变化特征。结果显示, 对照池DOM 总荧光强度在0.15~0.25 之间, 平均值为0.21±0.02, 随时间变化整体较为稳定(图1)。DOM 的三组分C1、C2、C3 荧光强度分别为 0.11±0.06、0.07±0.03 和0.06±0.04, 在总荧光强度中的占比分别为 41.68%~48.16%、26.49%~32.83%和22.07%~28.30% (图2a)。对照池DOM 各组分荧光强度均维持在较低水平, 随时间变化呈现缓慢下降的特征。
养殖池DOM 总荧光强度在0.61~0.96 之间, 平均值为0.84±0.11, 随时间变化呈逐渐上升趋势, 各采样时间点均大于对照池(图1)。DOM 的四个组分C1、C2、C3、C4 荧光强度分别为0.27±0.08、0.26±0.07、0.14±0.03 和0.13±0.03, 在总荧光强度中的占比分别为28.97%~35.55%、31.59%~35.08%、15.31%~21.71%和13.82%~18.52% (图2b)。养殖池水体DOM 组分C1、C2 含量明显高于组分C3、C4。组分C1、C2、C4 荧光强度随养殖时间变化呈现波动上升的特征,组分C3 基本保持稳定, 组分C4 荧光强度在后期(10月6 日至17 日间)大于组分C3。
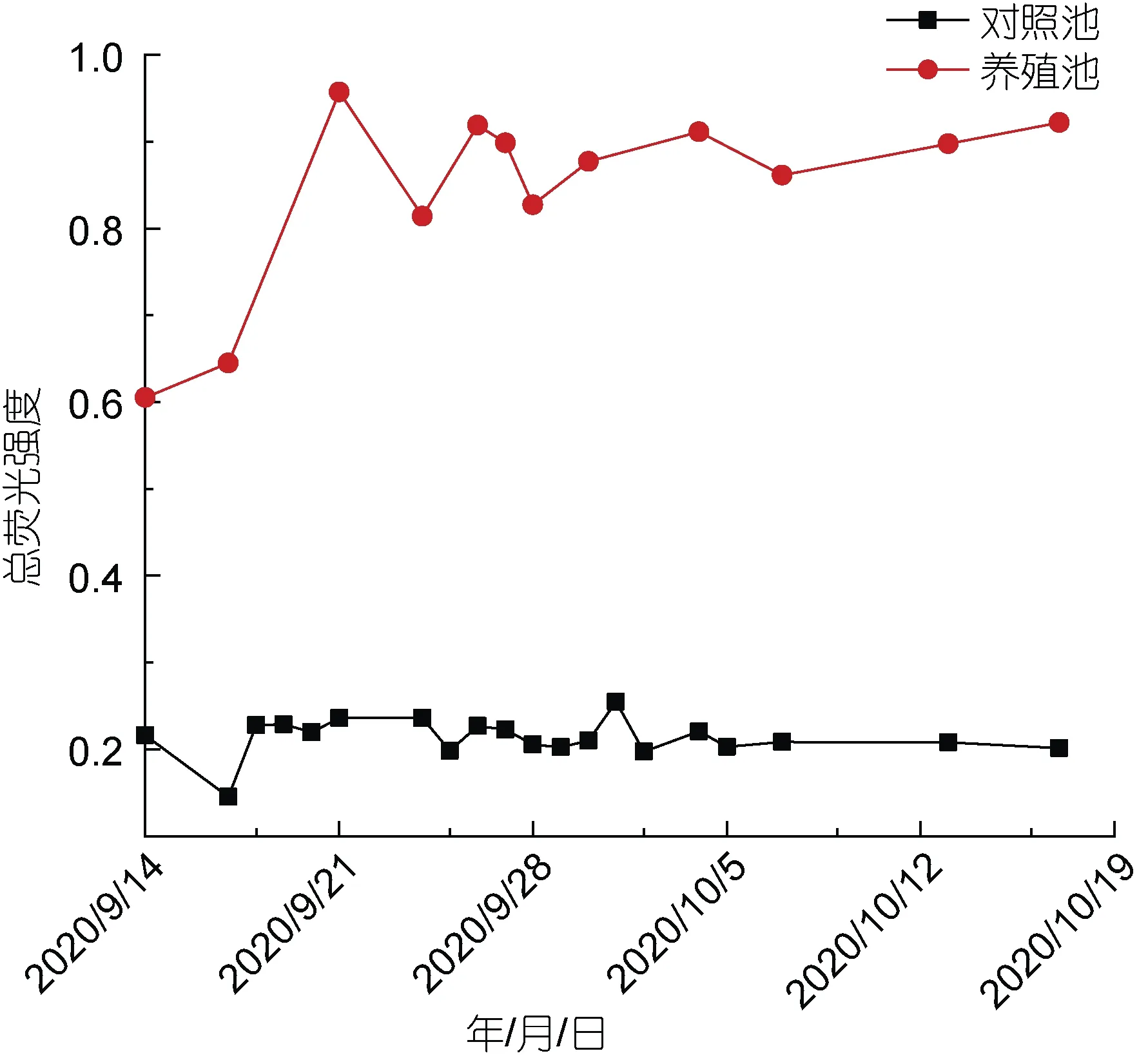
图1 对照池和养殖池DOM 各组分总荧光强度随时间变化情况Fig.1 Variation in total fluorescence intensity of DOM components with time in control pond and aquaculture pond
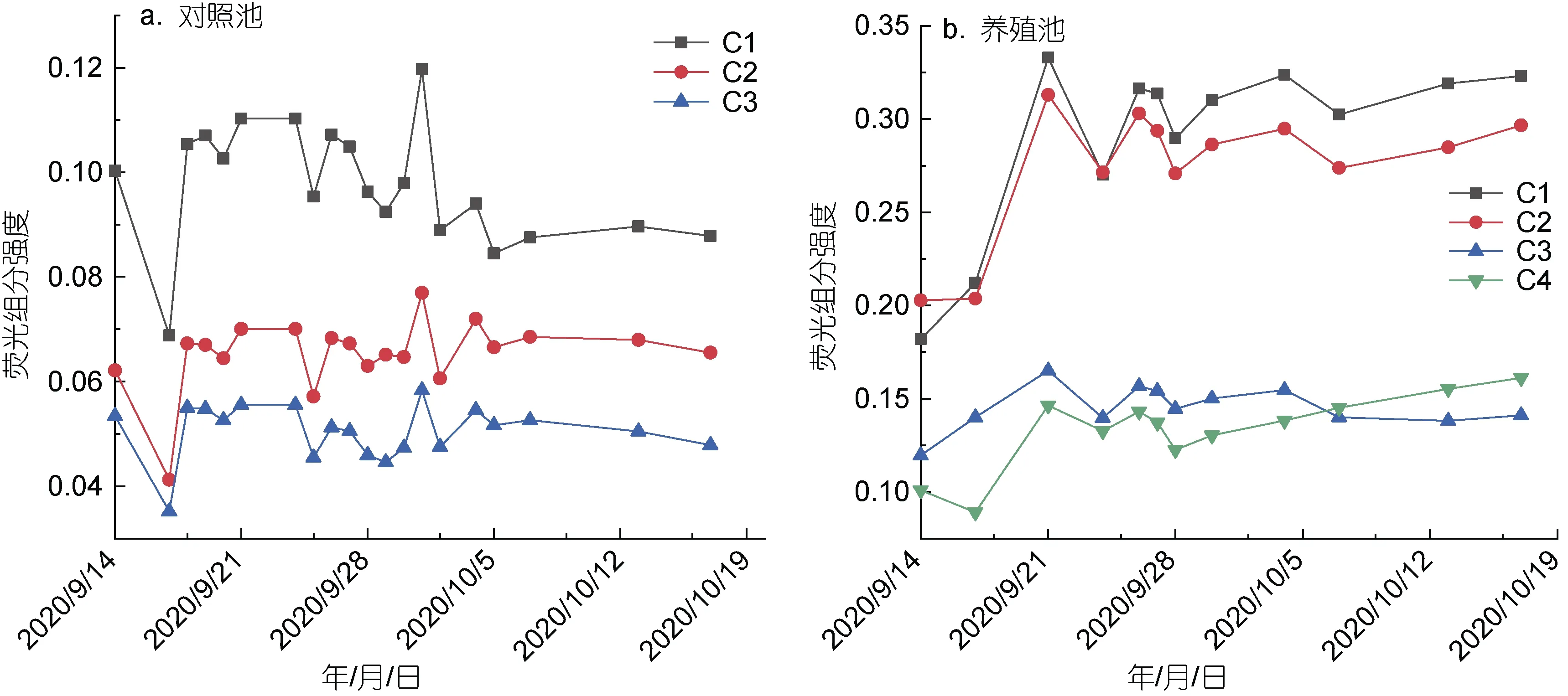
图2 对照池(a)和养殖池(b)DOM 各组分荧光强度随时间变化情况Fig.2 Variations of DOM fluorescence components with time in control pond (a) and aquaculture pond (b)
2.2 养殖水体主要水质参数的变化特征
本研究对养殖池和对照池水体主要水质参数进行了分析测定, 包括 TOC、DOC、营养盐(主要为NO3-、NO-2、 PO34-)和chla。
2.2.1 TOC 和DOC 对照池水体TOC 和DOC浓度变化范围分别为11.27~15.04 和9.23~11.87 mg/L,平均值分别为13.58 和10.36 mg/L, 二者随时间变化呈现波动变化趋势, 且均维持在较低水平(图3a, 3b)。养殖池水体 TOC 和 DOC 浓度变化范围分别为27.60~46.82 和 13.67~20.32 mg/L, 平均值分别为34.01 和17.75 mg/L, 二者随时间变化呈总体呈波动上升趋势, 各采样时间点均大于对照池(图3a, 3b)。
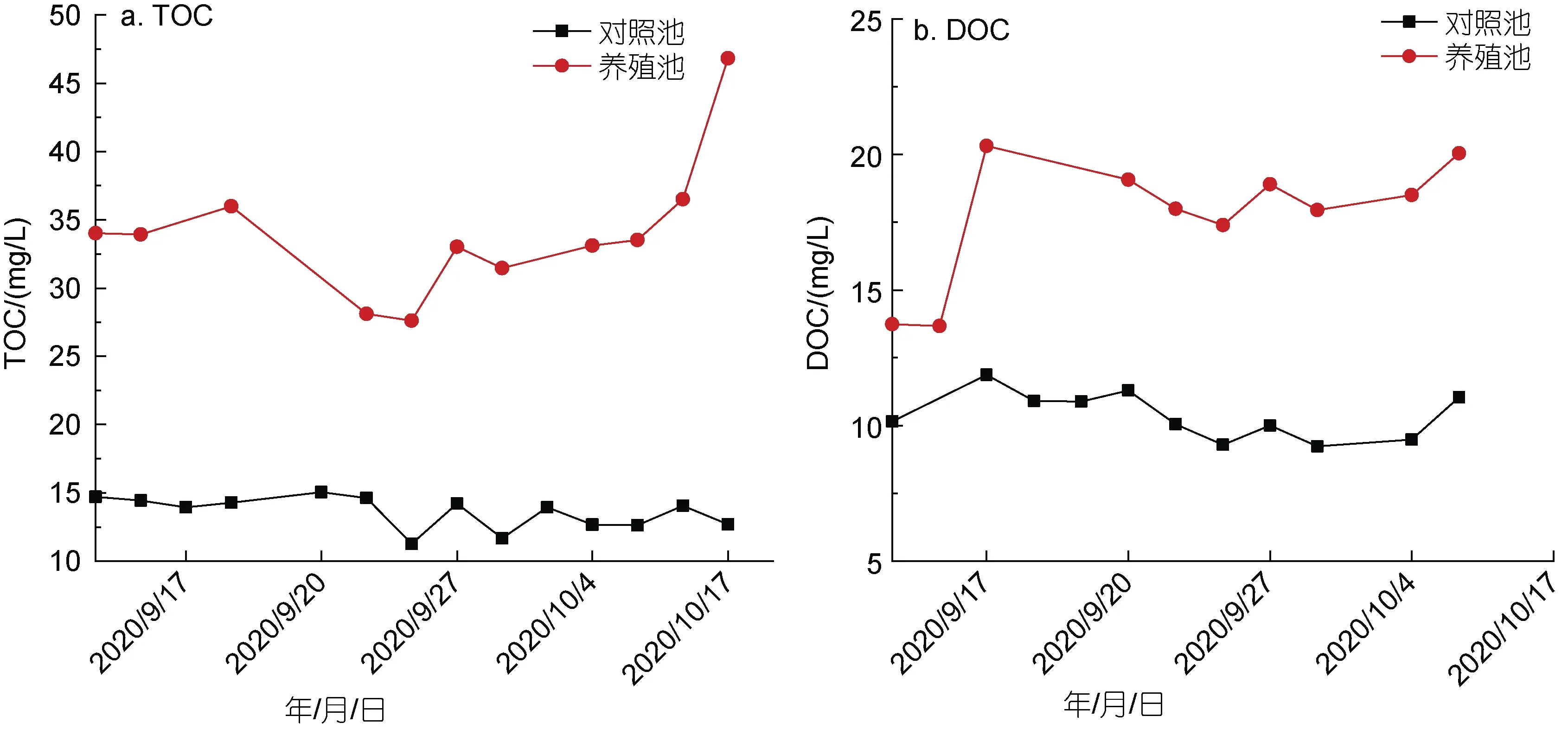
图3 对照池和养殖池TOC(a)和DOC(b)浓度随时间变化情况Fig.3 Variations of TOC (a) and DOC (b) concentrations with time in control pond and aquaculture pond
2.2.2 营养盐和叶绿素 对照池NO3-、NO-2和PO34-浓度变化范围分别是0.09~0.92、0.10~0.35 和0.34~0.70 μmol/L, 平均值分别为 0.30、0.17 和0.50 μmol/L, 各营养盐浓度随时间变化整体较为稳定且保持在较低水平(图4)。
养殖池NO3-和NO-2浓度变化范围分别是1.05~6.95 和0.13~8.29 μmol/L, 平均值分别为3.30 和3.77 μmol/L, 随时间变化呈现波动上升趋势, 二者于各采样时间点均明显高于对照池。养殖池 PO34-浓度变化范围是0.74~5.62 μmol/L, 平均值为2.65 μmol/L,随时间变化总体呈现先升高后逐渐降低的特征, 各采样时间点均明显高于对照池(图4)。
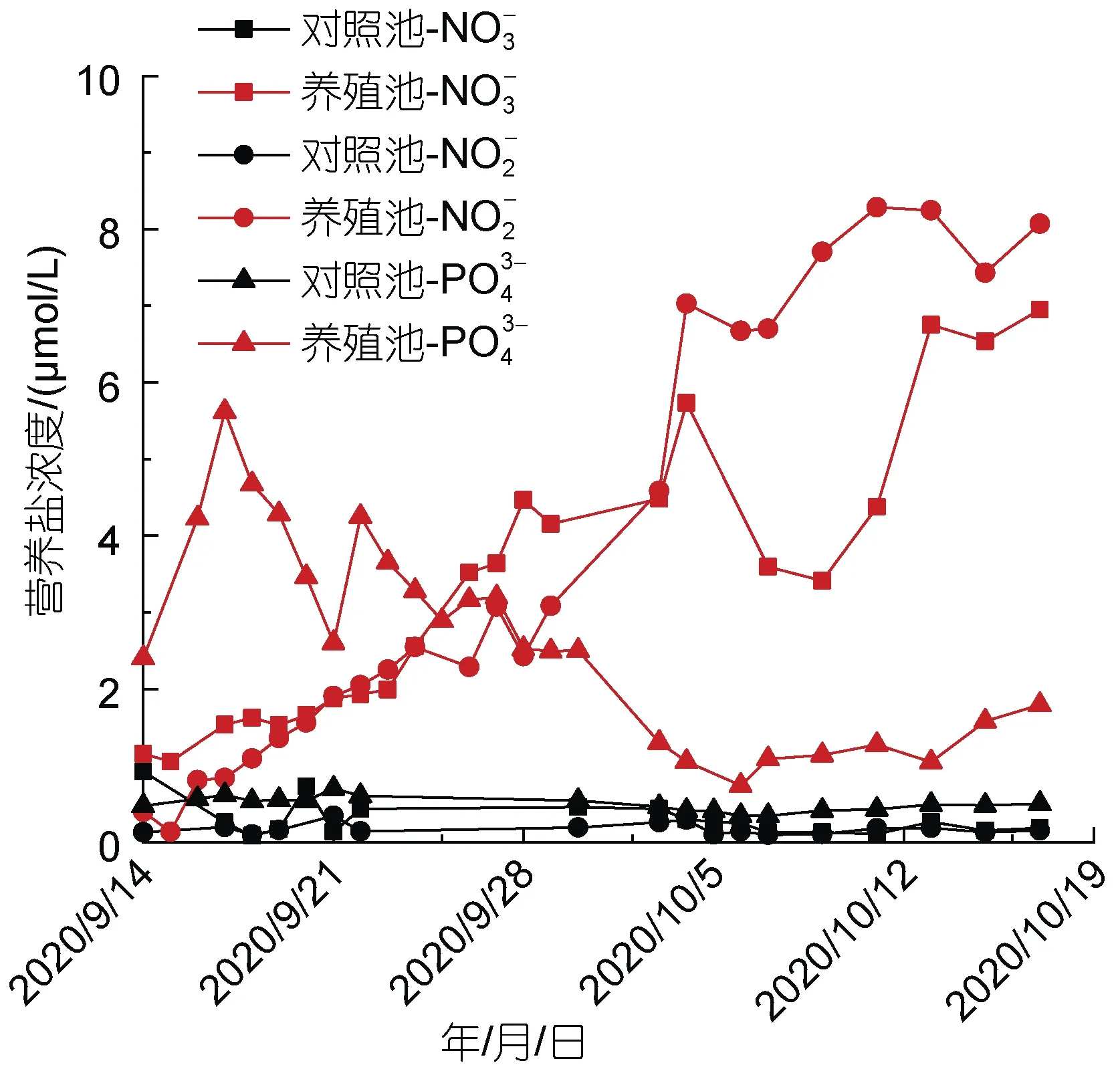
图4 对照池和养殖池营养盐浓度随时间变化情况Fig.4 Variation of nutrient concentration with time in control pond and aquaculture pond
对照池水体 chla浓度变化范围是 10.83~49.39 μg/L, 平均值为29.21 μg/L, 在调查期间维持在较低水平。养殖池水体 chla浓度变化范围是62.86~576.73 μg/L, 平均值为275.13 μg/L, 随时间变化整体呈现逐渐上升的变化特征, 各采样点均显著高于对照池(图5)。
3 讨论
3.1 DOM 荧光组分特征分析
DOM荧光峰位置是表征有机质组分的重要指标,荧光峰值出现的位置不同表征有机质的组分构成不同(Wuet al, 2001)。通过平行因子分析可以确定有机质的荧光峰位置, 从而将有机质组分主要分为类蛋白质和类腐殖质两大类(刘笑菡等, 2012)。通过分析测定以及与以往的研究结果比较发现, 本文的养殖池水体DOM 荧光组分为类腐殖酸(C1、C2 与C3)和类蛋白质(C4); 对照池水体DOM 荧光组分为类腐殖酸(C1、C2 与C3)。类腐殖酸主要是外源输入的腐殖酸和富里酸, 与类富里酸和腐殖质结构中的羟基及羧基有关(Wuet al, 2003), 也有研究指出类腐殖酸(C1、C2 与C3)可能来源于原位细菌降解过程中细菌呼吸作用的副产物或人类活动产生的类腐殖质物质(Nieto-Cidet al, 2006), 具有易光降解、生物可利用性差的特点(Stedmonet al, 2005; 傅平青等, 2005)。此外,有研究报道浮游藻类原位降解产生的DOM 中包含大约25%的类腐殖酸(Krameret al, 2004)。相较于对照池, 类蛋白质(C4)是养殖池水体DOM 特有组分, 与藻类生长和腐烂的本地生产以及近岸水体来源和养殖生态系统的输入有关, 蛋白质组分可以从浮游藻类的生长和降解中产生(Yanget al, 2013; Wanget al,2020)。对虾养殖过程中, 饵料的投入可以提高浮游藻类的营养浓度、大小和生物量(Wanget al, 2020), 导致chla浓度较高(图5), 进而原位增加了类蛋白质(C4)的含量。同样, Yamashita 等(2008)发现伊势湾含有较高chla浓度, 类蛋白质成分得到了原位增加。
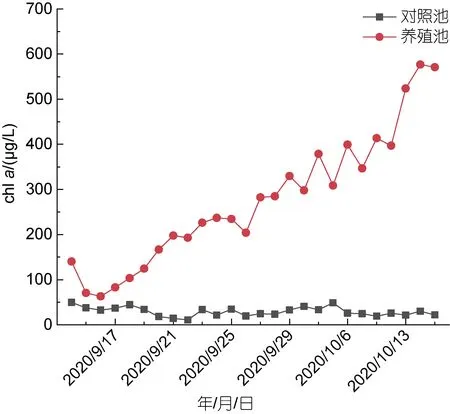
图5 对照池和养殖池叶绿素(chl a)浓度随时间变化情况Fig.5 Variation of chl a concentration with time in control pond and aquaculture pond
养殖池水体DOM 总荧光强度显著高于对照池,约为后者的 3~5 倍, 随养殖时间变化呈上升趋势,且各采样时间点均明显高于对照池(图1), 表明养殖池水体DOM 中荧光类有机物质含量较高, 主要是由残余饵料积累、生物活动频繁等导致养殖水体中有机质分解所致。同时, 养殖池水体TOC 和DOC浓度均明显高于对照池, 且随养殖时间变化呈波动上升趋势(图 3), 表明养殖池水体有机质含量较高,主要包括生物饵料、对虾等生物排泄、动植物残体等, 将对周边环境的富营养化带来潜在威胁。对照池有机质含量较低, 其主要原因可能包括单一、有限的外源海水补给, 以及微生物不断消耗分解有机质。对照池和养殖池水体DOM 以类腐殖酸为主, 其中对照池组分C1 占总荧光强度的41.68%~48.16%,养殖池组分C1 和C2 共占总荧光强度60%以上, 因为类腐殖酸主要来自水体微生物对虾类残骸、浮游藻类等有机质的分解, 且分解时间越长, 腐殖化程度越高, 导致类腐殖酸等难降解物质累积增多(朱爱菊等, 2019)。养殖池各组分随时间变化均逐渐升高(C3 除外)且都高于对照池各组分(图2), 同时发现养殖池DOM 组分C4 含量虽然最低, 但都高于对照池DOM 各个组分, 因为采样时期对照池水体DOM 主要来自莱州湾海水有限补给, 并无其他来源; 而养殖池正值对虾生长旺盛时期, 水体中产生更多的有机质(图3)。此外该时期养殖水体微生物活性处于较高水平(数据未发表), 促进了水体中大量有机质和残饵的分解, 易降解成分优先被分解利用, 而难降解成分逐渐积累增多, 水体中类腐殖酸浓度显著增加, 该研究结果与郭卫东等(2010)的认识基本一致。另外, 研究发现, 在养殖后期(10 月6 日至17 日间)养殖池水体DOM 组分C3 呈缓慢降低趋势, 而组分C4 则不断升高且大于组分C3 (图2b), 推测该结果可能是由于养殖池水体DOM 组分C3 向C4 转化所致, 该结论还需进一步实验验证。
3.2 DOM 的来源分析
养殖过程中水体DOM 来源途径主要可分为内源和外源输入。内源输入与生物活动关系密切, 这部分有机质主要来源于养殖水体中藻类、养殖生物、微生物等生物活动(Zhanget al, 2011), 而外源有机质主要来源于陆地土壤输入、陆源动植物残体输入以及人为输入等(吕伟伟等, 2018), 这两种来源对养殖水体DOM 的贡献不同。
本研究结果显示, 对照池FI、BIX 和HIX 变化范围分别是1.53~1.68、1.71~2.18 和1.48~2.81; 养殖池FI、BIX 和HIX 变化范围分别是1.66~1.73、1.69~4.29和2.07~2.22, 养殖池各指数值整体上均高于对照池(图6)。养殖池和对照池水体DOM 的FI 值均处于1.4和1.9 之间, 在中间值1.65 附近, 这表明水体有机质来源于内源及外源两部分; BIX 指数均大于1.0, 说明各采样点有机质降解程度较高, 主要为生物细菌活动产生, 自生源特征明显; HIX 指数均小于4, 说明水体有机质整体处于弱腐殖质特征, 且以自生源为主(图6)。结合三种荧光指数及养殖现场实际情况, 对照池水体DOM 主要来源于有限补给的外源海水和自身水体的有机质, 而养殖池水体DOM 则主要来自内源浮游藻类、过剩饵料、动植物残体等有机质。
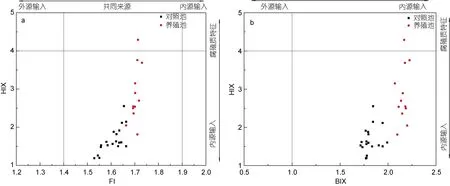
图6 对照池和养殖池DOM 荧光组分的FI-HIX、BIX-HIX 分布Fig.6 FI-HIX and BIX-HIX distribution of DOM fluorescent components in control pond and aquaculture pond
综上所述, 3 种荧光指数(FI、BIX、HIX)对表征不同养殖水体有机质来源具有良好的指示作用, 养殖池浮游微藻、饵料及动植物残体等有机质的降解作用导致的内源输入较对照池有限水源补给的外源输入作用对养殖水体DOM 具有更大的贡献。
关于水体中DOM 荧光组分之间的相关关系也有较多的文献报道, 江俊武等(2017)对太湖水体DOM荧光组分之间的相关性研究发现, 各荧光组分之间存在极显著的相关性, 说明它们在来源上具有相似性。朱爱菊等(2019)在研究亚热带河口陆基养虾塘水体DOM 三维荧光特征变化时发现不同DOM 荧光组分之间存在极显著相关性, 表明其来源具有相似性。本文中养殖池水体DOM 除组分C3 与C4 之间无明显相关性外, 其他各组分之间均呈极显著正相关(P<0.01)(表2), 表明养殖池中类腐殖酸之间或类腐殖酸与类蛋白质之间可能具有相同的来源, 养殖池水体的高密度生物量(浮游藻类、养殖对虾等)是养殖水体DOM 来源的主要贡献者。
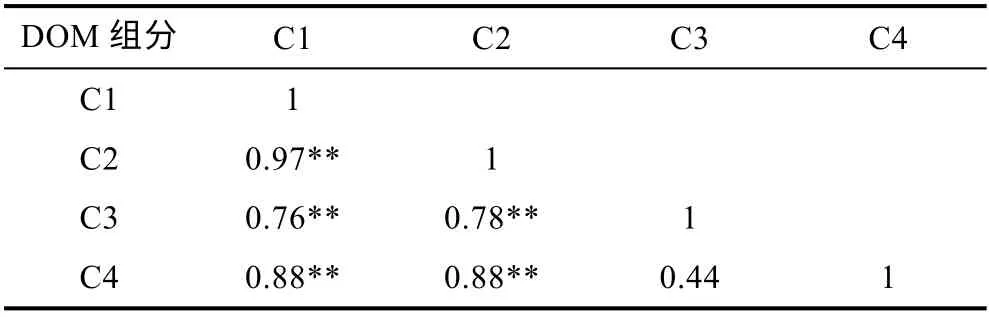
表2 养殖池水体DOM 荧光组分的相关分析Tab.2 Correlation analysis between DOM fluorescence components in aquaculture pond
3.3 DOM 荧光组分与主要水质参数之间的关系
DOM 可通过光降解或微生物降解过程释放出氮、磷等生源要素(McCallisteret al, 2006; Mayeret al,2009; 吕伟伟等, 2018)。宋晓娜等(2010)的研究表明,类腐殖酸和类蛋白质与TN、TP 及NO3-等呈显著正相关关系。江俊武等(2017)研究也发现, DOM 与氮、磷营养盐具有良好的相关性, 与氮、磷等元素迁移转化密切相关。众多的研究表明DOM 荧光强度对营养盐具有较好的指示意义, 可以作为表征营养盐浓度高低的指标(吕伟伟等, 2018)。本研究中, 养殖池NO3-和NO-2含量均明显高于对照池, 且随养殖时间呈现浓度总体升高, 因为养殖过程水体产生了大量有机质,包括过剩饵料、生物排泄物等, 在采样时期内水体微生物活性较高, 分解有机质产生大量营养盐并随时间逐渐积累增多。相关性分析发现, 养殖池水体DOM 荧光组分C1 和C4 与NO3-和NO-2含量具有显著相关关系(P<0.05), 组分C4 与含量具有极显著相关关系(P<0.01), 对照池DOM 各荧光组分均与NO-2、NO3-、含量具有极显著正相关关系(P<0.01)(表3), 表明DOM 组分的产生与利用伴随着营养盐的生成与消耗, DOM 组分与氮、磷元素的迁移转化行为密切相关。
还有研究者发现荧光组分与DOC 含量之间具有一定相关性, 并试图通过荧光组分来反演DOC 的含量(Spenceret al, 2012; 姜广甲等, 2015; 邵田田等,2018)。分析本研究中的有关数据发现, 养殖池水体中DOM 荧光组分与DOC 的相关性不显著(表3), 推测可能是因为在生物降解、光化学降解等作用下, DOM中的蛋白类物质、腐殖酸、富里酸以及一些非荧光物质在DOC 中所占比例不同(Moranet al, 1997), 导致DOM 荧光组分与DOC 的相关性存在一定差异, 这与江俊武等(2017)的研究结果基本一致。另外, 前人研究表明DOM 荧光组分与chla含量之间也会呈现出良好的相关关系, 表明浮游藻类是DOM 组分来源的重要贡献者(姚昕等, 2014; 王书航等, 2016; 江俊武等, 2017; 吕伟伟等, 2018)。本研究中养殖池水体chla含量不断升高, 原因主要有两方面, 一方面因为水体产生大量有机质, 其中部分有机质可被浮游藻类直接吸收利用, 进而产生更多的生物量; 另一方面因为大量有机质在被微生物分解利用后, 产生更多的营养盐, 进而被浮游藻类吸收利用, 支持了更多的生物量, 导致水体叶绿素含量不断升高。研究发现, 养殖池水体DOM 荧光组分C1 和C4 与chla含量均呈显著正相关(P<0.05)(表3), 说明浮游藻类是养殖池水体DOM 类蛋白质(C4)和类腐殖酸(C1)的重要来源。同时, 荧光组分C2 和C3 与chla含量之间的相关性不显著(表3), 也表明了类蛋白质和类腐殖酸与chla含量的关系存在一定差异。综上所述, DOM 组分与氮、磷营养盐等具有良好的相关关系, 表明DOM 的产生与利用与营养盐的消耗和生成过程相耦合, 揭示了DOM 与氮、磷等营养元素的迁移转化行为密切相关。养殖池水体DOM 组分与chla相关性分析表明浮游藻类是养殖水体DOM 类蛋白质(C4)和类腐殖酸(C1)的重要来源。
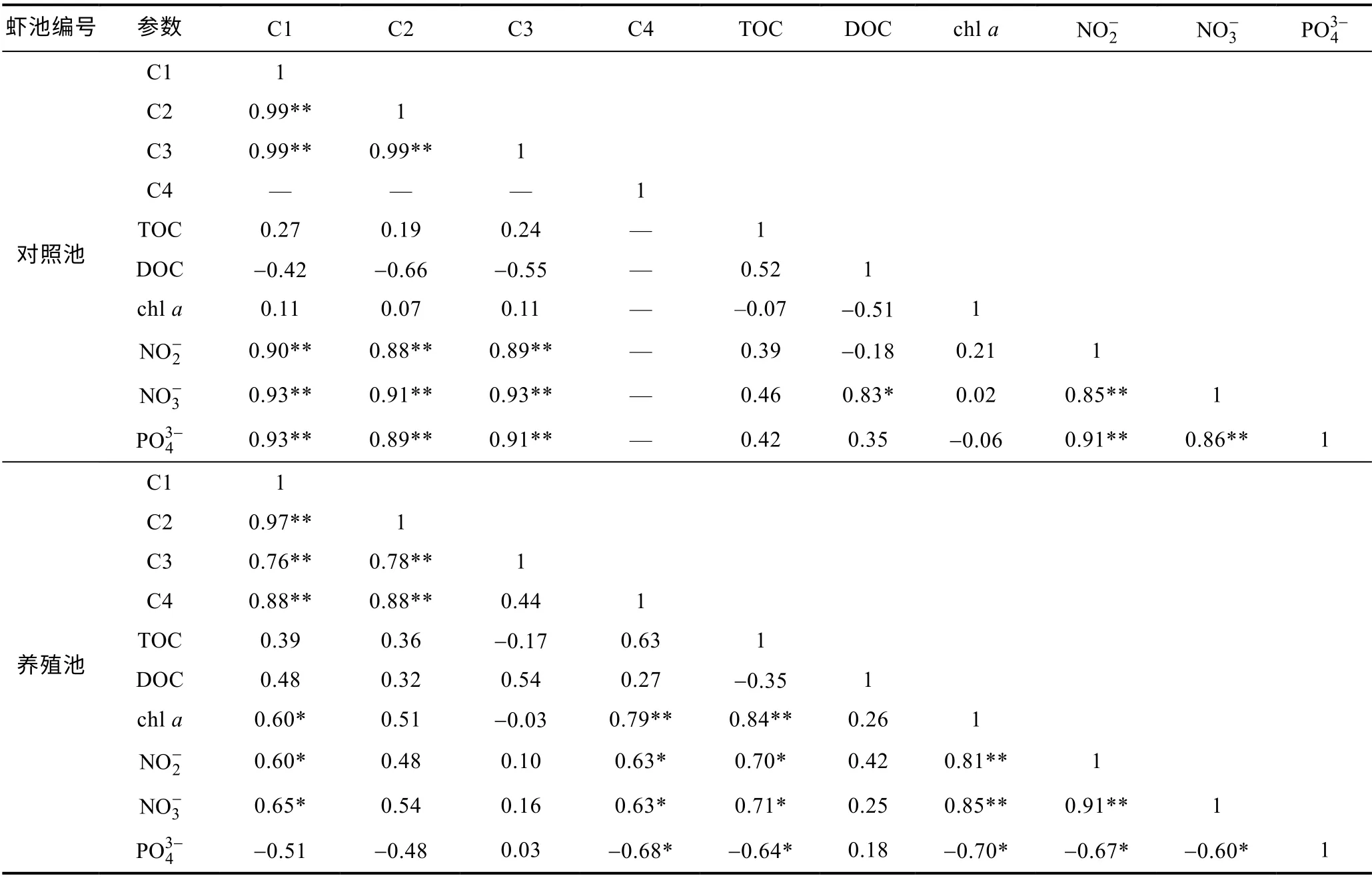
表3 不同水体DOM 荧光组分与各水质参数间的相关分析Tab.3 Correlation analysis between DOM fluorescence components and water quality parameters in different ponds
4 结论
(1) 本研究的养殖池水体DOM 组分主要包括1种类蛋白质物质(C4)和3 种类腐殖酸物质(C1、C2 与C3)。相较对照池而言, 养殖池DOM 组分C4 作为其特有荧光组分, 且荧光强度高于对照池各组, 表明养殖水体有机质高度积累, 对周边环境的富营养化带来潜在威胁。类腐殖酸为对照池和养殖池水体DOM的主要成分, 推测可能受采样时期水体中微生物较强的有机质分解作用。
(2) 3 种荧光指数对表征水体有机质来源及其贡献具有良好的指示作用。对照池和养殖池水体DOM来源于外源和内源, 主要以内源输入为主。养殖池水体DOM 内源特性相对较强, 高密度生物量(浮游藻类、对虾等)是养殖池水体DOM 来源的主要贡献者。
(3) 养殖水体DOM 与营养盐(氮、磷营养盐为主)之间具有不同程度的显著相关性, 表明DOM 组分的产生与利用与营养盐的消耗与生成过程相耦合,DOM 与氮、磷元素的迁移转化行为密切相关。浮游藻类是本研究养殖池水体DOM 类蛋白质(C4)和类腐殖酸(C1)的重要来源。
