羊奶粉对小鼠免疫调节功能作用的研究
2022-05-30石韶琦逄金柱赖必辉
石韶琦,逄金柱,赖必辉
(1.中国农业大学营养与健康系,北京 100191;2.内蒙古蒙牛乳业(集团)股份有限公司,呼和浩特 011500)
机体免疫力指机体抵抗外来侵袭、维护体内环境稳定性的能力,是机体识别和排除“异己”的生理反应[1]。环境影响和营养不良导致免疫稳态丧失,过去通过服用营养药物重建免疫平衡,如今,营养食品代表了一种保护、平衡或增强哺乳动物免疫系统的创新方法[2],各种乳制品成为深入研究的对象[3]。
羊奶营养丰富[4],具有提高消化率、促进生长发育、低致敏[5]、抗炎[6]、易消化吸收[7]、增强免疫力[8]等功能。研究表明,在HIV阳性患者摄入羊奶3个月后,CD4+细胞数量增加,免疫系统得到加强[9]。Jirillo等发现羊奶能够通过单核细胞和PMN释放NO激活先天免疫,并通过诱发IL-10、TNF-α等细胞因子的产生激活先天免疫和适应性免疫[10]。然而,羊奶粉等乳制品是否仍具有调节免疫功能尚缺乏充足的证据。
本研究利用健康小鼠模型,通过研究羊奶粉对小鼠细胞免疫、体液免疫和NK细胞活性等方面的影响,评价羊奶粉的免疫调节功能,为羊奶粉的开发与应用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 样品
羊奶粉,由内蒙古欧世蒙牛乳制品有限责任公司提供,主要成分为全脂羊奶粉、脱盐乳清粉、浓缩乳清蛋白粉等。
1.1.2 试验动物
Balb/C小鼠,雄性,体重18~22g,购自北京维通利华实验动物技术有限公司。饲养条件为12h光照交替,洁净度SPF级,湿度维持在45%~50%,温度保持在20±2℃。小鼠可自主摄食及饮水,活动自由。
1.2 试验设备
酶标仪(Biotek, ELX808);超净工作台(新加坡ESCO公司);CP21GⅡ高速冷冻离心机(日立公司);恒温培养箱(37℃、43℃);G560E漩涡混合器(美国SCIENTIFIC Instruments公司)。
1.3 试验方法
1.3.1 试验动物分组及处理
将48只Balb/C健康小鼠随机分成空白对照组、低剂量组和高剂量组,每组各16只。空白对照组灌胃生理盐水,低剂量组和高剂量组分别按每千克体重6.25g、12.5g的剂量灌胃羊奶粉,每日灌胃0.2mL,连续45d。
1.3.2 血清样本制备
摘取小鼠眼球采血,室温下静置2h,于4℃条件下1 000r/min离心10min,收集血清,-20℃保存。
1.3.3 脾淋巴细胞悬液制备
小鼠处死后在无菌条件下取脾脏,置于盛有Hank's液的平皿中,轻轻磨碎脾脏,制成单个细胞悬液。经200目筛网过滤,于1 000r/min条件下离心10min,用Hank's液洗2遍,最后将细胞悬浮在5mL RPMI-1640培养液中。
1.3.4 补体制备
采集豚鼠血,混合5只不同豚鼠血清,将1mL压积绵羊红细胞(SRBC)加入到5mL豚鼠血清中,4℃放置30min,振荡,离心取上清,分装,-70℃保存,用时以SA缓冲液1:8倍稀释。
1.4 测定指标
1.4.1 体重及脏器/体重比
动物按照分组灌胃给予生理盐水和低、高剂量羊奶粉,所有组连续灌胃45d。实验第0天第一次灌胃前称量小鼠初始体重并记录,实验第45天称量小鼠最终体重后,摘取胸腺和脾脏称重并记录,计算胸腺/体重比值和脾脏/体重比值。
1.4.2 脾淋巴细胞增殖能力检测
刀豆蛋白A(concanavalin A,ConA)诱导动物脾淋巴细胞转化,利用MTT试剂盒对淋巴细胞悬液进行测定,在490nm波长下检测吸光值(OD值)。通过式(1)表示淋巴细胞的增殖能力。若受试样品吸光值差值显著高于对照组(P<0.05),判定为阳性。

1.4.3 迟发型变态反应(DTH)
腹腔注射0.2mL 2%(v/v)SRBC悬液,免疫4d后,测量左后足跖部厚度,然后在测量部位皮下注射20μL 20%(v/v)SRBC,注射后于24h测量左后足跖部厚度,同一部位测量三次,取平均值,以此来表示DTH程度。
1.4.4 抗体生成细胞测定
腹腔注射0.2mL 2%(v/v)SRBC悬液,免疫4d后,解剖小鼠获得脾细胞悬液,并将其与琼脂糖培养基、10% SRBC(v/v)混合倾倒在玻片上,加入稀释后的补体温育1h,计数溶血的空斑数。
1.4.5 血清溶血素(HC50)测定
腹腔注射0.2mL 2%(v/v)SRBC悬液,免疫4d后,解剖小鼠收集血清,SA缓冲液稀释200倍,取稀释后的血清50μL加入反应板再加入25μL SRBC悬液、50μL补体混匀。37℃恒温培养箱中保温30min,冰浴终止反应,1 500r/min条件下离心10min。样品孔和空白对照孔各取上清液50μL加入96孔培养板内,加都氏试剂150μL。半数溶血孔加入12.5μL 10%(v/v)SRBC,再加都氏试剂至200μL。震荡器充分混匀,放置10min,于540nm处用全自动酶标仪测定各孔光密度值。小鼠血清溶血素由式(2)表示。

1.4.6 自然杀伤细胞(NK细胞)活性测定
将脾脏分离出的NK细胞与YAC-1淋巴瘤细胞各100μL共同培养,采用WST-8试剂盒法检测NK细胞活力。若受试样品的NK细胞活力显著高于对照(P<0.05),判定为阳性。
1.5 数据处理
应用SPSS 20.0进行统计学处理,结果以平均值±标准差表示,组间均数比较采用t检验,P<0.05为差异显著,具有统计学意义。
2 结果与分析
2.1 羊奶粉对小鼠体重及脏器/体重比的影响
羊奶粉对小鼠体重影响如图1A所示,灌胃45d后,各组小鼠体重随着灌胃时间延长而增加,低剂量组和高剂量组与空白对照组相比,无显著差异(P>0.05)。羊奶粉对胸腺/体重比值的影响如图1B所示,灌胃45d后,低剂量组和高剂量组与空白对照组相比无显著差异(P>0.05)。对脾脏/体重比值的影响如图1C所示,低剂量组和高剂量组与空白对照组相比无显著差异(P>0.05)。由此表明,羊奶粉对小鼠体重及脏器/体重比无显著影响。

图1 羊奶粉对小鼠体重、脏器的影响
2.2 羊奶粉对小鼠细胞免疫功能的影响
细胞免疫涉及T淋巴细胞及其产物(淋巴因子),ConA诱导淋巴细胞转化和DTH反应需要激活的T淋巴细胞对给定抗原的特异性识别,从而增殖和释放细胞因子,淋巴细胞增殖能力和DTH反应体现了细胞因子诱导巨噬细胞募集和激活的能力[11]。
T细胞是获得性免疫中细胞免疫的重要效应细胞,在自身免疫、肿瘤免疫、移植物排斥反应等方面起着重要作用[12],脾淋巴细胞中的T细胞在ConA的刺激下增殖,增殖程度反映T细胞的活性[13]。羊奶粉对小鼠脾淋巴细胞转化能力的影响如图2所示,灌胃45d后,与空白对照组相比,羊奶粉低剂量组脾淋巴细胞转化能力未显著增加(P>0.05),高剂量组淋巴细胞转化能力显著增加(P<0.05)。由此表明,羊奶粉可促进脾淋巴细胞转化能力。
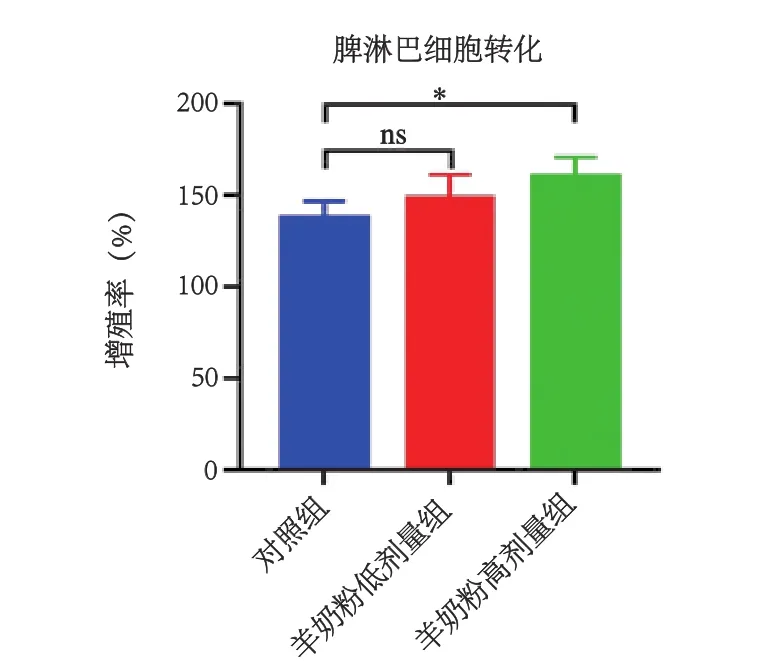
图2 羊奶粉对小鼠脾淋巴细胞增殖能力的影响
DTH是由特异性致敏T细胞介导的细胞免疫反应[14],是一种以单核细胞浸润及细胞变性坏死为主要特征的炎症反应,该反应可作为判定机体细胞免疫功能的指标[15]。羊奶粉对小鼠DTH的影响如图3所示,与空白对照组相比,羊奶粉低剂量组和高剂量组DTH水平显著提高(P<0.05),表明羊奶粉可以增强细胞免疫反应。
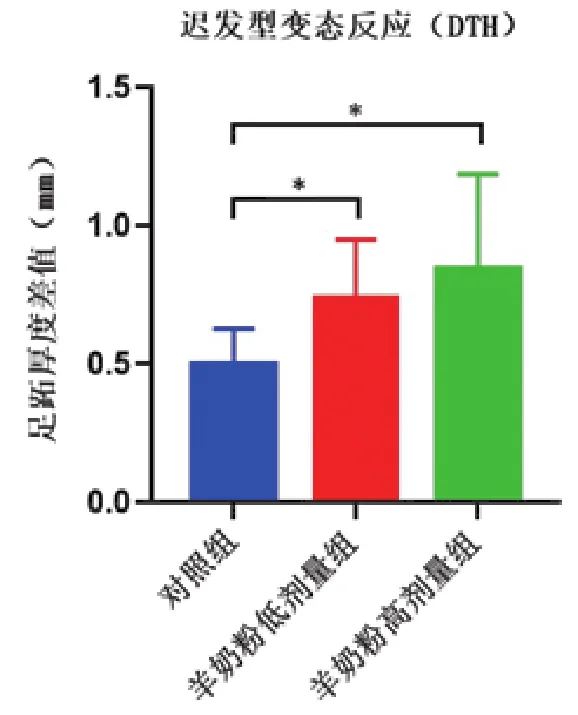
图3 羊奶粉对小鼠迟发型变态反应的影响
2.3 羊奶粉对小鼠体液免疫功能的影响
抗体生成细胞被认为是体液免疫反应的重要组成,其产生大量抗体,在宿主防御炎症和维持体内平衡方面实现一系列功能[16]。羊奶粉对小鼠抗体生成细胞的影响如图4所示,与空白对照组相比,羊奶粉低剂量组和高剂量组显著增加(P<0.05),表明羊奶粉可增强小鼠体液免疫反应。
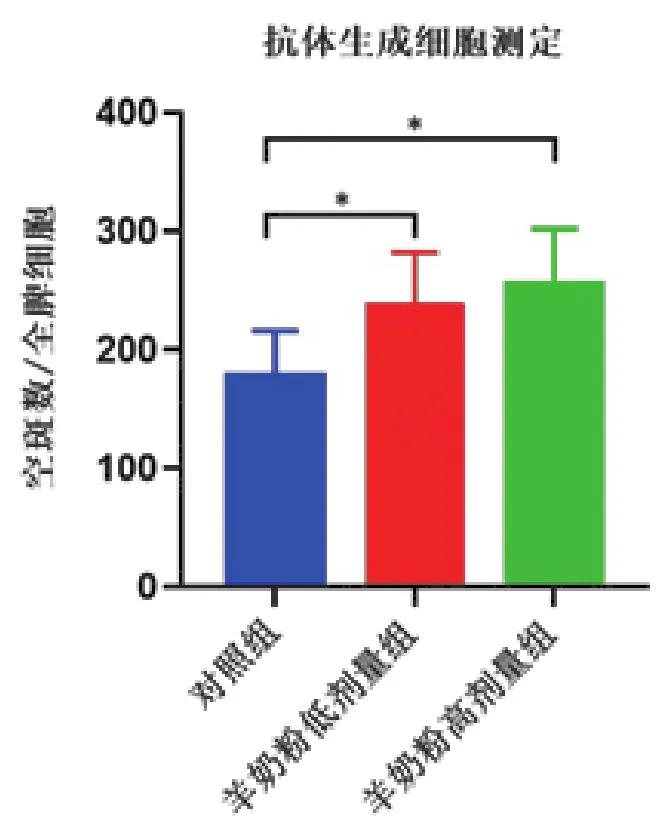
图4 羊奶粉对小鼠抗体生成细胞的影响
溶血素是一种能特异性结合红细胞的抗原型灵敏的互补固定抗体,该抗体可导致红细胞溶解释放出血红蛋白,血清中溶血素水平越高表明机体体液免疫水平越高,其可用来评价机体体液免疫状态[17]。羊奶粉对小鼠血清溶血素的影响如图5所示,羊奶粉低剂量组和高剂量组血清溶血素水平均高于空白对照组,但均无显著差异(P>0.05)。
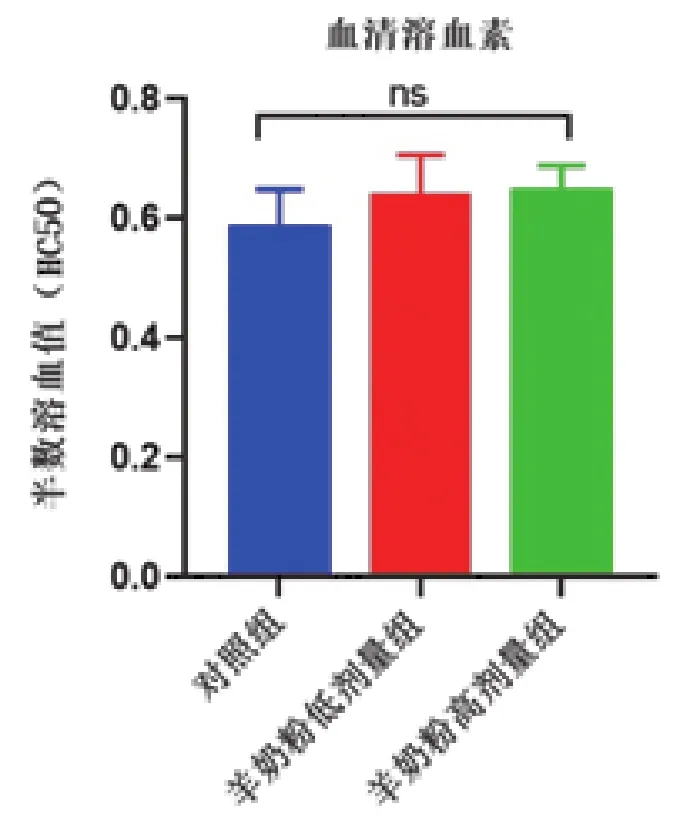
图5 羊奶粉对小鼠血清溶血素的影响
2.4 自然杀伤细胞(natural killer cells,NK细胞)活性测定
NK细胞是关键的先天免疫细胞,可以被激活以介导细胞毒性活性,并产生高水平的细胞因子和趋化因子,参与非特异性抗病毒防御机制[18],其在增强先天免疫反应和激活适应性免疫系统方面发挥重要作用[19]。羊奶粉对小鼠NK细胞活性的影响如图6所示,低剂量组和高剂量组NK细胞活性均呈上升趋势,但与空白对照组相比,两试验组NK细胞活性未显著增加(P>0.05)。

图6 羊奶粉对小鼠NK 细胞的影响
3 结论
本试验以Balb/C小鼠为动物模型,对羊奶粉对动物体的细胞免疫、体液免疫、NK细胞活性等调节作用进行了评价。结果显示,羊奶粉可增强小鼠脾淋巴细胞转化能力、迟发型变态反应程度等细胞免疫功能和抗体生成细胞等体液免疫功能。综上所述,羊奶粉具有增强小鼠免疫力的作用。
