西兰花粉营养成分及理化性质研究
2022-05-29刘培秀赵美萱雷晓英刘文强李玉鹏
刘培秀,赵美萱,杨 梅,雷晓英,刘文强,杨 敏, ,李玉鹏
(1.甘肃农业大学理学院,甘肃兰州 730070;2.临泽县科技开发中心,甘肃临泽 734200;3.甘肃金沙食品有限公司,甘肃临泽 734200)
西兰花营养物质丰富,富含蛋白质、矿物质、黄酮和多酚等,具有清除自由基、抗氧化、抗衰老等功效[1−2]。另外,有研究指出,西兰花含有硫代葡萄糖苷及其酶解产物,具有防癌、抗癌等医用价值[3−5]。西兰花以鲜食为主,因此关于西兰花的研究主要集中在采后贮藏保鲜方面。目前,众多学者研究了不同处理方式及贮藏条件对西兰花品质的影响,发现适度前处理以及适宜的贮藏温度有利于延长西兰花的鲜食期[6−9]。另外,为了丰富西兰花产品种类及扩大其应用范围,也有学者研究了烹饪条件、干燥方式对西兰花营养特性的影响,以及西兰花粉的加工工艺及粉末性质[10−12]。有研究指出,真空冷冻干燥和喷雾干燥西兰花老茎粉适宜作为功能性食品原料;微波真空干燥、变温压差膨化干燥、热风干燥西兰花老茎粉适宜进行片剂、胶囊等剂型产品开发[13]。就干燥方式而言,热风干燥会导致西兰花中吲哚类硫苷[14]、抗坏血酸[15]和色素[16]降解,而冷冻干燥不仅有利于保持细胞结构不发生明显改变,还能最大限度保留活性物质。
由于西兰花营养价值较高,越来越受到消费者的青睐,其种植面积及产量逐年攀升。然而,在种植面积扩大的同时,也造成了尾菜的大量产生,引起严重的环境问题。西兰花鲜食部分主要为花球,约占西兰花全株的30%;其茎和叶作为尾菜,部分用于饲喂家畜,部分废弃在田间地头,环境污染严重[17−18]。可见,如何实现西兰花废弃物的高值化利用是亟待解决的问题。
有研究指出,西兰花不同部位活性成分差异较大,其中花球粉末中蛋白质含量最高,为22.41 g/100 g(干基),叶中灰分含量最高(14.67 g/100 g 干基),而茎中粗纤维含量最高[19]。另外,花球脂肪含量最低,叶中脂肪含量最高(6.72±0.21 g/100 g),而茎中总糖含量最高(75.42 g/100 g)[19]。就活性成分而言,花球中硫代葡萄糖苷、新葡萄糖芸苔素含量较其他部位高,叶中类胡萝卜素、维生素E 和维生素K 含量较高[17]。另外,西兰花叶粉末中必需氨基酸占总氨基酸的26%,花球中酪氨酸含量最高,为70.0±3.0 mg/g(干基)[19]。西兰花叶中总酚含量为5.38~13.10 mg/g,因此表现出较高的抗氧化活性[20];另外,西兰花废弃物冻干粉水提液的DPPH 自由基清除活性显著高于花球[21]。由此可见,西兰花不同部位营养成分差异较大。虽然已有研究报道了西兰花不同部位营养成分含量,但是样品多为热风干燥粉末,冷冻干燥产品报道较少。另外,果蔬营养成分含量受品种和产地影响较大。因此,有必要针对甘肃省主产的西兰花茎和叶进行营养价值分析,为西兰花废弃物的可食化利用奠定基础。
本文以甘肃省临泽县主产的西兰花全株为原料,将其划分为可食花球、茎和叶3 部分,分析了其冻干粉的部分营养成分含量,对比了不同部位、不同粒度西兰花粉的理化性质,如填充性、持水持油性、膨胀力、色度等。研究结果可为西兰花废弃物的综合开发及利用提供参考依据。
1 材料与方法
1.1 材料与仪器
新鲜西兰花全株 由甘肃金沙食品有限公司提供;福林酚试剂、没食子酸、槲皮素 上海麦克林生化科技有限公司;其他试剂 均为分析纯。
UV-1780 双光束紫外可见分光光度计 岛津仪器有限公司;LGJ-12 真空干燥仪 北京松源华兴科技发展有限公司;Bettersize 2000 激光粒度分布仪丹东百特仪器有限公司;S-3400N 扫描电子显微镜日本日立公司;ZEEnit 700P 石墨炉原子吸收光谱仪德国耶拿分析仪器股份公司;STA 449F5 热分析仪 德国耐驰科学仪器制造有限公司;CS-200 型色差仪 杭州彩谱科技有限公司。
1.2 实验方法
1.2.1 西兰花粉制备 将新鲜西兰花全株用清水冲洗后晾干,分选出可食花球、茎、叶3 部分。将各部分切块后进行冷冻干燥,冻干后用粉碎机进行粉碎,然后过筛。参考文献[19]中果蔬粉常见粒度范围,粒度依次选择为180、140 和80 目,过筛后将样品装入样品袋中冷藏备用。其中,粉碎样品过80 目筛后用于营养成分分析,各成分含量以西兰花粉湿基计。
1.2.2 营养成分分析
1.2.2.1 水分测定 根据GB 5009.3-2016 《食品中水分的测定》方法,测定各样品水分含量。
1.2.2.2 灰分测定 采用 GB 5009.4-2016《食品中灰分的测定》方法,测定各样品灰分含量。
1.2.2.3 总酚含量测定 参考王治同等[22]的方法,以没食子酸为标准品制作标准曲线(y=0.1475x+0.0315,R2=0.9990)测定各样品总酚含量。
1.2.2.4 总黄酮含量测定 参考柏夏琼等[23]的方法,以槲皮素为标准品制作标准曲线(y=0.0338x+0.3876,R2=0.9995),测定总黄酮含量。
1.2.2.5 还原糖含量测定 采用GB 5009.7-2016《食品中还原糖的测定》方法,测定各样品还原糖含量。
1.2.2.6 叶绿素含量测定 采用NY/T 3082-2017《水果、蔬菜及其制品中叶绿素含量的测定分光光度法》,测定叶绿素含量。
1.2.2.7 矿物质含量测定 采用原子吸收光谱法测定样品中主要矿物质含量。准确取灰化后的样品0.1 g 置于试管中,采用1 mL 浓硝酸充分溶解后用蒸馏水稀释并定容至10 mL,采用原子吸收光谱仪测定样品中各元素的吸光度,通过标准曲线进行元素含量计算。
1.2.3 表面形貌观察 取适量西兰花粉末样品置于铜台上的导电胶条表面,小心涂抹使其分散为薄层,喷金后采用S-3400N 扫描电子显微镜观察,电压12.0 kV。
1.2.4 热稳定性分析 热稳定性参考Doh 等[24]的方法,略有修改。采用热分析仪对样品进行热稳定性测定。称取约5 mg 干燥样品,放入坩埚中加盖,以空坩埚作为对照,保护气为氮气,升温范围25~700 ℃,升温速率5 ℃/min,记录热重(Thermogravimetry,TG)及差示扫描量热(Differential Scanning Calorimetry,DSC)曲线,并求出微商热重(Derivative Thermogravimetry,DTG)曲线。
1.2.5 西兰花粉理化性质分析
1.2.5.1 色度测定 参考Doh 等[24]的方法,在室温下将色差仪进行校准,然后取适量测试样品铺平,将色差仪的测试口与被测样品紧密贴合,保持稳定且不漏光,按下测试键,显示屏上即为当前样品的颜色数据,进行记录。其中L*表示亮度,L*=0 表示黑色,L*=100 表示白色,a*表示绿(−)、红(+)两种色彩变化,b*表示蓝(−)、黄(+)两种色彩变化。
1.2.5.2 粒径和比表面积测定 将西兰花粉末分散于水中,用激光粒度分布仪测定粒度,泵速1800 r/min,介质折射率1.33,获得粒径和比表面积数据,取中位径D50 表示平均粒径。
1.2.5.3 松密度、振实密度和压缩度的测定 参照本团队方法[25],略作修改。准确称取0.5 g 粉末,用漏斗缓慢倒入10 mL 量筒中,轻轻夷平粉末顶部,记录粉末自然堆积时的体积V1。在操作台上轻扣量筒至粉末体积不再减小,记录粉末体积V2。松密度和振实密度计算式如下:

其中: V1为粉末自然堆积时的体积,mL;V2为粉末振实时的体积,mL;m 为称取样品的质量,g。
1.2.5.4 膨胀力的测定 准确称取0.5 g 样品于10 mL具塞量筒中,记录自然堆积时的体积V0,加水至总体积为10 mL,将样品振荡均匀后在室温下静置24 h,记录样品膨胀后的体积V1。膨胀力计算公式如下:
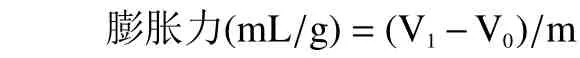
其中:m 为称取样品的质量,g;V0为自然堆积时的体积,mL;V1为样品膨胀后的体积,mL。
1.2.5.5 持水力和持油力的测定 准确称取0.5 g 样品于15 mL 离心管中,加10 mL 蒸馏水,振荡5 min,于37 ℃恒温水浴放置4 h,于4000 r/min 离心15 min,弃其上清液,称重。持水力计算公式如下:
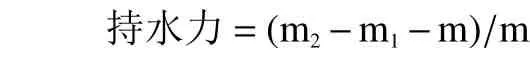
其中:m 为样品的质量,g;m1为离心管的质量,g;m2为离心后的总质量,g。
准确称取0.5 g 样品于15 mL 离心管中,加4 g植物油,振荡5 min,于37 ℃恒温水浴放置4 h,4000 r/min 离心15 min,弃其上层油液,称重。持油力计算公式如下:

其中:m 为样品的质量,g;m1为离心管的质量,g;m2为离心后的总质量,g。
1.3 数据处理
所有试验重复3 次,数据采用Excel 2010 处理并用平均数±标准偏差表示,用Origin Pro 9.0 作图,采用Duncan 法用IBM SPSS Statistics 22 进行差异显著性分析。
2 结果与分析
2.1 西兰花粉营养成分
西兰花不同部位水分、灰分、还原糖、总黄酮、总酚含量如表1 所示。由表1 可以看出,经干燥后西兰花不同部位水分含量没有显著差异(P>0.05),但3 个部位灰分差异显著(P<0.05)。其中,西兰花茎部灰分含量最高,其次为西兰花叶。就总黄酮、总酚而言,不同部位含量差异显著(P<0.05),其中西兰花叶总黄酮含量最高,是茎中总黄酮含量的3.46 倍。花球总酚含量最高,叶中总酚含量最低;花球中总酚含量是叶中总酚含量的3.52 倍。有文献报道,西兰花叶中灰分含量最高,为14.67%±0.12%,花球中灰分含量最低,为7.87%±0.12%(干基)[19],与本研究结果存在差异的原因可能在于样品品种、产地及处理条件不同。酚类、黄酮类物质与果蔬的营养价值和医疗保健作用具有关联性,其主要生理活性为抗氧化、提高免疫力。西兰花废叶和茎中总酚和黄酮类物质含量可观,营养价值较高,具有一定的开发价值。
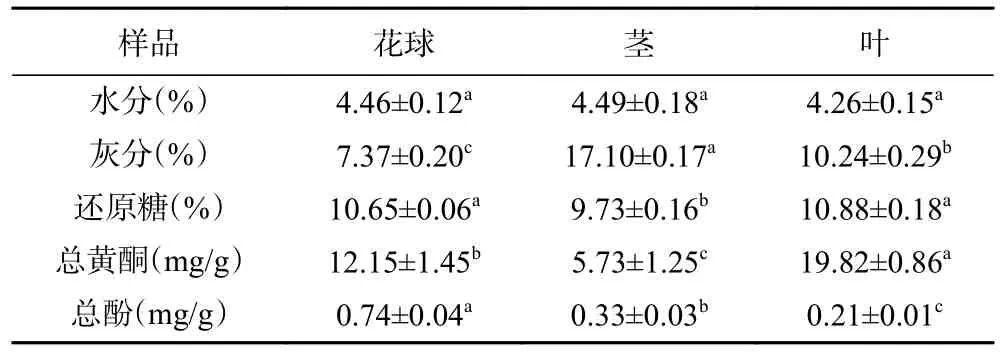
表1 西兰花粉部分营养成分含量(湿基)Table 1 Partial nutrients content of broccoli flours (wet basis)
2.2 西兰花粉叶绿素含量
西兰花不同部位叶绿素含量如表2 所示。由表可知,西兰花叶中总叶绿素含量最高,为11.35±0.65 mg/g,其中叶绿素a 含量为8.28±0.37 mg/g,叶绿素b 含量为3.07±0.29 mg/g。西兰花茎的总叶绿素含量最低,为0.16±0.006 mg/g。西兰花不同部位叶绿素含量差异显著(P<0.05)。据文献报道,西兰花“苏青 6 号”叶绿素含量约为0.6 mg/g[3],西兰花“优秀”中叶绿素含量为0.23 mg/g[4],均低于本研究的西兰花样本叶绿素含量。另外,Liu 等[17]报道称,西兰花花球中叶绿素a 含量为852.1±105.5 μg/g(干基,下同),叶绿素b 含量为134.6±14.3 μg/g;茎中叶绿素a 含量为143.7±51.6 μg/g,叶绿素b 含量为22.2±9.2 μg/g;叶中叶绿素a 含量为4477.9±408.6 μg/g,叶绿素b 含量为780.9±56.3 μg/g;上述叶绿素含量均低于本研究结果。可见,西兰花中叶绿素含量受品种和部位的影响。
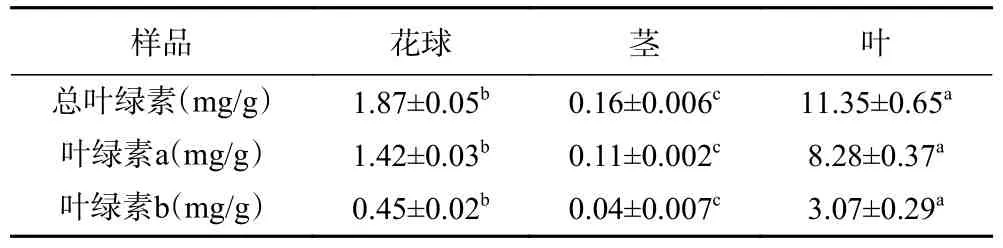
表2 西兰花粉叶绿素含量(湿基)Table 2 Chlorophyll content of broccoli flour (wet basis)
叶绿素是一种天然色素,因其来源广泛、安全无毒,在食品行业具有十分广泛的用途;叶绿素还具有一定的生理活性,如抑菌、抗氧化等[17]。西兰花废叶中叶绿素含量十分可观,可作为原料提取叶绿素,或作为保健食品基料,均具有一定的开发价值。
2.3 西兰花粉矿物质含量
不同部位西兰花粉矿物质含量如表3 所示,其中Ca、Mg 含量较高。西兰花叶中Ca 含量显著高于花球和茎,其含量是茎的2.52 倍(P<0.05);茎中Mg 含量最高,且不同部位Mg 含量差异显著(P<0.05)。花球中,Fe、Zn 含量最高,二者在茎中含量最低。西兰花叶中Cu、Mn 含量显著高于其他部位(P<0.05)。除了Ca 以外,其他所测得的各元素在西兰花不同部位的含量差异显著(P<0.05)。值得注意的是,西兰花叶中各元素含量均较高,具有开发价值。有报道指出,西兰花中Ca 含量为1421 μg/g,Mg 含量为835 μg/g,均低于本文研究结果;另外,Mn、Zn、Fe、Cu 含量也低于本文3 个样品研究结果[26−27],这可能是因为样品品种、产地不同。临泽为凹凸棒土产区,土壤中矿物质含量丰富,这可能是西兰花中矿物质含量较高的另一个原因。
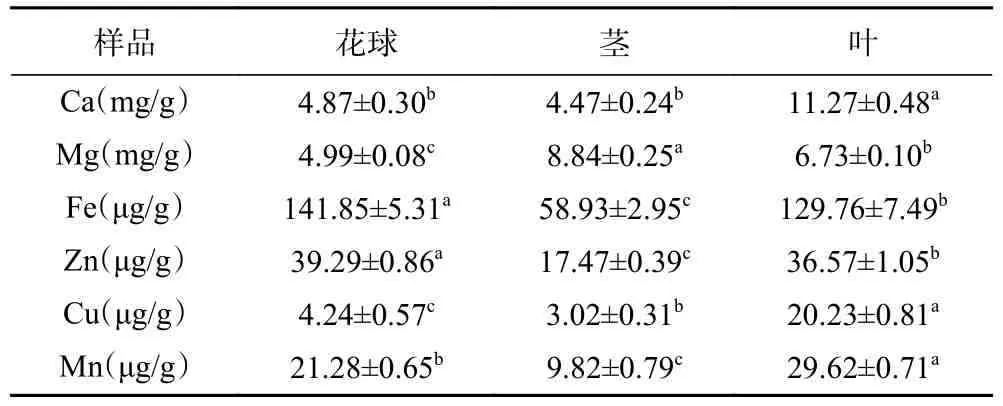
表3 西兰花粉矿物质含量(湿基)Table 3 Minerals content of broccoli flour (wet basis)
2.4 西兰花粉表面形貌
不同部位西兰花粉微观形貌如图1 所示。由图可以看出,可食花球粉末表面呈多孔、凹凸不平状,可看出部分短簇状纹理,其宽度小于1 μm,长度较短,可能为干燥失水后表面纤维。西兰花茎部表面较为平滑,有少量层状脱落,可能为粉碎时机械力所致。茎部粗纤维含量较高[26],因此表面较为光滑。与茎部相比,叶部呈现块状,部分呈层状,表面粗糙程度加大,但其粗糙度仍然低于花球,这是由于叶部粗纤维含量高于花球所致。

图1 80 目西兰花粉扫描电镜图Fig.1 SEM images of broccoli flour at 80 mesh
2.5 西兰花粉热稳定性
不同部位西兰花粉的DSC、TG 和DTG 曲线如图2 所示。由DSC 曲线可以看出,所有样品在80 ℃左右出现吸热峰,为样品中少量水分蒸发所致。西兰花叶的焓变最大,为−1392±31 J/g,茎的焓变为−1723±25 J/g,花球为−4095±53 J/g。由此可见,在热分解过程中,花球的放热量最大,这可能是由于其中酚类、黄酮等小分子化合物含量较高所致。就TG 曲线而言,3 种样品在80 ℃左右出现失重,在DTG 曲线上出现明显的失重峰,为水分蒸发所致。由DTG 曲线可以看出,花球的第一个变性温度为134.9 ℃,该温度下出现第一次失重,而茎和叶在该温度处的失重并不明显。该阶段失重主要是小分子碳氢化合物,如酚类、黄酮等成分蒸发及热分解所致[4]。由于花球中酚类物质含量较高(表1),因此出现明显的热变性峰。在202 ℃附近,3 个样品均出现失重,是由较为复杂的大分子烷烃等热分解所致[28]。花球在307.7 ℃出现第三次失重,该阶段主要为半纤维素、纤维素、蛋白质、淀粉等大分子的热分解[28−29]。就茎和叶而言,该阶段的热变性温度分别为312.2、312.8 ℃。由于茎和叶中粗纤维、灰分含量较高,因此热解后残留的碳渣较花球多。
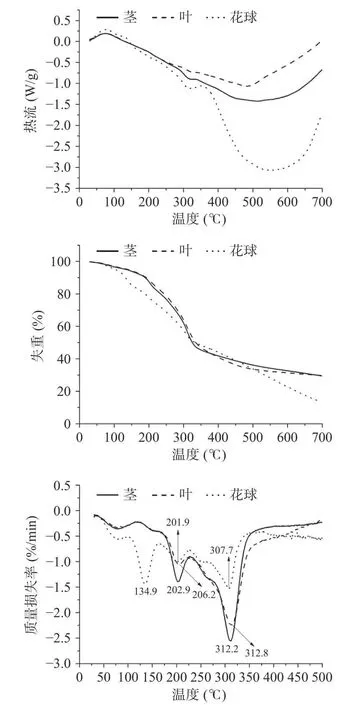
图2 80 目西兰花粉DSC、TG 和DTG 曲线Fig.2 DSC, TG and DTG curves of broccoli flour at 80 mesh
2.6 西兰花粉色度
色度是食品颜色的表征,西兰花粉末色度如图3所示。由图可以看出,西兰花不同部位各色度值差异显著(P<0.05)。不同部位西兰花粉均表现为黄绿色;其中,西兰花茎亮度值最大,绿色度最小;西兰花叶绿色度最大,花球黄色度最大。西兰花叶中叶绿素含量最高,因此a*和L*值最小,表现为绿色度最大,亮度最低;茎中叶绿素含量最低,其绿色度最小,亮度最大。就b*而言,花球黄色度最大,叶黄色度最小。刘瑶等[30]报道的西兰花可食部分色度绝对值均小于本文研究结果。张明等[13]报道西兰花老茎冻干粉的L*值为82.53±0.04,a*为2.44±0.07,b*为37.61±0.03,均高于本文研究结果。上述研究结果差异可能与样品产地、种类不同有关。
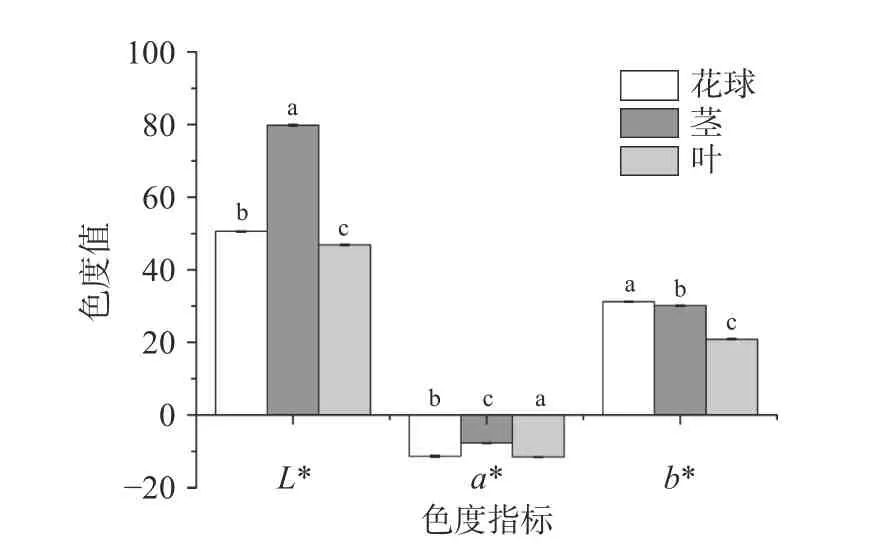
图3 80 目西兰花粉色度Fig.3 Chromatic value of broccoli flour at 80 mesh注:不同小写字母表示不同样品同一指标间差异显著P<0.05。
2.7 西兰花粉粒度和比表面积
不同目数西兰花粉粒度和比表面积如图4 所示。由图可以看出,经过80、140、180 目筛分后,西兰花茎D50 分别为466.7、243.4 和105.8 μm,且随着筛分目数的增加,粉体粒度显著降低(P<0.05)。相同目数下,花球粒径最小,且茎的粒度显著大于花球和叶的粒度(P<0.05),这是由于茎中粗纤维含量较高,难以破碎所致,与扫描电镜观察结果一致(图1)。就比表面积而言,随着粒度的减小,粉体比表面积增加。3 种目数下茎的比表面积最小,因为其粒度最大,加上粗纤维含量高,表面较为平滑(图1)。由于相同目数西兰花花球和叶粒径相当,其表面都具有凹凸不平状,因此二者比表面积相差不大。西兰花粉粒度越小,比表面积越大,其吸附性能可能越好。
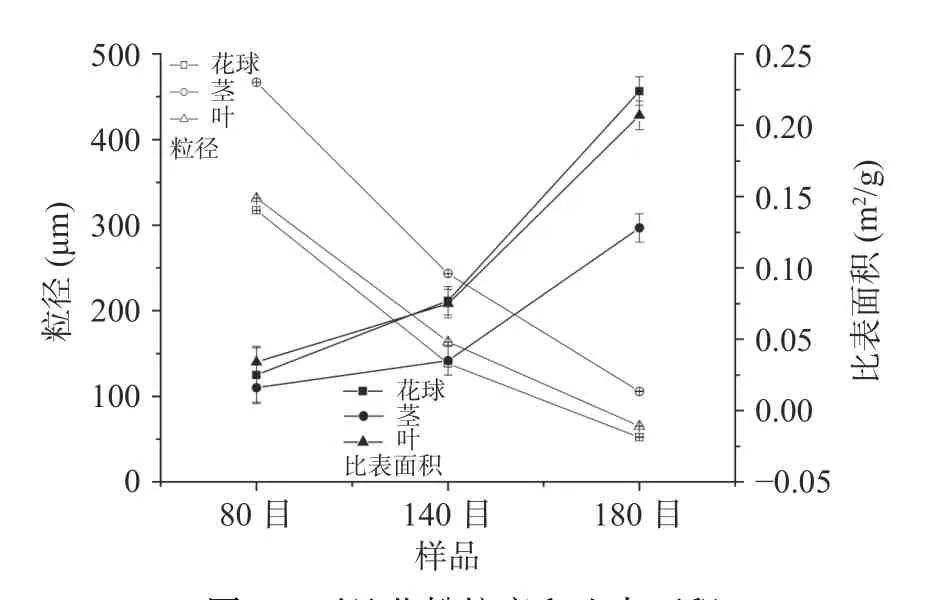
图4 西兰花粉粒度和比表面积Fig.4 Size and specific surface area of broccoli flour
2.8 西兰花粉松密度、振实密度及压缩度
松密度和振实密度是粉体物料填充性的重要指标,与颗粒大小、粒度均一性以及颗粒间聚合力等因素有关[25]。具有较高密度的粉末状物质更易于贮藏、包装和运输[17]。西兰花冻干粉的松密度、振实密度和压缩度如图5 所示。由图5 可以看出,粉末粒度对西兰花可食花球的松密度没有显著影响(P>0.05),但对西兰花叶和茎的松密度影响显著,具体表现为随着粉末粒度的减小,松密度显著减小(P<0.05),这是因为粉体颗粒越小,颗粒间的空隙越小。就西兰花不同部位而言,80 目粒度下花球松密度显著小于叶和茎(P<0.05)。由于花球粗纤维含量低,粉碎后粒径分布较宽(D10=150.6 μm,D90=713.7 μm),目数较大时小颗粒填充在大颗粒间隙,因此松密度较小。

图5 西兰花松密度、振实密度和压缩度Fig.5 Bulk and tap density and compressibility of broccoli flour注:不同小写字母表示同一样品不同粒度间差异显著P<0.05,不同大写字母表示同一粒度不同样品间差异显著P<0.05;表6、表7 同。
不同粒度西兰花花球粉末的振实密度差异不显著(P>0.05);140 目西兰花叶振实密度最小,为0.58±0.04 g/mL。80 目和140 目时,茎的振实密度均显著高于叶和花球(P<0.05),这是因为西兰花茎的粒径显著大于叶和花球。粒度为180 目时,三者粒径差异并不大(图4),因此振实密度差异不显著(P>0.05)。西兰花茎的压缩度随着粒度的增加而显著增大(P<0.05)。在80 目和140 目时,叶和花球的压缩度差异不显著(P>0.05)。当粒度为140 目时,西兰花茎的压缩度显著高于其他部位(P<0.05)。茎部膳食纤维含量较高,致使颗粒难以粉碎均匀,粒径较大且分布宽,堆积后孔隙较大,经振实后密度迅速增大,因此表现出较高的压缩度。由此可见,西兰花不同部位粉体表现出不同的填充性,该性质与粉末粒度密切相关。综合考虑粉碎能耗和填充性,西兰花粉末粒度选择140 目较为适宜。
2.9 西兰花粉膨胀力
膨胀力是衡量可食果蔬粉,特别是膳食纤维品质好坏的重要指标。膨胀力越大,表示样品的表面积及吸附性越大,在肠道内能产生较大的容积,进而引起饱腹感,有助于控制饮食[13]。不同粒度西兰花粉末膨胀力如图6 所示,当粒度为80 目时,西兰花叶和花球膨胀力相当,但140 目时叶的膨胀力显著大于茎和花球(P<0.05)。当粒度为180 目时,花球膨胀力最大,其次为叶,三者差异显著(P<0.05)。在3 种粒度下,西兰花茎的膨胀力均显著小于叶和花球(P<0.05),这是由于茎中不溶性纤维含量较高,灰分较高(表1),颗粒粒径较大,比表面积较小(图4)所致。总体而言,西兰花叶具有较高的膨胀力,且在80~140 目时不受粒度影响;花球也具有较好的膨胀力,二者可用于开发饮食控制类食品。
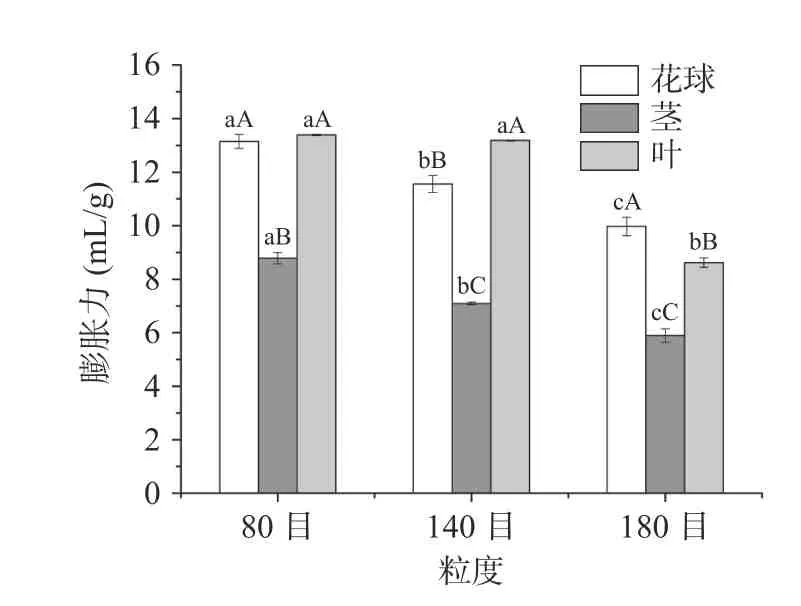
图6 西兰花粉膨胀力Fig.6 Swelling capacity of broccoli flour
2.10 西兰花粉持水力和持油力
持水力和持油力是可食粉体物化性质的重要指标。持水力和持油力越大,表示粉体的吸水能力、持油能力越强。西兰花粉持水力如图7 所示。由图可以看出,140 目花球持水力最高,为13.18±0.46 g/g,显著高于其他样品(P<0.05)。由于花球表面粗糙,颗粒的比表面积大,且粗纤维含量低而亲水性物质含量高,粉碎时更多亲水基团暴露出来,因而持水力最大。随着粒度的减小,西兰花茎和叶的持水力均呈现出减小趋势,这是由于粉碎的粒度越小,西兰花组织结构和细胞结构被破坏程度越大,其吸水溶胀作用越小。有研究指出,西兰花茎持水力最高,为15.64±0.75 g/g(湿基),高于本研究中花球持水力;叶的持水力为13.04±0.59 g/g(干基),花球的持水力为7.26±0.24 g/g(干基)[19],与本研究中80 目叶和茎粉末持水力相似。
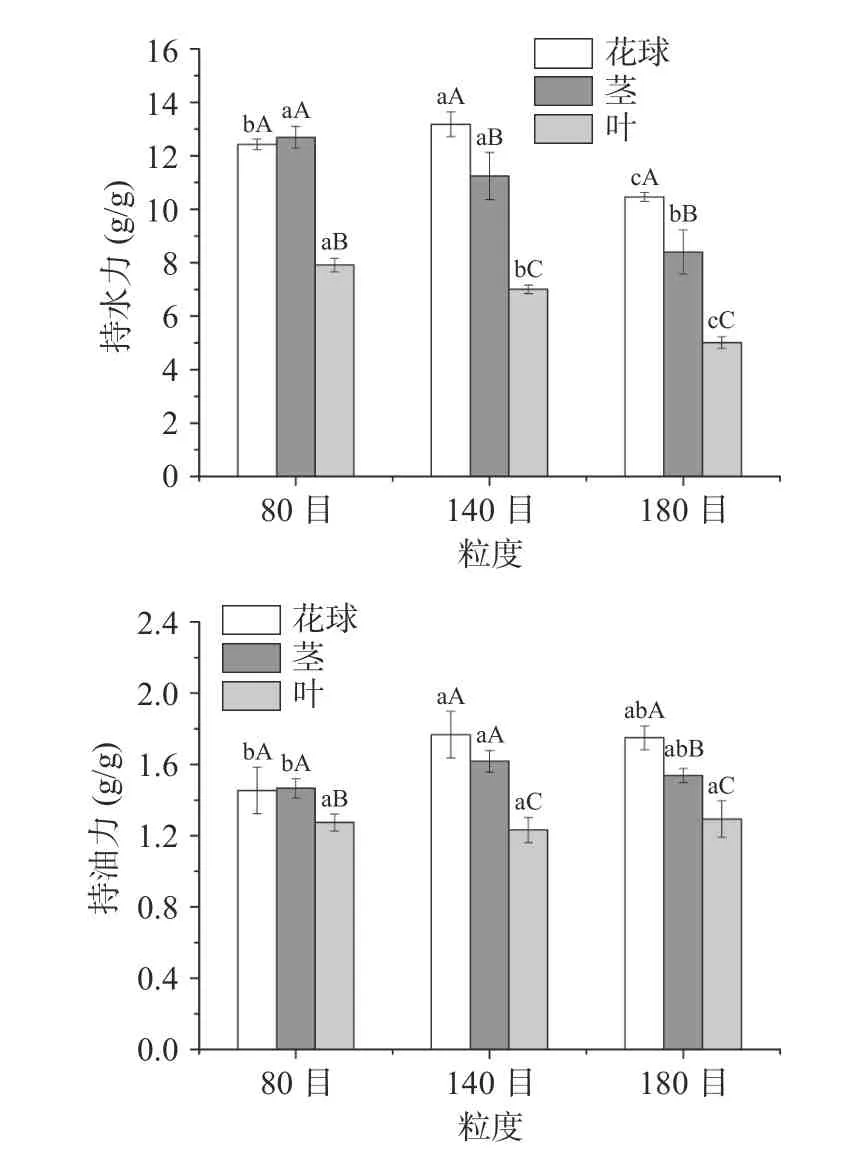
图7 西兰花粉持水力和持油力Fig.7 Water-holding and oil-holding capacity of broccoli flour
西兰花粉持油力受到部位和粒度的影响,当粒度为140 目和180 目时,花球的持油力最高,其次为茎。就西兰花叶而言,持油力随粒度变化不显著(P>0.05)。花球表面粗糙(图1),比表面积大(图4);另外,机械粉碎改变了纤维素和半纤维素构型,部分亲脂基团暴露,加之粉体粒子比表面积增加,将油吸附在颗粒表面和粒子之间,因此表现出较高的持油力[31]。综上所述,不同部位西兰花粉均具有较高的持水力和持油力,可作为防治便秘以及饮食控制类食品或基料,具有较高的开发价值。
3 结论
以西兰花为原料,将其分为可食花球、茎和叶,分析了不同部位冻干粉的基础营养成分和粉体理化性质。研究发现,西兰花3 个部位基础营养成分具有差异,其中西兰花叶中还原糖、总黄酮、总叶绿素、Ca、Cu 和Mn 含量较高,茎中灰分、Mg 含量较高;花球中总酚、Fe 和Zn 含量较高。就微观形貌而言,花球表面粗糙程度较大,茎部表面较为光滑。粉碎粒度对西兰花粉末理化性质具有一定的影响。不同粒度下,西兰花粉末压缩性不同,其中80 目时压缩度最小,180 目时最大。同一粒度下,不同部位西兰花粉理化性质具有差异。同一目数下,花球的粒径最小;茎的粒径最大,比表面积最小。西兰花叶具有较好的膨胀力,而花球持水力和持油力较高。由此可见,西兰花茎和叶均具有一定的开发价值,可利用其不同性能,开发出具有不同功能的食品。
