鼻咽癌细胞体外诱导肿瘤相关成纤维细胞形成并上调NNMT表达*
2022-05-29杨雨嘉霍慧敏姚小暄黄中恒唐锦平刘春磊韦正波
杨雨嘉,姚 茜,2,霍慧敏,崔 昆,姚小暄,,黄中恒,,唐锦平,,刘春磊,,韦正波,谢 莹,2△
(1.广西医科大学生命科学研究院,南宁 530021;2.广西区域性高发肿瘤早期防治研究教育部重点实验室,南宁 530021;3.广西医科大学附属肿瘤医院,南宁 530021)
鼻咽癌(nasopharyngeal carcinoma,NPC)是起源于鼻咽上皮细胞且在中国南方地区高发的恶性肿瘤,淋巴结转移是其早期主要临床表现[1]。自1889 年Steven Pegat 提出肿瘤微环境(tumor microenvironment,TME)学说以来,TME 与肿瘤发生、发展的关系越来越受关注[2-3]。TME包括肿瘤细胞、基质细胞如肿瘤相关内皮细胞(tumor-associated endothelial cells,TECs)、肿瘤相关成纤维细胞(cancerassociated fibroblasts,CAFs)、肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)等细胞成分及多种非细胞成分。其中CAFs 作为TME 中最重要的基质细胞之一,通过直接接触、旁分泌、重塑细胞外基质、诱导血管形成等方式对肿瘤细胞增殖、迁移和侵袭起到营养支持和促进作用[4-5]。
烟酰胺-N-甲基转移酶(nicotinamide N-methyltransferase,NNMT)编码基因位于人类11 号染色体上(11q23.1),有3个外显子和2个内含子,转录位点跨度约为16.7 kb,产生包含1 578 个碱基对的mRNA和264个氨基酸的蛋白质。单细胞测序结果显示,NNMT 在成纤维细胞和肿瘤细胞中呈高表达,被普遍认为是一种肿瘤相关代谢酶,可改变多种肿瘤细胞的代谢途径,显著促进肿瘤细胞增殖、迁移和侵袭[6-8]。另有最新研究报道,NNMT在CAFs中呈高度表达,可能是CAFs活化的关键蛋白,敲低CAFs 中NNMT 表达后,α-平滑肌肌动蛋白(αsmooth muscle actin,α-SMA)表达下调[9]。本研究拟通过条件培养基(condition medium,CM)和Transwell小室共培养模式,将人胚肺成纤维细胞MRC-5与NPC 细胞系5-8F 共培养后诱导MRC-5 向CAFs转化,检测NNMT及成纤维细胞生物标志物的表达情况和细胞增殖能力;同时分离纯化头颈肿瘤来源CAFs,验证相关标志物表达,探讨NNMT 与CAFs的相关性。
1 材料与方法
1.1 肿瘤组织来源和细胞培养
肿瘤组织取自广西医科大学附属肿瘤医院的2例头颈外科手术患者。本研究经广西医科大学医学伦理委员会审核通过,患者及其家属均已签署知情同意书。
人NPC 细胞株5-8F 购自湖南湘雅中心实验室细胞库。人胚肺二倍体成纤维样细胞株MRC-5 由中国科学院干细胞库提供。5-8F、MRC-5、CAFs 均培养于含10%胎牛血清的DMEM培养基中,并置于37 ℃、5%CO2的培养箱中常规培养,隔天换液,细胞生长至80%~90%融合度时,0.25%胰酶消化、传代。
1.2 主要试剂
DMEM 培养基、胎牛血清、青—链霉素均购自美国Gibco公司;α-SMA鼠单克隆抗体、NNMT鼠单克隆抗体、GAPDH 兔单克隆抗体、山羊抗兔二抗、山羊抗小鼠二抗均购自英国Abcam公司;Transwell小室(0.4 μm 孔径)、6孔细胞培养板购自美国Corning 公司;逆转录试剂盒购自北京全式金生物技术有限公司;PowerUp™SYBR™Green Master Mix 购自美国Thermo Fisher生物技术有限公司;CCK-8试剂购自日本东仁公司。
1.3 间接接触共培养
1.3.1 CM共培养体系
采用本课题组前期建立的CM 共培养体系[10],见图1A。(1)5-8F-CM 和CM-control(来源于MRC-5)的收集:取对数生长期的5-8F 或MRC-5 分别接种于6孔板,培养至细胞融合度为70%时,吸弃培养基,PBS 清洗,加入含2%胎牛血清的DMEM 培养基,继续培养48 h后收集培养上清液,用0.22 μm孔径的滤器滤除细胞碎片及死细胞。(2)CM共培养体系的构建:实验组(MRC-5+5-8F-CM组):将MRC-5细胞以3×105个/孔的密度接种于6 孔板,培养12 h后弃去培养基,PBS 清洗,随后加入5-8F-CM 与含2%胎牛血清的DMEM 新鲜培养基(按1∶1 比例混合);对照组(MRC-5+CM-control组):加入CM-control与含2%胎牛血清的DMEM培养基(按1∶1比例混合)。培养48 h后收集各组细胞。
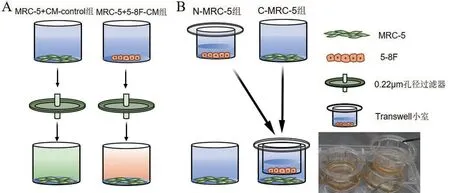
图1 体外间接接触共培养体系模型
1.3.2 Transwell小室共培养体系
构建Transwell 小室(0.4 μm 孔径)共培养体系[11],以共培养后的Transwell 下室MRC-5 细胞和6 孔板单独培养的MRC-5 细胞作为目标细胞,见图1B。实验组(C-MRC-5 组):取对数生长期的5-8F以3×105个/孔的密度接种于上室内,MRC-5以3×105个/孔的密度接种于下室(6 孔板)内。对照组(NMRC-5 组):将MRC-5 细胞以3×105个/孔的密度接种于6 孔板中单独培养。48 h 后收集各组下室细胞。
1.4 头颈肿瘤相关成纤维样细胞的分离与纯化
用含1%青—链霉素的PBS 缓冲液多次清洗头颈部肿瘤组织,去除脂肪组织,剪成1 mm×1 mm×1 mm 小块,加入含Ⅰ型胶原酶、透明质酸酶Ⅳ型、DNaseⅠ型的酶解液,37 ℃消化20~40 min,离心去除酶解液,PBS 清洗两次,用含10%胎牛血清的DMEM 完全培养基重悬,移入培养瓶,差速贴壁法纯化CAFs。将获得的两株头颈肿瘤来源CAFs 分别记为Fb-F0004和Fb-F0005。
1.5 倒置相差显微镜观察细胞形态
将两种诱导模型下经5-8F 细胞诱导前、后的MRC-5与头颈肿瘤来源的CAFs分别置于倒置相差显微镜下观察并进行拍照。
1.6 实时荧光定量PCR(RT-qPCR)
采用TRIzol 法从细胞中提取总RNA,并通过Nanodrop One 微量UV-Vis 分光光度计(Thermo 美国)检测其纯度和浓度,OD260/280在1.9~2.1的样本按照逆转录试剂盒的说明书逆转录为cDNA,以此为模板进行PCR扩增,采用2-△△CT法计算目的基因相对表达量,以GAPDH为内参,设计引物,见表1。

表1 PCR基因引物序列
1.7 CCK-8法检测细胞增殖能力
将MRC-5 按1×103个/100 μL 密度接种于96 孔板中,每组设5 个复孔,待细胞贴壁完全后,分别加入CM-control及5-8F-CM。分别于24 h、48 h、72 h、96 h、120 h 更换CCK-8工作液(CM-control或5-8FCM∶CCK-8试剂=9∶1),37 ℃避光孵育4 h后通过全波长酶标仪(Thermo 美国)测定450 nm波长处各孔的吸光度(OD)值。
1.8 Western blotting法检测α-SMA、NNMT蛋白表达
提取各组细胞总蛋白,BCA 法检测蛋白浓度,加入4×LDS Sample Loading Buffer,加热使蛋白变性;NuPAGE Bis-Tris电泳分离蛋白,转至PVDF膜,5% BSA 封闭1 h;加入一抗α-SMA、NNMT、GAPDH(均1∶1 000)4 ℃孵育过夜,TBST 洗膜,加入二抗(1∶15 000)室温下避光孵育1.5 h后,TBST洗膜,双色红外成像系统扫描结果。采用Image J 软件分析蛋白条带灰度值。
1.9 统计学方法
采用SPSS 21.0 统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 5-8F诱导MRC-5的形态学观察
MRC-5 形态多呈梭形、多角形、不规则形。经5-8F 细胞CM 诱导(MRC-5+5-8F-CM)和Transwell小室共培养诱导(C-MRC-5)后的MRC-5 生长速度较快,排列较紊乱,见图2。
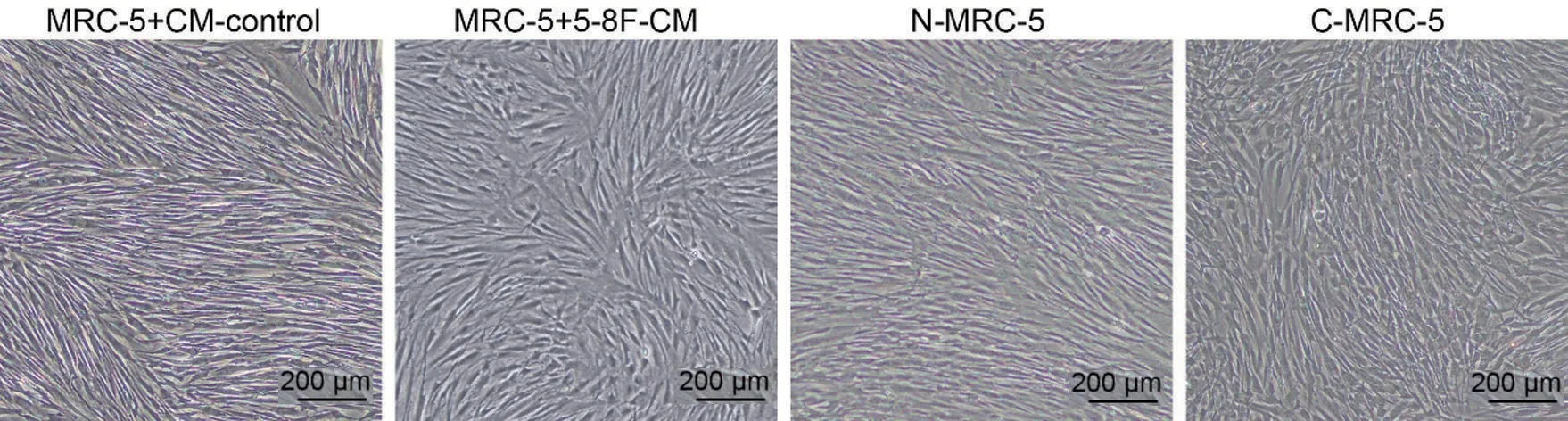
图2 成纤维细胞诱导前、后的形态学特征(×40)
2.2 各组细胞NNMT 及CAFs 相关标志物的基因表达水平比较
两种共培养模式诱导48 h 后进行RT-qPCR 检测,结果显示:两种培养模式的MRC-5 细胞α-SMA、FAP、Vimentin和NNMT表达均升高,且α-SMA和Vimentin在Transwell 小室共培养模式下的表达上升更明显,见表2。
表2 各组细胞α-SMA、FAP、FSP-1、Vimentin和NNMT mRNA相对表达量比较±s,n=3
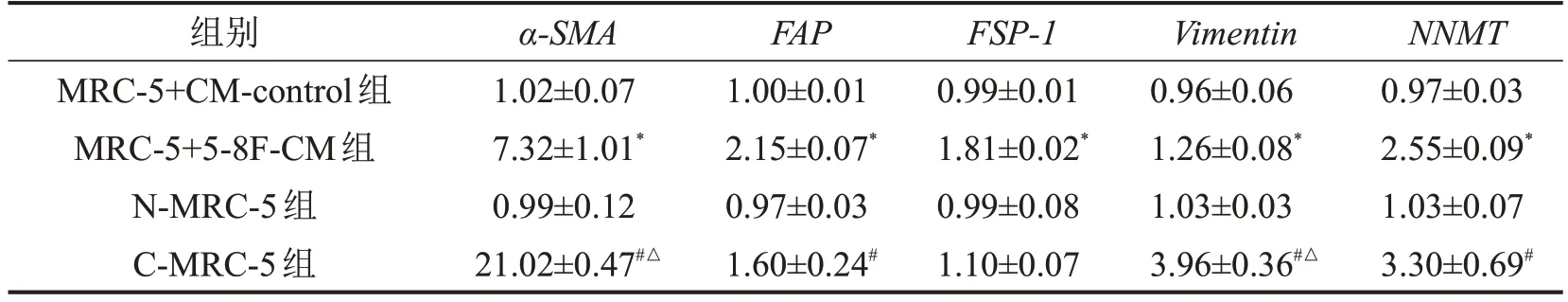
表2 各组细胞α-SMA、FAP、FSP-1、Vimentin和NNMT mRNA相对表达量比较±s,n=3
与MRC-5+CM-control 组比较,*P<0.05;与N-MRC-5 组比较,#P<0.05;与MRC-5+5-8F-CM 组比较,△P<0.001。
2.3 CM 共培养模式下5-8F-CM 对MRC-5 增殖能力的影响
与MRC-5+CM-control 组比较,MRC-5+5-8FCM组MRC-5细胞的增殖能力增强,见图3。

图3 NPC 5-8F 上清液对NPC 相关成纤维细胞增殖能力的影响
2.4 头颈肿瘤来源成纤维细胞的形态学观察
镜下观察两例头颈肿瘤相关CAFs,形态均呈梭形,细胞轮廓结构清晰,核仁较大且明显,见图4。
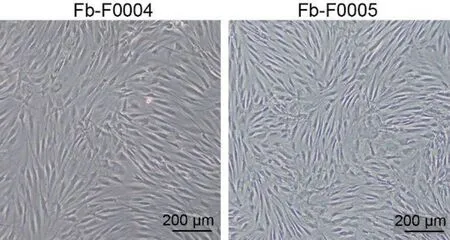
图4 头颈肿瘤来源成纤维细胞的形态学特征(×40)
2.5 CAFs相关标志物表达情况
与5-8F细胞比较,两例头颈肿瘤临床样本来源的CAFs(Fb-F0004 和Fb-F0005)中EPCAM表达量降低,与MRC-5 相似,可排除上皮细胞污染;Fb-F0004中所有CAFs生物标志物表达均高于MRC-5,Fb-F0005 中FAP、FSP-1、Vimentin及IL-6基因表达量高于MRC-5;两株CAFs 中NNMT表达均高于MRC-5,见表3。
表3 各组CAFs中α-SMA、FAP、FSP-1、Vimentin、NNMT、IL-6和EPCAM基因表达量比较±s

表3 各组CAFs中α-SMA、FAP、FSP-1、Vimentin、NNMT、IL-6和EPCAM基因表达量比较±s
与MRC-5组比较,*P<0.05;与5-8F组比较,#P<0.05。
2.6 CAFs中α-SMA和NNMT的蛋白表达水平
与MRC-5比较,NNMT在两株临床样本来源的CAFs 中的表达均上调,而α-SMA 仅在Fb-F0004 中的表达上调,见图5。
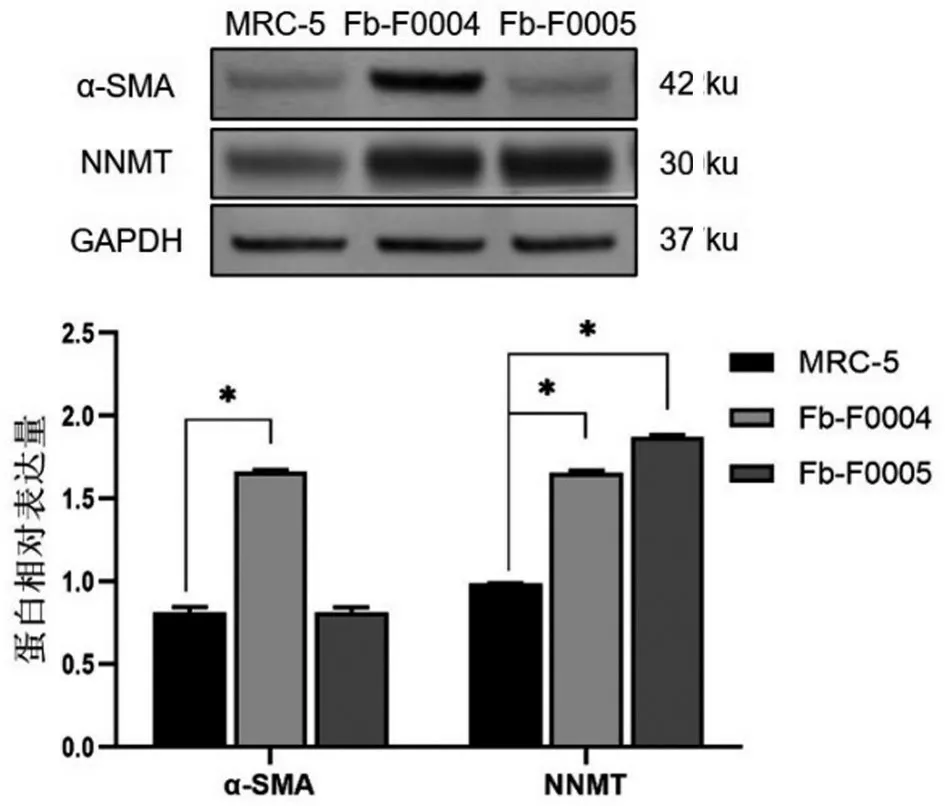
图5 α-SMA和NNMT在头颈肿瘤成纤维细胞和MRC-5中的蛋白表达
3 讨论
CAFs 是TME 中最主要的支持细胞之一,与肿瘤细胞增殖、迁移、侵袭、耐药、抗凋亡与免疫逃逸密切相关[12-14]。NNMT 主要将S-腺苷-甲硫氨酸(Sadenosyl-L-methionine,SAM)的活性甲基转移至烟酰胺(nicotinamide,NA),生成甲基烟酰胺(methyl nicotinamide,MNA)和S-腺苷-同型半胱氨酸(S-adenosyl-L-homocysteine,SAH)[15]。Eckert 等[9]研究表明,NNMT 介导的SAM 缺失和甲基化潜能降低是调节CAFs 分化的关键机制。因此,NNMT参与的细胞代谢与表观遗传调控可能是TME中CAFs重要的代谢途径,促进肿瘤发生、发展。本课题组通过两种体外间接接触共培养诱导MRC-5 向CAFs 转化,结果显示,CAFs 的NNMT 蛋白表达上调,且Transwell小室共培养较CM共培养能更有效地提高CAFs 相关标志物的表达,考虑原因有两方面:(1)相较于CM 共培养,Transwell 小室共培养方式是两种细胞相互影响,更符合体外TME模型;(2)相较于CM 共培养,使用低FBS 培养获得的CM 受细胞数量与状态影响较大,Transwell小室共培养方式使用完全培养基,对细胞生长状态更有利。因此,Transwell小室共培养可能是体外诱导CAFs的良好的共培养模型构建方式之一。
FSP-1 和Vimentin为成纤维细胞标志物,α-SMA 和FAP 为CAFs 标志物;EPCAM 为上 皮细胞标志物,在成纤维细胞中不表达,本研究采用NPC上皮细胞系5-8F作为阳性对照,头颈肿瘤组织来源的CAFs无上皮细胞混杂;IL-6也被认为与CAFs形成相关[7,16-19]。本研究结果显示,2 例头颈肿瘤来源的CAFs 分为两类不同的亚型:一种是肌纤维母细胞(myofibroblastic CAFs,myCAFs),α-SMA 表达较高,IL-6表达较低,可能为上皮细胞间充质转化形成的;另一种是炎症性CAFs(inflammatory CAFs,iCAFs),α-SMA表达较低,IL-6表达较高,通常由肿瘤间质旁分泌诱导产生[20]。因NPC生长部位特殊,局部肿瘤组织较小,其CAFs体外培养尚未成功,本研究从其解剖结构比邻的头颈肿瘤组织(口底癌)中获取了2 例CAFs,其α-SMA表达不一致,但NNMT基因和蛋白均呈高表达,提示NNMT有可能成为更有效的CAFs标记物。
综上所述,本研究通过体外间接接触共培养方式模拟体内TME,诱导CAFs,并从头颈部肿瘤组织分离的CAFs 中均检测到CAFs 相关标志物及NNMT 的表达水平升高,且CAFs 显示出较高的增殖能力,为后续NNMT与CAFs促进肿瘤发生、发展的分子机制研究奠定基础。
