雷帕霉素对糖尿病肾病大鼠足细胞生物学行为及mTOR 信号通路的影响
2022-05-28黄乔木何艳
黄乔木, 何艳
1.咸宁市中心医院/湖北科技学院附属第一医院肾内科,湖北 咸宁437199;2.咸宁市第一人民医院重症医学科,湖北 咸宁437099
糖尿病肾病是糖尿病临床中常见的并发症之一,由长期糖代谢异常、血流动力学改变和糖尿病微血管病变引起,发病率呈逐年上升的趋势,现已成为慢性肾脏病和终末期肾病的主要病因之一[1]。糖尿病肾病的发病机制较复杂,与肾小球高滤过、高灌注、高压力等肾脏局部血流动力学变化有关,同时,随着氧化应激反应、炎症反应和免疫反应等异常激活,晚期糖基化终产物的积累和糖脂代谢异常也会导致糖尿病肾病[2]。随着分子生物学的不断发展,有研究指出,足细胞损伤、自噬、凋亡、坏死等细胞过程介导了糖尿病肾病的疾病进展[3]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是目前公认的调控细胞增殖、凋亡等细胞周期的信号通路,参与多种恶性肿瘤疾病的发生发展[4-5]。研究表明,雷帕霉素作为mTOR 通路的靶向抑制剂,通过抑制mToR通路的活化,在多种疾病中发挥抗炎、抗肿瘤效应[6-7]。然而,目前尚不清楚雷帕霉素是否可以通过调控mTOR 信号通路影响糖尿病肾病大鼠足细胞的生物学行为。本研究通过构建糖尿病肾病大鼠模型,分离足细胞,以雷帕霉素处理细胞,观察模型大鼠足细胞生物学行为的变化情况,以期为临床治疗糖尿病肾病患者提供更多靶向药物。
1 材料与方法
1.1 动物及模型制备
20 只6~8 周龄清洁级SD 大鼠购自武汉大学动物实验中心[SYXK(鄂)2017-0065],体质量为180~220 g,恒温饲养笼环境:温度24 ℃,相对湿度65%,12 h光照/12 h黑暗,并给予充足的饮用水和食物,定期清理饲养笼。适应性喂养7 d 后取其中10 只大鼠采用60 mg·kg−1的链脲霉素一次性腹腔注射构建糖尿病肾病大鼠模型,3 d 后抽取大鼠尾静脉血检测血糖含量,当观察到血糖>16.7 mmol·L−1时认为造模成功。本试验已通过动物伦理委员会审核批准(编号:2019XLLL09S)。
1.2 方法
1.2.1 细胞培养及分组 按照大鼠足细胞原代培养方法[8]取正常饲养的大鼠以及模型大鼠足细胞,将细胞置于含10%胎牛血清和1%青霉素/链霉素混合物的培养基中进行培养,待细胞生长至90%融合时,以胰蛋白酶消化传代,将正常大鼠体内取出的足细胞设为对照组,模型大鼠体内取出的足细胞设为糖尿病肾病模型组(DN 组),以2 mg·kg−1雷帕霉素干预DN 组足细胞,并将其设为雷帕霉素组(RAPA组)。
1.2.2 足细胞形态学观察 取各组足细胞,采用5%戊二醛固定后脱水、干燥后以石蜡包埋,制成切片,于电子透射电镜(日本电子株式会社,型号:JEM-1400)下观察足细胞形态变化情况。
1.2.3 足细胞增殖检测 采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethylthiahiazo-z-y1)-2,5-diphenytetrazoliumromide,MTT]法检测各组足细胞增殖水平,将各组细胞制成5×104个·mL−1单细胞悬液,按照每孔200 μL 接种于96孔板中,培养箱内温度设置为37 ℃恒温,相对湿度65%、5% CO2浓度,分别于24、48、72 h 时滴加30 μL的MTT溶液,37 ℃恒温下再次孵育4 h后弃培养液,每孔加入150 μL 二甲基亚砜溶液,采用酶标仪(山东莱恩德智能科技有限公司,型号:LD-96A)检测波长为490 nm处每孔吸光度值。
1.2.4 足细胞迁移、侵袭检测 采用Transwell 法检测各组足细胞迁移和侵袭水平,将各组足细胞制成5×105个·mL−1细胞悬液,以每孔200 μL 接种于直径为8 μmol·L−1的24 孔板的Transwell 上室中,下室中加入600 μL 的含胎牛血清培养液,37 ℃恒温条件下共同培养24 h 后移除上室细胞,弃Transwell 膜上未穿过的细胞,4%多聚甲醛固定后,以1%结晶紫染色,并在倒置显微镜(广州市莱特光电技术有限公司,型号:LM200)下观察各组足细胞迁移数目。细胞侵袭实验采用50 mg·L−1Matrigel 基质胶稀释后以50 μL 涂抹包被Transwell 小室膜,晾干后再进行后续步骤,均与细胞迁移实验方法一致。
1.2.5 足细胞凋亡检测 采用流式细胞术检测各组足细胞凋亡水平,将上述各组以PBS 冲洗多次后,加入1 mL 不含EDTA 胰酶消化后使细胞悬浮,将细胞置于流式管中,高速离心5 min 后弃上清,采用200 μL 的Binding Buffer 缓冲液重悬细胞,滴加5 μL Annexin V-FITC 溶液,充分混匀后加入5 μL 碘化丙啶染溶液,摇匀后室温下避光孵育15 min,采用流式细胞仪(上海寰熙医疗器械有限公司,型号:FACSVia)检测各组足细胞凋亡水平。
1.2.6 足细胞上皮−间充质转化和mTOR 信号通路检测 采用Western blot 法检测足细胞上皮-间充质转化标志物E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形纤维蛋白(Vimentin)、mTOR 和核糖体S6 激酶1(ribosomal protein S6 kinase 1,S6K1)蛋白的表达水平,首先以BCA 法定量50 mg 足细胞内的总蛋白,在SDS-聚丙烯酰胺凝胶上进行电泳后,转移至聚偏二氟乙烯膜上,5%脱脂奶粉室温下封闭1 h 后与稀释后的E-cadherin、N-cadherin、Vimentin、mTOR、S6K1 和β-actin 一抗4 ℃下孵育过夜,Tris-HCl 缓冲盐溶液洗膜3 次后,加入稀释后的带有荧光标记的山羊抗兔二抗于脱色摇床上孵育1 h,Tris-HCl 缓冲盐溶液再次洗涤3 次后,采用ImageJ 软件扫描各组蛋白条带并进行成像,均以β-actin 作为标准化内参进行半定量分析。
1.3 统计学分析
采用SPSS 20.0统计学软件进行数据处理,采用Graphpad Prism 8软件进行图像绘制,计量资料均以平均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间多重比较采用重复测量方差分析,以P<0.05 为差异具有统计学意义。
2 结果与分析
2.1 各组足细胞形态学变化情况分析
如图1 所示,对照组足细胞形态结构完整,足突清晰可见,肾小球滤过膜结构完整,无明显系膜增生;DN 组足细胞结构大部分受损,足突部分融合,肾小球滤过膜结构被破坏,系膜出现明显增生,管腔结构受损,并伴有局灶节段性硬化;RAPA 组足细胞结构受损程度有所改善,足突融合程度有所改善,肾小球滤过率膜结构基本完整,系膜增生较DN 组显著改善。结果表明雷帕霉素可有效保护糖尿病肾病大鼠足细胞的形态结构。

图1 各组足细胞形态学变化Fig.1 Morphological changes of podocytes in each group
2.2 各组足细胞增殖水平比较
如图2 所示,与对照组相比,DN 组细胞增殖水平被明显抑制(P<0.01);与DN 组相比,RAPA组细胞增殖水平明显升高(P<0.05)。结果表明雷帕霉素可显著诱导糖尿病肾病大鼠足细胞体外增殖。
2.3 各组足细胞迁移、侵袭水平比较
如图3 所示,与对照组相比,DN 组细胞迁移、侵袭水平显著升高(P<0.001);与DN 组相比,RAPA 组细胞迁移、侵袭水平显著降低(P<0.001)。结果表明雷帕霉素可显著抑制糖尿病肾病大鼠足细胞迁移和侵袭能力。
2.4 各组足细胞上皮-间充质转化水平比较
如图4 所示,与对照组相比,DN 组上皮-间充转标志物E-cadherin 表达显著下调,N-cadherin 和Vimentin 表达显著上调(P<0.001);与DN 组相比,RAPA 组E-cadherin 表达显著上调,N-cadherin 和Vimentin 表达显著下调(P<0.001)。结果表明经雷帕霉素处理后糖尿病肾病大鼠足细胞上皮-间充质转化能力被显著抑制。
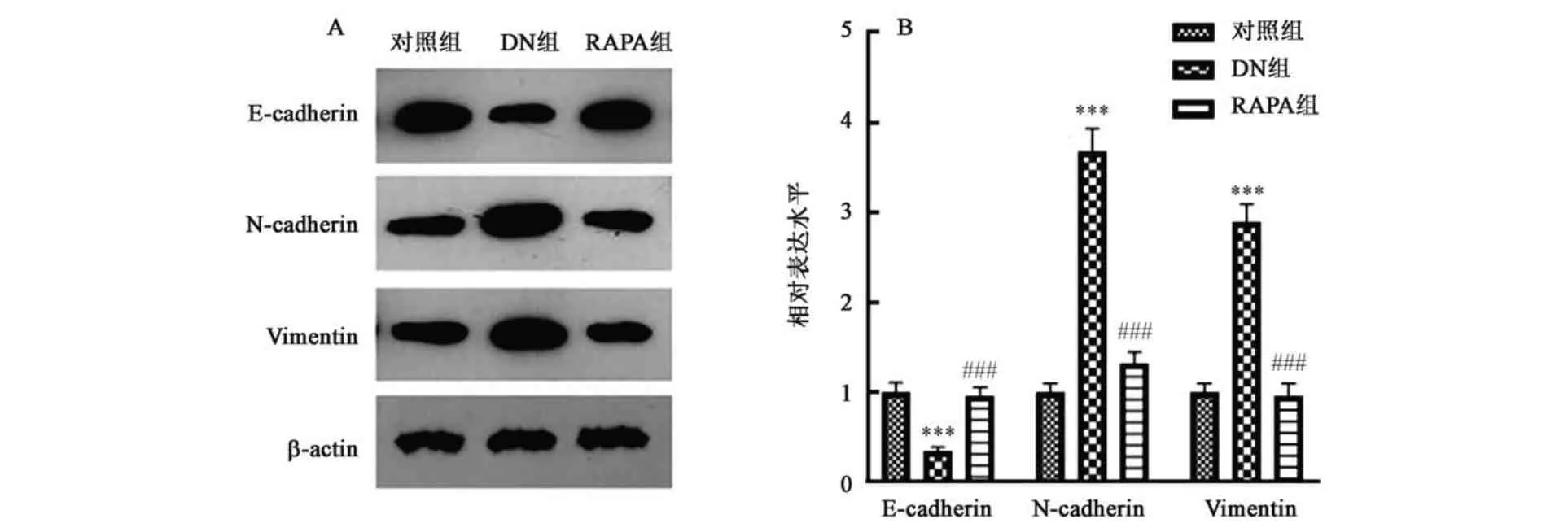
图4 各组足细胞上皮-间充质转化水平差异Fig.4 Comparison of podocyte epithelial-mesenchymal transition in each group
2.5 各组足细胞凋亡水平差异
如图5 所示,与对照组相比,DN 组细胞凋亡率显著增加(P<0.001);与DN 组相比,经雷帕霉素处理后的RAPA 组细胞凋亡率显著减少(P<0.001)。结果表明雷帕霉素可显著减少糖尿病肾病大鼠足细胞体外凋亡水平,发挥保护足细胞的作用。

图5 各组足细胞凋亡水平比较Fig.5 Comparison of podocyte apoptosis in each group
2.6 各组足细胞内mTOR信号通路表达比较
如图6 所示,与对照组相比,DN 组mTOR/S6K1 信号通路被显著活化(P<0.001);与DN 组相比,RAPA 组mTOR 和S6K1 的蛋白表达被显著抑制(P<0.01)。结果表明雷帕霉素对于mTOR/S6K1信号通路有较好的调控作用,通过活化该通路能够影响糖尿病肾病大鼠足细胞生物学行为。

图6 各组足细胞内mTOR信号通路表达比较Fig.6 Comparison of mTOR signaling pathway in podocytes of each group
3 讨论
糖尿病肾病作为糖尿病慢性微血管并发症之一,主要由膜细胞增生、细胞外基质增多、肾小球基底膜增厚和硬化引发患者肾功能障碍,最终导致慢性肾衰竭和终末期肾病[9],严重威胁患者的生命安全。糖尿病肾病的发病机制较为复杂,糖代谢机制紊乱、血流动力学异常、遗传易感因素和多种基因表达的失衡均会导致糖尿病肾病的发病风险增加[10]。研究表明,当肾脏中存在大量复合物沉积时,足细胞受到损伤,表面负电荷发生变化,引起肾小球损伤,并进一步进展为糖尿病肾病[11],因此,探究糖尿病肾病足细胞生物学行为及其变化对明确糖尿病肾病的发病机制和制定有效的治疗策略十分关键。本研究基于mTOR 信号通路探究足细胞生物学行为,采用mTOR 通路靶向抑制剂雷帕霉素处理糖尿病肾病大鼠足细胞,发现雷帕霉素对模型大鼠足细胞有较好的保护作用。
雷帕霉素是进化保守的蛋白激酶家族成员之一,也是现阶段临床常用的器官移植后抗排异的有效药物[12],可与其靶蛋白mTOR 分子特异性结合,靶向抑制mTOR 的表达,影响细胞内蛋白质翻译、核糖体合成,进而调控细胞增殖、迁移、侵袭、凋亡、自噬等细胞周期[13]。Gao 等[14]研究发现,雷帕霉素通过抑制mTOR 信号通路和内质网应激反应,进而抑制心肌梗死后大鼠H9c2 心肌细胞凋亡,诱导细胞自噬,抑制心脏重塑,改善心功能。Liu等[15]也发现,雷帕霉素可与mTOR 激酶特异性结合,抑制mTOR 通路的活性,调节糖尿病肾病大鼠肾组织细胞病理自噬过程,发挥改善蛋白尿和肾功能的作用。本研究通过链脲霉素腹腔注射构建糖尿病肾病大鼠模型,取出足细胞后以雷帕霉素进行干预,发现雷帕霉素可显著诱导足细胞体外增殖,抑制细胞迁移、侵袭、上皮-间充质转化和凋亡,发挥肾小球足细胞保护作用,其机制是通过调控mTOR 信号通路影响细胞生物学行为实现的。
mTOR 蛋白作为重要的丝氨酸/苏氨酸激酶,是细胞内多种信号通路的下游靶点,可调控下游S6K1、翻译起始因子4E 结合蛋白1 等基因,影响机体氧化应激反应、内质网应激反应以及炎症反应等过程[16],调节细胞生长因子水平和细胞周期进展,参与介导多种疾病的发生发展[17]。S6K1作为mTOR 的重要下游底物之一,可受磷酸化的mTOR分子活化,提高细胞内RNA的翻译、转录能力,促进细胞内多种mRNA 的合成,影响细胞增殖、迁移、侵袭、凋亡和上皮-间充质转化等细胞周期[18]。本研究结果表明,mTOR/S6K1 通路在链脲霉素诱导的糖尿病肾病大鼠足细胞内被显著激活,经雷帕霉素处理后,mTOR 和S6K1 的表达显著下调,发挥保护模型大鼠足细胞的作用。雷帕霉素通过竞争性结合FK-结合蛋白12,并与其形成RPM/FKBP12 复合物,使mTOR 通路失活,阻断mTOR/S6K1 通 路 的 信 号 转 导[19],影 响 细 胞 内mRNA 翻译启动,抑制足细胞迁移、侵袭和上皮间充质转化,避免足细胞功能结构损伤[20],促进细胞增殖,抑制细胞凋亡,延缓糖尿病肾病蛋白尿的发生,从而发挥保护足细胞的作用。
综上所述,雷帕霉素可显著促进糖尿病肾病大鼠足细胞的体外增殖,抑制细胞迁移、侵袭、上皮-间充质转化和凋亡,其调控机制为雷帕霉素可靶向抑制mTOR,下调足细胞内mTOR 和S6K1 的蛋白表达,发挥保护足细胞的作用。本研究结果为临床治疗糖尿病肾病提供了新的分子靶点和生物标志物,值得临床参考借鉴。
