人参皂苷Rg1 对阿尔茨海默症大鼠BDNF-TrkB 信号通路的影响
2022-05-28陈晓光潘晓峰王帆潘宋斌
陈晓光, 潘晓峰, 王帆, 潘宋斌*
1.武汉市第一医院(武汉市中西医结合医院)神经内科,武汉430022;2.武汉市第一医院(武汉市中西医结合医院)老年病科,武汉430022
阿尔茨海默症(Alzheimer's disease,AD)是老年人群中的常见疾病,又称老年痴呆,临床表现为记忆能力减退并伴随反应迟钝、理解能力下降等[1]。目前,AD 的发病机制尚未完全明确,临床仍缺乏疗效确切的治疗方法及药物。人参皂苷Rg1 是人参的有效成分,具有保护神经功能、抗衰老等作用,其也是AD 领域研究最多、最具代表性的成分之一[2-3]。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是中枢神经系统中的神经营养因子,可与酪氨酸激酶受体B(tyrosine kinase receptor B,TrkB)结合,调控神经元的生长、分化及突触的形成等过程[4]。近年来,多项研究表明,激活BDNF-TrkB 信号通路将有助于改善AD[5-6]。但目前关于Rg1改善AD的分子机制尚未统一,本研究旨在从BDNF-TrkB 信号通路的角度,分析人参皂苷Rg1对AD大鼠模型的保护机制,以期为人参皂苷Rg1用于治疗AD奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 试验动物 选取75 只雄性SPF 级6 周龄SD 大鼠作为研究对象,平均体质量为250±30 g,均购自西安交通大学医学部动物实验中心,许可证号:SYXK(陕)2018-001。本试验经动物伦理委员会审核批准且严格遵循动物试验减少(reduction)、优化(refinement)和替代(replacement)-3R原则。
1.1.2 药物与试剂 Aβ1-42 试剂购自美国SIGMA 公司;人参皂苷Rg1(货号:GD-GSJ125-585;纯度>98%)购自逊希公司;乙酰胆碱(acetylcholine,Ach)试 剂 盒、5-羟 色 胺(5-hydroxytryptamine,5-HT)试剂盒、乙酰胆碱酯酶(total cholinesterase,TChE)试剂盒均购自江莱生物有限公司;TUNEL染色试剂盒购自瑞士Roche 公司;切割后半胱氨酸蛋白酶-3(Cleaved Caspase-3)抗体(货号:sc-9661)、B 淋巴细胞瘤-2 抗体(B lymphocytoma-2,Bcl-2,货号:sc-15071)、Bcl-2 相关蛋白X 抗体(Bcl-2 associated protein X,Bax,货号:sc-5023),脑源性神经营养因子(brain-derived neurotrophic factor,BDNF,抗体货号:sc-65514)、酪氨酸激酶B抗 体(tyrosine kinase receptor B,TrkB,货 号:sc-8058)购自美国Santa Cruz 公司;HRP 羊抗兔IgG、HRP羊抗鼠IgG等二抗购自美国Thermo公司。
1.1.3 仪器 SMZ800 光学显微镜购自日本Nikon 公司;离心机购自德国Eppendorf 公司;垂直电泳槽、电泳仪及相关配件均购自美国Bio-Rad 公司。
1.2 方法
1.2.1 分组 75 只雄性SD 大鼠采用随机数字表法分为空白对照组、模型组、低剂量Rg1 组、中剂量Rg1组及高剂量Rg1组,每组15只。
1.2.2 脑片制作、模型建立[7]及给药处理 使用150 mmol·L−1NaCl,2 mmol·L−1CaCl2,1.2 mmol·L−1MgSO4,0.5 mmol·L−1KH2PO4配制人工脑脊液,另配制加入1 mmol·L−1Aβ1-42 试剂作为人工脑脊液诱导AD 模型,0 ℃保存备用。活体大鼠处死后立即取大脑切成厚度为400 μm的切片,挑选形态较好(含有海马和皮层组织)的脑片放入人工脑脊液中,培养温度32 ℃左右,氧气含量为95%,二氧化碳含量为5%。除空白对照组外各组加入含有Aβ1-42 试剂的人工脑脊液制备AD 模型,作用2 h后,低剂量Rg1 组、中剂量Rg1 组及高剂量Rg1 组分别加入60、120、240 μmol·L−1Rg1处理3 h,空白对照组和模型组加入等量0.9% NaCl 溶液,上述过程均在32 ℃、95%氧气、5%二氧化氮培养条件下进行。
1.2.3 HE染色 干预结束后取各组脑片,转移至4%多聚甲醛溶液中固定3 h,再放至30%蔗糖溶液中浸糖至沉底,制备组织冰冻切片,常规HE 染色,光镜下观察大鼠脑组织病理形态变化。
1.2.4 TUNEL 染色 干预结束后取各组脑片,参照上述方法制备组织冰冻切片,滴加3%过氧化氢溶液灭活内源性辣根过氧化物酶10 min,再加入蛋白酶K 37 ℃下消化15 min,加20 μL 标记缓冲液,再分别加入末端脱氧核苷酰转移酶(terminal deoxynucleotidyl transferase,TdT)和荧光素标记的三磷酸脱氧尿甘(2'-deoxyuridine 5'-triphosphated,UTP)溶液各1 μL,37 ℃下反应2 h,然后加50 μL 封闭液,室温下静置30 min,滴加50 μL抗光抗体,室温下孵育40 min,再加入抗体稀释液1∶100 倍稀释的链霉亲和素-生物复合物(streptavidin-biotin complex,SABC),37 ℃下反应1 h,二氨基联苯胺(3,3′-diaminobenzidine,DAB)显色后,苏木素复染,光镜下观察大鼠脑组织细胞凋亡情况,黄褐色为凋亡细胞阳性染色。
1.2.5 Ach、5-HT含量和TChE 活力检测 取上述脑片,采用相关试剂盒检测大鼠脑组织Ach、5-HT含量和TChE 活力,检测方法严格按照试剂盒说明书进行。
1.2.6 蛋白质印迹检测蛋白表达水平 取上述脑片,提取总蛋白进行聚丙烯酰胺凝胶电泳,并将蛋白转移至聚偏二氟乙烯(polyvinylidene fluorids,PVDF)上,加入脱脂奶粉,在37 ℃的条件下封闭2 h,后加入稀释后的Cleaved Caspase-3、Bcl-2、Bax、BDNF及TrkB蛋白抗体(稀释比例为1∶1 500),内参蛋白为GAPDH(稀释比例1∶1 000),4 ℃下孵育过夜,次日洗膜后加入HRP 羊抗兔IgG、HRP 羊抗鼠IgG 二抗(稀释比例1∶5 000),采用显色液显色后进行灰度值检测。蛋白相对表达量计算公式见式(1)。
蛋白相对表达量=目的蛋白灰度值/GADPH灰度值 (1)
1.3 统计分析
采用SPSS 22.0 软件进行数据分析,采用GraphPad Prism5 进行绘图,多组间比较使用单因素方差分析,组间两两比较采用LSD 法,以P<0.05表示差异有统计学意义。
2 结果与分析
2.1 大鼠脑片HE染色结果
如图1 所示,HE 染色观察大鼠脑组织病理形态变化,空白对照组未见异常,海马神经元细胞结构完整;模型组海马CA1 区细胞排列松散,损伤明显;低剂量Rg1 组、中剂量Rg1 组及高剂量Rg1组脑组织病理损伤较模型组症状明显减轻。

图1 大鼠脑片HE染色结果Fig.1 HE staining results of brain slices in rats
2.2 大鼠脑片TUNEL染色结果
如图2 所示,TUNEL 染色观察大鼠海马CA1区细胞凋亡情况,空白对照组、模型组、低剂量Rg1 组、中剂量Rg1 组及高剂量Rg1 组脑组织细胞 凋 亡 数 分 别 为(7.21±2.15)、(58.27±11.24)、(42.31±8.56)、(29.64±6.34)、(15.68±3.32)个。与空白对照组比较,模型组脑组织细胞凋亡数显著增加(P<0.05);与模型组比较,低剂量Rg1 组、中剂量Rg1 组及高剂量Rg1 组脑组织细胞凋亡数显著减少(P<0.05),且具有剂量依赖性。
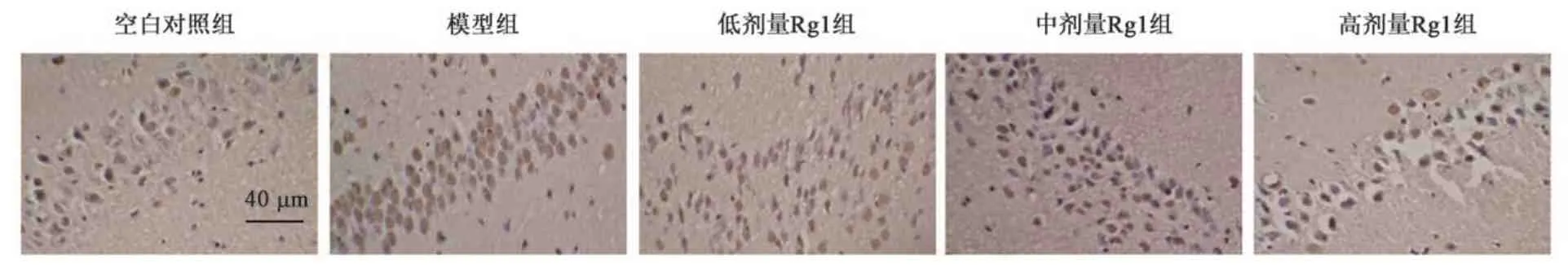
图2 大鼠脑片TUNEL染色结果Fig.2 TUNEL staining results of brain slices in rats
2.3 大鼠脑片中凋亡相关蛋白检测结果
检测大鼠脑片中凋亡相关蛋白发现,与空白对照组相比,模型组大鼠Cleaved Caspase-3/GAPDH和Bax/Bcl-2水平显著升高(P<0.05);与模型组相比,低剂量Rg1 组、中剂量Rg1 组及高剂量Rg1组Cleaved Caspase-3/GAPDH 和Bax/Bcl-2 水平显著降低(P<0.05),且具有剂量依赖性(图3、表1)。

表1 大鼠脑片中凋亡相关蛋白检测结果Table 1 Detection results of apoptosis-related proteins in brain slices of rats
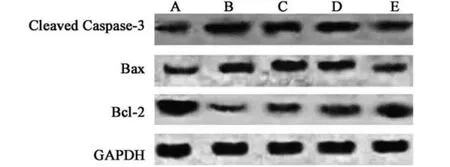
图3 大鼠脑片中凋亡相关蛋白检测结果Fig.3 Detection results of apoptosis related proteins in rat brain slices
2.4 大鼠脑片中5-HT、Ach 含量和TChE 活力检测结果
检测大鼠脑片中5-HT、Ach含量和TChE水平发现,与空白对照组相比,模型组大鼠5-HT 和Ach水平显著降低,TChE水平显著升高(P<0.05);与模型组相比,低剂量Rg1 组、中剂量Rg1 组及高剂量Rg1组5-HT和Ach水平均显著升高,TChE水平 均 显 著 降 低(P<0.05),且 具 有 剂 量 依 赖性(表2)。

表2 大鼠脑片中5-HT、Ach含量和TChE活力检测结果(x±s)Table 2 Detection results of 5-HT,Ach levels and TChE activity in brain slices of rats(x±s)
2.5 大鼠脑片中BDNF-TrkB 信号通路相关蛋白检测结果
检测大鼠脑片中BDNF-TrkB 信号通路相关蛋白发现,与空白对照组相比,模型组BDNF 和TrkB 蛋白表达量均显著降低(P<0.05);与模型组相比,低剂量Rg1 组、中剂量Rg1 组及高剂量Rg1 组BDNF 和TrkB 蛋白表达量均显著升高(P<0.05),且具有剂量依赖性(图4、表3)。

图4 大鼠脑片中BDNF-TrkB信号通路相关蛋白检测结果Fig.4 Detection results of BDNF-TrkB signal pathway related proteins in rat brain slices

表3 大鼠脑片中BDNF-TrkB信号通路相关蛋白检测结果(x±s)Table 3 Detection results of BDNF-TrkB signaling path ways related proteins in brain slices of rats(x±s)
3 讨论
AD 的主要病理特征为多种因素诱导神经细胞凋亡[8]。细胞凋亡可引起AD 脑内皮质皱缩,基底前脑胆碱能神经元的减少及海马胆碱能纤维和突触的丢失,会导致记忆认知障碍[9]。本研究病理观察显示,采用Aβ1-42 培育后,大鼠脑组织损伤明显,且存在大量的凋亡细胞,促凋亡蛋白Cleaved Caspase-3 表达明显升高,Bax/Bcl-2 平衡也偏向促凋亡(Bax)水平,经不同剂量人参皂苷Rg1 处理后,脑组织损伤表现出不同程度的减轻,凋亡细胞也明显减少,Cleaved Caspase-3 和Bax/Bcl-2 水平明显降低,表明人参皂苷Rg1 可抑制脑组织细胞凋亡,从而发挥保护AD 的作用。许彤等[10]研究也显示,人参皂苷Rg1 可抑制过氧化氢诱导的海马神经元凋亡。
Ach 是与学习和记忆密切相关的神经递质,主要由突触前膜释放,与突触后膜上乙酰胆碱受体结合开放离子通道,引起神经元兴奋的传递[11]。胆碱被激活后可以易化由齿状回成熟神经元形成的长时程增强效应[12]。5-HT 也是中枢神经系统的重要神经递质,主要参与学习与记忆[13]。TChE是生物神经传导中的一种关键性酶,其可以降解乙酰胆碱终止神经递质对突触后膜的兴奋,保持神经间信号正常传递[14]。本研究发现,与模型组相比,使用人参皂苷Rg1 各组5-HT、Ach水平显著升高,TChE水平显著降低。表明人参皂苷Rg1 可以有效改善神经元功能。Liu 等[15]研究表明,人参皂苷Rg1 可以有效改善神经元Ach、5-HT的表达情况,与本研究结果一致。
目前关于Rg1改善AD的分子机制研究较多,据报道,Rg1可通过MAPK/ERK、PI3K/Akt和PKA/CREB 等信号通路改善AD 症状[16],说明Rg1 对人体的作用可能是多途径、多方式和多靶点的。BDNF 是一种神经营养因子,主要在中枢神经系统中表达,具有神经保护功能[17]。据报道,提高海马体内的BDNF 水平,可以有效促进新突触形成并显著提高学习和记忆能力[18]。TrkB是BDNF 的特异性受体,BDNF可以与细胞膜上的TrkB结合,激活细胞内BDNF-TrkB 信号通路,通过调节钙离子对神经的生长和发育发挥促进作用,同时TrkB可以参与调节谷氨酸和γ-氨基丁酸突触后神经递质受体的数量和分布,从而调节突触可塑性,显著改善学习和记忆能力[19-20]。本研究发现,人参皂苷Rg1 处理后可有效逆转AD 导致的BDNF 和TrkB蛋白表达降低。说明人参皂苷Rg1可以通过激活BDNF-TrkB 信号通路,调节神经递质受体的数量和分布,改善神经受损后突触可塑性,加快大鼠神经功能的恢复。
综上所述,人参皂苷Rg1可有效保护AD模型大鼠脑组织损伤,抑制神经细胞凋亡,其作用机制可能与激活BDNF-TrkB信号通路相关。
