中老年非糖尿病人群中预估人体脂肪质量及比例与胰岛素抵抗的关系研究
2022-05-28阮海燕李丽英郑翼陈晓平何森
阮海燕,李丽英,郑翼,陈晓平,何森*
本研究行业价值:
国外学者根据NHANES 1999—2006人群构建了基于年龄、身高、腰围、体质量等简易计算指标预估人体脂肪质量(pFM)及预估人体脂肪比例(pFP),现已有国外学者研究发现,在欧美人群中pFM、pFP可较好地预测糖尿病及心血管事件发生。因中国人群与欧美人群脂肪分布存在差异,在中国人群中,pFM和pFP是否可较好预测胰岛素抵抗(IR)的相关研究较少。本研究探讨了在成都地区中老年非糖尿病自然人群中pFM及pFP与IR的相关性,研究结果提示pFM和pFP与IR独立相关,对于IR具有较好的预测价值。
胰岛素抵抗(insulin resistance,IR)是指胰岛素的相关靶组织和器官(如肝脏、骨骼肌、脂肪组织和下丘脑等)对内源性或外源性的胰岛素利用效率降低,以致正常水平的胰岛素不能发挥相应的生物学效应,是机体对胰岛素生物反应性降低甚至丧失而产生的一系列病理生理变化[1-3]。越来越多的研究发现,IR是代谢综合征、2型糖尿病、高血压、动脉粥样硬化、多囊卵巢综合征、脂肪肝及抑郁等多种疾病的共同病理基础[3-6];因此识别IR具有重要的临床价值。既往众多研究提示人体脂肪的过度增加与IR密切相关[2,5,7-9];临床实践中,测定人体脂肪的金标准通常采用双能X线吸收测量法[10],但其经济卫生学成本较高。
近期,国外学者根据NHANES 1999—2006人群构建了简易计算指标:预估人体脂肪质量(predicted fat mass,pFM)及预估人体脂肪比例(predicted fat percent,pFP)[11]。上述指标构建后,已有研究提示在欧美人群中pFM及pFP可较好地预测糖尿病及心血管事件的发生[12-14]。但是,目前研究提示中国人群和欧美人群pFP具有较大差异,因此,上述指标在中国人群的应用价值需要进一步探讨。如前所述,脂肪异常与IR密切相关,而pFM及pFP在中国人群中是否能预测IR,目前相关研究较少。因此,本研究探讨成都地区中老年非糖尿病自然人群中pFM及pFP与IR的关系,以期为IR的预测提供有效的指标。
1 对象与方法
1.1 研究对象 本研究为“中国代谢综合征发病趋势和综合控制研究”(“十一五”科技支撑项目)的一部分(中国四川省成都市队列)。于2007年5月,在四川省成都市成华区采用随机整群抽样方法抽取中老年自然人群共711例,排除已诊断为糖尿病者141例,最终纳入570例非糖尿病人群。
本研究系中华人民共和国卫生部和中华人民共和国科学技术部重点支持的国家“十一五”科技支撑项目,由卫生部心血管病防治研究中心、中国医学科学院阜外医院牵头负责,联合了国内50余家心血管疾病医疗和防治机构共同参与。该项目经中华人民共和国卫生部及中国医学科学院阜外医院伦理学委员会批准,四川大学华西医院为参与该项目的分中心,研究对象均对本研究知情同意。
1.2 数据收集 由经培训的医务人员对抽样人群进行调查研究,调查内容主要包括标准化的问卷调查、体格检查和实验室检查。问卷调查内容包括一般人口学资料,如性别、年龄、高血压病史及糖尿病病史等;体格检查包括血压、心率、身高、体质量、腰围及臀围等;实验室检查包括空腹血清总胆固醇、三酰甘油、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖、尿酸、空腹胰岛素等。研究人群的其他相关信息可参考已发表文献[5,15-16]。
1.3 相关定义 IR采用稳态模型评估的胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)进行评估:HOMA-IR=空腹胰岛素(mU/ml)×空腹血糖(mmol/L)/22.5;根据既往研究[6,17],IR定义为HOMA-IR的最高1/5位(本研究中即≥1.66)。
此外,根据原始研究中的定义[11],pFM及pFP的计算公式如下。
pFM计算公式为,男性:pFM=-18.592-0.009×年龄(岁)-0.080×身高(cm)+0.226×体质量(kg)+0.387× 腰 围(cm)+0.080× 墨 西 哥 -0.188× 西班牙-0.483×黑人+1.050×其他种族;女性:pFM=11.817+0.041× 年 龄( 岁)-0.199× 身 高(cm+0.610×体质量(kg)+0.044×腰围(cm)+0.388×墨西哥+0.073×西班牙-1.187×黑人+0.325×其他种族。
pFP计算公式为,男性:pFP=0.02+0.00×年龄(岁)-0.07×身高(cm)-0.08×体质量(kg)+0.48×腰围(cm)+0.32× 墨 西 哥 +0.02× 西 班 牙 -0.65× 黑人+1.12×其他种族;女性:pFP=50.46+0.07×年龄(岁)-0.26×身高(cm)+0.27×体质量(kg)+0.10×腰围(cm)+0.89×墨西哥+0.49×西班牙-1.57×黑人+0.43×其他种族(注:以上方程式以白人为参考,其他种族变量选择为是=1,否=0)。
本研究中其他指标的相关定义:体质指数(body mass index,BMI)=体质量(kg)/身高(m)2。身体形态指数(a new body shape index,ABSI)=腰围/(BMI2/3×身高1/2)( 其 中 腰 围 和 身 高 单 位 为 m)[15,18]。腰高比(waist to height ratio,WHtR)=腰围(cm)/身高(cm)。糖尿病诊断标准参照中华医学会糖尿病学分会2020年制定的《中国2型糖尿病防治指南(2020版)》[19]:有糖尿病病史或空腹血糖≥7.0 mmol/L;满足上述标准即诊断为糖尿病,由于临床实践操作性,本研究未进行口服葡萄糖耐量试验(OGTT)检查。高血压诊断标准参考《中国高血压防治指南(2018年修订版)》[20]:收缩压≥ 140 mm Hg(1 mm Hg=0.133 kPa)和/或舒张压≥90 mm Hg或正在服用降压药物。
1.4 统计学方法 采用R软件(版本4.1.0)进行统计分析,符合正态分布的计量资料以(±s)表示,非正态分布的计量资料以M(P25,P75)表示,计数资料以相对数表示,趋势性分析分别采用Spearman检验和Mantel-Haenszel检验;采用单因素及多因素Logistic回归分析探究各个变量与IR之间的关系;并使用受试者工作特征(receiver operating characteristic,ROC)曲线评估各个变量对IR的区分能力。以P<0.05为差异有统计学意义。
2 结果
2.1 人口学资料 570例研究对象中,男320例(56.14%),女250例(43.86%);年龄44~83岁,中位年龄62.0(58.0,67.0)岁;身高141.0~182.0 cm,中位身高162.0(156.0,168.0)cm;体质量36.0~92.0 kg,平均体质量(62.0±10.1)kg;腰围58.0~116.0 cm,平均腰围(82.0±9.6)cm;pFM 2.34~41.41 kg,平均pFM(18.59±6.47)kg;pFP 13.95%~48.46%,中位 pFP 28.97(23.77,37.39)%;HOMA-IR 0.01~5.50, 中 位HOMA-IR 1.05(0.72,1.53);其他人口学资料详见表1。
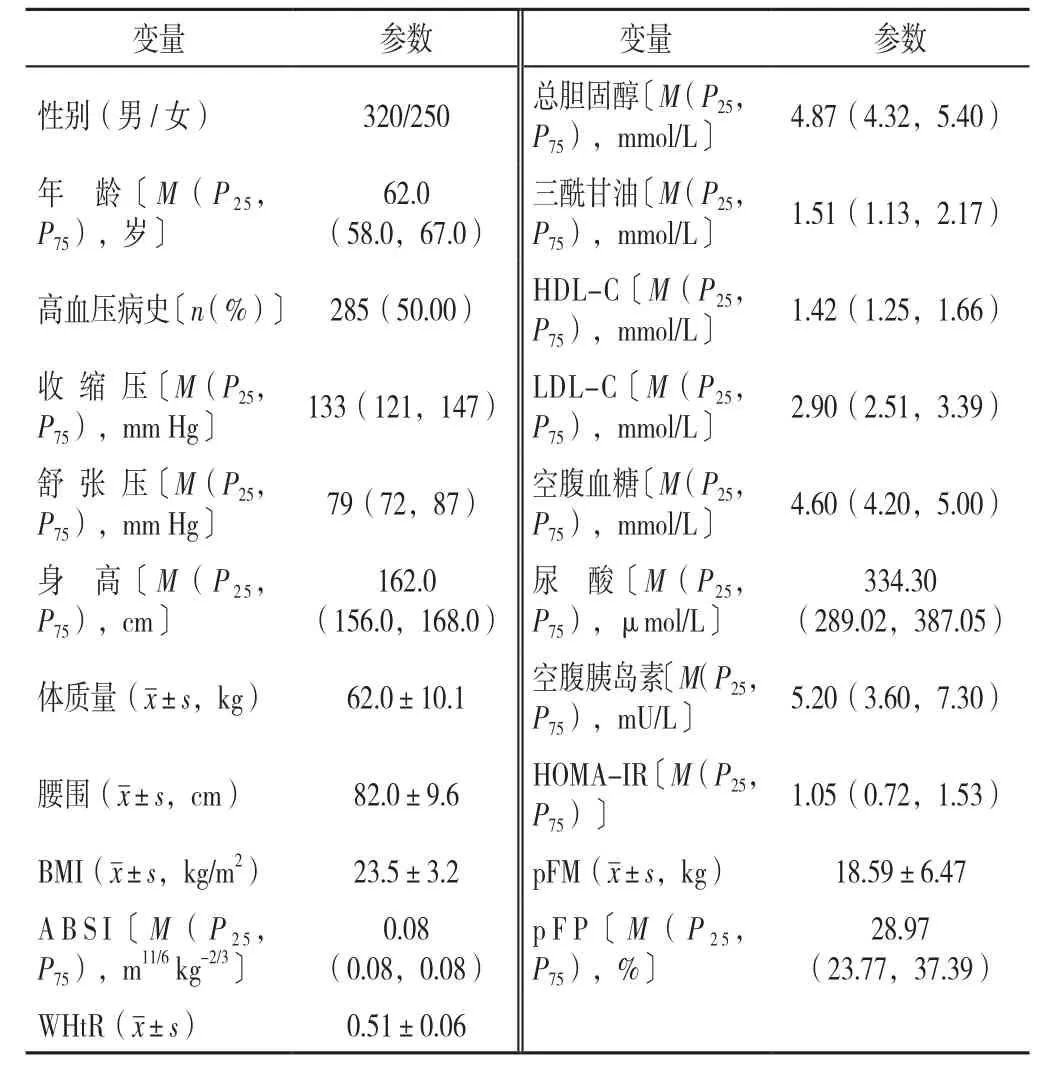
表1 研究对象的人口学资料(n=570)Table 1 Demographic,anthropometric and metabolic parameters of a middle-aged and elderly non-diabetic population of Chengdu
2.2 pFM及pFP与HOMA-IR及IR的关系 本研究中共115例研究对象发生IR。将研究人群按照pFM的切点(10、20 kg及30 kg)进行分组,分别为[2.34,10.00)组48例、[10.00,20.00)组295例、[20.00,30.00)组207例、[30,41.41)组20例,随着pFM的增加,HOMA-IR和IR患病率逐渐增加(P<0.05),见表2。
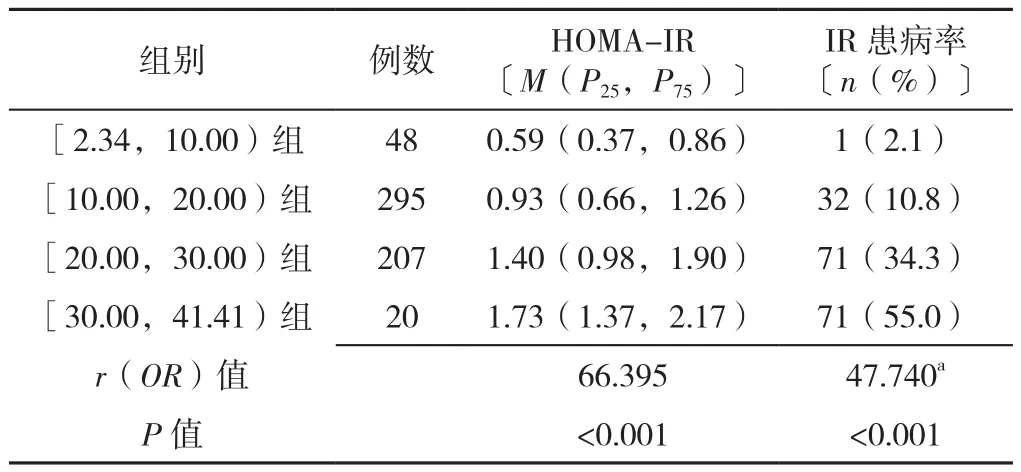
表2 不同水平的pFM组HOMA-IR和IR患病率比较Table 2 Comparison of HOMA-IR and insulin resistance in a middle-aged and elderly non-diabetic population of Chengdu by predicted body fat mass
将研究人群按照pFP的切点(20%、30%及40%)进行分组,分别为[13.95,20.00)组41例、[20.00,30.00)组258例、[30.00,40.00)组210例、[40.00,48.46)组61例,随着pFM的增加,HOMA-IR和IR患病率逐渐增加(P<0.05),见表3。

表3 不同水平的pFP组HOMA-IR和IR患病率比较Table 3 Comparison of HOMA-IR and insulin resistance in a middleaged and elderly non-diabetic population of Chengdu by predicted body fat percentage
2.3 单因素及多因素Logistic回归分析 以是否发生IR为因变量(赋值:是=1,否=0),以性别(赋值:男=1,女=2)、年龄、高血压病史(赋值:有=1,无=2)、收缩压、舒张压、身高、体质量、腰围、BMI、ABSI、WHtR、总胆固醇、三酰甘油、HDL-C、LDL-C、空腹血糖、尿酸、pFM、pFP(其他变量为连续变量)为自变量进行单因素Logistic回归分析,结果显示,性别、高血压病史、收缩压、舒张压、体质量、腰围、BMI、ABSI、WHtR、三酰甘油、HDL-C、空腹血糖、尿酸、pFM和pFP是非糖尿病人群发生IR的影响因素(P<0.05),见表4。

表4 非糖尿病人群发生IR的单因素Logistic回归分析Table 4 Univariate Logistic regression analysis of the performance of different variables for identifying insulin resistance in a middle-aged and elderly non-diabetic population of Chengdu
根据pFM及pFP的计算公式,年龄、身高、体质量及腰围系计算公式的组分,为避免过度校准,在多因素Logistic回归分析时未纳入以上指标,在校正相关混杂因素后(包括高血压病史、收缩压、舒张压、尿酸、三酰甘油及HDL-C等),分别以pFM、pFP为自变量进行多因素Logistic回归分析,结果显示,pFM和pFP是非糖尿病人群发生IR的影响因素(P<0.05),见表5、6。
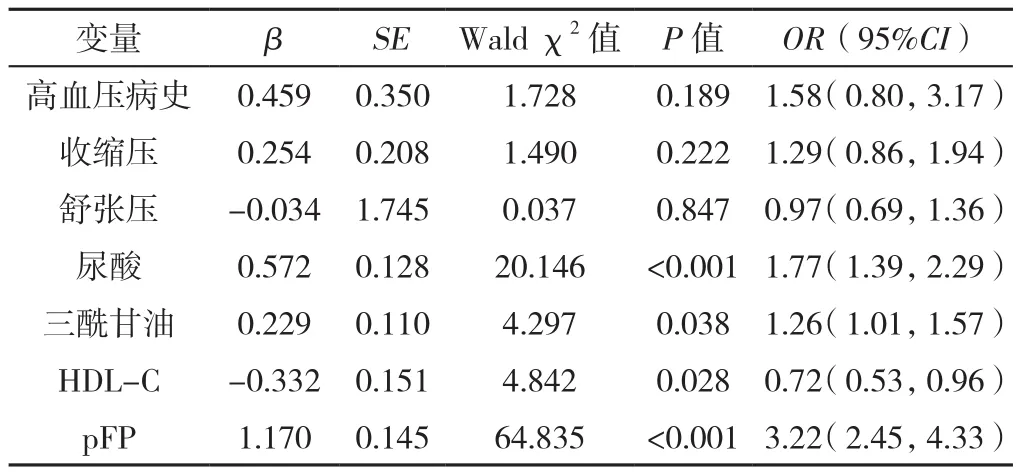
表5 pFM对非糖尿病人群发生IR影响的多因素Logistic回归分析Table 5 Multivariate Logistic regression analysis of factors associated with the correlation between predicted body fat mass and insulin resistance in a middle-aged and elderly non-diabetic population of Chengdu

表6 pFP对非糖尿病人群发生IR影响的多因素Logistic回归分析Table 6 Multivariate Logistic regression analysis of factors associated with the correlation between predicted body fat percentage and insulin resistance in a middle-aged and elderly non-diabetic population of Chengdu
2.4 pFM及pFP预测IR的ROC曲线分析 绘制pFM及pFP预测非糖尿病人群发生IR的ROC曲线,结果显示,ROC曲线下面积(AUC)分别为0.777〔95%CI(0.733,0.822)〕、0.719〔95%CI(0.668,0.769)〕(图1),截断值分别为38.10 kg、17.74%,见表7。
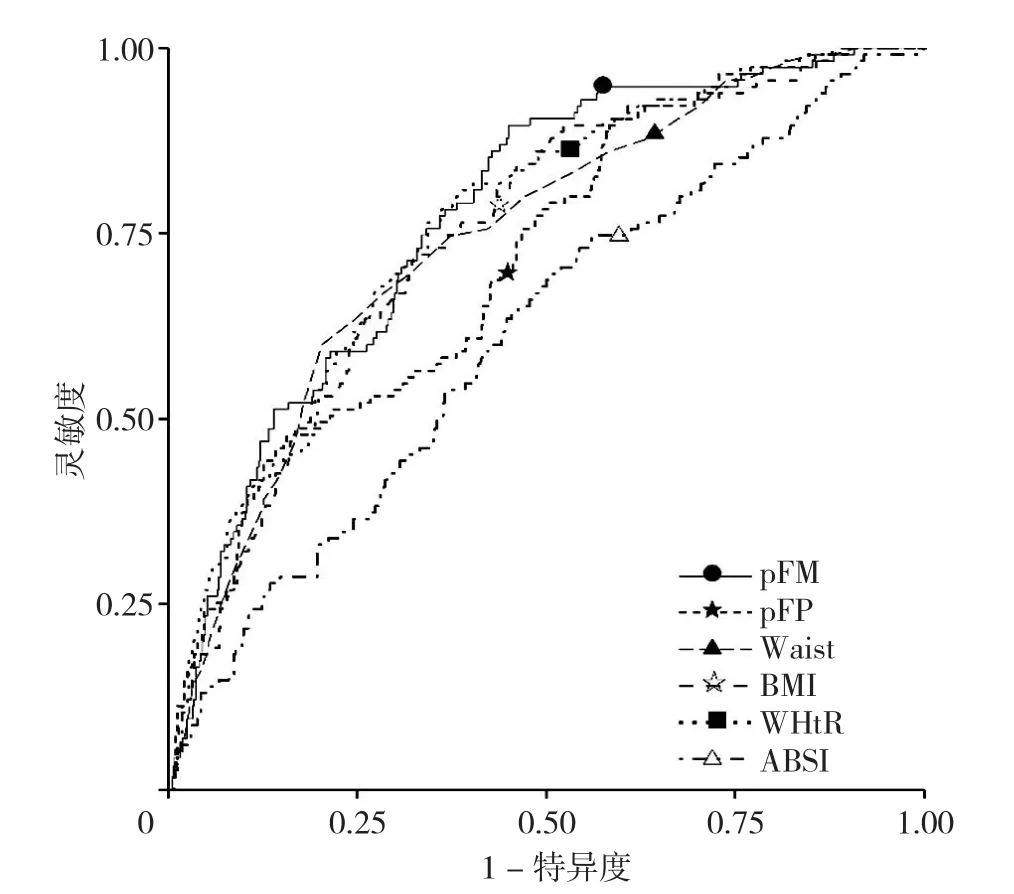
图1 人体测量学指标预测中老年非糖尿病人群发生IR的ROC曲线Figure 1 Receiver operating characteristic curves of predicted body fat mass,predicted body fat percentage,waistline,BMI,WHtR and ABSI in identifying insulin resistance in a middle-aged and elderly non-diabetic population of Chengdu

表7 人体测量学指标预测中老年非糖尿病人群发生IR的效能Table 7 Predictive efficacies of predicted body fat mass,predicted body fat percentage,and four anthropometric parameters for insulin resistance in a middle-aged and elderly non-diabetic population of Chengdu
同时绘制腰围、BMI、WHtR、ABSI预测IR的ROC曲线,结果显示,腰围、BMI、WHtR及ABSI预测IR的AUC分别为:0.749〔95%CI(0.700,0.798)〕、0.753〔95%CI(0.706,0.801)〕、0.768〔95%CI(0.722,0.815)〕及0.618〔95%CI(0.561,0.675)〕(图1、表7)。
pFM与腰围、BMI、WHtR的AUC比较,差异均无统计学意义(Z=1.243,P=0.214;Z=1.439,P=0.150;Z=0.520,P=0.603),pFM的AUC大于ABSI,差异有统计学意义(Z=4.452,P<0.001)。
pFP与腰围、BMI、WHtR的AUC比较,差异均无统计学意义(Z=-0.900,P=0.369;Z=-1.252,P=0.210;Z=-1.911,P=0.056),pFP的AUC大于ABSI,差异有统计学意义(Z=2.486,P=0.013)。
3 讨论
IR与2型糖尿病、代谢综合征、高血压、冠心病、肿瘤、内皮功能障碍、抑郁及肺动脉高压等有关。肥胖引起IR的主要机制与炎性反应、线粒体功能障碍、高胰岛素血症、脂肪毒性、氧化应激等有关,同时与基因、年龄、脂肪肝、组织缺氧和脂肪代谢障碍有关。
本研究目的系探讨成都地区中老年非糖尿病自然人群中pFM及pFP与IR的关系,结果显示pFM及pFP与IR独立相关,可较好地识别IR;但pFM、pFP对IR的识别能力并不优于传统人体测量指标。
既往常用BMI、腰围等预测IR,但由于不同种族脂肪分布存在差异。WU等[5]学者研究发现,在南亚人群中,IR的高发病率与中心型肥胖有关,IR可增加糖尿病、高血压发病率,增加空腹及餐后血糖、三酰甘油水平,降低HDL-C;在亚裔印度人中,IR与内脏脂肪有关,内脏脂肪的增加也可引起脂代谢障碍,增加糖尿病、冠心病的发病率。
LEE等[11]根据 NHANES 1999—2006人群构建了简易计算指标pFM及pFP,上述简易计算指标基于年龄、身高、体质量、腰围及种族,指标构建过程中与双能X线吸收测量法评估的脂肪进行对照,结果显示pFM及pFP与双能X线吸收测量法结果一致。上述指标构建后,系列研究提示pFM及pFP在欧美人群中预测2型糖尿病及肥胖的能力优于传统指标BMI及腰围[11,14];并发现在欧美人群中,pFM与射血分数保留性心衰(HFpEF)具有相关性[12],且与心血管及肿瘤的死亡率也呈正相关[13]。这些结果提示pFM及pFP具有较好的临床应用价值。
目前,IR及2型糖尿病已经成为全球广泛流行的疾病之一,而肥胖及相关脂肪组织的异常堆积是导致上述疾病的主要影响因素[6,18,21-22]。肥胖状况下的脂肪组织增加及其引起的巨噬细胞浸润可导致促炎细胞因子如肿瘤坏死因子α(TNF-α)、白介素6(IL-6)和白介素1β(IL-1β)等分泌增多,并可导致游离脂肪酸(free fatty acid,FFA)的异常释放[2,23-25]。上述脂肪组织堆积相关的炎性因子改变最终可影响糖代谢异常,进而导致IR及糖尿病等;因此,代表人体脂肪的pFM及pFP指标可区分IR,并与IR密切相关。但是,需要注意不同种族的脂肪分布存在差异[15],如加拿大的一项研究比较了其原著住民、中国人、欧洲人、南亚人不同种族人群内脏脂肪堆积特点,发现当全身脂肪含量>9.1 kg时,中国人内脏的脂肪分布比例比欧洲人明显增加(P=0.008)[25-26]。本研究探讨的指标pFM及pFP来自欧美人群,因此,虽然本研究提示pFM及pFP可在中国人群中预测IR,但相关指标的系数是否需要在我国人群中进行校准,尚需进一步研究。
本研究也具有一定局限性:(1)本研究中IR未采用胰岛素钳夹技术进行确认,虽然该技术被认为是经典的方法[27],但测量程序复杂,且经济成本高,在流行病学调查中并不适用。因此,本研究通过HOMAIR进行评估,该方法更加方便且经济、有效。(2)基于HOMA-IR确认的IR,在不同研究中定义不同,HOMA-IR切点既往曾采用基于第50百分位、第75百分位与第90百分位,以及最高五分之一位或三分之一的下界等[28]。在本研究中,高于第80百分位定义为IR(HOMA-IR切点为≥1.66);定义切点虽较武断,但具有临床操作性[6,17]。(3)本研究是基于成都市成华区中老年人群,研究人群样本量相对较小、具有一定局限性,是否可外延到其他地区及其他人群,需扩大样本量进一步研究验证。另外,本研究也未在不同种族中进行对比研究。
本研究显示在成都地区中老年非糖尿病自然人群中,pFM及pFP与IR独立相关,并可有效地识别IR。IR作为2型糖尿病发生、发展的必然病理生理过程,未来的研究是否可在中国人群中运用pFM及pFP预测2型糖尿病,尚待进一步研究。
作者贡献:阮海燕负责数据清洗和统计学分析、绘制图表及论文起草;李丽英、郑翼负责试验调查对象的选取、样本的采集、指标化验与检测等核查;陈晓平提出研究思路,设计研究方案,提出研究命题;何森参与并负责研究所有过程,负责论文最终版本修订,对论文负责。
本文无利益冲突。
