益生菌干预治疗狼疮肾炎Ⅳ~Ⅴ型患者的效果研究
2022-05-28黄朦黄存军欧秋娟戴洪波何阶德梁航陈喆徐秋笔
黄朦,黄存军,欧秋娟,戴洪波,何阶德,梁航,陈喆,徐秋笔
狼疮肾炎(LN)是系统性红斑狼疮(SLE)严重的并发症之一,临床可出现单纯性蛋白尿、血尿、氮质血症、高血压和水肿等,常表现为慢性肾小球肾炎和肾病综合征,LN患者随着病程延长易发生终末期肾脏病,严重威胁患者生命健康[1-2]。有研究发现肠道菌群紊乱与LN进程关系密切,LN患者肠道菌群具有明显促炎作用,易导致自身免疫功能障碍的特征性改变[3]。有研究显示,在LN经典模型MRL/lpr小鼠中,口服乳杆菌可明显改善雌鼠和阉割雄鼠的肾功能及其存活率[4]。因此,本研究旨在探讨益生菌干预治疗LN的临床疗效,并观察其对肾功能改善、肠道菌群变化以及短链脂肪酸的影响。
1 对象与方法
1.1 研究对象 选取2019—2020年于湘南学院附属医院收治的Ⅳ型和Ⅴ型LN患者。纳入标准:(1)符合2019年美国风湿病协会制定的SLE分类诊断标准[5];(2)年龄18~65岁;(3)经肾活检确诊,参照SLE肾脏疾病活动指数(R-SLEDAI)评分[6]评估为静止组的患者。排除标准:(1)合并其他自身免疫系统疾病;(2)合并肿瘤性疾病;(3)合并急慢性感染、重大创伤、手术等;(4)合并其他系统引起的肾脏病变,如高血压、糖尿病等引起的肾脏病变;(5)合并其他脏器严重疾病,如心脏、肺、肝脏、消化系统、神经系统等严重疾病。
本研究共纳入98例LN患者,纳入患者均知情同意。本研究经过湘南学院附属医院伦理委员会审批通过(伦理批号:XNXY-2019-0105)。
1.2 研究设计 采用隐匿数字随机法将LN患者分为常规治疗组和干预治疗组,每组各49例。常规治疗组使用激素、羟氯喹和血管紧张素转换酶抑制剂(ACEI)治疗(常规治疗);干预治疗组在常规治疗组治疗基础上,给予双歧杆菌四联活菌片1.5 g口服,3次/d。随访24周。
1.3 观察指标
1.3.1 治疗前一般资料与临床指标 患者接受治疗前1 d,记录患者一般资料,包括性别、年龄、体质指数(BMI)、收缩压和舒张压;检测血红蛋白、血清白蛋白、血肌酐(Scr)、补体C3和补体C4。
1.3.2 临床疗效评价 患者治疗前和治疗24周后,采用R-SLEDAI评分评估疾病的活动性,评分越高代表病情越严重。
1.3.3 实验室检查指标 患者接受治疗前和治疗4、12、24 周后检测24 h尿蛋白定量、尿素氮(BUN)、Scr、免疫球蛋白(Ig)E和IgG水平。患者接受治疗前和治疗24 周后采用酶联免疫吸附法检测血清C反应蛋白(CRP)、白介素(IL) -6、肿瘤坏死因子(TNF)-α水平。
1.3.4 肠道菌群检测 选取同期本院体检中心体检健康者16例作为健康志愿者。收集健康志愿者、LN患者(患者治疗前)、常规治疗组治疗24周后、干预治疗组治疗24周后的粪便。(1)取粪便约2 g,装入2 ml无菌冻存管中,置于液氮中速冻,然后转移到-80 ℃超低温冰箱中保存。(2)使用DNA提取试剂盒提取DNA后,通过琼脂糖凝胶电泳检测DNA提取质量,同时采用紫外分光光度计对DNA进行定量。(3)对细菌16S rDNA基因V3~V4区域进行PCR扩增。16S rDNA基因V3~V4区引物序列正向引物:5'-CCTACGGGNGGCWGCAG-3',反向引物 5'-GACTACHVGGGTATCTAATCC-3'。PCR反应程序为:首先在98 ℃条件下预变性30 s;然后进行35个循环,包括:98 ℃变性10 s,54 ℃退火30 s,72 ℃延伸45 s;最后在72 ℃条件下延伸10 min。PCR产物经2%琼脂糖凝胶电泳进行证实。在整个DNA提取过程中,使用超纯水排除假阳性PCR结果作为阴性对照的可能性,PCR产物由AMPure XT beads(Beckman Coulter Genomics,Danvers,MA,美国)纯化,Qubit(Invitrogen,美国)定量。扩增子池用于测序,扩增子文库的大小和数量分别在Agilent 2100生物分析仪( Agilent, 美国)和 Illumina (Kapa Biosciences,Woburn,MA,美国)的文库定量试剂盒上进行评估。在NovaSeq PE250平台上对库进行排序。(4)样品按照制造商的建议进行测序,由LC-Bio提供。根据样品独特的条形码,将配对端序列分配给样品,并将建库引入的barcode和引物序列去除。使用FLASH合并匹配端读取。根据fqtrim(v0.94),在特定的过滤条件下对原始数据进行质量过滤,以获得高质量的clean标签。使用Vsearch软件对嵌合序列进行过滤。利用DADA2(Divisive Amplicon Denoising Algorithm)进行解调,使用ASVs(Amplicon Sequence Variants)的概念构建类操作分类单位(Operational Taxonomic Units,OTU)表,获得最终的feature特征表以及特征序列。多样性通过归一化到相同的随机序列来计算。然后根据SILVA(release 132)分类器,利用每个样本的相对丰度对特征丰度进行归一化。采用Blast进行序列比对,每个代表性序列用SILVA数据库对特征序列进行注释。采用LEfSe 分析肠道菌群丰度。
1.3.5 短链脂肪酸检测 采用气相质谱分析法测定健康志愿者、LN患者、常规治疗组治疗24周后和干预治疗组治疗24周后粪便中短链脂肪酸(甲酸、乙酸、丙酸、丁酸)含量。(1)将新鲜粪便使用蒸馏水以1∶9进行均值稀释,混匀,于-80 ℃保存备用。(2)使用固相动态微萃取技术将混合物分离,将所得上清液使用气相质谱分析,条件为:色谱柱VF-WAXms,0.25 mm×30.00 m,0.25 μm,初始 温度 70 ℃,保持1 min,按10 ℃/min升温速率升温至200 ℃,保持2 min,30 ℃/min升温速率升温至240 ℃,保持2 min,进样口温度为250 ℃。(3)将所得产物进行质谱分析,测量样本中甲酸、乙酸、丙酸、丁酸含量。
1.4 统计学方法 应用SPSS 17.0和GraphPad 8统计软件对数据进行统计分析,符合正态分布的计量资料以(±s)表示,两组间比较采用独立样本t检验,组内比较采用配对t检验;多组间比较采用方差分析,组间两两比较采用SNK-q检验。分类资料的组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 患者治疗前一般资料及临床指标比较 本研究最终共93例患者完成试验,其中常规治疗组46例,干预治疗组47例。两组患者性别、年龄、BMI及治疗前收缩压、舒张压、血红蛋白、血清白蛋白、Scr、补体C3和补体C4比较,差异均无统计学意义(P>0.05),见表1、2。

表1 两组患者治疗前一般资料比较Table 1 Comparison of general between lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics at baseline
表2 两组患者治疗前临床指标比较(±s)Table 2 Comparison of clinica indices between lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics at baseline

表2 两组患者治疗前临床指标比较(±s)Table 2 Comparison of clinica indices between lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics at baseline
注:Scr=血肌酐
补体C4(g/L)常规治疗组 46 76.0±13.3 26.68±6.38 61.99±12.07 0.55±0.20 0.11±0.03干预治疗组 47 75.6±12.6 25.96±6.05 62.03±12.96 0.56±0.15 0.12±0.02 t值 0.049 0.559 0.015 0.273 1.895 P值 0.961 0.578 0.988 0.785 0.061组别 例数 血红蛋白(mmol/L)血清白蛋白(g/L)Scr(μmol/L)补体C3(g/L)
2.2 临床疗效评价 治疗前,两组患者R-SLEDAI评分比较,差异无统计学意义(P>0.05)。治疗24周后,干预治疗组SLEDAI评分低于常规治疗组,差异有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后SLEDAI评分比较(±s,分)Table 3 Comparison of SLEDAI scores between lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics before and after treatment

表3 两组患者治疗前后SLEDAI评分比较(±s,分)Table 3 Comparison of SLEDAI scores between lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics before and after treatment
组别 例数 治疗前 治疗24周后常规治疗组 46 16.8±4.9 8.7±3.6干预治疗组 47 17.3±5.1 6.3±2.1 t值 0.520 4.090 P值 0.604 <0.001
2.3 患者治疗前后肾功能变化情况 治疗前两组患者24 h 尿蛋白定量、BUN、Scr比较,差异无统计学意义(P>0.05);治疗4、12、24 周后,两组患者24 h尿蛋白定量、BUN、Scr较治疗前降低,差异有统计学意义(P<0.05);治疗4、12、24周后,干预治疗组患者24 h尿蛋白定量和BUN均低于常规治疗组,治疗24周后Scr低于常规治疗组,差异有统计学意义(P<0.05),见表4~6。
表4 两组患者治疗前后24 h尿蛋白定量比较(±s,g)Table 4 Comparison of 24-hour urinary protein between lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics before and after treatment

表4 两组患者治疗前后24 h尿蛋白定量比较(±s,g)Table 4 Comparison of 24-hour urinary protein between lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics before and after treatment
注:a表示与治疗前相比P<0.05
组别 例数 治疗前 治疗4周后 治疗12周后 治疗24周后常规治疗组 46 4.79±1.52 3.82±1.19a 2.65±0.69a 1.48±0.11a干预治疗组 47 4.82±1.69 3.27±1.32a 1.94±0.79a 1.03±0.18a t值 0.090 2.109 4.612 14.510 P值 0.929 0.038 <0.001 <0.001
表5 两组患者治疗前后BUN比较(±s,mmol/L)Table 5 Comparison of BUN between lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics before and after treatment

表5 两组患者治疗前后BUN比较(±s,mmol/L)Table 5 Comparison of BUN between lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics before and after treatment
注:a表示与治疗前相比P<0.05
组别 例数 治疗前 治疗4周后 治疗12周后 治疗24周后常规治疗组 46 15.87±1.62 13.13±1.51a 10.25±1.59a 8.64±1.08a干预治疗组 47 15.92±1.87 12.49±1.49a 9.59±1.02a 7.08±1.39a t值 0.138 2.057 2.388 6.035 P值 0.891 0.043 0.019 <0.001
表6 两组患者治疗前后Scr比较(±s,μmol/L)Table 6 Comparison of Scr between lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics before and after treatment

表6 两组患者治疗前后Scr比较(±s,μmol/L)Table 6 Comparison of Scr between lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics before and after treatment
注:a表示与治疗前相比P<0.05
组别 例数 治疗前 治疗4周后 治疗12周后 治疗24周后常规治疗组 46 132.81±9.33 118.95±8.77a 97.35±7.13a 82.42±5.92a干预治疗组 47 133.61±8.76 117.11±8.42a 98.29±6.24a 75.18±5.84a t值 0.426 1.032 0.677 5.937 P值 0.671 0.305 0.500 <0.001
2.4 患者治疗前后血清IgE、IgG水平变化 两组患者治疗前血清IgE、IgG水平比较,差异无统计学意义(P>0.05);治疗24周后,两组患者血清IgE、IgG水平均较治疗前下降,且干预治疗组患者血清IgE、IgG水平低于常规治疗组,差异有统计学意义(P<0.05),见表7。
表7 两组患者治疗前后血清IgE、IgG水平比较(±s,g/L)Table 7 Comparison of serum IgE and IgG between lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics before and after treatment

表7 两组患者治疗前后血清IgE、IgG水平比较(±s,g/L)Table 7 Comparison of serum IgE and IgG between lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics before and after treatment
注:Ig=免疫球蛋白;a表示与治疗前相比P<0.05
组别 例数 IgE IgG治疗前 治疗24周后 治疗前 治疗24周后常规治疗组 46 26.32±3.42 21.89±2.87a 15.92±3.22 12.93±2.47a干预治疗组 47 26.51±3.15 18.60±1.53a 16.03±3.24 10.28±2.65a t值 0.278 6.919 0.164 4.986 P值 0.781 <0.001 0.870 <0.001
2.5 患者治疗前后血清炎性因子水平变化 两组患者治疗前CRP、IL-6、TNF-α水平比较,差异无统计学意义(P>0.05)。治疗24周后,两组患者CRP、IL-6、TNF-α水平均较治疗前下降,且干预治疗组患者CRP、IL-6、TNF-α水平低于常规治疗组,差异有统计学意义(P<0.05),见表8。
表8 两组患者治疗前后血清CRP、IL-6、TNF-α水平比较(±s)Table 8 Comparison of serum CRP,IL-6 and TNF-α between lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics before and after treatment

表8 两组患者治疗前后血清CRP、IL-6、TNF-α水平比较(±s)Table 8 Comparison of serum CRP,IL-6 and TNF-α between lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics before and after treatment
注:CRP=C反应蛋白,IL=白介素,TNF-α=肿瘤坏死因子α;a表示与治疗前相比P<0.05
组别 例数 CRP(mg/L) IL-6(μg/L) TNF-α(μg/L)治疗前 治疗24周后 治疗前 治疗24周后 治疗前 治疗24周后常规治疗组 46 2.68±0.96 1.43±0.75a 21.96±2.21 8.05±2.32a 4.65±0.67 1.78±0.68a干预治疗组 47 2.69±1.05 1.09±0.69a 22.08±2.21 6.67±2.48a 4.73±0.69 1.16±0.73a t值 0.048 2.276 0.262 2.770 0.567 4.236 P值 0.962 0.025 0.794 0.007 0.572 <0.001
2.6 肠道菌群变化 LEfSe分析显示,健康志愿者粪便中疣微菌门(Verrucomicrobia)、韦荣球菌科(Erysipelotrichaceae)、 阿 克 曼 菌 属(Akkermansia)等菌群含量较高,LN患者治疗前粪便中幽门螺杆菌属(Helicobacter pylori)、梭状芽孢杆菌(Clostridium)、肠球菌门(Enterococcus)等有害菌群含量增加;常规治疗组和干预治疗组治疗后粪便中有害菌群含量降低,同时厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、嗜胆菌属(Bilophila)等有益菌群含量增加。药物治疗后,粪便中阿克曼菌含量增加,见图1。
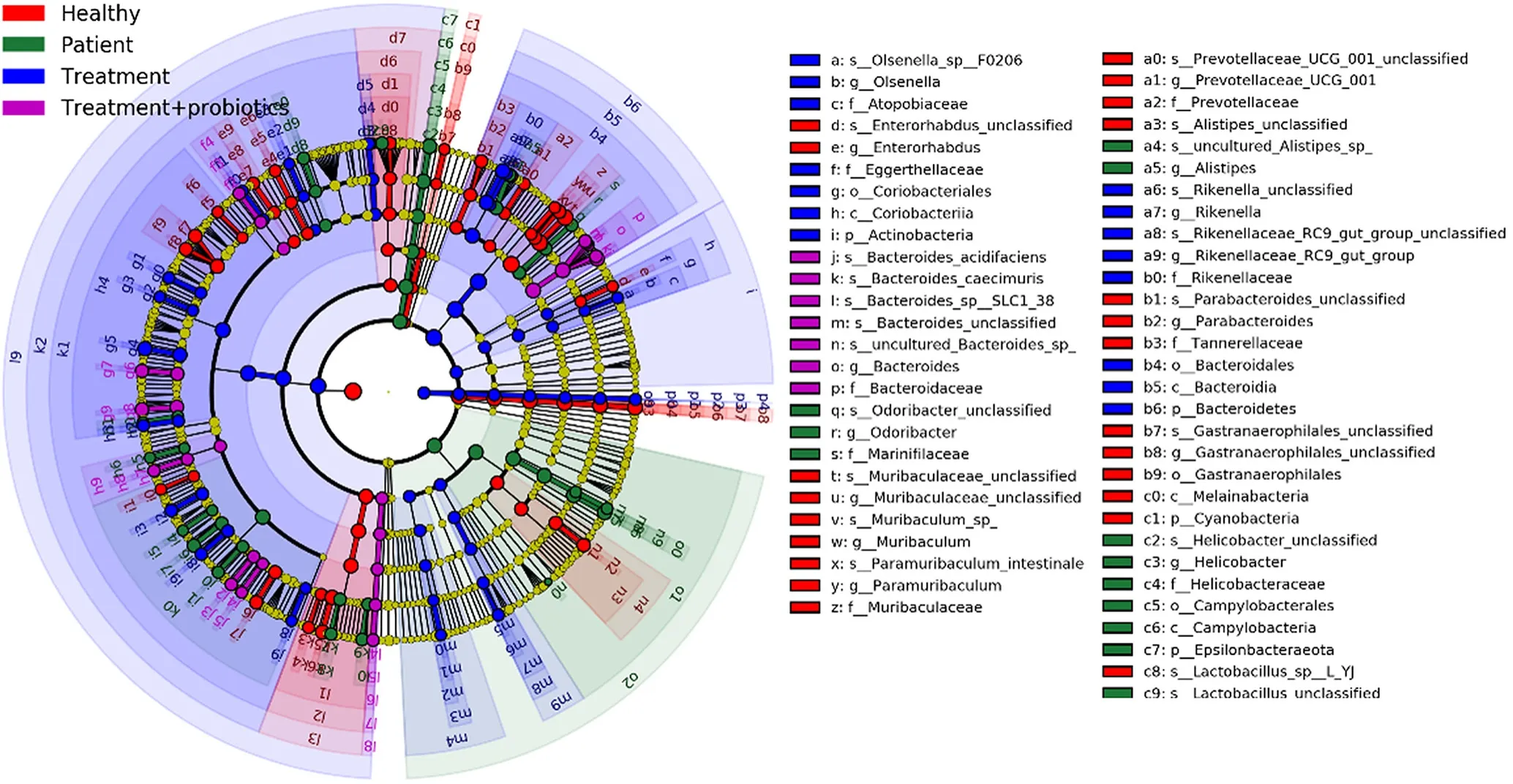
图1 健康志愿者、LN患者治疗前及常规治疗组、干预治疗组治疗24周后粪便肠道菌群LEfSe差异分析Figure 1 Taxonomic cladogram of LEfSe analysis of fecal flora between healthy controls,lupus nephritis patients before treatment,lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics
2.7 粪便短链脂肪酸含量变化 与健康志愿者比较,LN患者治疗前粪便中甲酸、乙酸、丙酸、丁酸含量降低,差异有统计学意义(P<0.05),见表9。健康志愿者及常规治疗组、干预治疗组治疗24周后粪便中甲酸含量比较,差异无统计学意义(P>0.05)。健康志愿者及常规治疗组、干预治疗组治疗24周后粪便中乙酸、丙酸、丁酸含量比较,差异有统计学意义(P<0.05),其中常规治疗组治疗24周后和干预治疗组治疗24周后粪便中乙酸、丙酸、丁酸含量均较健康志愿者增加,且干预治疗组治疗24周后粪便中乙酸、丙酸、丁酸含量较常规治疗组治疗后增加,差异有统计学意义(P<0.05),见表10。
表9 健康志愿者和LN患者治疗前粪便中短链脂肪酸含量比较(±s,μg/g)Table 9 Changes of short-chain fatty acid concentrations in feces between healthy controls and lupus nephritis patients before treatment

表9 健康志愿者和LN患者治疗前粪便中短链脂肪酸含量比较(±s,μg/g)Table 9 Changes of short-chain fatty acid concentrations in feces between healthy controls and lupus nephritis patients before treatment
样本 例数 甲酸 乙酸 丙酸 丁酸健康志愿者 12 254.03±26.27 259.68±27.38 246.61±26.01 249.23±26.28 LN 患者 93 232.12±21.50 153.99±13.21 146.21±12.51 147.76±12.65 t值 3.726 12.01 26.14 25.57 P值 <0.01 <0.01 <0.01 <0.0001
表10 健康志愿者及常规治疗组、干预治疗组治疗24周后粪便中短链脂肪酸含量比较(±s,μg/g)Table 10 Changes of short-chain fatty acid concentrations in feces between healthy controls and lupus nephritis patients with routine treatment,and routine treatment plus probiotics

表10 健康志愿者及常规治疗组、干预治疗组治疗24周后粪便中短链脂肪酸含量比较(±s,μg/g)Table 10 Changes of short-chain fatty acid concentrations in feces between healthy controls and lupus nephritis patients with routine treatment,and routine treatment plus probiotics
注:a表示与健康志愿者相比P<0.05,b表示与常规治疗组治疗24周后相比P<0.05
样本 例数 甲酸 乙酸 丙酸 丁酸健康志愿者 12 254.03±26.27 259.68±27.38 246.61±26.01 249.23±26.28常规治疗组治疗24周后 46 235.33±24.06 188.86±22.70a179.33±21.59a181.24±21.81a干预治疗组治疗24周后 47 246.48±34.28 216.31±23.42ab205.41±22.23ab207.59±22.47ab F值 2.736 46.788 46.783 46.785 P值 0.067 <0.01 <0.01 <0.010
2.8 安全性评价 治疗24周后,两组患者出现的肝功能异常、感染(上呼吸道、肺部、尿路)、腹泻、心动过速以及其他药物不良反应发生率比较,差异均无统计学意义(P>0.05),见表11。

表11 两组患者治疗后药物不良反应情况比较〔n(%)〕Table 11 Comparison of adverse drug reactions after treatment between lupus nephritis patients treated with routine treatment,and routine treatment plus probiotics
3 讨论
有研究发现,人体肠道菌群有助于维持机体糖脂代谢和免疫功能[7]。肠道菌群相关研究证实,在SLE、类风湿关节炎、多发性硬化症、LN等自身免疫性疾病发病过程中均出现了肠道菌群紊乱的现象[8]。相关动物实验发现,狼疮小鼠肠道菌群中乳酸杆菌数量明显减少,口服乳酸杆菌可以通过调节免疫反应改善小鼠肾功能并延长小鼠生存时间[9],推测其可能与肠道菌群调节免疫应答、炎性反应、氧化应激、代谢等有关[10]。因此,本研究拟探讨LN患者肠道菌群改变特征以及益生菌对患者肠道菌群、肾脏功能的影响。
本研究在常规治疗的基础上,给予LN患者益生菌辅助治疗,结果显示,相较于常规的羟氯喹加ACEI治疗,添加益生菌的干预治疗方式提高了LN患者的临床有效率,常见实验室检查指标(24 h尿蛋白定量、BUN、Scr等)得到明显改善,提示两种治疗方式均可以改善患者肾功能,防止肾病发展。经进一步检测发现,患者血清IgE、IgG以及炎性因子水平治疗后明显降低,提示两种治疗方式均可以缓解患者血清中异常指标,并且益生菌干预治疗组患者指标变化更明显,益生菌干预治疗可以起到更好的抗炎作用[11]。
LEfSe分析结果显示,健康志愿者肠道菌群中疣微菌门、韦荣球菌科、阿克曼菌属比例较高,LN患者粪便中幽门螺杆菌属、梭状芽孢杆菌、肠球菌门等有害菌群比例增加,治疗后,LN患者粪便中有害菌群含量降低,同时厚壁菌门、拟杆菌门、嗜胆菌属等有益菌群比例增加。SU等[12]研究发现,拟杆菌门和阿克曼菌可以增加肠黏膜屏障相关黏蛋白2(Muc-2)表达。本研究中,常规治疗和干预治疗均可以增加拟杆菌门丰度,药物治疗可以通过改善肠黏膜屏障和降低细胞旁通透性,减少细菌脂多糖入血,降低炎性反应,保护肾脏。此外,本研究中,常规治疗和干预治疗均可以增加厚壁菌门丰度,且药物治疗后,粪便中乙酸、丙酸、丁酸含量增加,提示药物治疗可以通过提高短链脂肪酸含量,提高肠上皮细胞能量代谢,改善LN病情,这与MEIJERS等[13]研究结果一致。2019年AZZOUZ等[3]检测了61例SLE患者粪便肠道菌群和自身抗体水平,发现SLE患者微生物组物种丰富度多样性降低,毛螺菌科瘤胃球菌(Ruminococcusgnavus,RG)含量明显增加,并且发现血清中抗RG抗体与R-SLEDAI评分相关,与补体C3和补体C4呈负相关,提示RG菌群丰度与狼疮疾病的活动性相关。然而在本研究中,并未发现患者治疗前后RG菌群丰度的改变,推测疾病活动期患者和非疾病活动期患者的肠道菌群可能存在差异。
综上所述,LN患者存在肠道菌群紊乱,益生菌干预治疗可以增加肠道中有益菌群含量,减少有害菌群含量,提高短链脂肪酸含量,降低血清Ig水平,改善患者肾功能,提高临床治疗效果。但本研究未对LN患者进行生存随访,后续需长期随访并收集患者康复信息,进一步阐明肠道菌群在LN患者治疗中的作用,为益生菌的临床治疗推广提供理论依据。
作者贡献:黄朦、徐秋笔提出研究主题,负责研究思路的设计并对文章负责,进行研究实施、样本检测、资料收集整理、撰写论文;戴洪波、何阶德进行研究的质量控制及审校;黄朦、黄存军、欧秋娟、戴洪波、何阶德、梁航、陈喆、徐秋笔参与研究实施、试验检测评估、技术操作和资料收集。
本文无利益冲突。
