罗田板栗外生菌根真菌多样性研究
2022-05-28徐碧林罗周瑜郑贺元郑永良
徐碧林,王 政,罗周瑜,武 卉,郑贺元,郑永良
(黄冈师范学院生物与农业资源学院,经济林种质资源改良与综合利用湖北省重点实验室,湖北省大别山特色资源开发协同创新中心,湖北 黄冈 438000)
【研究意义】板栗树(Castaneamollissima)属于壳斗科(Fagaceae),是原产于中国并在世界范围内广泛种植的重要经济落叶乔木,既可生产坚果也可用作木材[1]。据估计中国板栗树种植面积占全世界的38%,板栗产量占全球的75%,是全球板栗产量最高的地区[2]。凭借板栗坚果独特风味和营养成分,以及作为制作高品质家具首选木材之一,板栗树受到越来越多的关注。此外,在过去10年间,生长在板栗树下野生食用蘑菇的采集和商业化种植,已成为人们一项重要经济来源[3]。然而,我国大多数板栗树生长在与其他树木混合的丘陵和山区。近20年来,为提高板栗产量,人们大量施用化肥、农药和抗生素严重影响了自然生态系统,导致土壤和水质恶化[2, 4]。因此,为实现农业可持续发展,寻找新消除生物和非生物胁迫的策略迫在眉睫。【前人研究进展】外生菌根(Ectomycorrhiza,ECM)是菌与根相互作用的主要类型之一,外生菌根真菌(Ectomycorrhizal fungi,ECMF)菌丝穿透根皮层细胞和表皮细胞之间的空隙,形成一个包围植物根外部鞘的哈蒂格网络[5-6]。在森林生态系统中,ECMF与细根形成的互利共生关系在生态功能中起着关键作用:菌丝体既可以增加表面积来增强植物获取水分和营养的能力[7-8],还可以提高作物对干旱、重金属、病虫害的抵抗力[8-12],而ECMF则从它们的寄主植物接收有机化合物(如葡萄糖)[13-14]。在温带和北方森林中,ECM是树木吸收养分的主要器官,据估计,这些生态系统中高达95%的根系能形成ECM[13]。壳斗科(Fagaceae),尤其是板栗树,是形成菌根优势种之一[15]。Baptista等对葡萄牙东北部板栗相关的大型真菌进行研究表明,其中82%是菌根真菌[16]。Palmer等发现Scleroderma、Russula、Sebacina、Tomentella和Pezizaceae是美洲栗外生菌根真菌的优势属[17]。Chen等人的发现表明,与C.mollissima共生的外生菌根通过激活基因表达和H+流出来促进磷吸收[18]。此外,也有报道表明,欧洲栗树幼苗和微繁殖植株接种菌根真菌早期可以改善植物的整体状况[19-20],并且可以保护植株免受墨病的侵袭[21]。以上研究表明,板栗外生菌根既提高了板栗树的营养水平,还增强了其抗病能力。【本研究切入点】目前对“罗田”板栗菌根真菌群落结构的了解较少。罗田县位于中国湖北省大别山地区,是中国板栗的产地之一,也是中国南方板栗的中部主产区,全县各地共约有6万公顷的优质板栗基地。研究表明,不同的菌根真菌对寄主植物的影响不同,且菌根真菌群落在不同生境的相同寄主植物之间存在差异[22]。综上所述,对大别山广泛栽培的“罗田”板栗外生菌根真菌进行系统研究,对板栗种植具有重要的指导作用。【拟解决的关键问题】本研究以国家地理标志产品保护区的罗田板栗菌根真菌为研究对象,一方面运用高通量测序技术揭示其群落多样性;同时结合菌根真菌的形态特征以及ITS序列分析对菌根真菌进行分离鉴定,以期为罗田板栗的病害防控提供依据。
1 材料与方法
1.1 供试材料
1.1.1 样品采集地 本研究在罗田板栗地理标志产品保护区(分布于12个乡镇:白庙河乡、白兰河乡、大子乡、大边镇、凤山镇、合浦镇、九子河镇、荒河乡、骆驼坳乡、平湖乡、三里板乡、胜利镇)选取具有代表性大于80年的板栗果园中进行。罗田县(115°23′57.37′′E, 30°47′2.364′′N)属于北亚热带季风气候(冬季干冷,夏季湿润,春暖秋凉)。年均总日照时数为2047 h,年辐射热为109.25 kcal/cm2。全年温度范围为-14.6~41.6 ℃,年均气温为16.4 ℃,平均无霜期240 d。年平均降水量为1330 mm,降雨主要集中在5、6、7月,占全年降水量的50%左右。降水和热量与板栗产生期同步:开花期降水较少,有利于板栗授粉。梅雨季节是板栗果实生长的高峰期,也是板栗对降雨需求最大的时期。秋季干旱期是板栗的成熟期,有利于提高板栗的含糖量,降低含水量,提高板栗的品质和耐贮藏性。
1.1.2 样品采集 在罗田板栗地理标志产品保护区的每个乡镇选取1个具有代表性的大于80年的板栗园,随机抽取5个具有代表性的板栗树(彼此间隔至少20 m)。根据Palmer等[17]描述的方法采集样本。首先,确定与板栗根相连后,沿主根生长方向选择侧根。然后将长度为20~30 cm的完整、新鲜、有代表性的纤维根剪断,与土块一起装入自封袋中并贴上标签。每棵树采集5个样本。所有样品均在4 ℃下及时保存,保存时间不超过1个月。
1.1.3 菌根处理 将采集的样品在自来水中浸泡并用胶头滴管沿须根生长方向仔细冲洗后,分离菌根与附着土壤和非菌根。将所有根段切成5~10 cm的小段后,在体式显微镜下根据菌根的大小、形状、颜色、分叉、外延菌丝和粗糙度将ECM根(删除根)划分为不同显微类型(每组1~10个根尖),一共得到55种显微类型。每一种显微类型选取3个菌根混合为一个复合样品。用75%酒精消毒30 s,5%次氯酸钠浸泡10 min后,用无菌水冲洗4~5次后用无菌吸水纸吸干水分,并将须根两端用无菌剪刀除去,保留中间段。将最后一次冲洗的无菌水均匀涂布于PDA培养基上,28 ℃黑暗培养3~7 d,观察是否有菌长出,以验证表面消毒的有效性。
1.2 试验方法
1.2.1 DNA 提取、PCR 扩增及测序分析 将上述消毒完全的样品,按照OMEGA试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit说明书的步骤进行DNA提取,并用琼脂糖凝胶检查DNA的提取效果。然后用2×TaqPCR Mix(Takara, Japan),通用引物ITS1F:5’-TCCGTAGGTGAACCTGCGG-3’和ITS4:5’-TCCTCCGCTTATTGATATGC-3’[23]对ITS区段进行扩增。50 μL的反应体系含有20 ng模板,10 pmol正反引物,25 μL 2×mix。扩增条件为:94 ℃ 3 min后,94 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min循环30次,最后在72 ℃保持10 min。使用QuantiFluorTM-ST蓝色荧光定量系统(Promega, Madison, WI, USA)进行凝胶成像检测和定量后,合格的PCR产物送往上海生工生物工程有限公司使用Illumina MiSeq测序系统(Illumina, USA, CA)进行测序。同时,按照Palmer等[17]方法,将每种形态10个菌根尖浸泡在0.9%无菌生理盐水中,4 ℃保存,用于ECM真菌分离鉴定。
1.2.2 菌根真菌的分离鉴定 将菌根切成2~3 cm小段,按上述方法消毒。每4~5个根段接种于PDA培养基中,28 ℃孵育6~7 d后挑取单菌落进行分离纯化。根据上述方法提取菌根真菌DNA,利用琼脂糖凝胶对DNA进行检测后,扩增单一菌株的ITS序列,检测合格的PCR产物送至上海生工生物工程有限公司进行测序。过滤后的菌根真菌ITS序列(去除不准确的头部和尾部序列)上传到国家生物技术信息中心(NCBI: http://blast.ncbi.nlm.nih.gov)使用核苷酸—核苷酸局部比对搜索工具(BLAST)与GenBank数据库进行比对,只有在种或属水平上被命名的库序列被用于比对。与ITS1和ITS4区全长相似度最高(≥98%)的ECMF序列以其种名命名,如果最高序列相似度低于98%或ECM真菌序列与属内多个物种有亲缘关系,则以属来表示[24]。最后将ECM真菌序列与文库序列相似性最高序列一起提交进行邻接分析。
1.3 数据处理及分析
Illumina MiseqTM得到的原始图像数据文件经CASAVA碱基识别(Base Calling)分析转化为原始测序序列(Sequenced Reads)。使用软件Cutadapt去除引物接头序列,再根据PE reads之间的重叠关系,用PEAR将成对的reads拼接成一条序列[25]。去除样本中reads尾部质量值在20以下的碱基。设置10 bp的端口,如果窗口内的平均质量值低于20,从窗口开始去除后端的碱基。切除reads中含N部分序列,并去除数据中小于200 bp的短序列。随后再对低复杂度的序列进行过滤,得到有效数据。使用Usearch去除预处理后序列中非扩增区域序列,而后对序列进行测序错误校正,并调用Uchime进行嵌合体鉴定[26-27]。随后,再将去除嵌合体的序列与数据库代表性序列进行比对,并剔除掉低于阈值的比对结果。通过Usearch将所有样本序列根据序列间的距离进行聚类,然后按照97%的相似性将序列分成不同的操作分类单元(OTU),在此基础上,选择丰度最高的序列作为OTU的代表性序列,而后进行各类分析[28]。使用Mothur计算Alpha多样性指数,如Shannon指数、Simpson指数、Chao1指数及覆盖率(coverage)等,并对相似度97%的OTU进行稀释性分析,检测样品的取样深度[29]。采用R对物种分类学统计结果作图,计算样品中所含何种微生物以及各微生物的相对丰度。使用GraPhlAn和iTOL对分类和系统发育信息进行可视化分析[30-31]。选取OTU聚类结果中总体丰度最大的前50个OTU聚类的代表性序列和数据库中与这50个代表性序列种属信息一致且最长的序列,使用MUSCLE进行多序列比对得到alignment文件,采用FastTree根据最大似然法(approximately-maximum-likelihood phylogenetic trees)构建进化树[32]。
2 结果与分析
2.1 物种组成(OTU)分析
通过对真菌ITS1-4区段进行高通量测序(图1),共得到49 807条高质量序列,基于≥97%的相似度水平,通过聚类分析共获得1782个有效OTU。随着样品序列数的不断增加,当序列数超过30 000时,其稀释性曲线越来越趋于平缓,说明即使继续增加取样量也只能产生极少量新的OTU。说明取样量合理,能够比较准确地反映板栗菌根真菌群落。
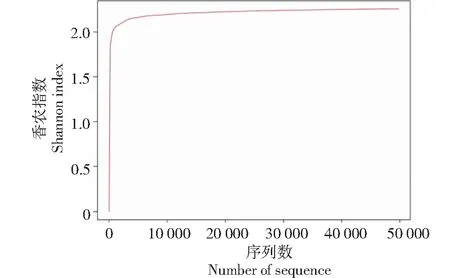
图1 Alpha指数稀释曲线
2.2 群落组成分析
基于OTUs聚类分析,排名前50的OTU属于34 个属,15个未分类的种和其他类群(图2)。其中,Lactarius(约占60%)为优势属,其次为Guehomyces(约占7.9%),Inocybe(4.56%),Russula(3.93%),unclassified_Thelephoraceae(2.74%),unclassified_Ascomycota(2.21%),以及其余属(14.74%)。
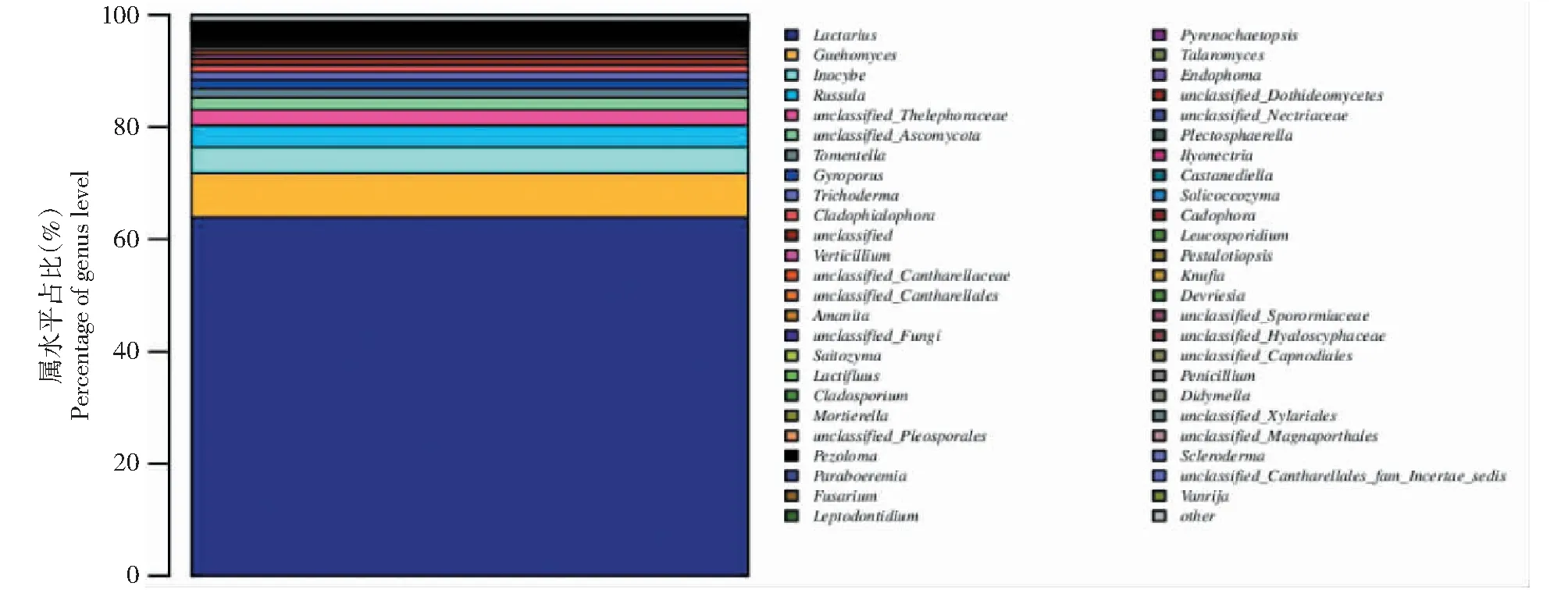
图2 排名前50的OTU属水平群落结构分布
图3显示,在所有样本中,丰度排名前20位的类群占95.99% 分别属于Basidiomycota(约60%)、Ascomycota(约30%)、Mortierellomycota(约5%),其他类群占4.01%。此外,5个优势属:Lactarius、Guehomyces、Inocybe、Russula和unclassified_Thelephoraceae均属于Basidiomycota。
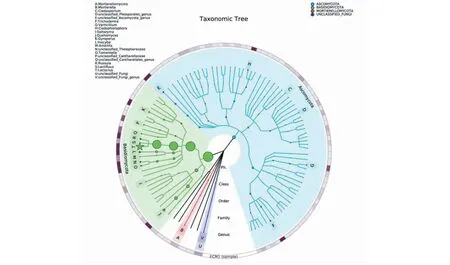
图居中的是丰度前100个物种进化分类树,并将丰度前20个物种(以星号标出)所对应的门按不同的颜色标出,圈和星号的大小代表丰度大小。外围环为热力图,每一环为一个样本(组),每个样本对应一种颜色。颜色深浅随物种丰度变化
2.3 不同外生菌根的形态特征
如图4所示,不同的外生菌根在大小、形状和颜色上都有着显著差异。少数菌根没有分叉,但也有部分菌根分叉较多、分枝较长,使得菌根的形状主要有棒状、分叉状、椭球状、姜状、辣椒状、竹状、树枝状等,因此,分叉在一定程度上反映了菌根的形态和特征。菌根颜色以棕色、黄色、黑色、灰色、白色为主,深浅层次不一。部分菌根被明显的外延菌丝包围,外延菌丝颜色以黑色、棕色和白色为主,特别是ECM1、CY5、ECM2、GL1、CM2、L6和YZZ29。形态学指标为后续与板栗共生的外生菌根根尖的筛选和ITS序列扩增分析提供了重要依据。

箭头所指为外生菌根
由于具有相同形态的菌根根尖可能是由相同的ECM真菌类群形成的,所以只从具有不同形态的ECM根尖中分离ECM真菌。然而,在前50个OTU中,只从10个OTU中获得了22株ECM真菌(表1)。基于序列比对,在种水平上共鉴定出13株ECM真菌,在属和门水平上分别鉴定出8和1株ECM真菌。在这些菌株中,Trichoderma菌株种类最多(6株),Fusarium(4株),Penicillium(3株),Talaromyces(3株),Pestalotiopsis(2株),Ilyonectria、Castanediella和Leptodontidium各1株。
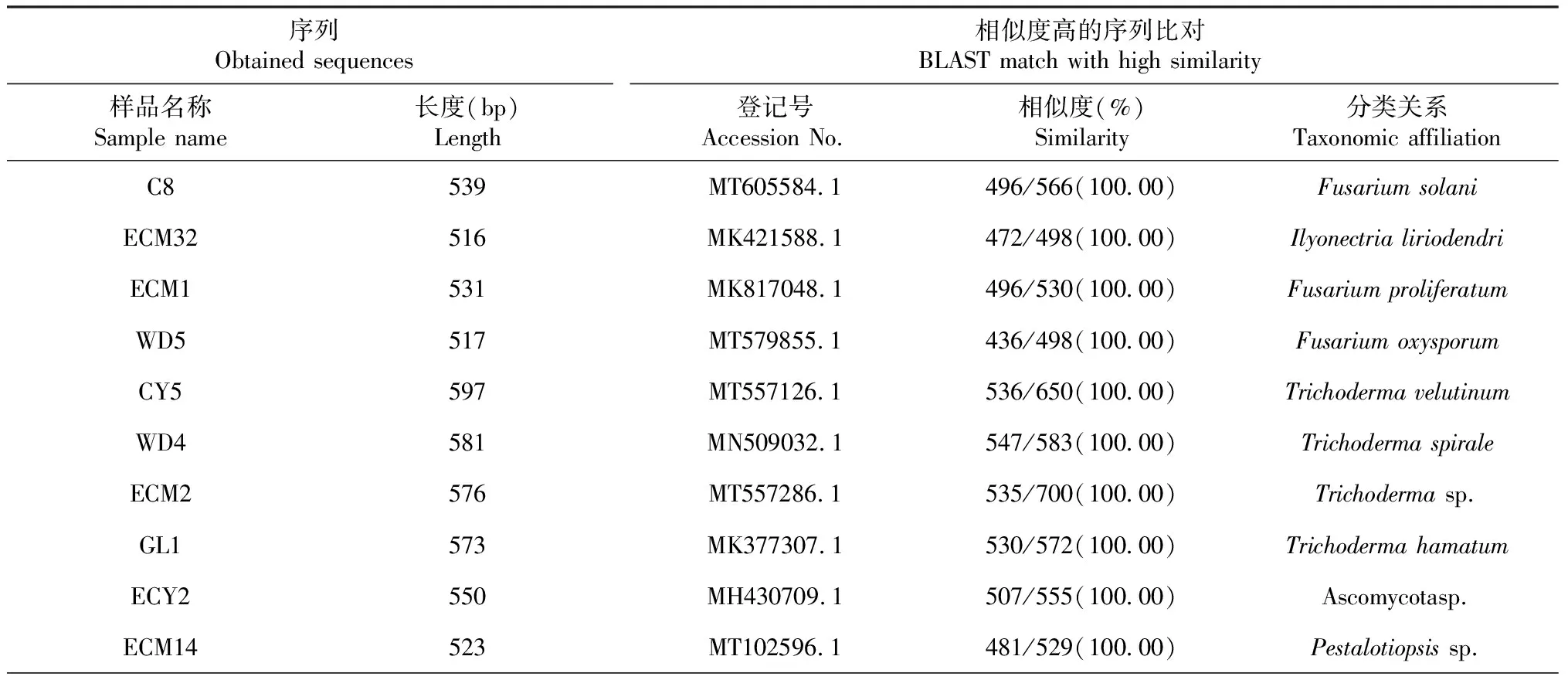
表1 分离菌株ITS序列与GenBank数据库比对结果
将所有获得的ECMF 的ITS序列与GenBank数据库中其近亲属序列进行系统发育分析,如图5所示。已鉴定的11株菌具有生物防治功能,分别属于Fusarium、Trichoderma、Talaromyces和Penicillium。
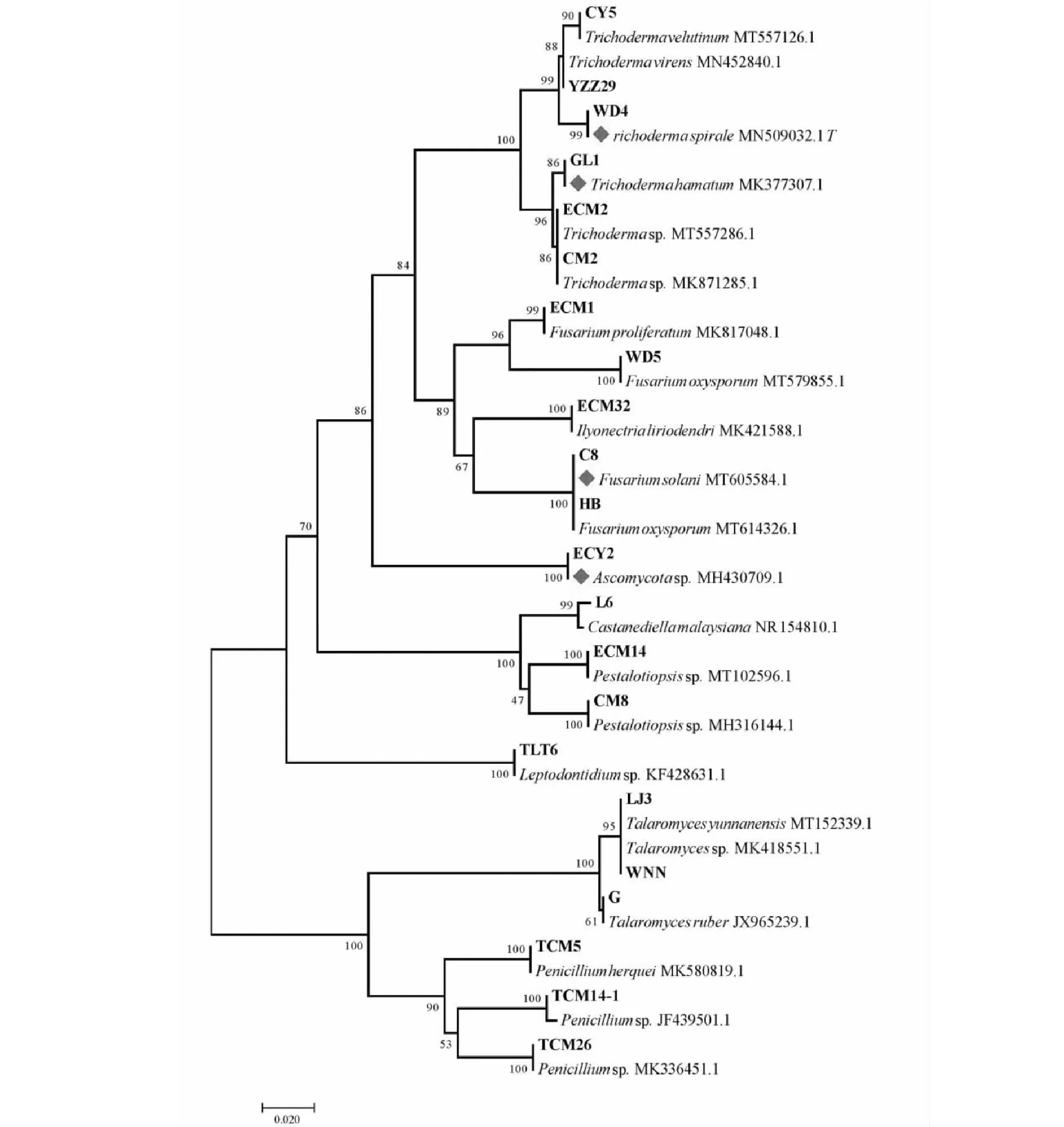
菱形标记表示前期报道的具有生防作用的真菌,该进化树使用邻接法构建[33],图示为分值长度和等于0.95921366的最优进化树。分支旁显示了在引导测试中关联类群聚类的复制树的百分比(1000个重复)[34]。进化树是按比例绘制的,分枝长度与用来推断系统发育树的进化距离单位相同,进化距离是以每个位点的碱基替换数为单位采用最大复合似然法计算的[35]。该进化分析用MEGA7软件完成,一共涉及44条核苷酸序列,所有空格和缺失数据的317个位置均被剔除[36]
3 讨 论
本文对罗田板栗ECM真菌群落进行了调查,在属水平上共发现50个ECM真菌类群。在所有的样品中,丰度前20的种分别属于Basidiomycota(约占60%),Ascomycota(约占 30%),Mortierellomycota(约占5%)和未分类真菌(约占5%)。此外,5个优势类群:Lactarius、Guehomyces、Inocybe、Russula和unclassified_Thelephoraceae都属于Basidiomycota。
虽然物种丰富度存在差异,但物种丰富度最高的属为Lactarius,占所有菌株的63.9%,是罗田板栗的优势属。据统计,在葡萄牙东北部、美国和意大利板栗的板栗果园中发现了数十种ECM真菌,其中Lactarius是优势属之一[16, 37-39]。此外,本研究中检测到的分别占4.56%、3.93%、1.63%和1.3%的Inocybe、Russula、Tomentella和Tricholoma均为已报道的板栗菌根真菌[16, 37, 39-40]。基于以上结果,可以推断Lactarius、Inocybe、Russula、Tomentella和Tricholoma可能是与板栗共生的广谱真菌。不仅如此,除了Tricholoma的上述其余4个属均能与壳斗科植物共生[41-44]。上述结果表明,Lactarius、Inocybe、Russula和Tomentella的ECMF可能是壳斗科植物的重要共生类群,在壳斗科植物的生长发育中发挥着重要作用。然而,与其他板栗园ECM真菌群落结构相比,研究区板栗外生菌根群也表现出一定的特殊性:Gyroporus、Verticillium等7个类群此前均未见报道,它们可能是罗田板栗林区特有的,但该结果有待进一步研究证实。
Trichodermasp.是最成功的生物防治有益菌之一,在农业生产微生物病害防治中发挥着重要作用。Murolo等[45]发现Trichodermaspp.对Cryphonectriaparasitica引起的栗疫病有一定的抗性。Banerjee等[46]的研究结果表明Trichodermavirens能抑制引起黄檀属枯萎病菌株80%的菌丝生长。Baiyee等[47]发现TrichodermaspiraleT76-1对Corynesporacassiicola或Curvulariaaeria引起的莴苣(LactucasativaL.)叶斑病具有生物防治活性。通过将孢子悬浮液加入移植盆栽组合,并将生菜幼苗种植到小菌核菌侵染的区域,在非常高的疾病压力(100%)下,与未处理的对照相比,TrichodermahamatumLU595和LU593可以减少30%~50%的患病率[48]。此外,研究发现,作为细胞壁降解酶(CWDEs)生产者的TrichodermavelutinumACR-P1可被开发用于生物防治[49]。除Trichodermasp.外,Fusariumsp.在生物防治中也起着重要作用。Singh等[49]发现,从民间药用植物CissusquadrangularisL.中分离的FusariumproliferatumACQR8具有抗菌潜力。此外,一株非致病性Fusariumoxysporum被证明是一种潜在的橄榄黄萎病生物防治剂[45]。Wei等[50]研究表明,FusariumsolaniCEF559在田间试验中减少30.1%~56.3%枯萎病的发生。Alam等[51]研究表明,施用植物生长促进菌(PGPF)Penicilliumsp.EU0013作为生防剂,可以有效地防治茄藻引起的秋葵根腐病。Miyake等[52]从一株水稻幼苗中分离得到的Talaromycessp.KNB422对几种水稻幼苗病害有较好的防治效果。上述结果表明,本研究分离得到的菌株T.velutinumCY5、T.virensYZZ29、T.spiraleWD4、T.hamatumGL1、F.proliferatumECM1、F.oxysporumWD5、F.oxysporumBH、F.solaniC8、Penicilliumsp.TCM14-1、Penicilliumsp.TCM26和Talaromycessp.WNN可能也具有潜在的生物防治功能。
然而,本研究仅分离到少数(22株)板栗菌根真菌,其中只有7株(均属于Ascomycota)属于丰度前20的分类群,其余15株为稀有种。可能有以下几个原因:①非培养菌活菌(Viable but non-culturable,VBNC)占自然环境微生物的99%以上,目前,在实验室用常规方法无法分离得到这些菌株[53],部分ECMF可能属于VBNC,导致可培养ECMF比例降低;②由于两个或两个以上近缘种在形态上的相似性,通过形态分型可能将它们归为一类,这可能增加准确区分ECM根(删除根)的误差,并导致可培养ECMF的低估;③单季度取样也可能会在准确探索ECM真菌种类方面造成误差,因为ECM真菌种类可能随天气条件,特别是降雨而波动;④由于对目标微生物所处的自然环境缺乏了解,例如对在微生物生长和代谢过程中起关键作用营养因素的认识不足,不同生理阶段对底物浓度的要求以及生长所需环境条件变化规律不明,导致无法为目标微生物生长提供营养需要和培养条件[54];⑤一些寡养或生长缓慢的微生物细胞通常形成超细菌落。如果培养时间不够或者检测技术的灵敏度不高,那么这些微生物的生长就不容易被检测到,往往被忽视,并被定义为“未培养”[55]。因此,采用单一培养基(PDA)和仅仅一周的培养时间可能会导致很多ECMF无法培养。综上所述,连续长时间多采集根系样品、改善分离方法和培养条件,才能更准确地了解ECM真菌的多样性,获得更多可培养的ECM真菌。
4 结 论
通过对罗田板栗菌根真菌的系统研究,本研究揭示了罗田板栗菌根真菌的群落结构,并分离得到11株具有潜在生物防治功能的菌根真菌,为罗田板栗病害科学防控奠定基础。
