基于链接独立成分分析的神经精神疾病多模态MRI研究进展
2022-05-28胡冰谭萱羽刘婉晴李丹阳张清
胡冰,谭萱羽,刘婉晴,李丹阳,张清
作者单位:大连大学附属中山医院放射科,大连116001
多数神经退行性疾病及精神障碍类疾病发病机理复杂多变,导致较高的发病率与致残率,使临床诊疗方面存在较大困难。在诊断方面,影像学从传统多模态MRI 分析逐渐向数据融合分析发展,为这些疾病的功能、结构等研究提供了多种手段。传统多模态MRI 数据分析是基于单个模态分别分析,再在统计阶段对数据进行简单的比较或相关性分析,导致最终结果较分散,可重复性较低,不能有效利用各模态之间的先验交互信息。而数据融合分析则是在统计分析之前对数据本身进行融合,利用各模态数据间的互补性,提供多角度、多层次的综合视角,从而更深入透彻地揭示与神经精神疾病相关的复杂病理机制。
链接独立成分分析[1](linked independent component analysis,LICA)是一种基于数据驱动的多模态数据融合分析方法,可以同时对不同模态进行独立成分分析。相对于其他融合方法,该方法在约束的嵌入方面条件更加宽松,模态组之间可具有完全不同的单位、信噪比、体素计数、空间平滑度和强度分布。此外,该方法能够自动确定每个模态的最佳权重,以提取出单模态及多模态独立成分。因此LICA 凭借其可重复性强、可适性高的优势,在神经精神疾病,尤其是神经退行性疾病及精神障碍疾病等疾病领域应用较广泛。
1 LICA基本原理
独立成分分析[2](independent component analysis,ICA)在磁共振数据处理的应用已经开展近二十年,它是一种盲源分离技术,不需要先验假设模型,而是基于数据驱动将观察到的磁共振信号直接分离成一系列的独立成分,但其只能对单一模态数据进行分析处理。
LICA 是在ICA 的基础上使用模块化贝叶斯框架,同时建模和发现多个模态之间的共同特征,这些特征可能具有完全不同的单位、信噪比、体素计数、空间平滑度和强度分布。链接ICA有两种配置:一种是“链接张量ICA”,另一种是“链接矩阵ICA”,在这两种配置中均使用贝叶斯张量ICA 对每个模态进行建模,所有模态之间共享的被试加权矩阵会自动平衡各模态的信息,每个成分(independent component,IC)由单个被试权重和每个模态中的一张空间地图组成。LICA根据变分贝叶斯这一完全概率方法自动确定每个模态的最佳权重,甚至可以检测到单模态成分,但因其链接分析模型可以更好地解释特异性,因此优于单模态独立成分分析。
在该模型中,“模态”被定义为单个对比度图像,即从数据中提取出的特征,不同的模态具有不同的单位、信噪比等,单个数据分析可能会产生多个不同的对比度图像,例如,扩散张量成像(diffusion tensor imaging,DTI)分析可以生成各向异性分数(fractional anisotropy,FA)、平均扩散率(mean diffusivity,MD)分和扩散张量模式(diffusion tensor mode,MO)等,因其包含不同的互补信息被视为多模态,将相似的模态收集到“k个模态组”中,同一模态组中的模态空间上彼此对齐,并具有相同的空间掩码、相似的空间属性。使用贝叶斯张量ICA 模型对每个模态组建模。对于每个模态组k,使用张量分解将数据表示为若干个成分之和,其中每个成分i=1,2,…,L可以表示为体素、被试以及模态的张量乘积,如下所示:

2 LICA在神经退行性疾病中的应用
2.1 阿尔茨海默病
阿尔茨海默病(Alzheimer′s disease,AD)是一种与年龄增长密切相关的中枢神经系统退行性疾病,其特征是记忆障碍和认知功能逐渐下降等[3]。Groves 等[1]首次提出LICA 这一方法,并将其应用于AD 研究。结果表明AD 患者MD 普遍增加、灰质体积减小,胼胝体和大钳FA和MO减少,内囊、放射冠和上纵束等上纵束穿过下行纤维的区域FA和MO增加,笔者推测其原因可能是交叉纤维区域弱势纤维选择性退化导致的代偿性增加。
Kincses等[4]用LICA对AD患者的DTI数据进行了分析,发现了两个具有组间差异的成分。IC0 以轴向扩散系数(axial diffusivity,Da)增加为主,主要分布在胼胝体、放射冠、上纵束等白质纤维束交汇处以及中颞结构。IC3主要是Da和MD变化,表现为左侧海马旁轴向扩散率增加左侧楔前叶皮质旁MD增加。该研究结果表明AD 的扩散变化主要是由轴向扩散率的增加引起的,而且轴向扩散率的增加与平均扩散率、径向扩散率的增加平行,这可能表明轴突丢失是病理关键,并且支持晚期髓鞘相关纤维的白质解体[5]与华勒氏变性相关解体[6]并存。
Doan等[7]运用LICA分析了AD、轻度认知障碍(mild cognitive impairment,MCI)和主观认知障碍(subjective cognitive impairment,SCI)患者的五个DTI 指标、两个交叉纤维指标以及白质连接密度(white matter connection density,CDM),识别出对AD 高度敏感的多模态成分,且其结果分布比单模态分析更为广泛。其主要成分IC0 是一个对疾病严重程度高度敏感的多模态成分,扩散率指标占该成分的33%,包括枕、颞、顶、额叶以及胼胝体、穹窿,该成分与认知呈正相关,与执行功能呈负相关,反映全脑扩散率随着认知障碍的进展而增加,这与Cremers 等[8]的研究相符。FA、MO 和f1 (dominant fiber map,f1)的普遍协调下降表明非痴呆者在大多数白质区域保留了优势纤维,如胼胝体膝部和穹窿,FA、MO及f1的增加主要局限于半卵圆中心、皮质脊髓束。半卵圆中心、胼胝体压部的f2 (non-dominant fiber map,f2)增加表明非痴呆者的非优势纤维方向保持不变。此外,CDM 约占IC0 的5%,它提供了基于交叉纤维模型的全脑体素概率束成像的白质连接的独特特征,AD 中已知与疾病有关的通路CDM 降低,如穹窿、钩状束和胼胝体膝部,而投射通路、包括双侧皮质脊髓束在内的运动相关通路的CDM 增加,这一结论支持了AD 逆行模型假说[5]。此外,相较于基于感兴趣区的传统分析,IC0 对AD 与SCI 之间产生了更大的分类效应和更高的组分类准确性(AUC=0.80),这表明LICA 是一种研究AD 患者白质差异性的敏感方法。IC21 是一个与年龄无关但与认知呈负相关的诊断成分,主要表现为两侧胼胝体和内囊的CDM 增加,该成分可以识别分类AD 和MCI (AUC=0.70),推测可能是由于AD 患者更依赖保留的白质束,而不是更受影响的边缘系统。该研究结果表明AD 谱中的病理生理过程与白质结构畸变相关,其大小与临床严重程度密切相关,为AD 的白质结构研究提供了一个新的视角。但是研究仅从DTI模态出发,发现了AD患者白质相关变化,未来的研究应该着重于跨成像模态(结构MRI、扩散MRI、功能MRI等)组合特征。
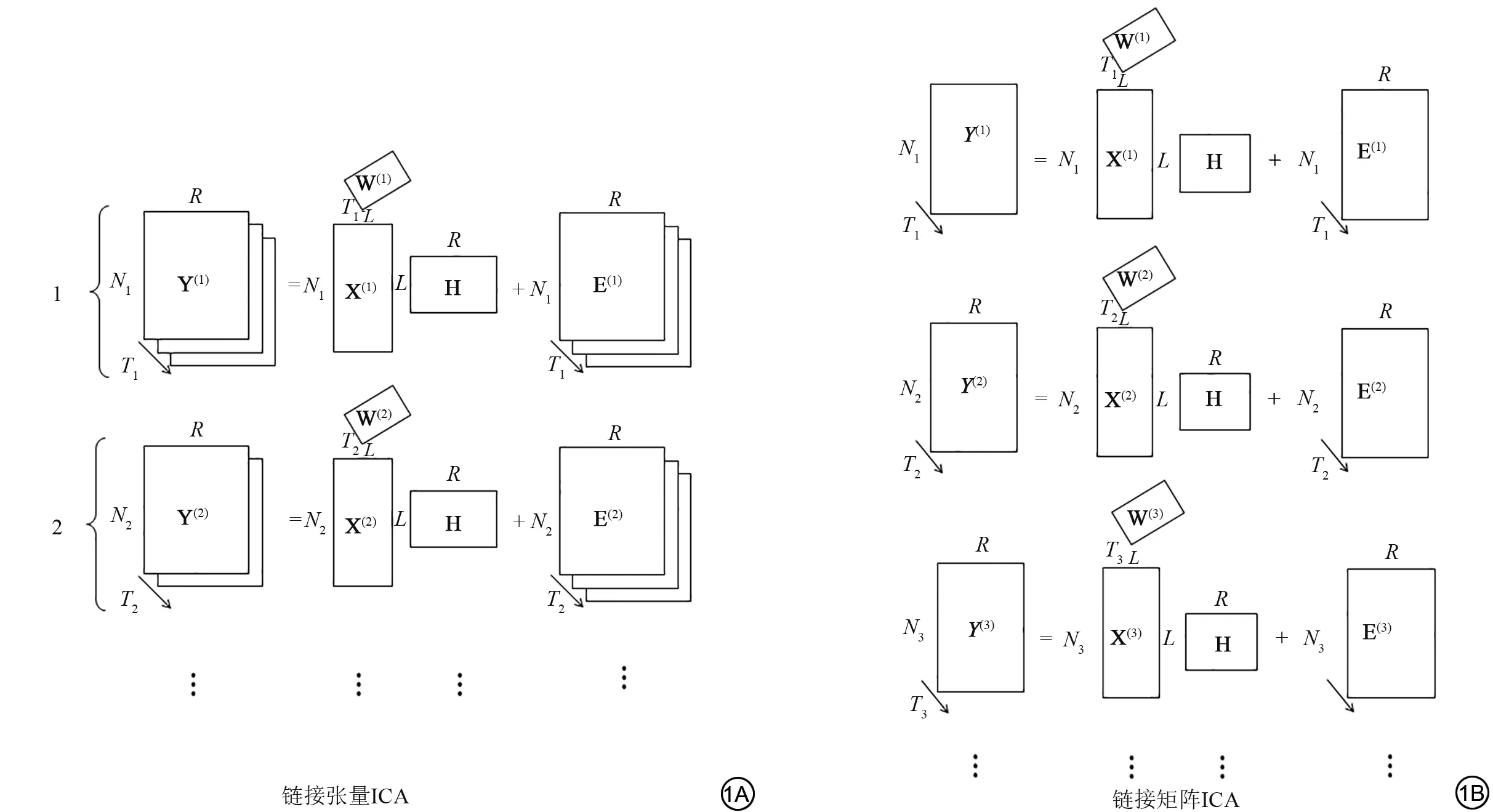
图1 多模态数据Y 的链接独立成分分析示意图,X(k)代表空间地图,W(k)代表模态权重,H 代表共享的被试加权矩阵,E(k)代表残差。1A:链接张量ICA,每个模态组对应单独的张量ICA,其数据维度为Nk × Tk × R (体素×模态×被试)。每个模态组包含一个或多个模态数据;1B:链接矩阵ICA,所有模态通过被试加权矩阵H 链接在一起。Fig. 1 The diagrammatic sketch of the LICA that models multimodal data Y, spatial map X(k), modality weights W(k), a shared subject-weighting matrix H,residual E(k). 1A: Linked tensor ICA, each modal group corresponds to a separate tensor ICA, and its data dimension is Nk × Tk × R (voxels×modalities×subjects).Each of the modality groups contains one or more modalities.1B:Linked flat ICA,all modes are linked together through subject weighting matrix H.
Doan等[9]运用LICA 分析了AD、MCI 和SCI 患者的灰质结构,并使用LASSO分类器(lesat absolute shrinkage and seletion operator,LASSO)评估了LICA 成分对AD 以及早期和晚期正常衰老的敏感性和诊断准确性,发现3 个成分对AD 的诊断和认知状态敏感性较高,IC0 以皮质厚度和灰质密度为主,是衰老和AD 之间的共同特征,随着年龄的增长,皮质广泛变薄,这与Vidal-Pineiro 等[10]的发现一致,灰质密度则是双向性变化,既有增高也有减低,表明皮质厚度和灰质密度之间存在脑区域差异,推测其可能与年龄差异有关。而IC5与IC9则是AD特异性特征。IC5 以晚期内侧颞叶萎缩为主,AD 患者内嗅皮层、海马和岛叶的皮质厚度和灰质密度协调性减低,但该研究表明内侧颞叶萎缩并非AD的特异性表现,这一点与Fjell等[11]的研究一致。IC9代表皮质厚度和灰质密度的前后梯度变化,是唯一与诊断相关但与年龄无关的成分,表现为对称性分布的皮质厚度和灰质密度由前向后呈梯度降低,如楔前叶、后扣带回皮质变薄,灰质密度减低。在分类方面,发现LICA 多模态成分可以高精准度预测AD 和衰老[早期(18~45 岁)、晚期(45~90 岁)和全年龄范围R2分别为0.42、0.62 和0.77],还观察到AD 和健康人之间的高分类性能(AUC=0.87),符合理想生物标志物的要求。Doan等[9]还发现早发性AD枕叶和顶叶萎缩最为严重,而晚发性AD 则是海马明显萎缩,支持早发性和晚发性AD 发病机制并不相同。该研究表明衰老和AD 之间既有共同的特征,也有独有的特征,共同的大脑变化是全局性的,而差异变化更趋向于局部,为AD 的研究提供了一个新的方向。该研究同样仅对AD 患者的结构MRI 进行了分析,未来的研究应结合功能MRI评估AD患者的脑影像变化。
2.2 帕金森病
帕金森病(Parkinson′s disease,PD)是一种神经退行性运动障碍,病理改变主要是黑质中的多巴胺能神经元进行性退变[12]和α-突触核蛋白的广泛聚集[13]。运动迟缓、静止性震颤和异常步态为其运动症状特征,神经认知和精神症状为非运动症状。
Klein 等[14]使用LICA 研究了早期PD 的皮质变化,发现了一个与诊断明显相关的多模态成分,该成分主要由背外侧前额叶皮质、扣带回、运动前皮质和顶上小叶的FA 减少所决定,表明PD 早期的皮质多模态变化主要以扩散率为主,提示皮质微结构的不完整,且其程度与认知能力相关。而该成分中中边缘皮质、体感皮质和上顶叶皮质MD 的增加表明组织完整性或细胞总体性丧失。此外,该成分中还包括顶叶外侧和右前额叶皮质的稀疏扩散率减少。该研究证实并拓展了既往关于PD患者FA的研究,为早期PD患者的认知状态和皮质微观结构之间提供了联系,而且这些变化在单模态分析中未被发现。
Andica 等[15]使用轴突定向弥散和密度成像(neurite orientation dispersion and density imaging,NODDI)和LICA评估了与帕金森病神经认知和精神障碍相关的白质微结构改变,探寻到一个与诊断明显相关的多模态成分IC1,细胞内体积分数(intracellular volume fraction,ICVF)占最高权重(59%)。ICVF 作为NODDI 的一个指数,反映了神经轴突密度。PD患者轴突密度普遍降低,表明PD白质病理的一个主要因素是以ICVF 减少为标志的轴突丢失,而且与神经认知和精神障碍有关,与不伴有神经认知和精神障碍的患者相比,前者轴突密度下降更广泛,以后部为主,如胼胝体大钳、扣带回、内囊后肢及上纵束等一些长联合纤维。证明PD患者的大脑后部在神经认知和精神障碍进展中起着重要作用,这与Zhang等[16]、Kamagata 等[17]的研究结果相吻合。该研究结果表明ICVF 可作为一种与帕金森病神经认知和精神障碍相关的大脑皮层微观结构变化的生物标志物。
2.3 亨廷顿病
亨廷顿病(Huntington′s disease,HD)是一种由HTT 基因突变引起胞嘧啶-腺嘌呤-鸟嘌呤(cytosine-adenine-guanine,CAG)三核苷酸重复序列异常增殖的遗传性神经退行性疾病,其症状包括运动障碍、认知功能障碍以及精神症状[18]。尽管潜在基因突变相同,但每种症状的突出程度却有高度的异质性,这可能是由不同神经回路的退行性变程度的差异导致的。
Garcia-Gorro 等[19]首次将LICA 应用于HD,根据亨廷顿病统一评定量表(Unified Huntington′s Disease Rating Scale,UHDRS)的诊断置信分数(diagnostic confidence score,DCS),将HD基因携带者分为显性和预显性两组,对其灰质和白质数据进行融合分析,结果发现HD 的认知和运动症状具有共同的神经生物学基础,而精神症状则呈现出不同的神经特征,这与Kim 等[20]研究一致,其原因可能是所涉及的皮质-纹状体回路及多巴胺能途径不同。该研究还发现与认知-运动症状相关的空间地图和与精神症状相关的空间地图之间存在较大差异,而且重叠程度较低。认知和运动症状与涉及该功能脑区的皮质厚度、灰质体积及结构连通性减低有关,如辅助运动区和躯体感觉皮层的皮质厚度变薄和灰质体积减小,皮质脊髓束和胼胝体连通性减低,且各模态对此贡献程度大致相同。精神症状则是与情绪处理相关脑区中皮质厚度变薄、灰质体积减小和白质连通性的减低相关,且以明显左侧化的皮质厚度变薄为主,这与Tu 等[21]关于抑郁症的研究一致。此外,该研究还表明HD 患者的抑郁症状与纹状体变性无关,因此抑郁症状在疾病不同阶段各有变化,但与疾病进展无关[20],然而认知和运动障碍与疾病分期有显著关系,随着疾病的进展而恶化[22]。该研究表明对HD 的研究应考虑个体差异,开拓了一种新的视角。
3 LICA在精神障碍疾病中的应用
3.1 精神分裂症
精神分裂症(schizophrenia,SZ)是一种以妄想、幻觉和思维混乱为特征的精神类疾病,具有显著的认知功能障碍[23]。关于SZ患者脑多模态MRI研究向来是热点,包括皮质厚度、表面积、灰质体积的减少[24]、额颞白质束破坏[25]、额颞叶之间的连接改变[26]。
Brandt 等[27]采用LICA 测试了在n-back 工作记忆任务中由静息态磁共振激活产生的任务阳性(额顶网络)和任务阴性(默认网络)脑网络与大脑灰质指标之间的关联,结果发现SZ患者的额顶叶网络激活与额颞叶灰质厚度之间存在显著且稳健的功能-结构关系,额顶网络的激活随着厚度的增加而增强,表明大脑结构和功能在相关区域的整合中断,该发现与Nemoto 等[28]的文章所述一致,反映神经元和突触水平的改变对认知网络及加工产生了影响。该研究表明,认知加工过程中的大脑激活与大脑形态计量学之间存在复杂的耦合关系,扩展了先前关于SZ额颞部异常的发现。
Doan等[29]用LICA对SZ和双相情感障碍的灰质结构进行了研究,发现了6个具有生物学意义的成分,其中2个成分反映了全脑皮质厚度和表面积,IC1以全脑表面积为主,且是SZ特有,SZ患者的全脑表面积减小,这一发现与Gupta等[24]的文中所述相符。IC2反映全脑皮质厚度,SZ和双相情感障碍患者整体皮质变薄,且双相情感障碍患者更甚,这与Takayanagi 等[30]的研究一致。另有4 个成分反映大脑的局部变化。IC5 主要由皮质厚度和灰质密度图(gray matter density maps,GMD)驱动,SZ 和双相情感障碍患者扣带回、岛叶等区域皮质厚度和GMD 增加,白质密度(white matter density, WMD)降低,这种变化模式符合气球模型假设,即随着白质的生长,皮质柱拉伸并变薄,表明SZ和双相情感障碍患者皮质厚度和GMD的增加可能是由于白质体积以及皮质柱分化减少所致。IC8 由颞叶外侧、顶叶和额叶内侧皮质厚度变薄以及颞叶、枕叶和海马GMD减低决定,而且该成分和处理速度呈正相关性,SZ比双相情感障碍更强(P=0.0037 vs.P=0.0435),与Karbasforoushan 等[31]的研究相符。IC12表现为皮质厚度的由前向后呈梯度变薄,类似于Chen 等[32]文章中的前后区域化模式,而且这种变化超过了整体皮质变薄(IC2),体现了LICA的一个重要优势,就是能够将整体皮质变薄单独建模成一个独立成分,从而揭示IC12所反映的更细微的相对皮质厚度变化。IC25 反映了SZ 患者小脑GMD减少,有力地支持了既往关于SZ和双相情感障碍[33]的研究,也符合Moberget 等[34]的研究,强调了小脑与严重精神障碍的病理生理学的相关性[35]。值得注意的是这些发现在以前的单模态分析方法中并未显示。此外,该研究的群体分类结果表明脑成像、认知表现和多基因风险的之间具有互补价值,添加多基因风险和成像特征可以显著提高分类准确性(AUC=0.85)。
3.2 抑郁症
抑郁症是一种病程长且易复发的心境障碍类精神疾病,表现为持久的情绪低落、意志力的减退、思维迟缓等[36]。Maglanoc 等[37]采用LICA 对抑郁症患者的皮质微结构、白质扩散指标和静息态功能磁共振的默认网络(default mode network,DMN)振幅进行融合分析,发现有两个灰质结构为主的成分(IC1、IC7)与年龄呈负相关,年龄越大,全脑体积越小,表面积越小,全脑皮质变薄,这与Fjell 等[38]的研究相符合。IC1与性别之间也存在相关性,女性的全脑体积及表面积比男性小,这与牟静平等[39]研究一致。而IC2是一个白质微结构变化为主的多模态成分,FA 权重最高,随着年龄的增加,全脑FA降低,径向扩散系数(radial diffusivity,Dr)与MD 在一定程度上增加,这与既往关于老化[40]的研究一致。IC5 的主要贡献者为DMN 振幅,与年龄呈负相关,这与Mowinckel 等[41]的研究相同,而且男性比女性具有更高的DMN 振幅,补充了Mowinckel等[41]、Weissman-Fogel等[42]的发现。IC13同样是一个以FA 为主的多模态成分,表现为女性的皮质脊髓束、部分上纵束和丘脑后辐射的FA 较男性更低,这与Ritchie 等[43]的研究一致。
4 小结与展望
LICA 作为一种多模态数据融合方法,有着相较于其他融合方法的独特优势,在假定所有模态对被试的影响相同的同时,自动确定各个模态的最优权重,而且对于各模态组的单位、噪声水平、空间平滑度和强度分布并无特殊要求。该方法能够充分挖掘多模态MRI 数据信息,从不同角度探索神经精神疾病在大脑功能以及结构上的变化,并且该方法已经在多种神经精神疾病的病理生理机制、临床诊断及分类识别等方面取得了丰硕的成果。然而该方法也存在如下的不足之处:(1)对于多模态的选择问题,如何保持融合后各个模态优势最大化,减少融合过程中的信息损失,采用何种模态融合能取得较优结果,因此在融合分析时需进行多种模态组合结果比较,甚至与单一模态结果进行比较;(2)研究不应仅针对各种影像数据,还可以充分利用其他可采集到的如病理切片、基因及临床行为学等数据进行融合分析,能够更好地从不同角度揭示各种神经精神疾病的机制,挖掘与感兴趣指标密切关联的脑影像变化,辅助临床诊疗,甚至实现认知能力与治疗疗效的个体化预测;(3)该方法在处理分析大尺寸高维度数据时对硬件要求较高,运算量较大,而且它假设各模态之间的被试影响一致,这种约束属于强约束,制约了该方法的进一步应用。
如今,深度学习在各个研究领域有着广泛的应用。深度学习是一种数据驱动学习技术,其模型特点是数据量大、神经网络层数深、结构复杂等,导致其可解释性较差。多模态融合技术可以充分利用多模态之间的互补性,获得更完整特征信息,使得在保证模型效果的情况下,可以在学习的过程中对不同的特征进行不同程度的强化,这对深度学习的可解释性有一定的帮助。随着神经精神疾病MRI 数据研究的进一步深入以及对算法的创新改进,相信LICA 在多模态数据融合分析中能够得到更广泛的应用以及更大的发展与突破。
作者利益冲突声明:全体作者均声明无利益冲突。
