楸树茎腐病致病菌的分离鉴定及不同楸树材料抗病性差异
2022-05-27王曙光娄长城王利民张和臣
杨 潇,王曙光,梁 慎,娄长城,王利民,师 曼,张和臣
(1. 西南林业大学 生命科学学院,云南 昆明 650224;2. 河南省农业科学院 园艺研究所,河南 郑州 450002)
楸树(Catalpa bungei)是紫葳科(Bignoniaceae)梓属(Catalpa)落叶乔木,栽培历史悠久,分布地区广泛,是我国特有的珍贵优质木材和园林观赏树种,具有很高的生态效益和经济价值[1-3]。由于楸树大面积苗圃种植结构单一,管理稍有不善,易受到炭疽病、根结线虫病[4]等一些病害的影响。近些年,楸树人工栽培和繁育面积不断扩大,一些新的病害也随之产生,如楸树茎腐病,其对楸树危害十分严重,症状表现为楸树苗木在移栽后出现长势衰弱、树冠萎蔫、茎基部组织褐色病变的现象,严重时导致植株死亡。目前,国内尚未见楸树茎腐病的相关报道,鉴于此,采用柯赫氏法则对楸树茎腐病的病原进行分离鉴定,明确其病原菌,并在此基础上评价3 个楸树材料对茎腐病的抗性,以期为楸树茎腐病的防治及抗性品种选育提供参考。
1 材料和方法
1.1 材料
楸树茎腐病植株于2020年春、秋两季采集自位于河南省新乡市平原新区的河南现代农业研究开发基地楸树苗圃。抗病性评价试验中3种供试楸树材料均来自上述苗圃,均通过组培繁殖获得,分别为CJS[金丝楸(Catalpa bungivar.Jinsi)]、CL1(洛楸1号)、CZ2[以豫楸2 号为母本、灰楸(Catalpa fargesiiBur.)为父本杂交选育的后代]。
1.2 培养基
PDA 培养基:马铃薯浸粉3 g、葡萄糖20 g、琼脂10 g、1 000 mL水,分装烧瓶后高压灭菌备用。
1.3 病原菌的分离和纯化
采集楸树茎腐病植株(17 株)后,清理掉表面的泥土和砂砾,在流动自来水下冲洗20 min。在植株病健交界处切取面积1 cm×1 cm、厚6 mm 样品。用75%乙醇处理30 s 后无菌水清洗2 次,然后用0.1%HgCl2处理3 min 后无菌水清洗3 次。在无菌纱布上吸干水分后,用无菌刀片去除表皮,切取内部面积5 mm×5 mm、厚3 mm 小块,每株病样取3~5块,切成薄片接种在PDA 培养基上,于28 ℃恒温光照培养箱中12 h 光/12 h 黑暗培养。待形成一定大小的菌落后,挑取边缘菌丝进行纯化。
1.4 病原菌致病性验证
将纯化后的单孢菌株在PDA 培养基上培养7~10 d,待其长满培养皿并产生大量孢子后,用无菌水配制成1×108个/mL 的孢子悬浮液。采用浸根法接种病菌,以株高10 cm 左右的CZ2 钵苗为材料,在上述孢子悬浮液中浸染20 min,以清水处理为对照。然后移栽至装有灭菌土的盆钵中,置于28 ℃恒温培养箱(湿度75%)中,12 h 光/12 h 黑暗培养。2 d 浇1次水。每个菌株接种3 株CZ2 钵苗,对照1 株。观察发病情况,初步筛选病原菌。当植株出现发病症状后,观察是否与田间发病症状一致,并切取病健交界处组织,对病原菌进行再分离和培养,验证是否与接种菌株一致。
1.5 病菌的形态和分子鉴定
1.5.1 形态鉴定 将有致病性的菌株分离纯化到PDA 培养基上,28 ℃下培养后观察形态学特征。并参照《植物病原真菌学》[5],对病原菌进行形态学鉴定。
1.5.2 分子鉴定及发育树构建 采用机械微波破壁法获取致病菌株的DNA,用于PCR 扩增[6]。取菌丝100 mg 于2 mL 离心管,加300µL 10×TE 溶液,放入一颗钢珠,置于机械破碎仪(3 000 r/min)中3 min。打开管盖置于微波炉加热至微沸,盖上管盖趁热置于离心机中,常温12 000 r/min离心5 min,取上清液冷冻保存以备PCR 扩增。采用ITS1(5′-TCCGTAGGTGAACCTGCGG-3′) 和 ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)进 行PCR 扩 增,PCR 反应体系为30µL:2×TaqMaster Mix 15µL,引物ITS1 0.5 µL,引物ITS4 0.5 µL,DNA 模板1 µL,ddH2O 13 µL。反应程序:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1.5 min,共30 个循环;最后72 ℃延伸10 min。取2µL PCR 产物进行1%琼脂糖凝胶电泳检测,以250 bp DNA Ladder Marker 为对照。PCR 产物由尚亚生物公司进行测序,将测序结果上传至GenBank,与已发表的基因进行同源性比对,利用MEGA 7.0 软件采用邻接法构建系统发育树,Bootstrap为1 000次。
1.6 不同楸树的抗病性评价
1.6.1 离体叶片穿刺法 在培养皿中放入2层灭菌滤纸,用无菌水浸湿。取成熟度一致、叶面积大小相近的叶片,用75%乙醇消毒后用无菌水清洗,擦干放入培养皿中,用接种针在叶片正面扎取3 个穿刺孔,切取生长10 d 并产生孢子的致病菌菌丝块(4 mm×4 mm)覆盖上面,于28 ℃恒温光照培养箱(12 h 光/12 h 暗)中培养,5 d 后观察发病情况。每个楸树材料10 皿为一个重复,3 次重复,每次重复以相同大小无菌PDA 培养基切块为对照,设2 皿。运用Image J 软件统计病斑面积(Lesion area,LA)。叶片病斑分级依照文献[7-8]稍加改进,按照LA大小分为5 个病级,0 级:未出现病斑;1 级:0<LA≤5%;2级:5%<LA≤10%;3 级:10%<LA≤20%;4 级:20%<LA≤30%;5级:LA>30%。
病叶率=发病叶数/总叶数×100%,
病情指数=∑(各级病斑叶数×相应级数值)/(调查总叶数×最高级数)×100。
1.6.2 植株浸根法 采用浸根法分别对3个楸树材料进行接种处理,选取健康、长势优良、株高为25~35 cm 的楸树钵苗,将根部冲洗干净后浸泡在1×108个/mL 的致病菌孢子悬浮液中20 min,每个楸树材料3次重复,每次重复10盆,每次重复设清水对照2盆。置于温室中培养,7 d 后开始观察,每隔1 d 观察统计1 次发病情况,共观察5 次。依照张亮[9]的方法,稍作改良,统计并计算发病率和病情指数。
楸树病菌侵染发病的程度分级标准为,0 级:植株健康,无任何症状;1 级:轻微感病,有1~3 片叶子出现退绿发黄,无明显卷曲症状;2级:症状较明显,有1/3 数量的叶片出现退绿发黄,伴有萎蔫、卷曲症状,叶柄无明显大幅度下垂;3 级:症状较严重,有1/2 数量的叶片出现枯黄,萎蔫,并且叶柄下垂;4级:超过半数的叶片都出现不同程度的症状,且大量树叶叶柄下垂,健康叶片所剩无几;5级:整棵植株无任何绿叶,植株基本死亡。
发病率=发病株数/总株数×100%,
病情指数=∑(病情级数×该级病情株数)/(病情最高级数×调查总株数)×100。
1.7 感病后楸树材料叶片酶活性测定
采用浸根法对3个楸树材料进行病原菌接种处理,每个楸树材料处理30 株,以无菌水为对照。取样时间为接种前0 d 和接种后3、6、9、12 d。随机采取叶位、叶龄、叶面积相近的叶片进行检测,设3 次重复。β-1,3-葡聚糖酶、超氧化物歧化酶(SOD)、过氧化物酶(POD)活性分别使用北京索莱宝科技有限公司生产的β-1,3-葡聚糖酶活性检测试剂盒(微量法)、SOD 活性检测试剂盒(微量法)、POD 活性检测试剂盒(微量法)测定。
1.8 数据分析
采用Microsoft Excel 2016 软件对数据进行处理,采用SPSS 23.0 软件进行差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 楸树茎腐病的症状
楸树茎腐病在田间呈点片发生。感病初期,植株下部叶片失绿卷缩,稍下垂;感病中期,植株叶片大面积萎蔫失绿,叶片相继下垂,但不脱落;发病后期,植株顶芽枯死,茎基部外表皮出现深褐色病变,内皮组织也出现褐色软化腐烂(图1)。地下根部发褐腐烂,推断致病菌从楸树根部和茎基部进行侵染,破坏根部和茎基部的输导组织,阻断植株地上地下组织水分和养分的交换,从而导致植株死亡。

图1 楸树茎腐病田间发病症状Fig.1 Symptoms of Catalpa bungei stalk rot in field
2.2 病原菌致病性验证
经分离纯化,共得到33 株菌株。在室内,将分离纯化的33 株菌株分别制成孢子悬浮液对楸树进行浸染,发现菌株NG0201、NG0212、GO100307侵染后,楸树植株长势明显减弱,叶片均出现萎蔫现象,与清水对照有明显差异。其中,菌株GO100307 致病速度快,致使植株出现茎腐现象,且导致植株死亡。因此,在后续试验中,以GO100307 作为供试菌株。楸树在接种菌株GO100307第6天时,叶边缘出现卷曲、萎蔫现象,叶柄微垂;第10 天,植株叶片边缘枯黄,失去水分,叶柄完全下垂,出现的症状与田间一致。将植株从盆中挖出,清洗根部后发现根部变褐,有明显的腐烂迹象;茎基部横切后发现,输导组织和薄壁组织明显发褐(图2)。同时,切取发病植株茎基病健交界处组织进行病原菌分离培养,得到菌株与接种病菌一致。根据柯赫氏法则,证明GO100307菌株为楸树茎腐病的主要致病菌。

图2 病原菌GO100307分离纯化后回接发病症状Fig.2 Symptoms after inoculation with the isolated and purified strain GO100307
2.3 病原菌形态和分子鉴定
2.3.1 病原菌形态鉴定 由图3 可见,PDA 培养基上,GO100307 菌株菌丝呈白色绒毛状,菌丝中间浓密,边缘稀薄,气生菌丝不发达,背面淡黄色。28 ℃培养6 d 左右能在菌落中间观察到明显的孢子堆,孢子堆呈黑色或墨绿色油漆状。在显微镜下观察,分生孢子梗紧密排列,光滑无色,至少2 次分支,末端分支轮生2~7 个产孢细胞,产孢细胞无色,细长,筒装或棍棒状,分生孢子为单孢,无色,形状为长卵形或椭圆形,两端钝圆。依据形态学特征,将该菌株初步鉴定为漆斑菌属(Myrothecium)。
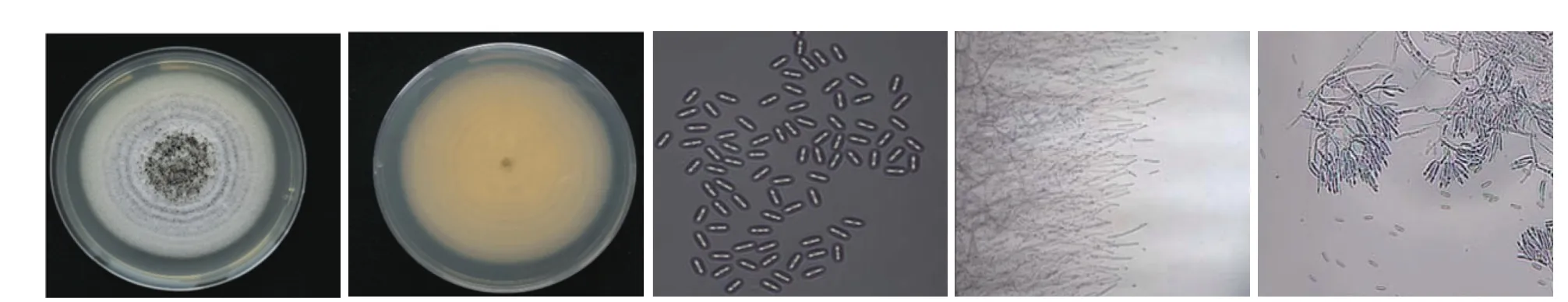
图3 病原菌形态观察Fig.3 Observation of fungus morphology
2.3.2 分子鉴定 提取GO100307 菌株DNA 后,利用ITS1 和ITS4 引物进行PCR 扩增,经1%琼脂糖凝胶电泳检测获得大小约600 bp 的基因片段(图4a)。将测序结果在GenBank 上与已发表的基因进行同源性比对,利用MEGA 7.0 软件构建系统发育树(图4b)。图4b 显 示,菌 株GO100307 的ITS 序 列 与HQ115647.1Myrothecium roridum和HQ433334.1Myrothecium roridum聚于同一分支。结合形态学鉴定和分子生物学鉴定,最终将GO100307 菌株确定为露湿漆斑菌(Myrothecium roridum)。
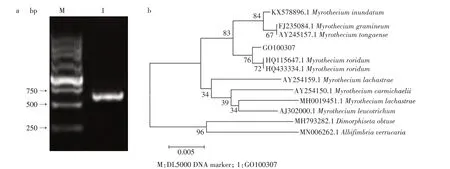
图4 PCR产物凝胶成像(a)与GO100307菌株系统发育树(b)Fig.4 PCR product gel imaging(a)and GO100307 phylogenetic tree(b)
2.4 3个楸树材料无性系的抗病性评价
2.4.1 叶片离体穿刺试验结果 将露湿漆斑菌菌块分别接种在CJS、CL1、CZ2 楸树离体叶片上,接种5 d后,3个楸树无性系叶片均出现发病现象(图5)。从表1 可以看出,病情指数为39.17~50.50。其中CZ2 病情指数最高,并与CL1 有显著差异(P<0.05),与CJS 差异不显著(P>0.05)。3个楸树材料的发病率无显著差异(P>0.05),但CZ2 发病率最高(表1)。综合对比,在离体叶片穿刺试验中,CL1 抗性最好,CZ2 最差。观察发现,CL1 叶片表面革质化程度高于其他2 个楸树材料,这可能是其叶片离体穿刺试验发病率低于其他2个楸树材料的原因之一。

图5 3个楸树材料叶片穿刺试验差异Fig.5 Differences in leaf puncture experiments of three Catalpa species
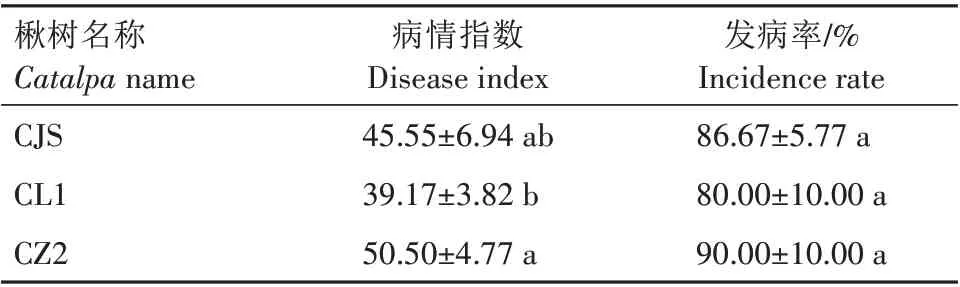
表1 露湿漆斑菌对不同楸树叶片离体穿刺情况对比Tab.1 Comparison of in vitro puncture of different Catalpa tree leaves by Myrothecium roridum
2.4.2 楸树浸根法试验结果 通过浸根法对3个楸树材料进行接种,在第15 天统计最终发病情况(图6)。表2 可见,3 个楸树材料均出现感病现象,病情指数为26.67~37.33。CJS 病情指数最低,显著低于其他2 个楸树材料(P<0.05),CZ2 与CL1 病情指数相差1.33,差异不显著(P>0.05);CJS 发病率最低,但3 个楸树材料的发病率并无显著差异(P>0.05)。综合对比,三者对茎腐病的抗性为CJS>CL1>CZ2。
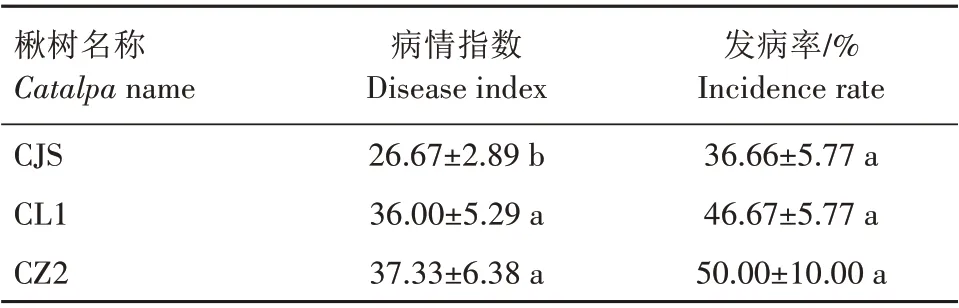
表2 露湿漆斑菌孢子悬浮液对不同楸树材料的浸染情况对比Tab.2 Comparison of Myrothecium roridum infestation of different Catalpa species

图6 3个楸树材料无性系浸根试验差异Fig.6 Differences in root immersion tests of three Catalpa species
2.5 浸根接种致病菌对3个楸树材料叶片酶活性的影响
2.5.1 β-1,3-葡聚糖酶活性 从图7 可以看出,CJS 接种后β-1,3-葡聚糖酶活性在第3 天达到峰值,之后逐渐下降;CZ2 在接种后β-1,3-葡聚糖酶活性先下降,于第6 天达到最低值,然后逐渐回升,呈“V”字形;CL1 在接种后第6 天β-1,3-葡聚糖酶活性达到峰值,然后趋于平稳。3 种楸树酶活性峰值表现为CJS 比CZ2 和CL1 分别高出7.12% 和14.89%,且峰值时间最早。说明抗性较好的楸树材料在接种病原菌后能较快地产生抗性反应,其自身的β-1,3-葡聚糖酶活性会迅速升高,以此来应对病原真菌的侵染。
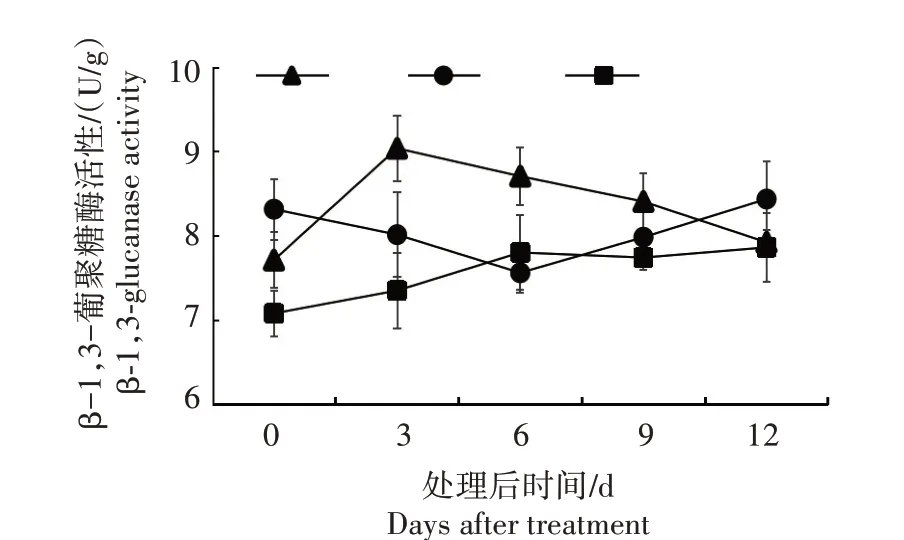
图7 3个楸树材料处理后叶片β-1,3-葡聚糖酶活性变化Fig.7 Changes of β-1,3-glucanase activity in treated leaves of three Catalpa species
2.5.2 SOD 活性 从图8 可以看出,CJS 在接种后SOD 活性先上升再下降,第9 天达到峰值;CZ2 在接种后SOD 活性先是持续下降,第6天时达到最低值,随后急剧上升然后又稍有下降;CL1 接种后SOD 活性增加迅速并在第6天达到峰值,随后逐渐下降。3个楸树材料中,CL1 SOD 活性峰值最高,比CJS 和CZ2 SOD活性峰值分别高6.67%和35.07%。
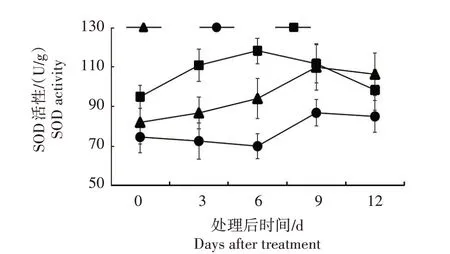
图8 3个楸树材料处理后叶片SOD活性变化Fig.8 Changes of SOD activity in treated leaves of three Catalpa species
2.5.3 POD 活性 从图9 可以看出,CJS 在接种后POD 活性迅速上升,在第6 天达到峰值后下降;CZ2在接种后POD 活性呈“M”形的双峰现象;CL1 接种后POD 活性在第3 天达到峰值后呈下降趋势。3 个楸树材料在接种后POD 活性普遍上升,且以CJS POD 活性较高,其活性峰值比CZ2 和CL1 峰值分别高25.00%和11.11%。
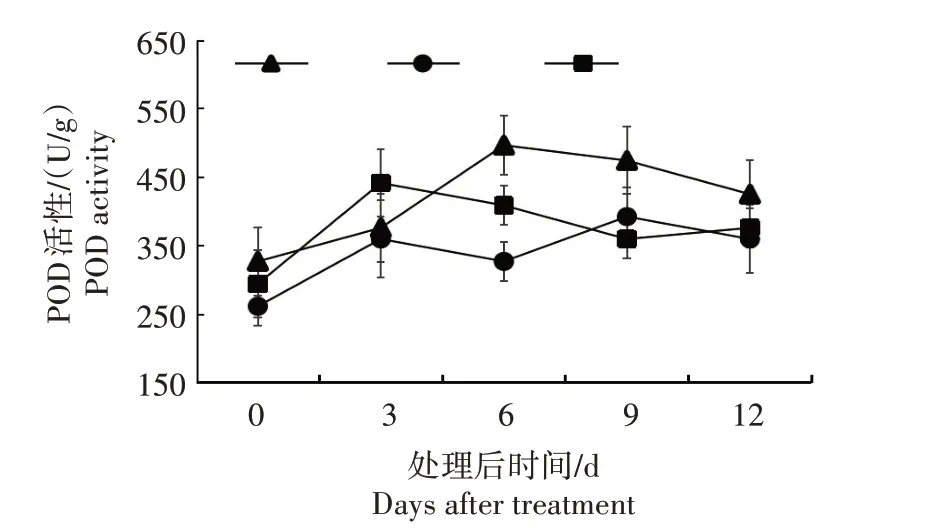
图9 3个楸树材料处理后叶片POD活性变化Fig.9 Changes of POD activity in treated leaves of three Catalpa species
3 结论与讨论
楸树茎腐病的发生在国内尚未见相关报道。本试验首次对楸树茎腐病感病植株进行了病原菌分离纯化,通过柯赫氏法则对致病性进行验证,确认GO100307 菌株致病症状与田间感病植株症状一致,将其确定为楸树茎腐病的病原菌。经形态学结合分子生物学鉴定后,确认该菌株为露湿漆斑菌(Mymthecium roridum)。根据文献报道,露湿漆斑菌对西红柿[10]、山药[11]、西葫芦[12]、铁皮石斛[13]及苜蓿[14]等植物都能产生致病性,可造成植株叶斑、果斑、根腐和茎腐等现象。在禾谷类和木本植物研究中发现,禾谷镰刀菌(F.graminearum)、禾生腐霉菌(P.graminicola)、层出镰刀菌(F.proliferatum)、拟轮枝镰孢菌(F.verticillioides)、木贼镰刀菌(F.equiseti)、终极腐霉菌(P.ultimum)等[15-17]均能引起茎腐病。但本研究首次发现露湿漆斑菌可以引起楸树发生茎腐病。
通过离体叶片穿刺接种与浸根法将分离筛选得到的致病菌GO100307 回接到3 个不同楸树材料上,结果表明,该菌对3 个楸树材料都有致病性,但对不同楸树材料的致病性差异明显。在离体叶片穿刺试验中,CL1 的抗性优于CJS 和CZ2,通过观察发现,CL1叶片的革质化程度高,能更好地保护叶片免受侵害,体现了很好的叶部抗性;但在浸根试验中CJS 的抗性优于CL1 和CZ2,且没有感病植株死亡的现象,体现了更好的根部抗性。
浸根法接种病原菌后,不同楸树材料叶片的酶活性变化有明显差异。β-1,3-葡聚糖酶是植物抗病反应中的关键病程相关蛋白,在植物抗病防御反应中起着重要作用[18-19]。较高抗性的CJS 在接种病菌后β-1,3-葡聚糖酶活性达到峰值较早,对病原菌的反应较为迅速。
植物在受到病原菌侵染时,会引起其体内活性氧代谢失调,导致氧化胁迫。这时体内的保护酶系统会发挥作用,减轻胁迫给植物带来的伤害,SOD、POD 是植物体内主要的活性氧清除酶[20-21]。在接种病原菌后,CJS 和CL1 叶片SOD 活性均表现为先升高后降低,CZ2 叶片SOD 活性则是先降低后升高,上升幅度也较小,说明在遇到侵染时,高抗材料的SOD 活性响应速度及幅度均优于低抗材料。在接种病菌后,3个楸树材料叶片POD活性均有提高,虽然CL1 的POD 活性较早达到峰值,但CJS 的POD 活性峰值高于其他2个楸树材料且上升幅度更大。结果表明,CJS 具有较高抗性的原因可能是其自身保护酶系统和病程相关蛋白对病原菌的感知能力较强,当遇到病原物刺激时,能及时做出防御反应,抵抗病原菌的侵染。
本研究对楸树茎腐病植株进行病原菌分离鉴定,并对获得的致病菌株进行形态与分子鉴定,确认引起楸树茎腐病的病原菌为露湿漆斑菌(Myrothecium roridum)。3 个楸树材料对茎腐病致病菌的抗性表现为金丝楸最强,叶片β-1,3-葡聚糖酶、POD活性峰值高于其他2个楸树材料。
