蜜蜂残翅病毒两步法荧光定量PCR 检测方法的建立
2022-05-27王红坤王艺桦周丹银
王红坤,王艺桦,周丹银,董 坤,张 炫
(云南农业大学 动物科学技术学院,云南 昆明 650201)
2006 年,蜂群崩溃综合症(Colony collapse disorder,CCD)在全球范围暴发,使蜜蜂病毒的危害引起人们的高度重视[1],蜜蜂病毒与其他病原的联合侵害导致蜜蜂种群数量持续减少[2]。其中,蜜蜂残翅病毒(Deformed wing virus,DWV)因其导致典型的发病症状,被作为蜜蜂病毒病研究的主要对象。DWV 可以侵染所有蜜蜂种群和性别(蜂王、工蜂和雄蜂)以及蜜蜂所有发育阶段的个体[3]。病毒有着长期共生和应急性侵染2 种生存策略,可通过调节病毒颗粒数量达到长期潜伏和急性致死的目的[4]。目前,低水平的DWV 感染非常普遍[5]。DWV 易变异、多因素联合致病[6],是全球蜜蜂种群中最流行的病毒,也是寄主范围最广的蜜蜂病毒[7]。由于缺乏病毒传播动力学、发病机制、流行病学和寄主免疫学等方面的知识及相关数据,蜜蜂病毒病的流行与传播机制仍未得到完全揭示,所以对其进行有效防控成为养蜂业的一大难点[8]。
对长期呈隐性感染的DWV 进行有效防控的基础是建立高灵敏度的诊断技术,实时荧光定量PCR技术诊断病毒病具有快速、灵敏度高、特异性强的特点,是DWV 诊断中运用最为广泛的技术[9]。实时荧光定量PCR 技术主要有TaqMan 探针法和SYBR Green Ⅰ染料法,有研究报道了采用TaqMan-MGB探针荧光定量RT-PCR 法检测DWV 感染情况[10],采用TaqMan 探针荧光定量PCR 方法检测DWV 和急性蜜蜂麻痹病毒(ABPV)感染情况[11],以及检测DWV、ABPV、蜜蜂黑蜂王台病毒(BQCV)、慢性蜜蜂麻痹病毒(CBPV)、囊状幼虫腐臭病毒(SBV)和狄斯瓦螨病毒1(VDV1)等6 种主要蜜蜂病毒的感染情况[12]。目前多采用TaqMan探针法进行DWV 病原监测、流行病学调查和病毒定量分析研究。TaqMan探针法需要特异性探针,费用相对染料法更加昂贵,且探针的保守性及设计要求相对染料法更加苛刻;而染料法在灵敏度及特异性方面与探针法无明显差异,适用于科研及临床应用[13]。
实时荧光定量PCR 检测技术分为一步法和两步法。有文献报道了采用一步法荧光定量RT-PCR检测技术研究西方蜜蜂[14]和东方蜜蜂[15]、蜂蛹[16]、粪便[17]、瓦螨[18]的DWV 感染。一步法荧光定量PCR 检测和两步法荧光定量PCR 检测均可快速、有效地诊断蜜蜂病毒,其中一步法荧光定量PCR 检测的cDNA 合成和PCR 反应在一个管中完成,缩短了反应时间,更快速、简便;但两步法荧光定量PCR 检测的灵敏度更高,运用两步法荧光定量PCR 检测以色列急性麻痹病毒(IAPV)、DWV、ABPV、BQCV 的灵敏度均高于一步法荧光定量PCR[19]。目前,对DWV的实时荧光定量PCR 检测多采用一步法荧光定量RT-PCR 检测技术,且多为探针法,还未见两步法(染料法)荧光定量PCR 检测技术的报道。为此,通过对DWV 保守基因片段设计特异性引物,建立基于染料法的DWV 两步法实时荧光定量PCR 检测方法,旨在为DWV 的诊断、检疫及监测提供一种高灵敏度、高适用性的精准检测方法。
1 材料和方法
1.1 样品采集及保存
2020 年10—12 月于云南农业大学东方蜜蜂研究所校内实验蜂场,分别选取东方蜜蜂实验蜂群和西方蜜蜂实验蜂群各4 群,每群每月在蜂箱巢门口随机采集无症状蜜蜂样品10 只,共计240 份样品,分别按群按月标记,置于-80 ℃保存。
BQCV 及IAPV 阳性样品,由云南农业大学东方蜜蜂研究所蜜蜂保护学实验室提供。
1.2 主要试剂及仪器
TRIzolTMReagent 购自Invitrogen 公司;限制性内切酶(HindⅢ、EcoRⅠ)购自Thermo Fisher Scientific公司;EastepTMGel and PCR Clean-up System 试剂盒购自Promega 公司;一步法反转录RT-PCR 试剂盒、cDNA 第一链合成试剂盒、荧光定量预混试剂盒、质粒小提试剂盒、DNA MarkerⅡ、RNase-free H2O均购自天根生化科技有限公司;pUC57 质粒、DL3000 Marker、即用型无缝克隆试剂盒和TOP10 感受态细胞购自生工生物(上海)股份有限公司;低熔点琼脂糖粉、固体及液体培养基购自北京索莱宝公司。
超微量核酸测定仪购自Implen 公司;普通PCR仪和荧光定量PCR仪均购自BIO-RAD公司。
1.3 引物设计与合成
根据GenBank 公布的DWV 参考序列(NC_004830.2),应用Primer Premier 5.0 软件,针对其保守基因片段设计实时荧光定量PCR 特异性引物,DWVF (5′-TGTGGTGTAGTAAGCGTCGT-3′ ) 、DWVR(5′-TCATCCGTAGAAAGCCGAGT-3′),预期扩增片段长度为121 bp。引物由生工生物(上海)股份有限公司合成。用RNase-free H2O 溶解至10µmol/L,-20 ℃保存备用。
1.4 核酸提取
按照TRIzolTMReagent 操作说明,将蜜蜂样品从-80 ℃冰箱中取出磨碎,在无菌工作台内加入细胞裂解剂,漩涡振荡、室温孵育后,加入氯仿混匀,再次孵育;使用台式高速冷冻离心机在4 ℃下12 000 r/min 离心,使样品总RNA 与氯仿等分离;将上清水溶液(含样品总RNA)移入新的离心管中,加入异丙醇,混匀后室温静置,再次离心使RNA 沉淀于离心管壁内侧;倒掉离心管内溶液,加入75%乙醇清洗RNA 沉淀,倒掉乙醇溶液,并用高压灭菌滤纸吸去剩余乙醇;最后加入100µL RNase-free H2O溶解RNA 沉淀,用超微量核酸测定仪测定,所有样品OD260/OD280均高于1.9。将RNA 于-80 ℃冰箱暂存备用。
1.5 反应条件的优化及RT-PCR检测
根据一步法反转录RT-PCR试剂盒操作说明对提取的RNA 进行扩增,反应体系:RNase-free H2O 9.2 µL,2×FastKing One Step RT-PCR Master Mix 12.5 µL,25×RT-PCR Enzyme Mix 1 µL,上、下游特异性引物(DWVF、DWVR)各0.65 µL,RNA 模板1µL。根据普通PCR 仪梯度自动设置,选择55.0、55.7、57.0、59.0、61.4、63.3、64.5、65.0 ℃这8 个梯度对退火温度进行优化,确定最适退火温度[20]。正式试验中,采用1 µL RNase-free H2O 替换1 µL RNA模板设置为阴性对照组,对6 个蜜蜂样品进行RTPCR 扩增,使用1.5% 琼脂糖凝胶电泳和DNA MarkerⅡ进行检测,用EastepTMGel and PCR Cleanup System试剂盒对目的片段进行纯化回收。
1.6 标准阳性质粒模板的制备
利用即用型无缝克隆试剂盒将pUC57 质粒DNA 与经纯化回收后的目的片段连接构建重组质粒,并将重组质粒转化到感受态细胞TOP10 中,挑取单菌落过夜培养,经菌落PCR 初步鉴定,并用内切酶HindⅢ和EcoRⅠ对阳性质粒进行酶切鉴定,进行1%琼脂糖凝胶电泳。用质粒小提试剂盒提取阳性质粒,使用超微量核酸测定仪对阳性质粒标准品的浓度和纯度进行测定,分装后置-80 ℃保存备用。
1.7 标准曲线的建立
根据荧光定量预混试剂盒操作说明,扩增体系:2×SuperReal PreMix Plus 12.5 µL,上、下游特异性引物(DWVF、DWVR)各0.75 µL,质粒标准品1µL,RNase-free H2O 10 µL。将阳性质粒标准品10 倍梯度稀释,以6.58×101~6.58×108拷贝/µL 质粒标准品作为模板,每个稀释梯度设3个重复,使用荧光定量PCR 仪进行荧光定量PCR 试验。根据预试验,选择最佳的扩增程序:95 ℃15 min;95 ℃10 s,59 ℃30 s,40 个循环。反应结束后,绘制标准曲线[21]。
1.8 特异性试验
以云南大学东方蜜蜂研究所蜜蜂保护学实验室保存的BQCV、IAPV 质粒为模板,进行两步法荧光定量PCR,反应体系和条件参照1.7。
1.9 敏感性试验
分别以6.58×100~6.58×107拷贝/µL 的DWV 阳性质粒标准品为模板进行普通PCR 反应;同时,按1.7中反应体系和条件进行荧光定量PCR,确定反应的最低检出量,并比较两者的敏感性[22]。
1.10 重复性试验
分 别 以6.58×102、6.58×103、6.58×104、6.58×105拷贝/µL 的DWV 阳性质粒标准品为模板,每个梯度设置3个重复,进行两步法荧光定量PCR检测,计算组内标准差和变异系数[23]。在3 个不同时间进行荧光定量PCR 检测,根据Ct 值计算组间变异系数,评价建立检测方法的重复性和稳定性[24]。
1.11 蜜蜂样品的检测
对收集于云南农业大学校内蜂场的无症状东方蜜蜂和西方蜜蜂样品各120 份提取RNA,使用cDNA 第一链合成试剂盒将RNA 反转录为cDNA。先去除基因组DNA 污染,反应体系:5×gDNA Buffer 2 µL,Total RNA 1 µL,RNase-free H2O 7 µL。42 ℃孵育3 min,然后进行反转录。将配制好的混合液加入去除基因组DNA的反应液中,混合液体系:10×King RT Buffer 2µL,FastKing RT Enzyme Mix 1µL,FQ-RT Primer Mix 2 µL,RNase-free H2O 5 µL。反应程序:42 ℃15 min,95 ℃3 min。用RNase-free H2O将上述反应液稀释,再加入荧光定量预混试剂,反应体系和条件参照1.7,并与常规PCR 方法检测结果进行比较。将检出的部分阳性样品送生工生物(上海)股份有限公司测序,验证所建立检测方法的可行性,并调查云南农业大学校内蜂场DWV 的流行情况。
2 结果与分析
2.1 蜜蜂样品中DWV的RT-PCR检测结果
引物退火温度为59.0 ℃时,条带亮度最佳。该条件下的6个蜜蜂样品均仅在120 bp长度附近出现1 个特异性条带,与预期相符(图1),表明引物对DWVF、DWVR特异性好。
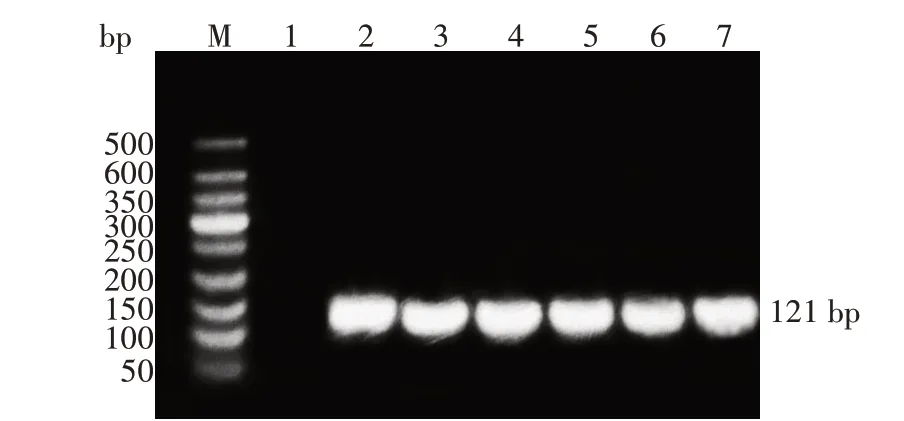
图1 蜜蜂样品中DWV的普通RT-PCR 扩增结果Fig.1 Results of conventional RT-PCR amplification of DWV in honeybee samples
2.2 DWV阳性质粒标准品的制备
利用DWVF、DWVR 引物对构建的重组质粒过夜培养后进行酶切鉴定,可看到2 个条带,2.4 kb 的片段和121 bp的PCR 产物片段,与预期相符(图2)。可见,重组质粒构建正确,能够作为标准阳性质粒模板使用,计算出DWV 阳性质粒标准品浓度为6.58×109拷贝/µL。
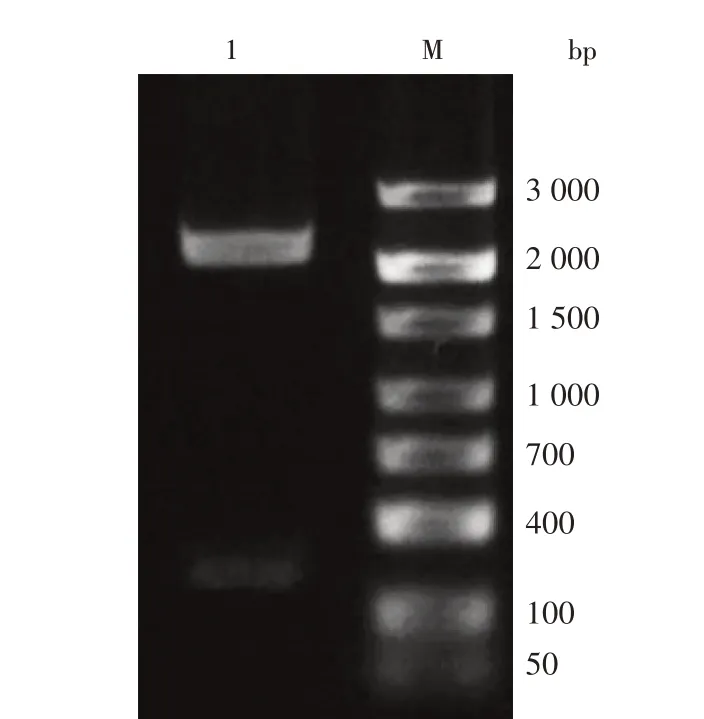
图2 DWV阳性质粒标准品的酶切鉴定Fig.2 Enzyme digestion identification of DWV positive plasmid standard
2.3 两步法实时荧光定量PCR标准曲线的建立
将2.2 中的阳性质粒标准品进行10 倍梯度稀释,根据优化后的反应条件,用建立的两步法实时荧光定量PCR 检测方法对不同浓度(6.58×101~6.58×108拷贝/µL)的质粒标准品进行检测,绘制标准曲线,y=-3.301 9x+37.439,R2为0.999 7,扩增效率为100.8%(图3)。表明梯度稀释的阳性质粒标准品与Ct值之间具有良好的线性关系。
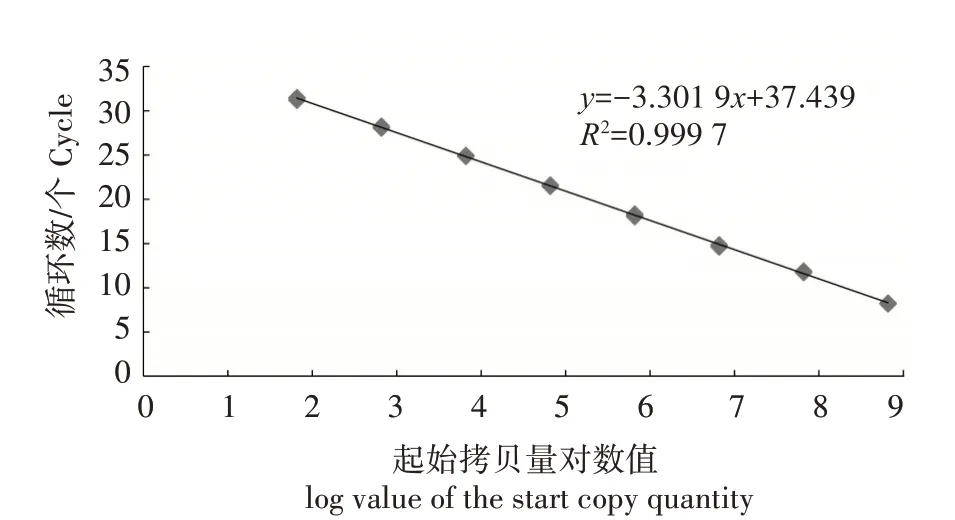
图3 DWV两步法实时荧光定量PCR标准曲线Fig.3 DWV standard curve of two-step real-time fluorescence quantitative PCR
2.4 两步法实时荧光定量PCR方法的特异性试验结果
应用建立的两步法实时荧光定量PCR 方法对蜜蜂保护学实验室提供的BQCV、IAPV 样品进行检测,结果显示,除DWV 在Ct 值约为21 时起峰,BQCV、IAPV 在Ct 值 为37.439 之 后 起 峰 或 无 峰(图4),证明该方法特异性较好。
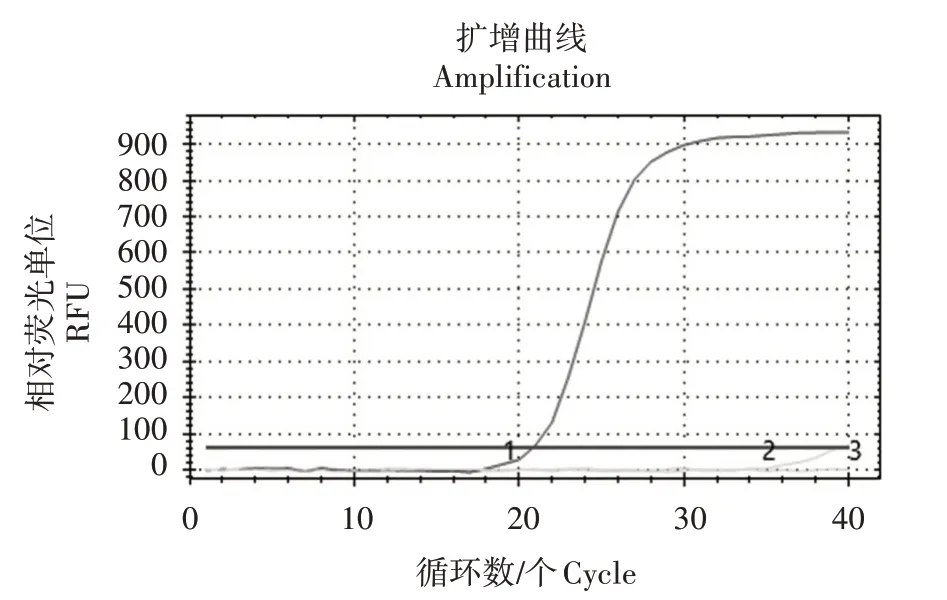
图4 DWV两步法实时荧光定量PCR特异性试验结果Fig.4 Results of specificity test of DWV two-step realtime fluorescence quantitative PCR
2.5 两步法实时荧光定量PCR方法的敏感性试验结果
用建立好的两步法实时荧光定量PCR 方法对10 倍倍比稀释为6.58×100~6.58×107拷贝/µL 的阳性质粒标准品进行敏感性试验,结果显示,最低检出限为6.58 拷贝/µL(图5),当循环数≤34.73 时即可判定为阳性,且能够准确定量;而普通PCR 最低检出量为6.58×104拷贝/µL(图6),证明该方法灵敏性较好。
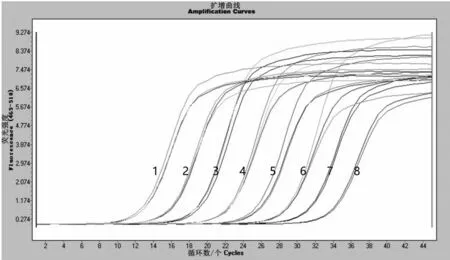
图5 DWV两步法实时荧光定量PCR灵敏性试验结果Fig.5 Sensitivity test results of DWV two-step real-time fluorescence quantitative PCR

图6 DWV阳性质粒标准品的普通RT-PCR 扩增结果Fig.6 Results of ordinary RT-PCR amplification of DWV positive plasmid standard
2.6 两步法实时荧光定量PCR方法的重复性试验结果
建立的两步法实时荧光定量PCR 方法的组内变异系数为0.20%~0.66%,组间变异系数为0.08%~0.98%(表1)。可见,本研究建立的检测方法具有良好的稳定性。

表1 DWV两步法实时荧光定量PCR组内和组间重复性试验结果Tab.1 Repeatability test results of DWVtwo-step real-time fluorescence quantitative PCR in and between groups
2.7 样品检测结果
表2结果显示,西方蜜蜂的DWV 阳性检出率普遍高于东方蜜蜂;另外,在采用相同模板RNA 的前提下,采用两步法实时荧光定量PCR 方法检测时,总样本量的阳性检出率和不同蜂种的阳性检出率均明显高于普通PCR。同时,对两步法实时荧光定量PCR 及普通PCR 阳性产物各随机挑选12 份东方蜜蜂样品和12 份西方蜜蜂样品,经测序证实均为DWV基因组片段。以上结果表明,云南农业大学校内蜂场的东、西方蜜蜂DWV 感染率较高,尤其是西方蜜蜂DWV感染率高达100.0%。

表2 普通PCR与两步法实时荧光定量PCR对蜜蜂样品DWV感染率检测结果Tab.2 Detection of DWV infection rate in bee samples by conventional PCR and two-step real-time fluorescence quantitative PCR
3 结论与讨论
DWV 是一种会导致寄主表现典型发病症状的蜜蜂病毒[25],感染力强,在狄斯瓦螨的媒介作用下,可进行多寄主跨种传播[26];其宿主涵盖了68 种节肢动物的10 个目,其中64 种属于昆虫纲,4 种属于蛛形纲[27];蜂巢内储存的花粉和蜂蜜中的DWV可以保持感染能力6 个月[28]。DWV 一般情况下呈隐性感染,在蜂群受到特定生物压力或不良环境条件时,迅速表现发病症状,造成蜂群的衰弱甚至消亡[29]。目前,主要根据临床症状来检测和诊断DWV。建立新的高灵敏、特异性强、费用适宜的蜜蜂RNA 病毒定量检测方法和病毒病诊断技术是进行蜜蜂病毒病研究的必要手段,用以对野生或饲养蜂群病毒载量进行监测,掌握蜂群健康动态,并及时制定有效的病毒病防治措施。实时荧光定量PCR 技术因其简单、稳定、快速以及准确的特点[30],已成为蜜蜂病毒检测较为成熟可靠的方法之一。
在选择实时荧光定量PCR 检测方法时,与探针法相比,染料法特异性略显不足,且容易受引物二聚体影响。本研究基于DWV 衣壳蛋白基因保守序列设计的引物特异性强,能够弥补染料法的缺陷,满足检测要求。在此基础上建立的两步法实时荧光定量PCR 方法灵敏度高,可达到6.58 拷贝/µL,较WU等[31]建立的拷贝数为101~109的染料法荧光定量PCR 检测方法灵敏度更高,且与本研究检测的BQCV 和IAPV 无交叉反应,特异性良好。重复性试验结果表明,组内、组间变异系数均小于0.98%,具有良好的稳定性。本研究中,cDNA 第一链合成试剂盒在将RNA 反转录为cDNA 的过程中,可高效、稳定、快速去除基因组DNA 干扰,且其反转录效率高,通读二级结构复杂的RNA 模板,适用于易变异的蜜蜂RNA 病毒检测。本研究建立的两步法实时荧光定量PCR 检测方法对蜜蜂样品的检测结果显示,蜜蜂样品总数中DWV 阳性检出率、东方蜜蜂样品和西方蜜蜂样品中DWV 阳性检出率均明显高于普通PCR 的检测结果。另外,西方蜜蜂的DWV 阳性检出率普遍高于东方蜜蜂,这与前人的研究成果一致[32]。王蕾等[15]对昆明地区东方蜜蜂DWV 的检出率为54.0%。检出率不同的主要原因可能是采样蜂群状态不同,本研究采集的蜂群群势均相对较弱,可能已经受到DWV 的侵袭或者蜂群状态不佳,更易受到DWV 的侵害,而后者样本主要采自强群蜂群,不带毒或者病毒含量低。此外,还有可能跟采样时间、地点及检测方法有关,尤其是检测方法,本研究建立的检测方法灵敏度较高,不易漏检。本研究中,云南农业大学实验蜂场DWV 隐性感染率较高,虽未引起大量东方蜜蜂蜂群损失,但是导致东方蜜蜂群势较弱以及西方蜜蜂蜂群大量损失。因此,提高对DWV 的认识,加强监测和防控,切实维护养蜂业绿色、健康发展迫在眉睫。
综上,本研究成功建立了一种灵敏度高、能够满足临床检测需求的DWV 两步法实时荧光定量PCR 检测方法,可为我国蜜蜂残翅病的诊断、防治、检疫提供准确、简便、实惠的检测方法,为蜜蜂残翅病的流行病学调查、疫情监测和预警机制的构建提供新的技术支持,为有效防治蜜蜂残翅病提供技术保障。
