稻蟹共生系统根际土壤菌群组成及主要代谢通路分析
2022-05-27宋宇
宋 宇
(辽东学院,辽宁 丹东 118003)
微生物是土壤腐殖质的制造者和土壤形成过程中最活跃的因素[1],可调控土壤生态平衡和养分物质循环,在农田土壤生态系统中起着非常重要的作用[2]。植物可与根际微生物相互作用,植物通过根系分泌物为根际微生物提供营养物质,根际微生物群落结构变化又可影响植物的生长发育及产量和品质[3-5]。
农业生产中化肥与农药的使用会造成土壤酸化等一系列问题,绿色生产作为新型农业生产方式正在广大农村示范与推广。生物有机肥是有机肥料与功能性微生物相结合的肥料,研究表明,生物有机肥比化肥能保持更稳定的土壤微生物群落结构[6]。在稻米生产中,可通过施用无公害又具有一定杀虫能力的生物有机肥,或通过稻鱼共作、稻虾共作、稻鳖鱼虾共作等方式实现绿色生产[7-11]。在施用生物有机肥的稻田中引入河蟹,使稻蟹共生,有助于改善农田环境、收获河蟹,并可满足人们对绿色稻米的需求。
随着分子生物学和高通量测序技术的发展,微生物群落结构及其多样性的研究也不断深入。目前,对稻田与养殖动物共生的根际土壤微生物群落结构及其多样性的研究多是基于Illumina NovaSeq测序平台的16S rRNA 基因测序分析[12]。廖咏梅等[13]通过比较稻鸭共育与常规管理种植水稻的根际土壤微生物种群多样性发现,稻鸭共育的水稻根际土壤真菌的种群结构更丰富。如今,基于Illumina NovaSeq 测序平台的宏基因组测序分析因其获得的数据量更大、微生物信息更多而得到人们的广泛关注,已成为各种环境中微生物功能和代谢通路研究的主要方式之一[14]。目前,有关稻蟹共生系统中水稻的根际土壤菌群组成及主要代谢通路分析未见报道。鉴于此,基于Illumina NovaSeq 测序平台,以水稻单作为对照,利用宏基因组双端测序方法来分析稻蟹共生系统中水稻根际土壤细菌、古菌和真菌的种类和丰度以及主要代谢通路差异,为水稻绿色栽培提供依据。
1 材料和方法
1.1 处理设置和土壤样品采集
试验地设在辽宁省丹东东港市北井子镇盖家坝有机种植农场,水稻品种为越光。水稻单作对照(YJTCS,CK)施用的生物有机肥为日照益康有机农业科技发展有限公司生产的海藻生物有机肥(内含海藻生物菌),分别在2020 年3 月份和7 月份均按1.35 kg/hm2施用;稻蟹共生系统(HXTCS)中生物有机肥的施用量和时间同对照组,并在4 月末按0.5 kg/hm2投入河蟹苗,10 月初收蟹。于2020 年10 月15 日(水稻成熟期)利用5 点采样法采集根际土壤。土壤样品混匀后分成2 份,1 份用于土壤理化指标测定,1 份用于DNA 提取和宏基因组测序。每个处理各设置3次生物学重复。
1.2 稻田土壤理化指标测定
土壤pH 值采用酸度计测定;速效磷采用碳酸氢钠浸提-钼锑抗比色法测定;速效钾采用氯化钙浸提-火焰光度计法测定;全氮采用凯氏定氮法测定;有机质采用重铬酸钾氧化-分光光度法测定[15]。
1.3 DNA提取、建库与宏基因组测序
利用E.Z.N.A.®Soil DNA Kit(Omega Biotek,美国)试剂盒进行样品DNA 抽提。完成基因组DNA抽提后,利用TBS-380 微型荧光计检测DNA 浓度,利用NanoDrop 2000 分光光度计检测DNA 纯度,利用1%琼脂糖凝胶电泳检测DNA 完整性。利用Covaris M220 超声波破碎仪将DNA 片段化,筛选约400 bp 的片段,使用NEXTflexTMRapid DNA-Seq(Bioo Scientific,美国)试剂盒构建PE 文库。使用Illumina NovaSeq 测序平台委托上海美吉生物医药科技有限公司进行宏基因组测序。
1.4 宏基因组测序分析
使 用fastp(https://github.com/OpenGene/fastp,version 0.20.0)对reads 3′端和5′端的adapter 序列进行质量剪切[16];使用基于succinct de Bruijn graphs 原理的拼接软件MEGAHIT(https://github.com/voutcn/megahit,version 1.1.2)对优化序列进行拼接组装,在拼接结果中筛选≥300 bp 的contigs 作为最终的组装结果[17];使用MetaGene(http://metagene.cb.k.u-tokyo.ac.jp/)对拼接结果中的contigs 进行ORF 预测[18]。选择核酸长度≥100 bp 的基因,并将其翻译为氨基酸序列;使用CD-HIT(http://www.bioinformatics.org/cdhit/,version 4.6.1)对所有样品预测出来的基因序列进行聚类(参数为90%identity、90%coverage),每类取最长的基因作为代表序列,构建非冗余基因集[19];使用SOAPaligner 软件(http://soap.genomics.org.cn/,version 2.21),分别将每个样品的高质量reads 与非冗余基因集进行比对(95%identity),统计基因在对应样品中的丰度信息[20];使用Diamond(http://www.diamondsearch.org/index.php,version 0.8.35)将非冗余基因集的氨基酸序列与NR 数据库进行比对(BLASTp 比对参数设置期望值e-value 为1e-5),并通过NR 库对应的分类学信息数据库获得物种注释,然后使用物种对应的基因丰度总和计算该物种的丰度[21]。
2 结果与分析
2.1 不同稻田根际土壤样品理化指标分析
如表1所示,河蟹引入生物有机肥稻田后,成熟期稻田根际土壤的pH 值、速效磷和速效钾含量均有所提升,其中pH 值和速效磷含量与对照相比差异显著。HXTCS 的pH 值为6.69,比YJTCS(5.94)高12.63%。有机质和全氮含量降低,但与对照相比差异不显著。
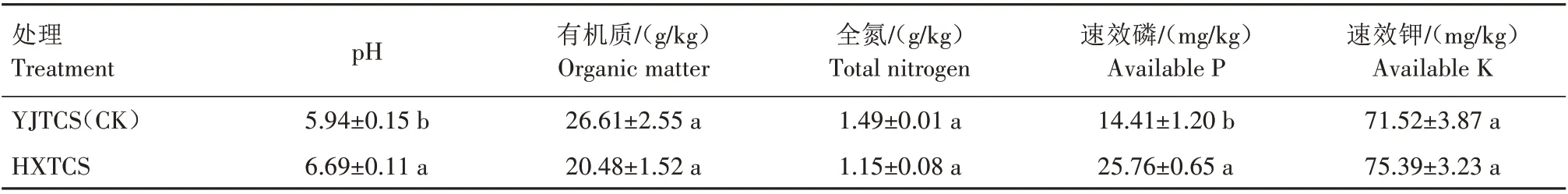
表1 不同稻田根际土壤理化指标Tab.1 Physichemical indexes of rhizosphere soil in different paddy fields
2.2 不同稻田根际土壤宏基因组测序结果分析
2 种稻田根际土壤宏基因组测序结果见表2。由表2 可知,基因长度平均为383.59 bp;有效读长平均为51 313 204.33 bp,占平均原始读长(52 401 028.34 bp)的97.92%;有效碱基数平均为7 736 219 405.67 bp,占平均原始碱基数(7 912 555 278.34 个)的97.77%。相比16S 多样性测序的序列长度(约200 bp)和有效数据量(10~70 M)[22],宏基因组测序基因长度较长且可产生的有效数据量较大(6 G),文库覆盖度更高,可获得样品中更多微生物信息。本研究共获得1 594 699 个非冗余基因用于生物信息学分析。
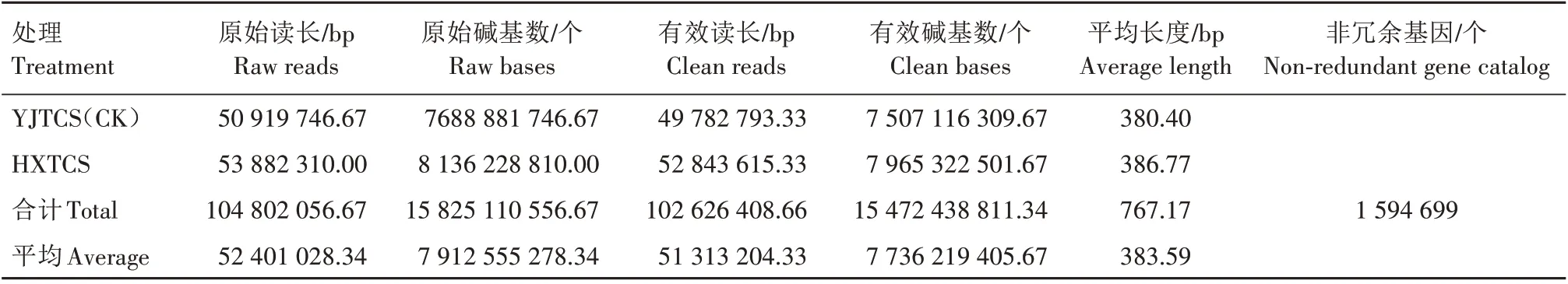
表2 不同稻田根际土壤微生物宏基因组测序结果Tab.2 Result of metagenome sequencing for microorganisms in rhizosphere soil of different paddy fields
2.3 不同稻田根际土壤样品细菌种群组成分析
2.3.1 细菌宏基因组测序结果 宏基因组测序分析结果显示,土壤样品中细菌界占98.09%。细菌种群 分 成149 个 门、240 个 纲、408 个 目、791 个 科、2 980 个 属、19 162 个 种。YJTCS 有17 669 个 种,HXTCS 中 有17 777 个 种。YJTCS、HXTCS 共 有 种16 284 个,特 有 种2 878 个。其 中,YJTCS 特 有 种1 385 个,HXTCS 特有种1 493 个。可见,与YJTCS相比,HXTCS的细菌种群更丰富。
2.3.2 细菌门水平的组成及相对丰度 如图1 所示,在细菌门水平上,YJTCS 和HXTCS 中的优势菌门一致,相对丰度前4 个门依次是变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)。4 个优势菌门在2 种稻田土壤中的相对丰度为90.86%,在2 种稻田土壤中占绝对优势。其中,YJTCS 中的变形菌门相对丰度为43.29%,略高于HXTCS(40.37%);YJTCS 中的放线菌门相对丰度是27.86%,是HXTCS(23.11%)的1.21 倍。HXTCS 中的绿弯菌门相对丰度为16.18%,是YJTCS(13.26%)的1.22 倍;HXTCS 中的酸杆菌门相对丰度为10.29%,是YJTCS(7.37%)的1.40 倍;HXTCS 中的芽单胞菌门(Gemmatimonadetes_d_Bacteria)的相对丰度是2.19%,是YJTCS(1.10%)的1.99 倍;HXTCS 中的拟杆菌门(Bacteroidetes)的相对丰度是1.11%,略高 于YJTCS(0.89%);HXTCS 中 的 疣 微 菌 门(Verrucomicrobia)的 相 对 丰 度 是1.14%,高 于HXTCS(0.75%)。
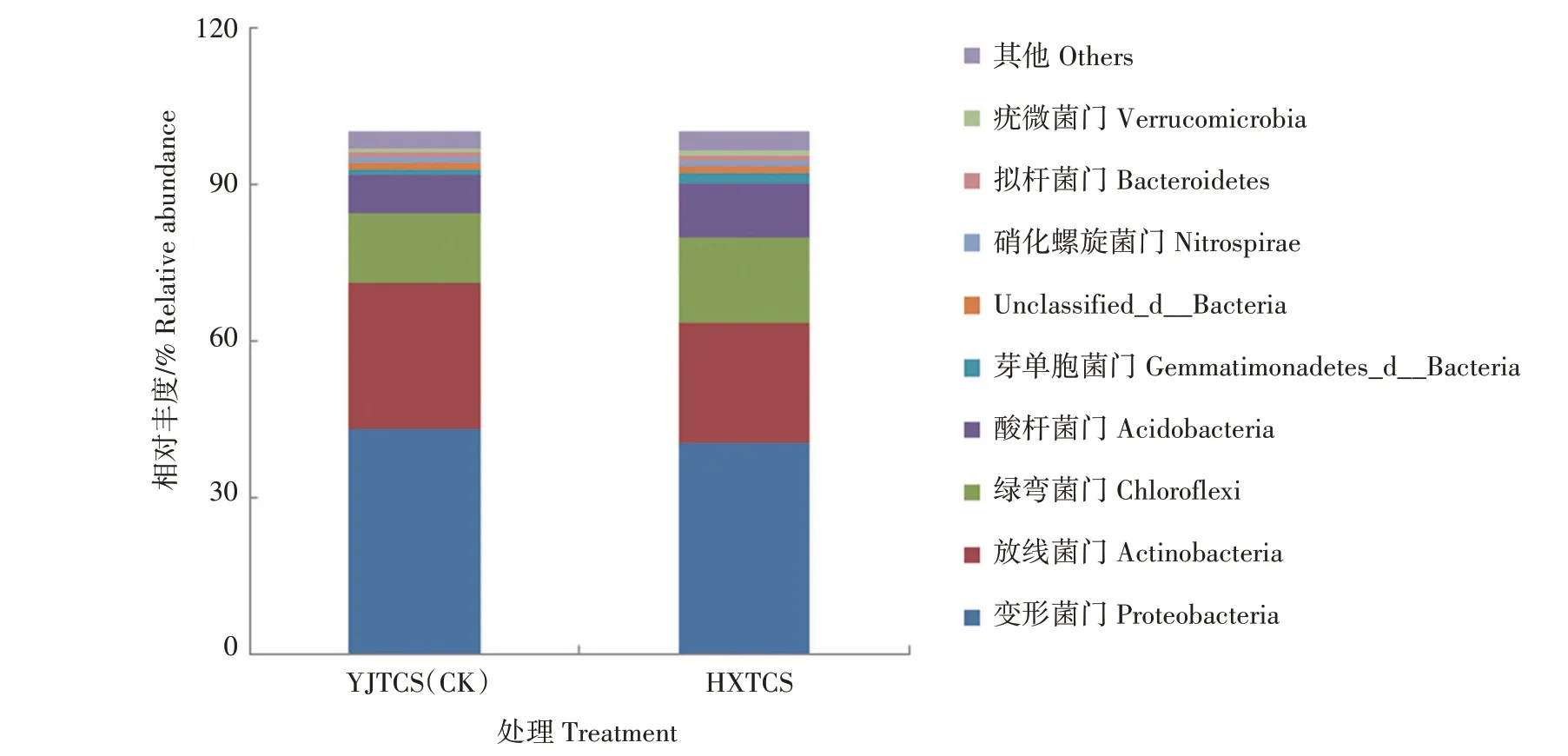
图1 不同稻田根际土壤细菌门水平相对丰度Fig.1 Relative abundance of bacteria on phylum level in rhizosphere soil of different paddy fields
2.3.3 细菌属水平的组成及相对丰度 如图2 所示,在细菌属水平上,2种稻田土壤中相对丰度前十的属隶属于4 个优势菌门,其中位居前四的菌属为
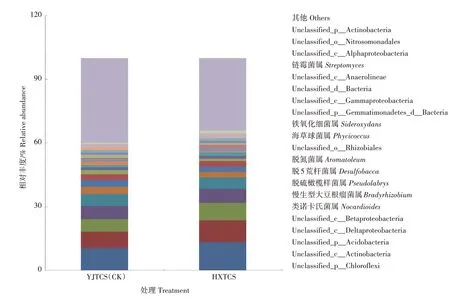
图2 不同稻田根际土壤细菌属水平相对丰度Fig.2 Relative abundance of bacteria on genus level in rhizosphere soil of different paddy fields
Unclassified_p_Chloroflexi、 Unclassified_c_Actinobacteria、 Unclassified_p_Acidobacteria、Unclassified_c_Deltaproteobacteria。 上 述 菌 属 在HXTCS 的相对丰度分别为13.17%、10.36%、8.30%、6.61%,分别高于YJTCS 的10.52%、7.67%、5.94%、6.33%。而YJTCS 的类诺卡氏菌属(Nocardioides)、脱5 荒 杆 菌 属(Desulfobacca)、海 草 球 菌 属(Phycicoccus)和链霉菌属(Streptomyces)的相对丰度分别为3.57%、1.96%、1.77%、1.37%,分别高于HXTCS 的2.70%、0.95%、0.76%、0.49%。慢生型大豆根瘤菌属(Bradyrhizobium)也是2 种稻田土壤中的优势菌属之一。
2.4 不同稻田根际土壤样品古菌种群组成分析
2.4.1 古菌宏基因组测序结果 宏基因组测序分析结果显示,土壤样品中古菌界占1.76%。古菌种群可分成20 个门、37 个纲、57 个目、88 个科、184 个属、669 个种。2 种样品共有种为528 个,特有种为141 个。其中,YJTCS 特有种58 个,HXTCS 特有种83 个。由此可见,与YJTCS 比较,HXTCS 中的古菌种群更为丰富。
2.4.2 古菌门水平的组成及相对丰度 据图3,相对丰度>1.00%的古菌菌门只有4 个,相对丰度由大到小依次是广古菌门(Euryarchaeota)、Unclassified_d_Archaea、深古菌门(Candidatus_Bathyarchaeota)、奇古菌门(Thaumarchaeota)。4 个古菌门中,广古菌门在2 种稻田土壤中相对丰度为83.68%,处于绝对优势。其中,广古菌门在YJTCS 的相对丰度为86.12%,高 于HXTCS(79.13%)。Unclassified_d_Archaea 在YJTCS 的相对丰度为8.76%,是HXTCS(7.24%)的1.21 倍。而深古菌门在HXTCS 的相对丰度是6.70%,是YJTCS(3.40%)的1.97 倍。奇古菌门在HXTCS 的相对丰度是4.41%,是YJTCS(0.48%)的9.19倍。
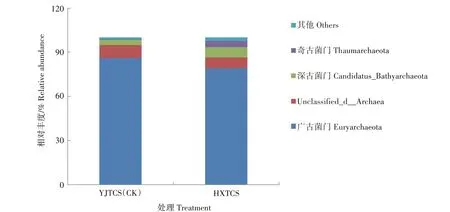
图3 不同稻田根际土壤古菌门水平相对丰度Fig.3 Relative abundance of archaea on phylum level in rhizosphere soil of different paddy fields
2.4.3 古菌属水平的组成及相对丰度 根据测序 结果,将相对丰度<1.00%的古菌属归到其他类,具体见图4。共有17 个古菌属的相对丰度>1.00%,其中甲烷螺菌属(Methanospirillum)和甲烷丝菌属(Methanothrix)共占53.63%,是样品中的主要菌属。相对丰度排名前十的古菌属中,甲烷螺菌属在YJTCS的相对丰度是35.16%,是HXTCS(31.94%)的1.10 倍;YJTCS 中甲烷丝菌属的相对丰度是21.96%,是HXTCS(15.13%)的1.45 倍;Unclassified_d_Archaea 在YJTCS 中的相对丰度是8.76%,是HXTCS(7.24%)的1.21倍;HXTCS中Unclassified_p_Candidatus_Bathyarchaeota 的相对丰度为7.00%,是YJTCS(3.40%)的2.06 倍;HXTCS 中Unclassified_p_Euryarchaeota 的相对丰度为3.57%,是YJTCS(2.30%)的1.55 倍;HXTCS 中 产 甲 烷 孢 菌 属(Methanocella)的相对丰度为2.97%,是YJTCS(2.15%)的1.38 倍。其余菌属的相对丰度在2 种稻田土壤中相差无几。
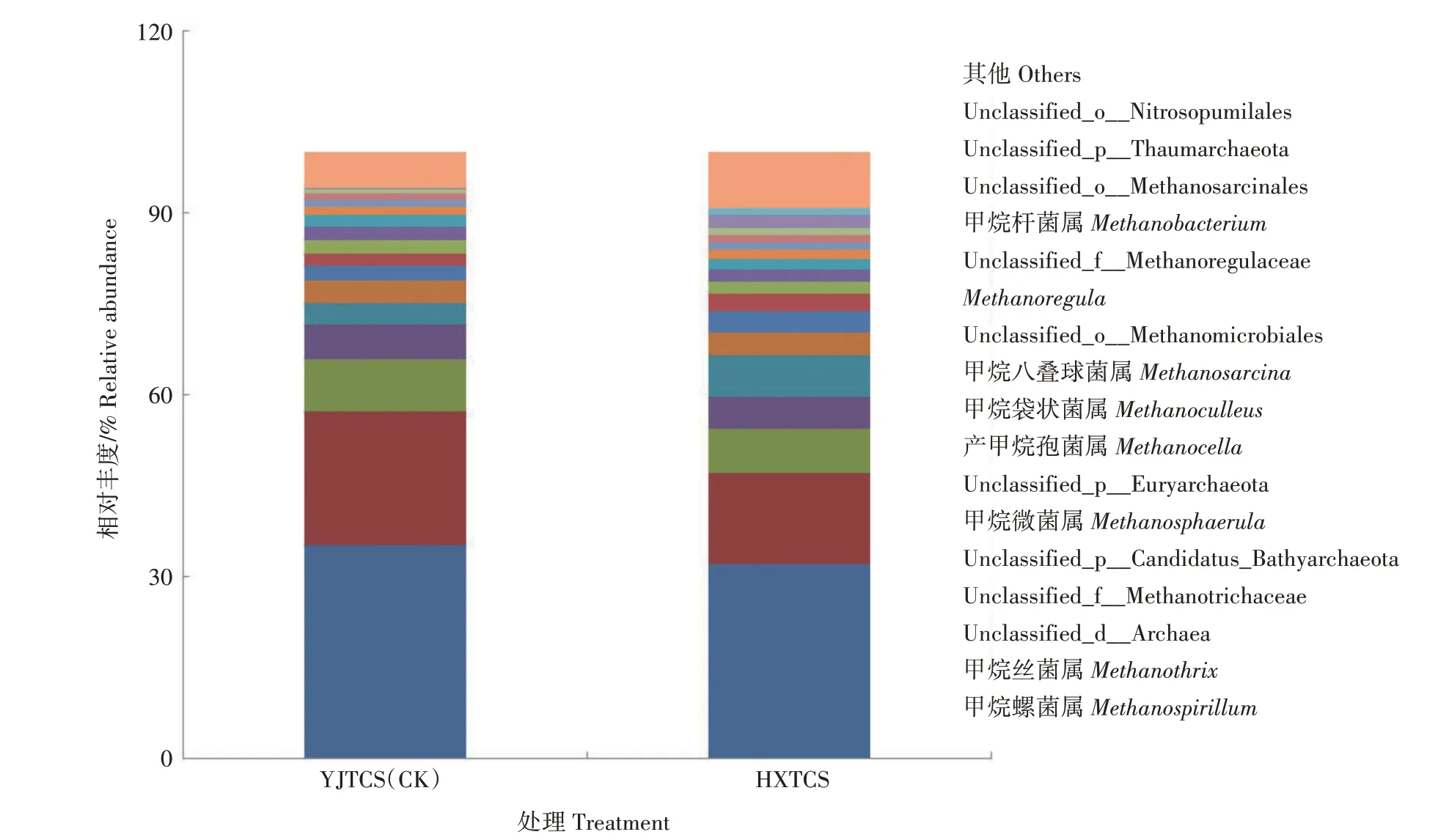
图4 不同稻田根际土壤古菌属水平相对丰度Fig.4 Relative abundance of archaea on genus level in rhizosphere soil of different paddy fields
2.5 不同稻田根际土壤样品真菌种群组成分析
2.5.1 真菌宏基因组测序结果 宏基因组测序分析结果显示,土壤样品中真菌界和其他占0.15%。真菌种群可分成6 个门、29 个纲、60 个目、94 个科、114 个属、147 个种。YJTCS 有124 个种,HXTCS 有129个种,2种稻田土壤共有种106个,特有种41个。其中,YJTCS 特有种18 个,HXTCS 特有种23 个,说明河蟹引入生物有机肥稻田后,真菌物种也略有增加。
2.5.2 真菌门水平的组成及相对丰度 如图5 所示,在真菌门水平上共注释出6个,其相对丰度大小依次为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉门(Mucoromycota)、捕虫霉门(Zoopagomycota)、壶菌门(Chytridiomycota)和芽枝霉门(Blastocladiomycota)。子囊菌门和担子菌门在2 种稻田土壤中的相对丰度为85.43%,其中子囊菌门的相对丰度最高,在2 种稻田土壤的相对丰度为68.70%,处于绝对优势。HXTCS中子囊菌门的相对丰 度 为72.58%,是YJTCS(64.81%)的1.12 倍。YJTCS 中担子菌门的相对丰度为19.71%,是HXTCS(13.59%)的1.45 倍。毛霉门在HXTCS 的相对丰度为7.57%,低于YJTCS(8.46%)。捕虫霉门在HXTCS的相对丰度为2.97%,低于YJTCS(3.73%)。壶菌门在HXTCS 的相对丰度为2.21%,略高于YJTCS(1.82%)。芽枝霉门在HXTCS 的相对丰度为1.09%,略低于YJTCS(1.47%)。
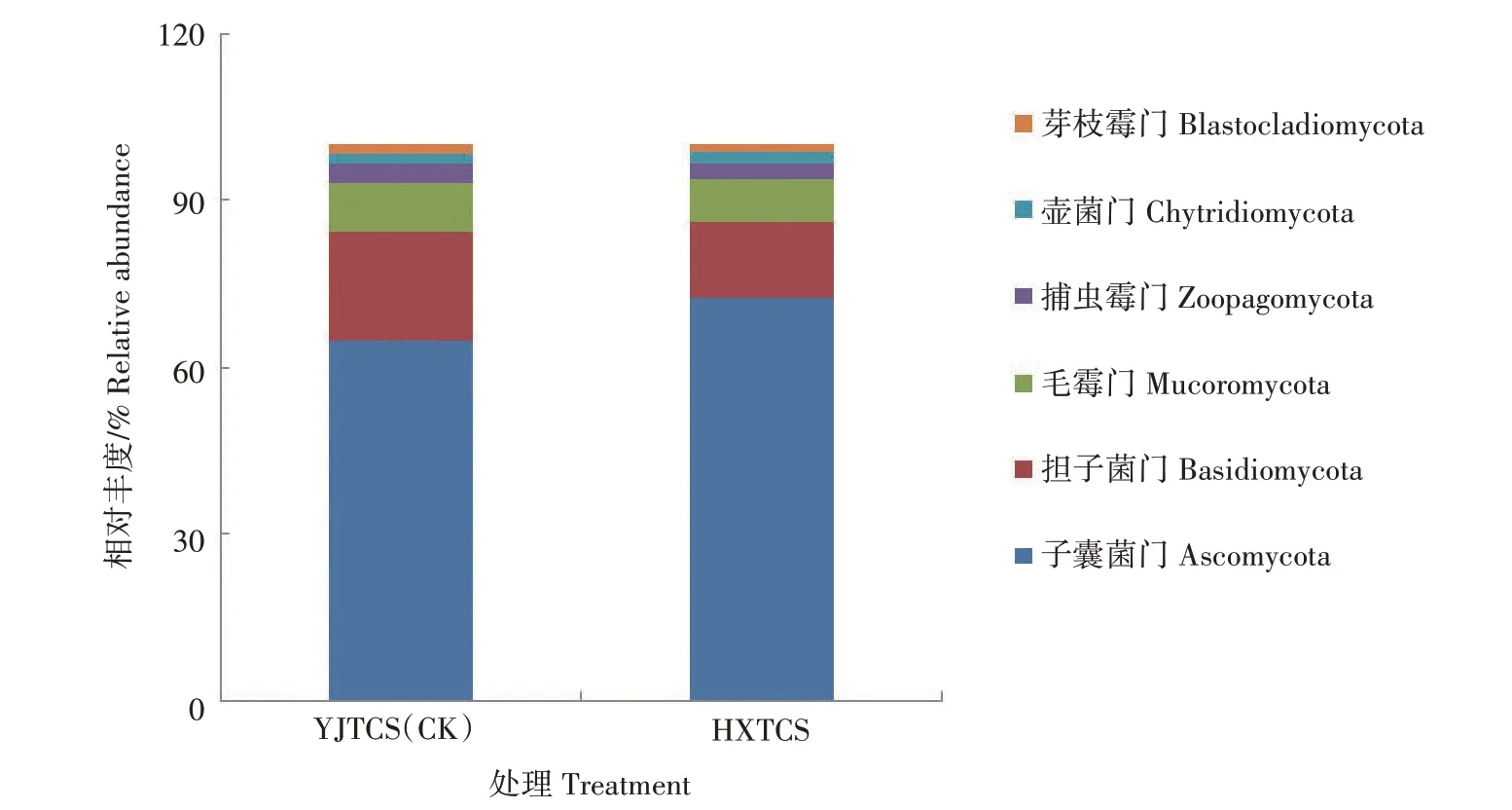
图5 不同稻田根际土壤真菌门水平相对丰度Fig.5 Relative abundance of fungi on phylum level in rhizosphere soil of different paddy fields
2.5.3 真菌属水平的组成及相对丰度 在真菌属水平上,HXTCS 注释出100 个,YJTCS 注释出97 个,相对丰度>1.00%的共有39个属,占72.25%,相对丰度<1.00%归到其他类,占27.75%。如图6 所示,相对丰度排名前十的真菌属中,HXTCS 中毛壳菌属(Chaetomium)的相对丰度为23.62%,是YJTCS(11.88%)的1.99 倍。木霉菌属(Trichoderma)在HXTCS 中 的 相 对 丰 度 为 2.56%,是 YJTCS(0.92%)的2.78 倍。Fibularhizoctonia是担子菌门(Basidiomycota)、伞菌纲(Agaricomycetes)、阿太菌目(Atheliales)、阿太菌科(Atheliaceae)的新属,在YJTCS 的相对丰度为3.93%,是HXTCS(0.46%)的8.54 倍。大团囊菌属(Elaphomyces)在YJTCS 的相对丰度为6.53%,是HXTCS(4.30%)的1.52 倍。其余真菌属的相对丰度在2种稻田土壤中差异不大。
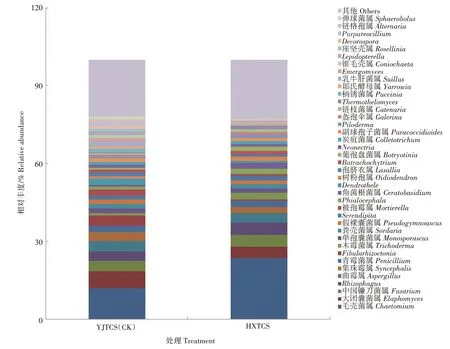
图6 不同稻田根际土壤真菌属水平相对丰度Fig.6 Relative abundance of fungi on genus level in rhizosphere soil of different paddy fields
2.6 不同稻田根际土壤样品主要代谢通路分析
将非冗余基因集与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库进行比对,共有1 594 699个非冗余基因注释到KEGG 的代谢通路中,分属于421 类代谢通路。代谢通路中非冗余基因相对丰度较高的前20 类代谢通路如表3所示。基因注释相对丰度最高的代谢通路是次生代谢产物的生物合成,在YJTCS 和HXTCS 中各占6.05%和6.73%,该通路共包含类黄酮生物合成,异喹啉生物碱生物合成,青霉素、链霉素等抗生素的生物合成等21 个代谢通路。在氨基酸生物合成途径中共发现14个氨基酸代谢通路,其中有8 个是人体必需氨基酸。三羧酸循环、丙酮酸代谢、戊糖磷酸和糖酵解异生等途径是碳水化合物的主要代谢通路,可通过代谢过程中产生的中间产物为许多物质的合成提供原料。从表3 可以看出,HXTCS 在这些代谢通路的基因注释相对丰度值均高于对照组YJTCS。
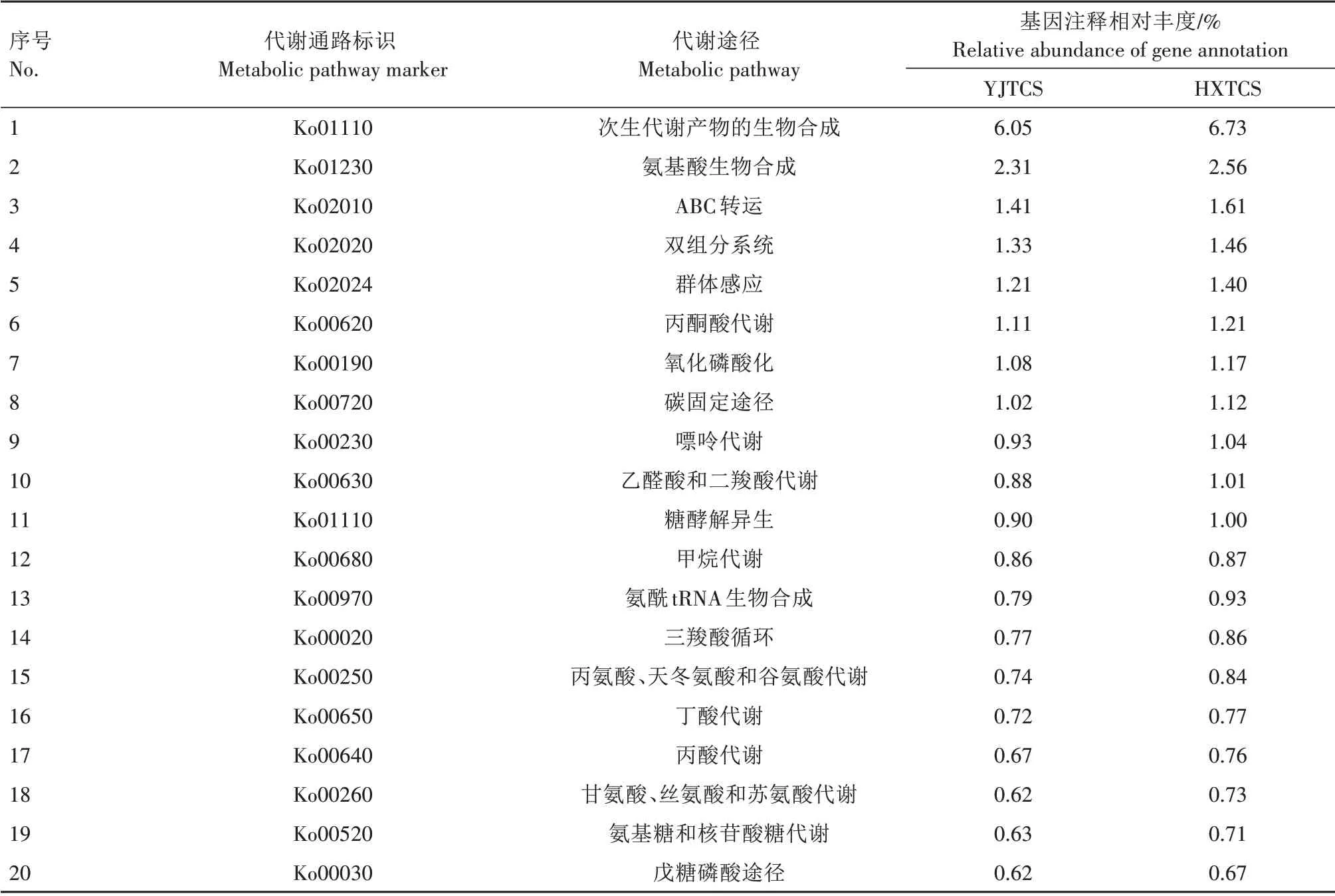
表3 不同稻田根际土壤样品主要代谢通路Tab.3 Main metabolic pathways of rhizosphere soil samples in different paddy fields
3 结论与讨论
对施入生物有机肥的水稻单作稻田和稻蟹共生系统稻田的成熟期根际土壤样品进行宏基因组测序分析后发现,变形菌门、放线菌门、绿弯菌门和酸杆菌门4 个优势菌门相对丰度达到90.86%,占有绝对优势。研究表明,变形菌门和放线菌门为富营养菌,适宜在有机碳和有机氮含量较高的土壤中增殖[23]。而酸杆菌门是寡营养细菌,其相对丰度与土壤有机质和氮量呈负相关[24]。YJTCS 的有机质含量为26.61 g/kg、全氮量为1.49 g/kg,HXTCS 的有机质含量为20.48 g/kg、全氮量为1.15 g/kg。YJTCS 中的变形菌门和放线菌门相对丰度偏高,而HXTCS中酸杆菌门的相对丰度则偏高,这与FIERER 等[24]的研究一致。有研究表明,绿弯菌门与pH 值呈正相关[25]。本 研 究 中,HXTCS 的pH 值 为6.69,高 于YJTCS 的5.94,而HXTCS 中绿弯菌门的相对丰度也高于YJTCS,这与黄博聪等[25]的研究结果一致。
相对丰度前四的细菌属在HXTCS 中的丰度值均高于YJTCS,分别隶属于前述的四大优势菌门,但尚未有明确的分类。类诺卡氏菌属、慢生型大豆根瘤菌属也是2种稻田土壤中的优势菌属。类诺卡氏菌属具有溶磷、产铁载体及固氮作用[26]。慢生型根瘤菌近期被发现可调控稻田中N2O 的排放[27],对环保具有现实意义。
宏基因组测序结果表明,2 种稻田土壤中的真菌门有6 个,其中子囊菌门的相对丰度最高,2 种稻田土壤中占比68.70%,且其在HXTCS 中的相对丰度是YJTCS 的1.12 倍。研究证实,该真菌门的大量存在可将木质素和角质素等难分解的物质分解成稻田可以吸收利用的营养物质[28],利于稻田养分循环,从而提升稻田土壤品质。最近,SPATAFORA等[29]根据基因组数据对传统接合菌门(Zygomycota)重新划分,将其归到毛霉门和捕虫霉门2个真菌门。担子菌门和传统的接合菌门可与植物共生形成菌根,有些可引起植物病害[30]。壶菌门多为腐生性,可降解角蛋白和甲壳素等难降解材料[13]。在HXTCS中相对丰度最高的是毛壳菌属,具有分解纤维素的能力[31]。
2 种稻田土壤中的古菌门中广古菌门占绝对优势,其中YJTCS 中广古菌门的相对丰度高于HXTCS,这可能与YJTCS 中的有机质含量高于HXTCS 有关。有研究报道,施入有机肥会增加有机质含量,增加广古菌门的相对丰度,使稻田中甲烷的排放量增加[32-36]。另有研究表明,利用稻鸭生态种养可增加田面水溶解氧浓度,促进甲烷氧化,从而降低甲烷的排放量[37]。而本研究中为稻蟹共生,可能河蟹在稻田中爬行时增加了土壤氧浓度,因此抑制了厌氧菌广古菌门的生长,降低了相对丰度值。但是这种共生模式能否降低甲烷的排放量还有待于深入研究。奇古菌门在HXTCS 中的相对丰度是YJTCS 的9.19 倍。有研究报道,该菌门是一类可同时参与自然界碳、氮循环的古菌[38],因此,该菌门在HXTCS 中的相对丰度值高更有利于降解土壤中的有机物,能更好地促进水稻生长。
对2 种稻田土壤中的1 594 699 个非冗余基因进行代谢通路分析,共发现421类代谢途径,包括三羧酸循环、丙酮酸代谢、戊糖磷酸、糖酵解异生等途径。三羧酸循环可利用糖类、脂类、氨基酸并可以产生大量的ATP 供微生物的生长。糖酵解异生是微生物对碳水化合物进行代谢的主要方式,是厌氧微生物获取能量的主要方式[14]。戊糖磷酸途径不仅可以为微生物提供能量,还可以为细胞的各种合成反应提供还原力,其中间产物也为许多物质的合成提供原料。HXTCS 中这些代谢通路的基因注释相对丰度值均高于对照组YJTCS,说明河蟹引入生物有机肥稻田后不仅丰富了微生物的物种组成,还加强了物种代谢能力,有利于降解土壤中的有机物,为提升生物有机肥稻田水稻产量、发展生态农业打下基础。
