内陆湿地与水体甲烷厌氧氧化功能微生物研究进展
2022-05-26沈李东金靖昊
沈李东,金靖昊,刘 心
南京信息工程大学生态系,南京 210044
甲烷作为大气中重要的温室气体之一,其浓度仍以每年1.0%—1.2%的速度增加,对当前全球气候变暖的贡献率达20%[1]。内陆湿地是甲烷的重要排放源之一,其每年向大气中排放的甲烷量高达100—200 Tg,约占全球年排放总量的三分之一[2]。全球湖泊甲烷年释放量为8—48 Tg,为自然源甲烷释放总量的6%—16%[3],且湖泊甲烷排放量呈逐年增加趋势[4]。全球河流甲烷年排放量为1.5—26.8 Tg,相当于湖泊甲烷年排放总量的40%[5—6]。河流甲烷排放对全球变暖较为敏感:在温度增加2 ℃的情景下,河流甲烷排放量将增加8%[7]。水库碳排放日益受到国内外研究者的关注,据估计全球水库甲烷年排放量为8.9—22.2 Tg,其单位面积甲烷排放量远高于其他水生生态系统[8]。


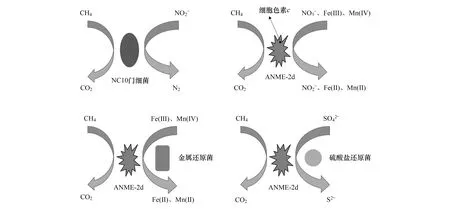
图1 NC10门细菌主导的亚硝酸盐型AOM反应及ANME-2d主导的硝酸盐型、金属还原型和硫酸盐型AOM反应Fig.1 NC10 phylum bacteria-mediated nitrite-dependent AOM pathway and ANME-2d-mediated nitrate-,metal-and sulfate-dependent AOM pathwaysANME:甲烷厌氧氧化古菌Anaerobic methanotrophic archaea;AOM:甲烷厌氧氧化Anaerobic oxidation of methane
1 NC10门细菌介导的甲烷厌氧氧化
由于受人类活动(如农田径流、生活污水排放等)的影响,内陆湿地与水体往往受到不同程度的氮素污染,这为亚硝酸盐型AOM反应的发生提供了有利条件[38]。至今,已有大量研究发现,亚硝酸盐型AOM反应及其功能微生物NC10门细菌存在于内陆湿地,以及湖泊、河流、水库等各种淡水水生生态系统中(表1)。
内陆湿地作为全球最重要的碳库之一,其甲烷排放通量与微生物控制机制备受关注[63]。长期以来,甲烷好氧氧化被认为是控制湿地系统甲烷排放的唯一重要生物途径[64]。近年来,亚硝酸盐型AOM反应作为湿地甲烷汇的贡献受到了国际、国内学术界的广泛关注。Hu等[15]利用13CH4稳定性同位素示踪和分子生物学手段,首次报道了淡水湿地系统中存在亚硝酸盐型AOM反应及其功能微生物NC10门细菌。据估算,由此类AOM反应所致的甲烷氧化量为4.1—6.1 Tg/a,约占全球湿地甲烷年排放通量的2%—6%[15]。随后,不断有证据表明,不同天然淡水湿地[16—17,34,39],以及潮汐流湿地[20]、垂直流湿地[44—45]、表面流湿地[46]和城市湿地[42—43]中均存在亚硝酸盐型AOM反应,以及NC10门细菌的分布。不同类型湿地中亚硝酸盐型AOM的甲烷氧化活性较为接近,NC10门细菌的绝对丰度多数为105—107拷贝/g(土壤)(表1)。Zhang等[20]研究表明,潮汐流湿地中亚硝酸盐型AOM反应对土壤甲烷氧化的贡献率为9.5%—26.3%,暗示了该类甲烷氧化反应在控制湿地甲烷排放中起了重要作用。最近,亚硝酸盐型AOM反应在氮素转化中的作用开始受到关注[20,45]。如有研究发现,此类AOM反应在湿地土壤氮气产生中的贡献率高达20.7%—40.1%[20]。此外,湿地土壤中亚硝酸盐型AOM的甲烷氧化活性及NC10门细菌的分布存在空间异质性。多数研究表明,深层土壤(20—60 cm)是亚硝酸盐型AOM反应的活跃区,亦是其功能微生物分布的峰值区[15—16,39,42,44]。这是由于深层土壤相对稳定的缺氧条件和高浓度甲烷,更有利于NC10门细菌的生长和代谢[39]。湿地中亚硝酸盐型AOM反应作用强度的空间变异还受土壤无机氮、有机碳等水平的影响[16,20,34]。但目前,针对湿地中亚硝酸盐型AOM的时间变异性研究较少[16]。多时空尺度下亚硝酸盐型AOM反应及其功能微生物的研究,将有助于更好地评估此类生物过程在湿地甲烷减排中的贡献及其环境调控机制。

续表生态系统Ecosystems电子受体Electron acceptors甲烷厌氧氧化活性Activity of anaerobic methane oxidation/(nmol CO2 g-1 d-1)功能微生物Functional microbes甲烷厌氧氧化微生物丰度Abundance of anaerobic methanotrophs/(拷贝/g)参考文献ReferencesØrn湖(丹麦)Lake Ørn (Denmark)Fe(III)Fe(III)/SO42-1.8 nmol cm-3 d-1NDNDANME-2dNDND[56][35]钱塘江Qiantang RiverNO-2NDNC101.3×106—1.0×107 (16S rRNA)[26]东江Dongjiang RiverNO-2NDNC109.1×104—3.0×106 (pmoA)[57]浑河Hunhe RiverNO-2NDNC10ND[58]北运河(北京)North Canal (Beijing)NO-2NDNC10ND[59]英格兰内陆河流Inland rivers in EnglandNO-2NO-3Fe3+SO42-0.4—61.00.5—5.71.5—8.10.6—4.4NC10ANME-2dANME-2dANME-2d3.7×106—1.5×107 (16S rRNA)2.1×104—2.5×105 (16S rRNA)[25][25]三峡水库Three Gorges ReservoirNO-2NDNC104.7×102—1.8×105 (16S rRNA)[60-61]新丰江水库Xinfengjiang ReservoirNO-2NDNC108.0×104—1.0×106 (16S rRNA)[62]印度大坝水库Dam-reservoirs in IndiaNO-2NDNC10ND[28]九龙湖水库Jinglonghu ReservoirNO-2NO-34.7—14.10.8—2.6NC10ANME-2d8.6×107—2.8×108 (16S rRNA)3.7×105—4.8×105 (16S rRNA)[29][29]


2 ANME- 2d介导的甲烷厌氧氧化
2.1 硝酸盐型甲烷厌氧氧化


2.2 金属还原型甲烷厌氧氧化

目前对于ANME-2d是如何利用铁、锰等难溶的金属电子受体,其电子转移机制是什么,尚存在争论。从现有研究来看,主要的电子转移机制可能存在以下两种。一种为胞外电子直接转移(图1)。Ettwig等[72]通过宏基因组发现,富集培养物中的ANME-2d含有大量编码细胞色素c的基因。细胞色素c在电子从胞内传至胞外以及细胞间传递过程中起着至关重要的作用。但有关ANME-2d的细胞色素c在不同金属电子受体存在条件下的表达仍需进一步验证。另一种电子转移途径为种间电子转移机制(图1)。Fu等[73]向ANME-2d富集培养物中添加异化铁还原菌ShewanellaoneidensisMR-1,发现ANME-2d和铁还原菌的丰度在培养过程中均有增加。他们认为ANME-2d和铁还原菌可能是通过电子穿梭体、细胞色素蛋白载体、纳米导线等方式协同完成电子转移过程[73]。此外,Lu等[74]通过向ANME-2d富集培养物中加入Cr(VI),观察到甲烷氧化伴随Cr(VI)还原的现象。这可能是ANME-2d和一种未知的Cr(VI)还原微生物共同完成了AOM耦合Cr(VI)还原过程[74]。
虽然富集培养物中的ANME-2d能催化铁、锰等(无论是可溶性金属离子还是不溶性金属氧化物)金属还原型AOM反应,但有关天然水体中ANME-2d介导的金属还原型AOM的研究还相当匮乏(表1)。内陆水体(特别是湖泊、河流等)沉积物容纳了来自流域自然风化及人为排放的包括铁、锰在内的各种金属元素,这为金属还原型AOM反应提供了电子受体来源。早期研究者依据元素的生物地球化学和同位素特征判断,湖泊生态系统中存在铁还原型或锰还原型AOM反应,但未涉及相关功能微生物的研究[54—56]。Weber等[35]在丹麦低硫高铁沉积物中检测到了AOM反应,且通过稳定性同位素核酸探针技术(RNA-based stable isotope probing,RNA-SIP)揭示了ANME-2d介导了Fe(III)还原型和(或)硫酸盐型AOM反应。Shen等[25]通过反转录实时荧光定量PCR发现,在13CH4+Fe3+泥浆培养体系中ANME-2d的mcrA基因显著表达,证明了此类古菌可催化河流沉积物中Fe(III)还原型AOM反应。但目前,有关内陆湿地与水体中是否普遍存在ANME-2d介导的Fe(III)和Mn(IV)还原型AOM反应,及其主要功能微生物类群有待更深入的研究。
最近,Shi等[36]揭示了天然湿地土壤中存在AOM耦合砷(V)还原的现象。他们利用同位素标记实验发现,湿地环境中AOM反应会促进土壤结合态砷酸盐向水溶性更高的亚砷酸盐转化,其中26.4%—49.2%的砷释放被认为是由AOM反应所致。但砷还原型AOM反应在减少湿地甲烷排放中贡献率较低,最高仅约0.7%。Shi等[36]还通过荧光定量PCR和宏基因组测序等分子生物学手段,分析了参与砷还原型AOM反应的功能微生物,并初步构建了AOM耦合砷还原的代谢通路。结果表明,ANME(ANME-1与ANME-2)首先通过逆甲烷生成途径活化甲烷并获得电子,随后将电子传递给细胞周质中的砷还原酶或者共生的砷还原菌中,进一步实现砷的还原[36]。
2.3 硫酸盐型甲烷厌氧氧化
一般认为,硫酸盐型AOM反应在淡水环境中不易发生,其原因是淡水水体中硫酸盐浓度较低(通常仅为海洋环境的1%不到)。但有研究表明,硫酸盐浓度似乎并不是制约硫酸盐型AOM反应发生与否的决定性因素,即使在低硫酸盐环境中亦可发生此类甲烷氧化反应。其发生机制可能是在缺氧环境下硫酸盐可同时进行氧化和还原反应,比如硫酸盐被还原成硫化物后又可在溶解性有机物或金属氧化物存在的情况下被重新氧化,从而构成了硫酸盐与硫化物的循环体系[75—76]。
不同于NC10门细菌,ANME-2d是一类多功能的甲烷代谢菌,它们除了可以催化硝酸盐型AOM及Fe(III)、Mn(IV)、Cr(VI)等金属还原型AOM反应外,还能催化硫酸盐型AOM反应[33]。由于ANME-2d基因组中缺少异化硫酸盐还原酶编码基因,此类古菌被认为不能独立催化完成硫酸盐型AOM反应,需与其它菌协同完成[77]。Nie等[33]研究发现,ANME-2d富集培养物中存在AOM耦合硫酸盐还原的现象,并认为ANME-2d和硫酸盐还原菌协同完成了硫酸盐型AOM反应。他们利用扫描电子显微镜观察到培养物中存在纳米网络结构,并通过宏转录组发现,ANME-2dflaB基因(编码古菌鞭毛合成的基因)以及脱硫球菌pilA基因(编码菌毛合成的基因)的表达均显著上调。由此认为,该纳米网络结构主要由ANME-2d的鞭毛和脱硫球菌的菌毛形成。ANME-2d在执行AOM反应的同时,通过纳米网络将电子传递给脱硫球菌实现硫酸盐的还原[33](图1)。

3 甲烷厌氧氧化功能微生物的分子生物学检测方法
由于尚未获得纯培养,对自然生境中NC10门细菌和ANME-2d等AOM功能微生物的检测主要依赖分子生物学手段,如聚合酶链式反应(polymerase chain reaction,PCR)、变性梯度凝胶电泳(Denaturing gradient gel electrophoresis,DGGE)和荧光原位杂交(Fluorescence in situ hybridization,FISH)等[78—79]。表2总结了当前用于测定环境中NC10门细菌和ANME-2d常用的PCR引物,其主要是针对它们的16S rRNA或功能基因。近年来,高通量测序已被广泛应用于微生物生态学研究中。目前,有不少研究者采用高通量测序技术(如Illumina Miseq)对环境样品中NC10门细菌和ANME-2d群落进行分析[16,29,34,87]。此外,Graf等[23]利用宏转录组手段分析了深水湖泊中NC10门细菌相关基因的转录水平,并结合宏基因组手段获得了一新的NC10门菌株的全基因组序列。另有研究者利用独特的脂肪酸生物标志物,对泥炭地环境样品中NC10门细菌进行了检测[88]。新的分子生物学手段的不断发展,将极大地推动对内陆湿地和水体环境中AOM功能微生物分布特征的理解。
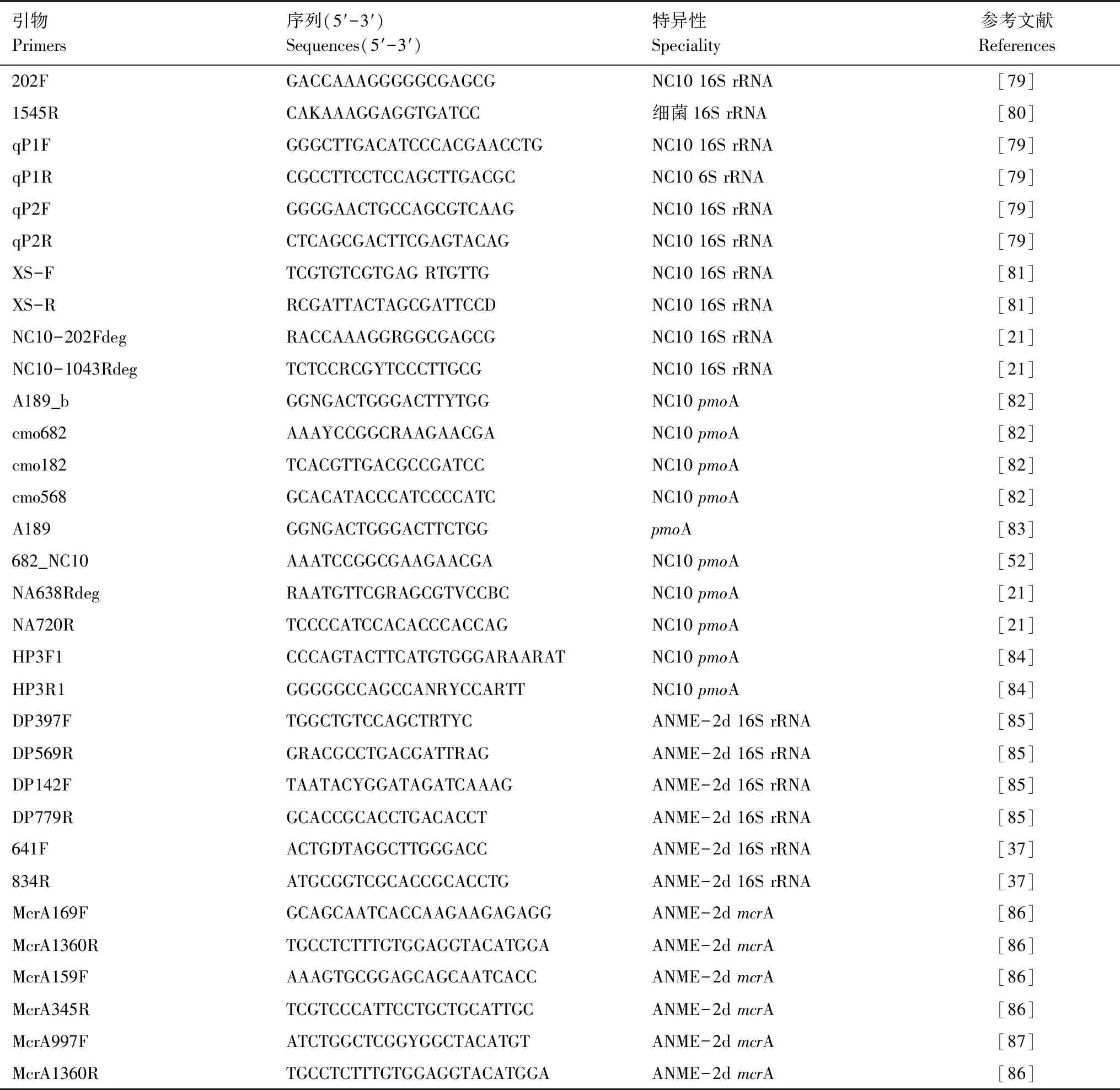
表2 用于检测NC10门细菌和ANME-2d常用的PCR引物Table 2 PCR primers commonly used for detection of NC10 phylum bacteria and ANME-2d
4 甲烷厌氧氧化活性测定的同位素示踪技术

5 问题与展望
5.1 不同AOM途径的功能微生物
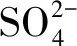
5.2 不同AOM途径在甲烷减排中的相对贡献
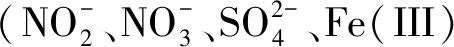
5.3 不同AOM途径在相关物质循环中的作用
现有的研究更多的是关注AOM反应在内陆湿地与水体甲烷减排中的贡献,很少量化其在其它物质循环中的作用[20,45,53]。事实上,亚硝酸盐型和硝酸盐型AOM反应在消减水体氮素污染物,以及金属还原型AOM反应在调节铁、锰等元素沉积方面的作用也不容忽视。采用稳定性同位素示踪与组学相结合的手段,有助于认识不同AOM途径在相关物质循环中的作用。
5.4 不同AOM途径的主要影响因素
当前关于内陆湿地与水体中不同AOM途径影响因素的研究,很少涉及宏观环境因子和人类活动等对AOM的影响。例如气候变化(大气CO2浓度升高和气候变暖等)对AOM过程会产生何种影响不得而知。研究表明,大气CO2浓度升高或气候变暖可通过促进植物光合作用,增加植物根系生物量,增强根系分泌物代谢,以及改变土壤理化性质等间接影响甲烷好氧氧化过程[90—91]。同样,气候变化很可能会对AOM过程产生影响。开展气候变化背景下AOM的研究,将有利于更好地评价相关微生物在减缓气候变化中的作用。另外,人为活性氮排放亦会对AOM过程产生影响[29],尤其会对河流、湖泊、水库等水生生态系统中亚硝酸盐型和硝酸盐型AOM过程产生影响。对于稻田系统中的AOM过程,其会受各种农业管理措施(如施肥、水分管理方式、耕作制度等)的影响。探明不同管理措施对AOM过程的影响,可以更好地评估AOM在稻田甲烷氧化中的贡献,同时为稻田甲烷减排提供科学依据。
