高通量测序分析冻融期碳源输入方式对土壤线虫群落的影响
2022-05-26张利敏徐胜楠于鸿淼王思琪
刘 月,张利敏,徐胜楠,王 瑶,于鸿淼,王思琪
哈尔滨师范大学寒区地理环境监测与空间信息服务黑龙江省重点实验室,哈尔滨师范大学地理科学学院,哈尔滨 150025
作为土壤碳库的重要组成部分,土壤有机碳(SOC)为土壤生物提供了其生存所需要的养分[1]。土壤有机碳主要来源于植被地上和地下的输入,自然状态下经过长期的积累,总量巨大,因而短期内难以检测到较明显的变化[2]。为了更深入探究土壤有机碳对土壤生物以及地下生态系统的影响,Francis Hole 博士早在20世纪50年代就设置了改变碳源输入方式的实验,即植物残体(凋落物及根系)的去除和添加实验(detritus input and removal treatments,DIRT),由去除凋落物处理、去除根系处理、去除凋落物和根系处理以及加倍添加凋落物处理等组成[3]。该实验通过控制地表凋落物和根系来探究地上部分植物与土壤生物之间的关系,以便在相对较短的时间内观测到土壤有机碳的变化,进一步对土壤生态系统的影响进行研究。大量的研究表明,植物碳输入方式的变化会对土壤理化性质产生一定的影响。Lajtha等[4]在美国安德鲁斯实验森林的针叶林中建立了一项野外控制实验发现,5年来通过阻隔地上和地下凋落物输入,该地块的土壤表现出土壤有机碳和有机氮逐年下降的现象。Kabzems等[5]研究发现,在落叶乔木林中,去除凋落物引起的表层土壤总有机碳的下降比去除植物体本身所产生的效果更明显。此外,植物碳源变化造成的土壤环境的改变又进一步影响着土壤生态系统的生物群落[6]。然而,目前关于植物碳源输入方式变化的研究多集中于对土壤理化性质及碳循环方面[7—8],而对如何影响土壤线虫群落却知之甚少[9]。
线虫是土壤食物网中最丰富的无脊椎动物[10],具有适应能力强、营养类群丰富、生活周期较短、对环境变化反应迅速等特点,被广泛用于评估土壤微食物网结构功能以及土壤环境质量[11]。由此本文推测,不同的植物碳源输入方式所引起的土壤环境的改变,也必然会对线虫的群落结构产生影响。因此,本研究通过对土壤线虫的研究来反映有机碳输入对环境的影响。但是,以往线虫群落多样性的研究多采用形态学鉴定的方法,鉴定过程难度大,且易受环境及其他因素干扰,因此需要研究者具备较为专业的知识素养和丰富的经验[12]。伴随着分子生物方法的发展,高通量测序技术在线虫方面的研究也取得了一定的进展[13]。该技术克服了传统形态学鉴定的很多不足,大大减少了劳动时间,提高了工作效率,为鉴定土壤线虫提供了一种相对经济有效的方法[14]。因此,本研究利用Illumina MiSeq测序技术来分析土壤线虫群落的组成以及生态多样性特征等。
春季冻融期是高纬度地区特有的时期,期间的冻融作用是该区域土壤生态的影响因素之一[15]。以往的研究表明冻融作用以及冻融期特有的气温差异会直接或间接对土壤生物产生影响[16]。但是就目前的研究结果看来,冻融时期的土壤生物群落变化特征还具有一定的不确定性。一方面,林尤伟等[17]对小兴安岭不同林型的土壤微生物量研究发现,冻融作用使得土壤食物网中微生物繁殖所需的资源基质增加。Zhou等[18]研究发现,冻融时期的土壤微生物和根系二者之间的促进和竞争关系,刺激了微生物的繁殖。另一方面,研究还发现,春季冻融期温差变化导致了表层植物根系以及土壤微生物死亡,进而造成微生物分解的速率下降[19]。冻融时期的土壤线虫对土壤有机碳变化的响应是否具有一个独特的模式,还尚不明确。因此,本文利用Illumina MiSeq技术,通过比较冻融期碳源输入的四种处理方式,即凋落物和根系同时输入(CK)、仅根系输入(NL)、仅凋落物输入(NR)以及无碳源输入(NLR)下土壤线虫群落结构,多样性以及生态指数的变化情况,揭示土壤线虫群落的响应机制,探讨地上、地下碳源输入改变后土壤微食物网的变化趋势,为研究土壤碳循环中土壤动物的重要作用奠定基础。根据以往的研究,本文假设(1)仅凋落物输入处理(NR)导致的地下碳分配变化会减少土壤线虫的食物量,进而降低食细菌线虫和食真菌线虫的相对丰度;(2)与其他限制碳源的输入方式相比,无碳源输入处理(NLR)的土壤线虫的均匀度和多样性必然会降低。
1 材料与方法
1.1 研究区概况
研究地设在黑龙江帽儿山森林生态系统观测研究站,地理坐标为45°24′N,127°28′E。气候为大陆性温带季风气候,年平均气温2.8 ℃,年平均降水量723 mm。地带性土壤为暗棕色森林土壤,母岩为花岗岩。植被为天然次生林及人工林[20]。该地区主要的天然次生林树种有白桦BetulaplatyphyllaSuk.、山杨PopulusdavidianaDode、黄菠萝PhellodendronamurenseRupr.、胡桃楸JuglansmandshuricaMaxim.、水曲柳FraxinusmandschuricaRupr.、色木槭AcerpictumThunb.exMurray、椴树TiliatuanSzyszyl.等,主要的人工林树种有红松PinuskoraiensisSiebold.etZuc.、落叶松Larixgmelinii(Rupr.)Kuzen.等。
1.2 样地布设和土壤样品采集
于2017年7月,在天然次生林中分别设置4个面积为400 m2(20 m×20 m)的样地,分别在每个样地进行不同碳源输入处理,处理方式包括:凋落物和根系同时输入处理(Control treatment,CK),仅根系输入处理(Litter removal treatment,NL),仅凋落物输入处理(Root removal treatment,NR)以及无碳源输入处理(Litter and root removal treatment,NLR)。具体的处理方式如下:凋落物和根系同时输入处理(CK):不做处理;仅根系输入处理(NL):用尼龙网兜将凋落物与样地土壤隔离,将尼龙网兜上的凋落物每月清理一次,直至网内再无凋落物;仅凋落物输入处理(NR):在样方四周挖深度1 m壕沟,切断根系后用塑料膜隔开,以阻止根系进入;无碳源输入处理(NLR):按上述方法进行去除根系处理,并在样方内设置尼龙网兜,按月将凋落物取出。样地之间间隔大于100 m,以防止相互之间的干扰,每块样地设置3个1.5 m×1.5 m的样方作为重复处理,共计12个样方。
土壤样品采集于2019年3月,在每个小区选取四个点(位于样方四个角),用内径为3.5 cm的土钻采集0—10 cm土壤层样品,挑除碎石以及植物根系,充分混合均匀后装入无菌袋中保存。将12个土壤样品分别分为两份:一份用于提取土壤线虫DNA,另一份风干后过100目筛,进行土壤理化性质测定。样地土壤理化性质如表1示。
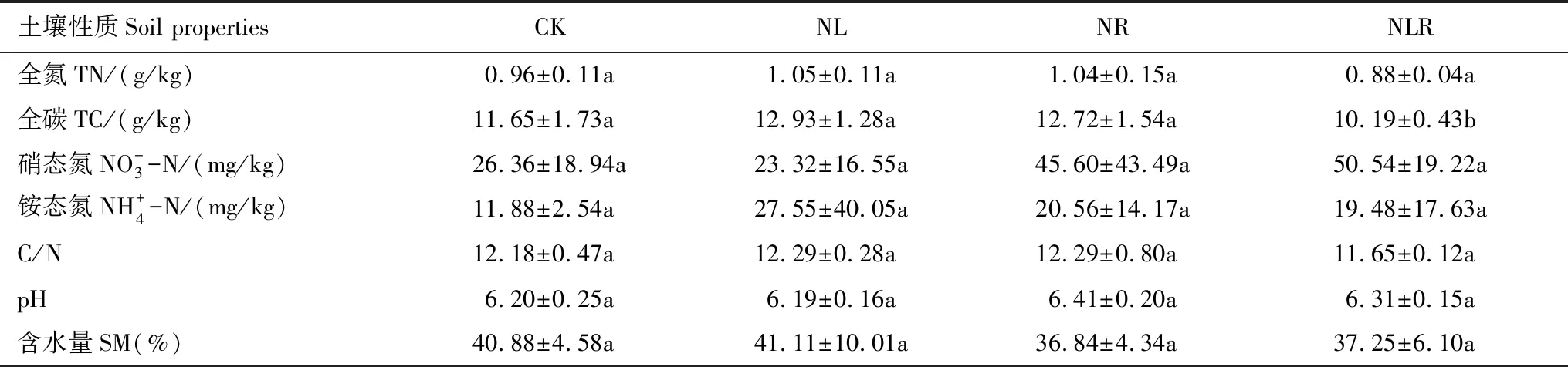
表1 不同碳源输入方式下土壤理化性质(平均值±标准差)Table 1 Soil physical and chemical properties under different carbon input methods(Mean±SD)
1.3 DNA提取和PCR扩增
采用Power Soil DNA Extraction Kit(MoBio)对土壤样品进行总DNA抽提,利用1.2%琼脂糖凝胶电泳检测DNA抽提质量。采用两步 PCR 扩增的方法,首先采用特异引物(内侧引物)扩增目的片段,将目的片段进行胶回收,而后将回收产物作为模板进行二次 PCR 扩增(外侧引物)。第一次PCR扩增前设计引物为:F内侧引物:5′-TTCCCTACACGACGCTCTTCCGATCT-特异引物-3′,F 外侧引物:5′-AATGATACGGCGAC CACCGAGATCTACAC-barcode-TCTTTCCCTACACGACGCTC-3′。将 PCR 扩增产物,于2%琼脂糖凝胶电泳切胶回收,回收产物进行二次 PCR 扩增。第二次PCR扩增前设计引物为:R 内侧引物:5′-GAGTTCCTTGGCACCCGAGAATTCCA-特异引物-3′,R 外侧引物:5′-CAAGCAGAAGACGGCATACGAGAT-barcode-GTGACTGGAGTTCCTTGGCACCCGAGA-3′。将 PCR 扩增产物,于2%琼脂糖凝胶电泳切胶回收,回收产物进行qPCR定量。在 Illumina MiSeq平台进行双端测序(2×300 bp),建库并测序(微基生物有限公司,上海)。
1.4 线虫生态指标
线虫属优势度的划分:相对丰度为10%以上者为优势属,1%—10%为常见属,1% 以下为稀有属。
根据取食习性将土壤线虫划分为食细菌线虫(Bacterivores);食真菌线虫(Fungivores);捕食/杂食线虫(Omnivores/predators);植食线虫(Plant-parasites)四个营养类群[21]。
(2)Pielou均匀性指数(J):J=H′/lnS;S为鉴定分类单元的数目。
(4)总成熟度指数(Maturity Index,MI):MI=∑c(i)×p(i);c(i)为第i种线虫的生活史策略c-p值;p(i)为第i种线虫在线虫总数中所占比重。
(5)线虫通路比值[22](NCR):食细菌线虫与食细菌线虫和食真菌线虫数量之比,即NCR=B/(B+F);其中,B和F分别代表食细菌和食真菌的线虫数量。
目前应用高通量测序技术对线虫群落的研究尚不成熟,存在文库不完善等现象[23]。这导致各碳源输入处理中出现较多未分类线虫属,因而无法对线虫进行营养类群的划分以及生态指标的计算。因此,本研究在划分土壤线虫营养类群,以及计算多样性指数和生态指数时将未分类线虫属排除,即基于已测得的68个线虫属进行分类和计算。
1.5 数据处理和分析
利用SPSS 20.0 软件分析土壤理化性质差异、测序数据统计差异、营养类群的相对丰度以及生态指数差异,采用 one-way ANOVA 进行线虫数据的统计学检验。土壤线虫群落的生态指标使用R软件以及Excel 2010进行计算。运用R软件进行主坐标分析(Principal coordinate analysis,PCoA)以及冗余分析(Redundancy analysis,RDA)。其余图形绘制使用Origin 2018。
2 结果与分析
通过Illumina高通量测序分析得到的不同碳源输入方式下土壤中有效序列总数为493186条,平均每个样品的有效序列为41099条。优化序列数如表2所示。覆盖率指数展示了研究的土壤样品文库的覆盖程度,测序的序列被覆盖到的越全面,数值则越高,本试验覆盖率能够反映各土壤样本线虫群落的真实情况[24](表2)。
2.1 碳源输入方式对土壤线虫群落组成的影响
2.1.1OTU组成分析
聚类后注释得到 CK均值为872个OTU,NL中均值为1032个OTU,NR中均值为799个OTU,NLR中均值为1095个OTU(表2)。本文中不同碳源输入方式下土壤线虫群落OTU韦恩图结果(图1)表明CK中独有的OTU占总OTU的16.80%(638),NL独有的OTU占20.30%(771),NR独有的OTU占14.69%(558),NLR独有的OTU占22.59%(858)。此外,CK与NL单独共有的OTU数量最多,为61,CK与NR单独共有的OTU数量最少,为26,CK与NLR共有的OTU数量为31。CK,NL,NR,NLR不同碳输入下土壤中共有的线虫OTU数量为60。

表2 不同碳源输入方式下土壤线虫测序数据统计(平均值±标准差)Table 2 Statistics of soil nematode sequencing data under different carbon input methods(Mean±SD)

图1 基于OTU丰度的不同碳源输入方式下土壤线虫群落维恩图Fig.1 Venn diagram of soil nematode community under different carbon source input methods based on OTU abundanceCK:凋落物和根系同时输入Control;NL:仅根系输入Litter removal;NR:仅凋落物输入Root removal;NLR:无碳源输入Litter and root removal;图中数字分别代表不同碳源输入方式下独有以及共有OTU的数量
2.1.2基于属水平不同碳源输入方式下土壤线虫相对丰度
为了解碳源输入方式对土壤线虫群落结构的影响,对OTU代表序列进行物种检测和注释。在排除各碳源输入处理中未注释OTU(Unclassified)后,得到已注释的OTU被识别为2纲,13目,54科,68属,104种。基于已注释线虫属水平的相对丰度进行分析,各碳源输入处理中的优势属和常见属的种类总共为28(图2),相对丰度低于1%的稀有属的种类为40(表3)。CK中土壤样品中常见属有异色矛属(Achromadora),似双胃属(Diplogasteroides),Paralamyctes,杆咽属(Rhabdolaimus)等。NL中土壤样品中优势属为棱咽属(Prismatolaimus),常见属为杆咽属(Rhabdolaimus),垫咽属(Tylencholaimus),异色矛属(Achromadora)等。NR中土壤样品中优势属为杆咽属(Rhabdolaimus),常见属为锉齿属(Mylonchulus),异色矛属(Achromadora),微矛属(Microdorylaimus)等。NLR中土壤样品中常见属为三裂体属(Trischistoma),小杆属(Rhabditis),棱咽属(Prismatolaimus),矛线属(Dorylaimus)等。不同碳源输入处理下的稀有线虫属如表3所示,其中真单宫属(Eumonhystera),异头叶属(Heterocephalobus),巴氏属(Bastiania),丝尾垫刃属(Filenchus),盘旋属(Rotylenchus)以及无孔小咽属(Aporcelaimellus)分布于各碳源输入处理中。

表3 不同碳源输入方式下土壤线虫群落稀有属组成Table 3 Composition of rare genus in soil nematode community under different carbon input methods
从食细菌线虫的组成来看(图2),NR中杆咽属(Rhabdolaimus)和无咽属(Alaimus)的相对丰度大大提升,分别是CK 的2.07倍和2.34倍。NL中食细菌线虫棱咽属(Prismatolaimus)的相对丰度远大于CK和NR,是CK的3.69倍,以及NR的4.57倍。从食真菌线虫的组成来看,NL中食真菌线虫垫咽属(Tylencholaimus)的相对丰度大大增加。从捕食杂食线虫的组成来看,NR中的锉齿属(Mylonchulus)和微矛属(Microdorylaimus)远远大于其他碳源输入方式的样地。此外,在NLR中,三裂体属(Trischistoma)的相对丰度大大增加。

图2 不同碳源输入方式下土壤线虫群落优势属和常见属的相对丰度Fig.2 Relative abundance of dominant and common genus in soil nematode communities under different carbon input methods
2.1.3碳源输入方式对土壤线虫营养类群的影响
由图3可知,不同碳源输入方式下均为食细菌线虫的比例最大,最高能达到38.30%,是土壤线虫的优势营养类群。和CK相比,NR中食细菌线虫的相对丰度有所上升(P>0.05),而食真菌线虫则呈现出与食细菌类线虫相反的趋势(P<0.05)。捕食杂食线虫在NL中相对丰度变化不明显(P>0.05),而在NR中相对丰度均大幅度上升,分别较CK增加了12.35%(P<0.05)。此外,NR降低了植食线虫的相对丰度(P>0.05)。

图3 不同碳源输入方式下各营养类型的线虫相对丰度 Fig.3 Relative abundance of nematodes in different nutrient types under different carbon input methodsBF:食细菌线虫Bacterivores;FF:食真菌线Fungivores;OP:捕食/杂食线虫Omnivores/Predators;PP:植食线虫Plant-parasites
2.2 碳源输入方式对土壤线虫生态指数的影响
不同碳源输入方式下土壤线虫群落生态学指数分析结果如表4所示,多样性指数(H′)表现为NR中最高,NLR中最低,表明去除凋落物和根系后土壤线虫群落的多样性降低,生态环境变差。NR中均匀度指数(J)最高,该群落较为稳定。优势度指数(Dom)为在NLR中最高。成熟度指数(MI)反映的是土壤资源的多样化[25],本文中线虫成熟度指数(MI)表现为NR最高,这说明将根系去除后,土壤资源的质量和多样性反而升高。碳源输入方式的变化并没有改变土壤中有机质的分解途径,在各处理中,线虫通路比值(NCR)均大于0.5,表明土壤食物网仍是为以细菌为基础的分解通道占优势。

表4 不同碳源输入方式下土壤线虫生态指数Table 4 Ecological index of soil nematodes under different carbon source input methods
2.3 土壤线虫β多样性分析
主坐标分析(Principal Coordinates analysis,PCoA)用于衡量不同碳源输入方式下土壤线虫群落物种组成的相似度,进而明确各样本之间在群落物种结构上的差异性。ANOSIM(Analysis of similarities)分析结果表明,各样地之间土壤的OTU组成之间存在极显著差异(R=0.296,P=0.006)。
对各样地数据进行主坐标分析(PCoA),如图4所示,PC1和PC2分别解释变量方差的13.23%和12.38%,两者累计贡献率达25.38%。PC1 将NL中的土壤线虫群落与NR明显区分开。通过分析各样本之间的距离来推测相似和差异情况,其距离越远,说明线虫群落差异越大。总体而言,CK,NL,NR样地的土壤线虫群落各样本组内聚集明显,且组间距离较远,各碳源输入处理之间土壤线虫群落结构发生了变化。
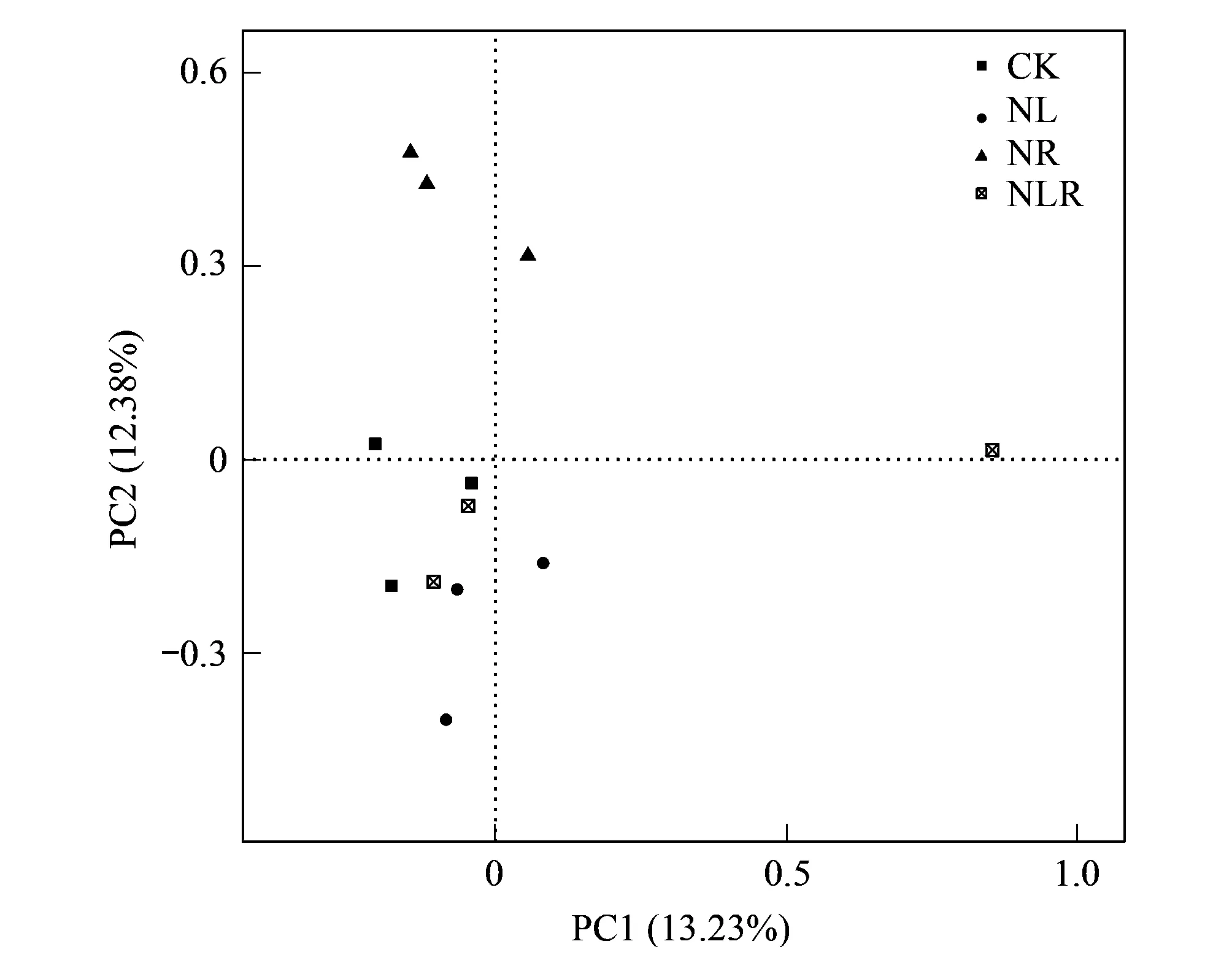
图4 不同碳源输入方式下土壤OTU的主成分分析 Fig.4 Principal component analysis of soil OTU under different carbon source input methods
2.4 土壤线虫群落与土壤理化性质之间的关系
土壤提供了线虫生长繁殖的微环境,而不同碳源输入方式使得土壤理化性质在一定程度上发生改变,这也进一步会对土壤线虫群落产生影响。为探究环境变量与线虫群落组成之间的关系,本文基于常见线虫属与土壤环境因子进行冗余分析(RDA)(图5)。第一、二轴解释的变量为44.86%以及29.30%。在图3中可以观察到TC,TN与异色矛属(Achromadora)以及杆咽属(Rhabdolaimus)呈显著正相关(P<0.05)。pH和三裂体属(Trischistoma)呈正相关(P>0.05),和棱咽属(Prismatolaimus)呈负相关(P>0.05)。SM和三裂体属(Trischistoma),皮杆亚属(Choriorhabditis)呈正相关(P>0.05)。铵态氮与棱咽属(Prismatolaimus)呈正相关(P>0.05),与三裂体属(Trischistoma)呈显著负相关(P<0.05)。硝态氮与似双胃属(Diplogasteroides),锉齿属(Mylonchulus)呈正相关(P>0.05)。
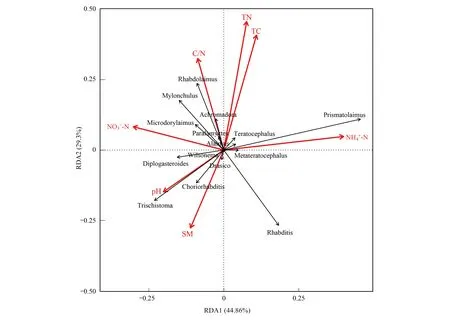
图5 常见线虫属与土壤环境因子冗余分析Fig.5 Redundancy analysis of common nematodes and soil environmental factorsTN:全氮Total N;TC:全碳Total C;SM:含水量Soil moisture
3 讨论
3.1 碳源输入方式对土壤线虫群落结构的影响
不同碳源输入方式通过控制输入碳源的数量和质量来改变土壤环境,间接影响土壤线虫群落组成与结构。本研究中,仅凋落物输入处理使得属于食细菌线虫的杆咽属(Rhabdolaimus)和无咽属(Alaimus)的相对丰度的大幅增加(图2)。此外,TN与杆咽属(Rhabdolaimus)呈显著正相关(图5)。李成一等[26]研究指出,在一定的阈值范围内,氮含量的提升对细菌生物量有直接的积极作用。杆咽属(Rhabdolaimus)等在仅凋落物输入处理中相对丰度大幅增加,原因可能是氮含量增加所致。去除根系使得植物不能吸收土壤中的有效氮[27],导致土壤中一部分氮被保留。同时,根系去除后由于易变性碳源减少,使得微生物量下降,释放了一部分被固定的氮,进而导致土壤中全氮量增加[28](表1)。而氮元素的提高增加了细菌生物量,进而刺激了该线虫大量繁殖。由此可见,TN是影响线虫群落组成的重要因子。本研究还发现,相比于凋落物和根系同时输入以及仅凋落物输入处理,仅根系输入处理中属于食细菌线虫的棱咽属(Prismatolaimus)比例大幅提升(图2),成为该样地中的优势属,同时其与土壤pH值呈负相关(图5)。Li等[29]研究指出,土壤pH值越高,食细菌线虫的比例反而越低。土壤pH值由土壤中阴阳离子决定,植物生长时,土壤中的阳离子被吸收,最后以落叶的形式重返土壤。Fujii等[30]认为,将凋落物移除后,没能使阳离子进入地下,造成阴阳离子失衡,土壤pH值降低。因此,本研究推测棱咽属(Prismatolaimus)相对丰度的增加可能是仅根系输入处理将凋落物移除引起的土壤pH值下降所致。
进一步对土壤线虫群落的营养类群进行分析。研究结果表明,不同碳源输入处理下CK;NL;NR;NLR)的食细菌线虫的相对丰度在各营养类群中均占绝对优势(图3)。焦向丽等[31]对东北地区不同林型土壤线虫群落研究表明,天然次生林中食细菌线虫数量最大,且组成最丰富,这与本文研究结果一致。根系释放的分泌物如碳水化合物、氨基酸等容易降解,主要在细菌能量通道中代谢,更多的刺激细菌和以细菌为食的线虫种群[29]。因此,本研究推测在仅凋落物输入处理中,将根系去除会使得食细菌线虫的相对丰度降低。然而,与假设相反,本研究发现去除根系后食细菌线虫的相对丰度却大大增加(图3)。根系分泌物等虽然为土壤动物群落提供了碳源,但根系对土壤养分的吸收也会与土壤细菌争夺养分[32]。由此可见,虽然去除根系阻止了光合产物从地上植物进入土壤,但是由于减少了土壤对植物所需碳源的输出,益于土壤中碳源的保留,反而丰富了食细菌线虫的食物来源。与食细菌线虫的变化不同,仅凋落物输入处理显著降低了食真菌线虫的相对丰度(图3)。Subke等[33]认为,去除根系抑制了树木和土壤之间的能量联系,并对菌根真菌产生负面影响,进而导致了真菌生物量的下降。因而,本研究推测将根系去除后,食真菌线虫的比例显著降低可能和菌根真菌的减少有关。此外,虽然仅根系输入处理在一定程度上影响着线虫群落营养结构,但是和仅凋落物输入处理相比,变化程度较小,且均不显著,这表明地下碳输入对土壤线虫的影响可能比地上碳输入更为重要[34]。Keith等[35]指出,根的输入可能是形成土壤食物网中营养成分的核心,地下碳源输入对土壤线虫的结构和复杂性的影响远远大于凋落物。另一方面,根际的基质容易降解,而凋落物的分解更加缓慢[36],而本实验周期较短,可能是导致变化不显著的另外一个原因。
3.2 碳源输入方式对土壤线虫群落生态指数的影响
物种多样性是维持生态系统正常功能的前提,土壤动物的多样性体现着土壤微食物网的复杂性和健康程度。本研究发现,与其他碳源输入方式相比,无碳源输入处理的多样性指数(H′)最低,且优势度指数(Dom)最高(表4),说明去除凋落物和根系使得土壤线虫群落的多样性下降,物种组成比例更加不均衡,这与本文的假设相一致。食物资源是影响土壤线虫群落多样性的重要因素之一[37]。在森林生态系统中,植物活根将碳源转移到根际土壤[38],植物凋落物也是土壤碳的主要来源[39]。与凋落物和根系同时输入相比,无碳源输入处理显著降低了土壤中的全碳(TC)的含量(表1),这也改变了土壤微生物的食物数量和质量[40],以微生物为食的的线虫必然也会因食物减少而受到影响。另外,去除凋落物后,由于不能抵挡紫外线的照射,也会影响土壤线虫的生长和繁殖[35]。因此,食物资源得减少以及庇护所的缺失可能是土壤线虫群落多样性下降的主要原因。帽儿山地区属温带大陆性季风气候,具有明显的季节变化。该地春季土壤的反复冻融是常见的温度变化现象,冻融作用通过改变土壤结构和土壤水热状况间接影响土壤生物的结构和活性[41]。将本次冻融期线虫群落生态指数数据和之前7月份生长期的土壤样品的数据相比较(数据未发表),发现3月份冻融期的多样性指数(H′)明显低于生长期。生长期水分和热量条件较好,更利于微生物分解有机质,并且土壤生物数量和种类较多,线虫食物资源也更为丰富[42]。而反复冻融破坏土壤团聚体,导致土壤中的微生物死亡,减少了微生物的多样性[43],造成了土壤线虫的食物来源的数量和种类减少,进而降低了土壤线虫的多样性。此外,三月份冻融期的线虫群落生态指标是运用高通量测序数据计算得到的,而生长期的生态指数是通过原始的形态学鉴定数据计算得到的。因而,数据获取方式的差异也可能是造成二者季节间差异的原因,这也有待于进一步探索和研究。
MI指数越低,表明土壤受到的干扰越严重,MI指数越高,表明土壤养分越富集,土壤环境越稳定[44]。有研究指出[35]与仅凋落物输入相比,根的存在可能会进一步改善土壤食物网结构,这和本研究结果相反。本研究发现,仅凋落物输入处理的线虫成熟度指数(MI)最高(表4)。一般认为,捕食杂食线虫是决定食物网复杂性的关键类群。本研究发现在仅凋落物输入处理中,捕食杂食线虫的相对丰度最高,这可能是由于将根系去除后,植物对营养物质摄取的减少[28],保留了土壤中的碳氮含量,增加了线虫所需的食物质量,进而提高了土壤中线虫群落的多样性(表4)。而丰富的营养物质和多样的物种为捕食杂食线虫提供了较好的生存环境,益于其生存和繁殖,进而提高了线虫成熟度指数(MI)。较高的线虫成熟度指数(MI)也反映出NR中土壤食物网的营养层次增加,食物网更加稳定。各处理间线虫通路比值(NCR)均大于0.5(表4),这表明土壤食物网的分解通道仍是以细菌占优势,营养转化效率较高,分解代谢过程均较快。有研究指出,细菌与其他微生物相比,对抗土壤冻融循环的抵抗能力更强[45],推测这可能是冻融期细菌途径分解土壤有机物质更加占优势的重要原因之一。
本研究中,线虫群落生态指标的结果均是将未分类线虫属排除后计算得到的。基于已测得的68个线虫属进行生态指标计算,用以反映已确定线虫群落对不同碳源输入处理的响应。但是,数据中大量的未分类线虫属必然会在一定程度上影响生态指标的结果,这也是目前高通量测序技术应用于线虫群落研究存在的缺点,是今后进一步改正和发展的方向。本文为高通量测序技术在线虫群落方面的研究提供了数据支持。此外,本研究可以检测到不同碳源输入处理引起的土壤线虫群落组成以及群落生态指标的变化,但由于实验周期较短,部分变化不是很显著。在森林生态系统中,特别是较少受人类干扰的森林生态系统,土壤食物资源富足,因此短时间内碳源输入方式变化对土壤微食物网影响相对较小[46]。这也需要今后继续进一步开展连续的动态的野外控制实验验证其间的内在联系。
4 结论
不同碳源输入处理之间的土壤线虫群落结构差异显著,说明碳源输入变化调节着土壤线虫群落。同时,仅凋落物输入处理比仅根系输入处理对土壤线虫群落的影响更明显。和本文假设一致的是,仅凋落物输入处理降低了食真菌线虫的相对丰度。无碳源输入处理使得土壤线虫的群落多样性下降,生态环境质量变差。这也说明重视森林生态系统中植被保护的重要性。同时,仅凋落物输入处理的捕食杂食线虫相对丰度最大,线虫成熟度指数(MI)最高。不同碳源输入处理下土壤食物网有机质分解均以细菌降解途径占主导。由于实验周期较短,部分碳源输入方式处理之间的实验结果差异不明显,因此还需要长期的观测,进一步深入探讨土壤环境变化与土壤线虫的适应过程。本研究利用的高通量测序技术可以对线虫进行快速评估,在方法上对线虫群落的研究提供了有力支持。但是,目前该技术存在的弊端,如序列注释的数据库不够完善,以及引物位点的序列不匹配等,亟待解决。尽管高通量测序技术存在局限性,但是由于它具有比形态分析提供更高的分类分辨率的潜力,必然有助于加快土壤线虫群落的研究进程。
