磷霉素在儿童感染中的应用研究进展
2022-05-26徐晓勇马芬芬黄怡菲
吕 鹏, 徐晓勇, 马芬芬, 张 玉, 黄怡菲
全球范围内,多重耐药菌(MDRO)引起的感染正在增加,成为全球重大的临床和公共卫生挑战之一[1]。不同地理区域内,儿童多重耐药革兰阴性菌导致的尿路感染患病率为5%~90%[2]。而儿童作为特殊人群,因独特的生理状况、缺乏安全抗菌药物及完善的儿科数据等,使得治疗具有挑战性。
目前,磷霉素用于儿童的主要适应证是社区获得性下尿路感染,作为一种“老”的抗菌药物,因其低毒性、对多重耐药革兰阳性菌和阴性菌具有良好的抗菌活性、安全性高,与氨基糖苷类、碳青霉烯类等抗菌药物联合使用时具有协同作用等,重新引起了人们对磷霉素的关注,使其成为治疗儿童MDRO感染,特别是碳青霉烯类耐药菌(CRO) 感染的一种新策略和选择[3-5]。与口服磷霉素相比,静脉注射磷霉素在儿科患者的推荐剂量差异较大,且临床经验有限,现将磷霉素在儿童MDRO感染中的作用、推荐剂量和安全性等综述如下。
1 作用机制及抗菌活性
1.1 作用机制
磷霉素作为一种杀菌剂,最早发现于1969年,其通过与细菌烯醇丙酮酸转移酶(MurA)不可逆结合,抑制细菌活性,阻断N-乙酰葡糖胺和磷酸烯醇丙酮酸合成N-乙酰胞壁酸,干扰细菌细胞壁的合成,发挥广谱抗菌作用[6]。它作用于肽聚糖合成的第一阶段,比大多数抗菌药物更早地抑制细菌细胞壁的产生。这种独特的作用机制使得磷霉素与其他抗菌药物之间具有协同作用且无交叉耐药性。磷霉素依赖两种不同的膜转运系统进入细菌细胞发挥抗菌活性:①甘油-3-磷酸转运系统(GlpT);②葡萄糖-6-磷酸存在下的己糖磷酸摄取转运系统(UhpT)[6-7]。除杀菌作用外,磷霉素还通过改变肿瘤坏死因子(TNF-α)、白细胞介素和白三烯的水平发挥免疫调节作用,以及减少细菌对呼吸道和尿道上皮的黏附[8]。
1.2 抗菌活性
磷霉素因对MDRO具有潜在的疗效,被世界卫生组织定义为“至关重要”的抗菌药物之一[9]。 其抗菌谱广、抗菌活性强,但尚无统一的磷霉素药敏折点判读标准,CLSI与欧洲共同体药敏试验委员会(EUCAST)两大国际权威标准间存在较大的差异,前者仅限尿路感染中分离的大肠埃希菌,对非尿路分离细菌,CLSI没有磷霉素药敏折点,EUCAST仅有肠杆菌科细菌、假单胞菌属和金黄色葡萄球菌的MIC折点(MIC≤32 mg/L为敏感),而无纸片扩散法标准,见表1[10-11],因此,不同文献中,对磷霉素药敏结果的判定仍不一致。
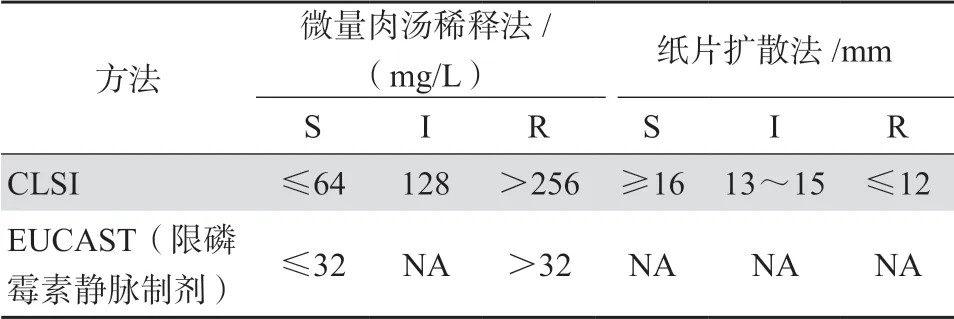
表1 磷霉素敏感性判定标准
就革兰阳性菌而言,磷霉素对包括耐甲氧西林金黄色葡萄球菌(MRSA)、凝固酶阴性葡萄球菌在内的葡萄球菌属具有良好的抗菌活性(敏感率>90%)[12]。对链球菌属(肺炎链球菌、溶血链球菌等)及包括万古霉素耐药肠球菌(VRE)在内的肠球菌属具有较好的抗菌活性[13]。
就革兰阴性菌而言,磷霉素对包括产超广谱β内酰胺酶(ESBL)的大肠埃希菌、肺炎克雷伯菌和奇异变形杆菌具有高度抗菌活性,敏感率为86%~100%[14];对某些碳青霉烯类耐药肠杆菌科细菌(CRE)仍保持活性。虽鲍曼不动杆菌对磷霉素天然耐药,但该药与其他抗菌药物联合使用时可能产生协同杀菌作用,如联合多黏菌素用于碳青霉烯类耐药鲍曼不动杆菌(CRAB)的治疗。磷霉素单药治疗铜绿假单胞菌疗效有限(因铜绿假单胞菌中Glp转运系统失活而有较高的MIC),但与其他抗菌药物联合使用可具有一定的协同作用[15],见表2[13-14]。
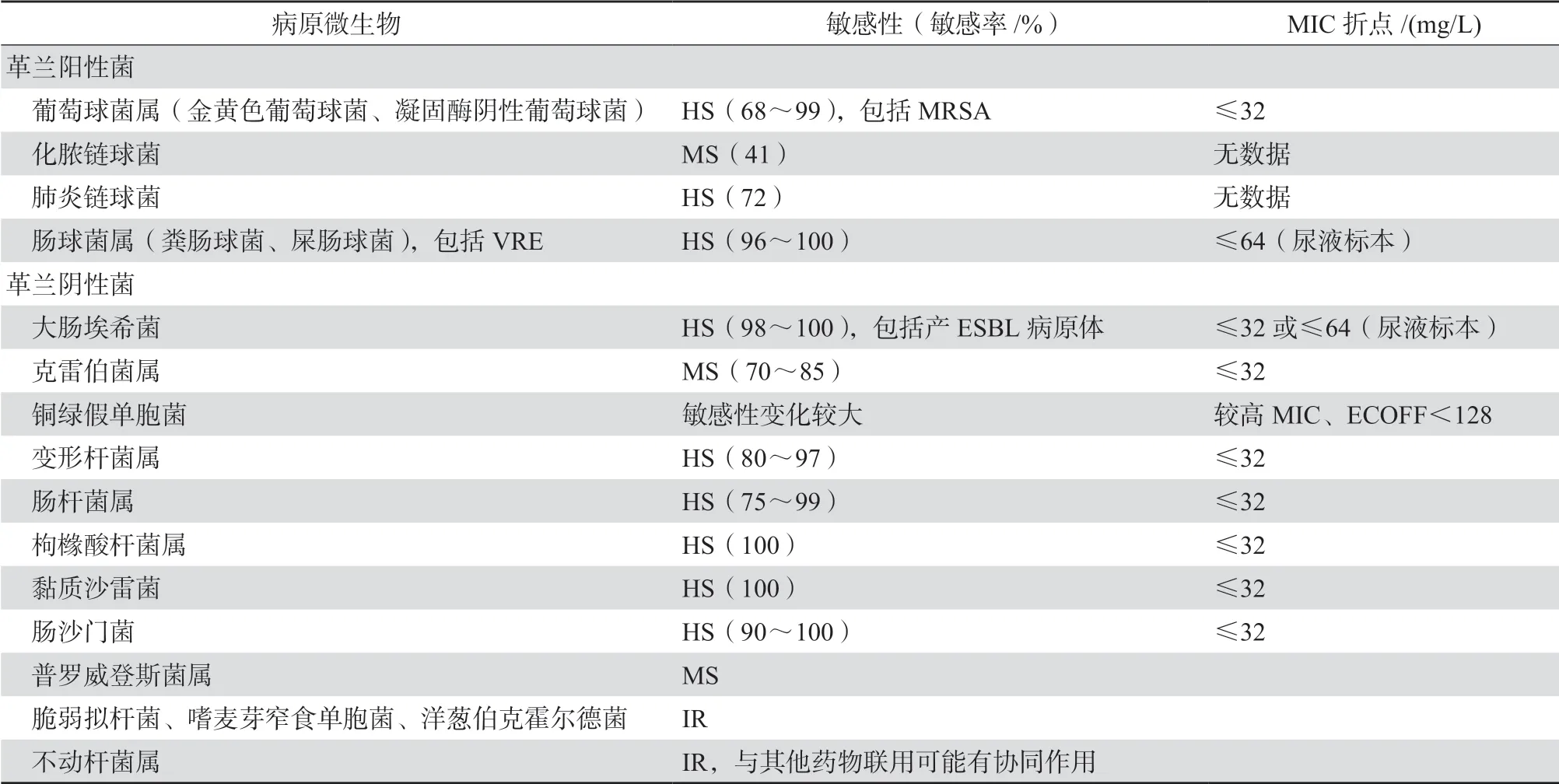
表2 磷霉素的抗菌活性
Williams等[16]通过琼脂稀释法分析磷霉素对儿童社区获得性和医院获得性革兰阴性菌菌血症分离株的敏感性,结果显示,磷霉素对包括产ESBL肠杆菌科细菌和铜绿假单胞菌有较高的体外抗菌活性(>90%),磷霉素联合阿米卡星的体外抗菌活性为100%,支持目前正在讨论的磷霉素-阿米卡星用于治疗新生儿败血症的经验方案[17]。磷霉素对葡萄球菌敏感率基本稳定,多在90%以上[18]。目前,磷霉素的耐药机制包括:①细胞摄取抗菌药物减少(UhpT或GlpT转运基因、调节基因突变、缺失或表达下调);②murA基因异常表达而引起的靶点改变;③细菌产金属酶(FosA、FosB和FosX)或激酶(FormA和FormB)而导致药物失活等[19]。
2 磷霉素在儿童中的PK研究
磷霉素是一种水溶性的小分子物质(相对分子质量138),蛋白结合率低,这使它具有较高的组织分布(分布容积为0.3 L/kg),成人单次静脉注射后,24 h内约90%随尿排出[7]。其PD评价指标为AUC/MIC,但日常实践中可根据病原微生物、患者的临床情况和感染类型优化PK/PD值[19]。磷霉素对大肠埃希菌、葡萄球菌和肺炎链球菌显示浓度依赖性杀菌活性,对金黄色葡萄球菌和铜绿假单胞菌具有时间依赖性的杀菌活性[20]。通过蒙特卡罗模拟优化后,达到有效治疗的PK/PD值为fT>MIC超过70%和fAUC/MIC>23[21]。
磷霉素在儿童和新生儿中的PK数据有限。口服磷霉素制剂主要在小肠吸收,通过肾小球滤过,但因磷霉素钙易被胃液水解和灭活,单剂量磷霉素氨丁三醇口服生物利用度较磷霉素钙高2~4倍[7],在3~8岁儿童的血浆半衰期和清除率与健康成人相似[22-23]。静脉注射磷霉素(25~50 mg/kg)用于新生儿的两项研究发现,其消除半衰期为2.4~7.0 h[24-25]。与儿童(5~13岁)相比,磷霉素在新生儿中的半衰期更长[26],这在很大程度上是由于肾小球滤过未成熟导致清除率降低,但也可能与新生儿具有更大的分布容积(新生儿为0.41 L/kg,儿童为0.28 L/kg)有关[25], 由于可用数据有限,难以准确描述早产或体重对清除率的影响。一项静脉注射和口服磷霉素在新生儿中的临床试验正在进行,将进一步阐明磷霉素在新生儿中的生物利用度和PK(https://clinicaltrials.gov/ct2/show/NCT03453177)。
3 磷霉素在儿童中的应用
3.1 适应证及推荐剂量
磷霉素有良好的组织(皮肤、软组织、肌肉、骨、肺、中枢神经系统)穿透性,并具有免疫调节、生物被膜穿透性[8,10]。目前,磷霉素有3种制剂:2种口服制剂(磷霉素钙、磷霉素氨丁三醇)和1种静脉注射用磷霉素钠,口服制剂主要用于尿路感染、肠道感染等,静脉注射用磷霉素钠可用的适应证明显扩大,可用于敏感菌所致的呼吸道感染、皮肤及软组织感染、肠道感染、尿路感染、败血症、腹膜炎、骨髓炎等,可与其他抗菌药物联合治疗由敏感菌所致的重症感染,其用于儿童的推荐剂量主要依据患儿的体重和年龄。与其他时间依赖性抗菌药物一样,除未足月的新生儿外,给药间隔为6~8 h,优于12 h[23]。
根据现有文献报道,磷霉素口服制剂用于儿童的推荐给药剂量见表3[26],欧洲国家静脉注射用磷霉素钠用于肾功能正常的儿童和新生儿每日推荐总剂量多为200~400 mg/kg,分2~3次给药,对于≥12岁或体重≥40 kg的患儿,其推荐剂量可与成人相似,见表4[23]。在MDRO感染的情况下,尚无儿童具体推荐剂量,目前,磷霉素在成人多重耐药革兰阳性菌和革兰阴性菌感染中的推荐剂量分别为8~12 g/d、16~24 g/d[27]。

表3 口服磷霉素在儿童中的推荐剂量
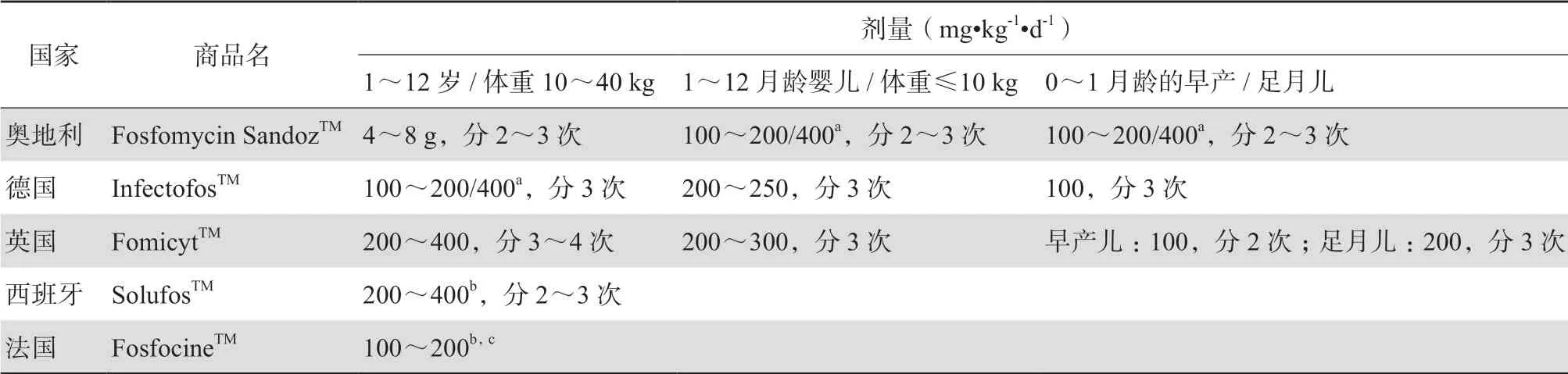
表4 静脉注射用磷霉素钠用于肾功能正常的儿童、婴儿和新生儿每日推荐总剂量[23]
3.2 尿路感染
尿路感染是儿童最常见的泌尿生殖系统疾病,根据年龄和性别的不同,其患病率约为2%~9%。在新生儿期和婴儿期,临床表现非特异性,约5%~8%的2岁以下儿童中,发热是尿路感染的唯一临床症状[28]。就尿路感染而言,93%~99%的磷霉素以原型经尿液排出,几乎不与血浆蛋白结合,广泛散布于肾实质、膀胱和无炎症的前列腺[6]。研究表明,成人口服3 g磷霉素氨丁三醇 2 h后尿液中浓度达到1 053~3 749 mg/L,平均药物浓度保持在128 mg/L以上[18]。口服磷霉素也可用于孕妇无症状菌尿和膀胱炎的治疗[29]。
Samancı等[30]回顾性分析2013—2017年16岁以下儿童尿培养结果及药敏,其最常见的微生物是大肠埃希菌(85.8%),其次为克雷伯菌属(5.3%)、肠杆菌属(3.3%)和变形杆菌(2.1%)。所有微生物对氨苄西林、氨苄西林-舒巴坦、阿莫西林-克拉维酸、头孢呋辛、甲氧苄啶-磺胺甲唑耐药率较高,对阿米卡星、美罗培南、磷霉素、呋喃妥因耐药率较低,这一结果与其他不同国家的研究一致[31-32]。Sorlózano-Puerto等[33]回顾性分析其所在地区2岁以下儿童尿路感染病原菌,仍以大肠埃希菌为主(60.3%),其次是粪肠球菌(22.4%)和克雷伯菌属(6.5%),对磷霉素的敏感率>95%。与成人相似,社区或医院获得性尿路感染经验治疗时,仍以大肠埃希菌为主,但不同地区、患儿年龄及感染类型的致病菌和耐药性仍不同,因此,仍需要根据当地细菌耐药率,选择适当的经验性治疗方案。
磷霉素用于治疗儿童尿路感染有许多优点[26]:①剂量易控;②尿液药物浓度高;③不良反应少见;④不影响肠道菌群等。由于磷霉素对大肠埃希菌及其他肠杆菌属细菌敏感性较高,磷霉素氨丁三醇也被认为是治疗儿童膀胱炎的首选药物之一。
3.2 骨关节感染/感染性心内膜炎
与成人相比,骨关节感染在儿童中更常见,50%的病例发生在5岁以下的儿童,其中,金黄色葡萄球菌是所有年龄段中骨关节感染最常见的病原菌。在新生儿和3个月以下的婴儿中,其他重要的致病菌是无乳链球菌和肠杆菌[26]。西班牙的一项研究发现,超过90%骨关节感染的儿童是由甲氧西林敏感金黄色葡萄球菌(MSSA)引起[34]。目前,法国推荐第三代头孢菌素联合磷霉素是儿童骨髓炎应用最广泛的经验治疗方案之一[35]。
感染性心内膜炎在儿童中并不常见,死亡率约为5%~10%,其常见感染的病原菌为链球菌和金黄色葡萄球菌[36]。欧洲心脏病学会指南推荐儿童和成人感染性心内膜炎具有相似的治疗方案,另外,磷霉素可与达托霉素和亚胺培南等抗菌药物联合使用,对多重耐药革兰阳性菌具有协同作用,且生物被膜穿透性强[37]。因此,欧洲心脏病学会和西班牙临床微生物和传染病学会均推荐磷霉素(联合达托霉素)作为骨关节感染、感染性心内膜炎联合治疗的一种选择,特别适用于MRSA感染的急性血源性骨髓炎、心内膜炎或β内酰胺类过敏的患者[38-39]。
3.3 血流感染
目前,尽管在降低儿童死亡率方面已取得了显著进展,但全球每年约290万死亡新生儿中,23%的死亡归因于多重耐药革兰阴性菌感染,显著增加患儿脓毒血症的发病率和死亡率[40]。新生儿脓毒血症根据发病时间分为早期和晚期脓毒血症。早期脓毒血症通常发生出生后的前72 h,由分娩前或分娩期间的垂直传播引起,最常见的感染微生物是无乳链球菌和大肠埃希菌;晚期脓毒血症则指出生3 d后的感染,多为医院获得性感染。除此之外,还应考虑凝固酶阴性葡萄球菌(新生儿重症监护患者败血症最常见的原因)、金黄色葡萄球菌和其他革兰阴性杆菌等[41]。
意大利进行的一项针对欧洲儿童脓毒血症细菌耐药性研究结果显示,26%是由革兰阴性菌感染所致,39%为MDRO感染[42]。磷霉素联合碳青霉烯类或多黏菌素对上述感染病原体的治疗具有协同作用,包括产ESBL和产碳青霉烯酶肠杆菌引起的脓毒血症[7]。近年来由肠球菌引起的医院内脓毒血症有所增加,特别是在新生儿和儿科重症监护室和血液肿瘤病房,可考虑磷霉素联合达托霉素或利奈唑胺用于万古霉素耐药菌株引起的严重感染[43]。在细菌耐药性严峻的情况下,磷霉素为儿童MDRO脓毒血症提供治疗选择的可能。
3.4 其他感染
磷霉素分子量小、蛋白结合率低,对脑脊液的渗透性高,可用于中枢神经系统感染[44]。Olivier等[45]对儿童头孢噻肟或头孢曲松敏感和不敏感肺炎链球菌脑膜炎的细菌学进行回顾性分析发现,磷霉素可联合第三代头孢菌素治疗头孢菌素敏感肺炎链球菌引起的脑膜炎。另外,磷霉素可与妥布霉素联合用于肺囊性纤维化的吸入治疗[46]。
3.5 安全性
2015年,美国FDA对磷霉素不良事件进行的回顾分析显示,成人和儿童患者中,磷霉素表现出较低的毒性,且安全性较高,即使在长达4周的静脉给药疗程中,仍表现出良好的安全性[5,47]。据报道,其最常见的不良反应(发生率为1%~10%)为胃肠道不适和静脉炎,尚未发现儿童使用磷霉素相关的严重安全问题的报道[48]。
静脉注射用磷霉素一般耐受性良好,其不良反应出现时通常不需要停药,但因注射用磷霉素钠中含有钠离子(0.33 g/1 g),新生儿排泄钠离子的能力及早产儿肾小管对钠的重吸收降低,远端小管对醛固酮的反应性下降,钠离子潴留的风险增加,建议在治疗期间监测电解质水平。
4 小结
儿童作为特殊人群,免疫功能弱,为MDRO高危易感人群,况且受限于安全、可靠的抗菌药物及有效的治疗方案,临床迫切需要新手段突破治疗困境,来解决日益突出的耐药状况。磷霉素作为广谱抗菌药物,组织穿透性强,对多种MDRO具有良好的抗菌活性。现有文献均表明,磷霉素可作为儿童MDRO严重感染治疗药物选择之一,与多种抗菌药物具有协同作用,在长期使用磷霉素的地区仍保持较低的耐药性,且安全性高[11,17]。然而,磷霉素在儿童感染中的应用仍有问题需进一步研究和评价:①联合抗感染治疗方案在儿童患者中的剂量和给药方案经验有限[26];②仍缺乏磷霉素在新生儿中的最新PK数据;③尚无针对肾功能不全患儿的磷霉素推荐剂量和给药方案等[35]。迄今为止,虽磷霉素在儿童中临床应用经验较少,但其广泛的抗菌谱和良好的安全性,人们重新对其产生关注,在细菌耐药性不断增加的情况下,磷霉素作为“老”药,可能是儿童MDRO感染的有效治疗药物“新”选择之一。
