肺部感染对支气管哮喘患儿肺功能和Th17、Treg T细胞亚群的影响及作用机制
2022-05-26班紫妍刘长富刘梦娜
班紫妍, 刘长富, 刘梦娜, 宋 敏
儿童支气管哮喘具有发病率高、容易反复发作的特点[1]。支气管哮喘的病因主要在于气管等慢性炎性反应导致气道高反应性,从而引起气道狭窄或痉挛使气道出现不完全可逆性气流受限,进而引发支气管哮喘。支气管哮喘可引起炎性介质等细胞因子水平升高,机体免疫功能异常,支气管哮喘患儿易于继发感染[2]。临床资料显示,在支气管哮喘合并感染患儿中,以肺部感染所占比例最高,而肺部感染可破坏气道上皮细胞,造成气道损伤,致使呼吸道管腔变窄,加重气道高反应性,这也是导致患儿支气管哮喘反复发作的主要原因[3]。研究发现,T细胞亚群调节免疫应答的强度,其数量及功能的异常与感染引起的炎性反应密切相关[4]。有报道称,在调控T淋巴细胞分化中Notch信号通路发挥重要的作用[5]。Notch信号通路是高度保守的信号转导途径,目前该通路在肺部感染对支气管哮喘患儿的影响尚无报道。本研究分析肺部感染对支气管哮喘患儿免疫紊乱的影响并对其相关机制进行初步研究,为临床防治支气管哮喘合并肺部感染奠定基础。
1 材料与方法
1.1 研究对象
选取2017年2月—2019年2月于四川省内江市中医医院就诊的支气管哮喘合并肺部感染患儿70例作为感染组,纳入标准:①符合《儿童支气管哮喘诊断与防治指南(2016 年版)》相关诊断标准[6];②肺功能指标第1秒用力呼气容积(FEV1)占预计值百分比在30%~80%;③肺部感染符合《美国急性病医院预防医院感染策略纲要(2014更新版)》[7];④年龄3~10周岁;⑤合并呼吸道病毒感染患儿(包括流感病毒 A 型、流感病毒 B 型、副流感病毒、腺病毒、合胞病毒)。排除标准:①伴随有血液系统、肝肾功能障碍以及恶性肿瘤的患儿;②就诊前2周服用影响免疫功能药物的患儿;③合并免疫功能缺陷、有呼吸衰竭史患儿;④合并精神疾病的患儿。选择同期经接受支气管哮喘治疗但并未合并肺部感染的支气管哮喘患儿84例作为未感染组。另纳入65例同期于我院体检健康儿童作为对照组。所有入组者的监护人均签署知情同意书,研究经医院伦理委员会批准展开。
1.2 方法
1.2.1 基本参数收集 收集入组者性别、年龄、病程、体质量指数(BMI)、收缩压等临床基本参数,所有受检者禁食8 h后抽取静脉血5 mL,乙二胺四乙酸抗凝,4℃、3 000 r/min离心15 min,血清通过全自动生化分析仪(美思康 MC6600)检测其白蛋白(Alb)、血钙(Ca)、血磷(P)、肌酐(Cr)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、空腹血糖(FPG)、尿素(BUN),比浊法检测尿白蛋白/肌酐(UACR)。
1.2.2 ELISA法检测血液炎性因子 检测前禁水禁食8 h,于次日清晨抽取肘静脉血3~5 mL,常温放置1 h,2 500 r/min离心15 min,取血清分装于无菌EP管内,置于-80℃保存,采用ELISA法检测血清白细胞介素17(IL-17)、转化生长因子β(TGF-β)和IL-10的水平,试剂盒均采购自北洋百川生物科技有限公司,检测过程严格按照试剂盒说明书进行操作。
1.2.3 肺功能检测 采用德国耶格BEI-159肺功能检测仪进行肺功能检测,肺功能指标包含用力肺活量(FVC)、FEV1、用力肺活量比值(FEV1/FVC)、第一秒用力呼气容积占用力肺活量百分比即一秒率(FEV1%)。
1.2.4 流式细胞术检测Th17、Treg细胞水平 取患儿空腹静脉血5 mL放入EDTA抗凝管中,一次加入抗体(FITC抗人IL-17 mAbIgG、FITC 抗人CD25mAb)10 μL,室温下避光孵育30 min,然后加入200 μL溶血素避光放置15 min,裂解红细胞。3 000 r/min离心5 min,用PBS重悬后再离心洗涤2次,沉淀底物100 μL的1%多聚甲醛溶液固定,流式细胞仪检测Treg、Th17细胞水平。
1.2.5 实时荧光定量聚合酶链反应(qRT-PCR)法检测外周血单核细胞Notch1、Hes1的mRNA表达 治疗前后,采集患儿清晨外周血并分离单核细胞,TRIzol试剂提取总RNA,用 DNA/RNA 测量仪测得RNA浓度。取符合要求的RNA样本,采用qRT-PCR 法扩增 Notch1 mRNA、Hes1 mRNA。按照PrimeScrip反转录试剂盒进行反转录成cDNA,采用SYBR Premix Ex Taq说明书进行扩增。扩增结束后,产物进行 1.0% 琼脂糖凝胶电泳20 min,PUX Mix Marker 作为分子量参照物同时电泳,引物序列为Notch1(上游 5'-ACTGAGCAAGCTTGGCCCAGGACA-3',下游 5'-TAGCCTCGCCAGAATTGTGA-3'),Hes1 (上游5'-ATGAAGCCGAACAGTTGTGC-3',下游5'-GTCGTAAACCCGTACGGAGA-3'),以β-actin(上游5'-GCTGATCGACGGATCCATAT-3',下游 5'-GGGTGATCCGTGGTTCAACT-3')为内参,在凝胶成像分析仪的紫外光下采集图像,采用 Gepro 4.2 软件分析目的基因与同一条带β-actin的光密度比值。
1.3 统计分析
数据分析采用软件SPSS 16.0,符合正态分布的计量资料采用平均数±标准差进行表示,多组间比较采用单因素方差分析,两两间比较采用独立t检验,采用Pearson进行相关性分析,P<0.05表示差异有统计学意义。
2 结果
2.1 一般资料对比
三组入组者年龄、性别、BMI、收缩压和舒张压等一般资料及血液生化指标相比,差异无统计学意义(P>0.05),未感染组与感染组患儿病程差异无统计学意义(P>0.05),三组间具有可比性,见表1。
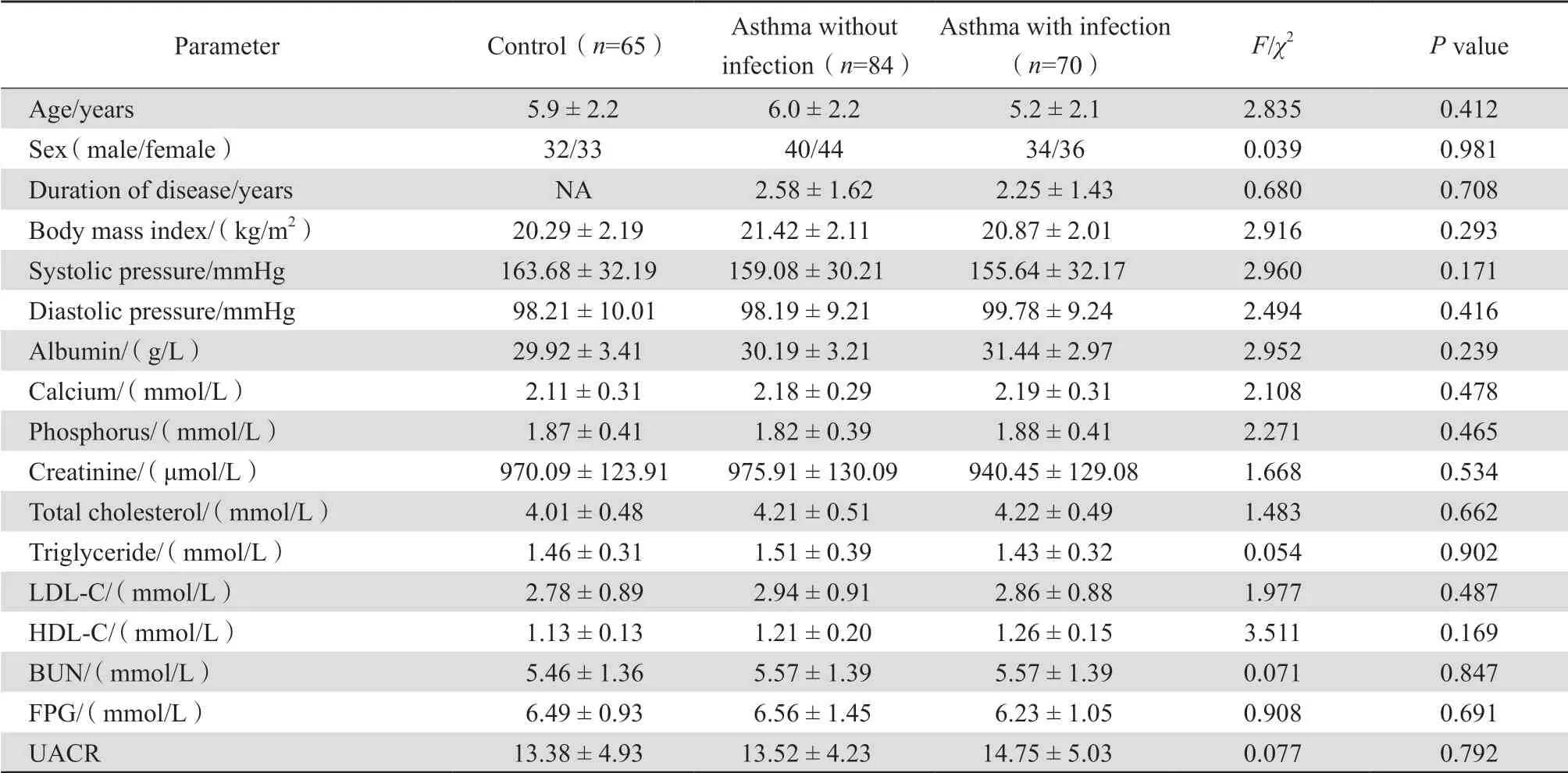
表1 三组入组者一般资料对比Table 1 Clinical data compared between children in terms of asthma and pulmonary infection
2.2 肺功能情况对比
感染组患儿FEV1、FVC、FEV1/FVC以及FEV1%明显低于未感染组和对照组,差异具有统计学意义(P<0.05);未感染组FEV1、FVC、FEV1/FVC以及FEV1%明显低于对照组,差异具有统计学意义(P<0.05),见表2。

表2 三组肺功能情况比较Table 2 Pulmonary function compared between children in terms of asthma and pulmonary infection
2.3 细胞因子的对比
与对照组相比,未感染组和感染组患儿血清IL-17、TGF-β水平明显升高,血清IL-10水平明显下降,差异具有统计学意义(P<0.05);感染组变化更明显,与未感染组相比差异均具有统计学意义(P<0.05),见表3。

表3 三组细胞因子比较Table 3 Serum level of cytokines compared between children in terms of asthma and pulmonary infection
2.4 Th17、Treg细胞水平比较
与对照组相比,未感染组和感染组Treg细胞比例明显降低,Th17细胞比例和Th17/Treg比值明显升高;感染组变化更明显,与未感染组相比差异均具有统计学意义(P<0.05),见表4。

表4 三组Th17、Treg细胞水平比较Table 4 Th17/Treg cell compared between children in terms of asthma and pulmonary infection
2.5 外周血单核细胞Notch1、Hes1的mRNA表达
感染组患儿Notch1 mRNA、Hes1 mRNA表达水平明显高于未感染组和对照组,差异具有统计学意义(P<0.05),未感染组Notch1 mRNA、Hes1 mRNA明显高于对照组,差异具有统计学意义(P<0.05)。见图1、表5。
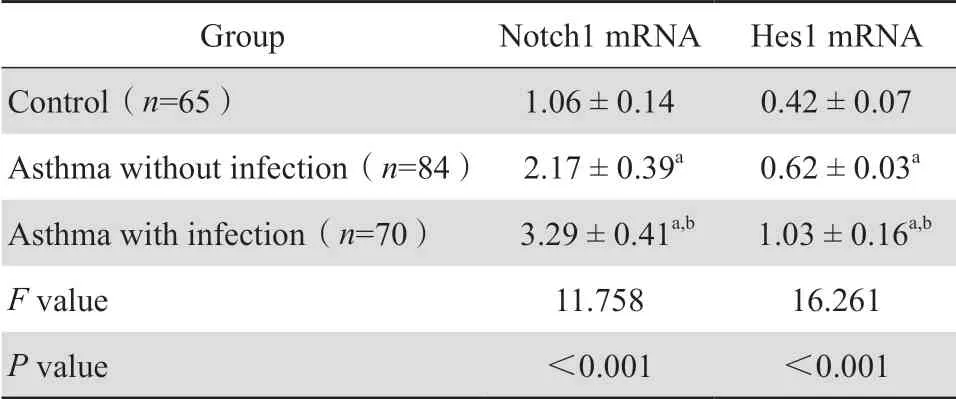
表5 三组Notch1 mRNA、Hes1 mRNA表达水平比较Table 5 Expression levels of Notch1 mRNA and Hes1 mRNA compared between children in terms of asthma and pulmonary infection
2.6 相关性分析
对 Notch1 mRNA、Hes1 mRNA与Th17、Treg细胞比例进行相关性分析,结果显示,Notch1 mRNA、Hes1 mRNA与Th17细胞比例呈明显正相关关系(r=12.356,P<0.01),与Treg细胞比例呈明显负相关(r=-11.458,P<0.01),见图2。
3 讨论
儿童支气管哮喘是儿科常见疾病,其病程较长,易发生并发症[8]。支气管哮喘患儿处于局部炎症反应时期,肺部黏膜保护机制受到破坏,防御能力减弱,病原菌穿透黏膜屏障易位,从而诱发感染[9]。即使临床对于支气管哮喘患儿肺部感染已经重视并采取预防控制,但该类患儿仍是肺部感染的高发人群[10]。本研究结果显示,感染组肺功能指标明显低于未感染组,说明在这两种呼吸系统疾病共同作用下,会加重患儿的临床症状,严重影响其生活质量。支气管哮喘的发生发展与免疫紊乱密切相关,而病原菌的直接侵害也会影响机体的免疫反应导致异常和慢性的炎症反应,但肺部感染对支气管哮喘患儿炎症-免疫的影响研究较少,因此,从此方面对上述患儿进行研究,以期为临床的预防和治疗工作提供参考。
近年来研究表明,Th17和Treg细胞属于CD4+T 细胞亚群,二者在生理功能上相互制约,共同参与调节机体免疫反应[11]。当机体处于稳态时,T细胞趋于向Treg细胞方向分化,维持免疫耐受。当发生炎性反应或感染时,免疫系统激活,诱导T细胞向 Th17 细胞分化,导致自身免疫性疾病的发生[12]。本研究中支气管哮喘患儿Treg细胞比例均明显低于对照组,而Th17细胞比例和Th17/Treg比值明显升高,提示支气管哮喘加剧Th17和Treg细胞平衡向Th17转化,从而参与气道及全身炎性反应。Th17细胞是新发现的辅助性淋巴细胞亚群,因分泌细胞因子IL-17而命名。IL-17可诱导IL-6、GM-CSF等基因的表达从而增强TNF-α介导的炎性反应,还可通过刺激巨噬细胞释放促炎因子加剧气道的炎症程度[13],还可趋化中性粒细胞进入肺组织释放弹力蛋白酶破坏肺组织[14]。研究发现,肺部感染可增加小鼠肺脏Th17水平,且IL-17可以在一定程度评价感染程度[15]。Treg细胞与其他CD4+T细胞不同,是一类具有抑制炎性反应作用的CD4+T细胞,在支气管哮喘黏膜组织修复过程中发挥重要作用[16]。其分泌的TGF-β、IL-10等细胞因子可以抑制巨噬细胞、Th细胞释放促炎因子,从而抑制炎性反应的产生及维持人体的免疫耐受[17]。报道称,肺部感染患儿血清IL-17水平明显高于正常人群[18]。本研究通过对稳定期支气管哮喘患儿Th17、Treg T细胞亚群及细胞因子的测定,探讨肺部感染对患儿全身系统炎症的影响,结果显示,肺部感染患儿IL-17、Th17及Th17/Treg比值均明显高于未感染患儿,IL-10、TGF-β、Treg均明显下降,说明肺部感染可导致支气管哮喘患儿Th17/Treg细胞免疫失衡,从而导致全身炎症反应加重。
Noth信号通路是T细胞分化、增殖和活化的重要通路,在多种免疫疾病中发挥重要作用。在成熟的免疫细胞表面均有Noth受体的表达,Notch是一种单次跨膜受体蛋白,通过细胞间相互作用可活化下游靶基因Hes,影响T细胞的生理功能,特别是在Th17/Treg细胞分化中作用最为显著[19]。研究发现,肺炎小鼠Th17细胞及Th17/Treg明显升高,同时Notch信号通路蛋白表达水平明显上调[20]。Gurczynski等[21]研究Notch信号通路γ分泌酶抑制剂(GSI)对肺部感染小鼠的炎症进展发现,小鼠脾脏Th17/Treg水平趋于平衡,气道炎症程度和临床症状明显减轻。本研究中感染组患儿Notch1 mRNA、Hes1mRNA明显增高,与该组患儿Th17细胞占优势相一致。进一步分析显示,Notch1 mRNA、Hes1mRNA的表达与Th17细胞呈正相关,与Treg细胞呈负相关,表明肺部感染可能通过Notch信号通路调节Th17/Treg免疫平衡参与支气管哮喘的进展。
综上所述,肺部感染降低支气管哮喘患儿肺功能,加重全身炎症程度,其可能的机制是肺部感染通过增强Notch信号通路促进支气管哮喘患儿Th17、Treg细胞免疫紊乱。
