高考中化学平衡常数的考查及解题策略
2022-05-26曹艳



摘要:化学平衡常数在高考中所占的分量逐渐提高,高考化学复习备考中的难点和易错点.从2021年的高考化学平衡常数题进行分析命题特点,并从四个方面总结化学平衡常数的考查方式和解题策略.
关键词:高考题;化学平衡常数;解题策略;高中化学
中图分类号:G632文献标识码:A文章编号:1008-0333(2022)13-0120-05
《普通高中化学课程标准(2017年版2020年修订)》指出,要能引导学生经历化学平衡常数模型建构的过程,结合具体实例,促使学生体会化学平衡常数在判断平衡状态、反应方向、分析预测平衡移动方向等方面的功能价值.而在学业要求中,也明确指出要求学生能书写平衡常数表达式,能进行平衡常数的简单计算,能利用平衡常数和浓度商的关系判断化学反应是否达到平衡及平衡移动方向.
近年来化学平衡常数在高考中所占的比例逐渐提高,化学平衡常数的考查紧扣课程标准,其考查形式有表达式书写、定量计算,有从化学平衡常数的角度分析化学反应,也有运用化学平衡常数解决问题.考查手段灵活,能较好地测试学生分析问题、解决问题的能力,区分度较高.尤其对于化学平衡常数的计算,这部分内容是高考化学复习备考中的难点和易错点.高考试题既具有创新性,又具有继承性,如何在2022年高考中突破化学平衡常数的这一重难点,笔者先从统计2021年的高考化学平常常数题入手.
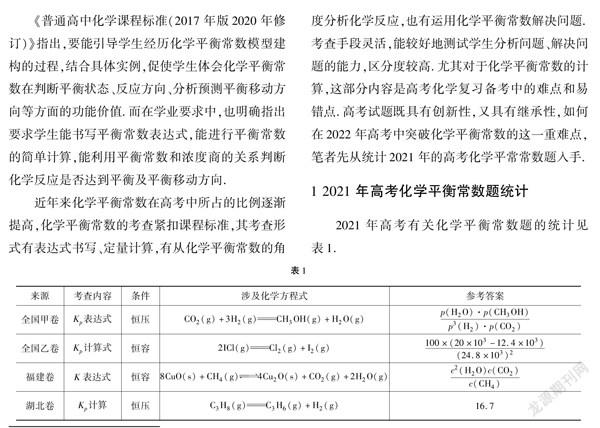
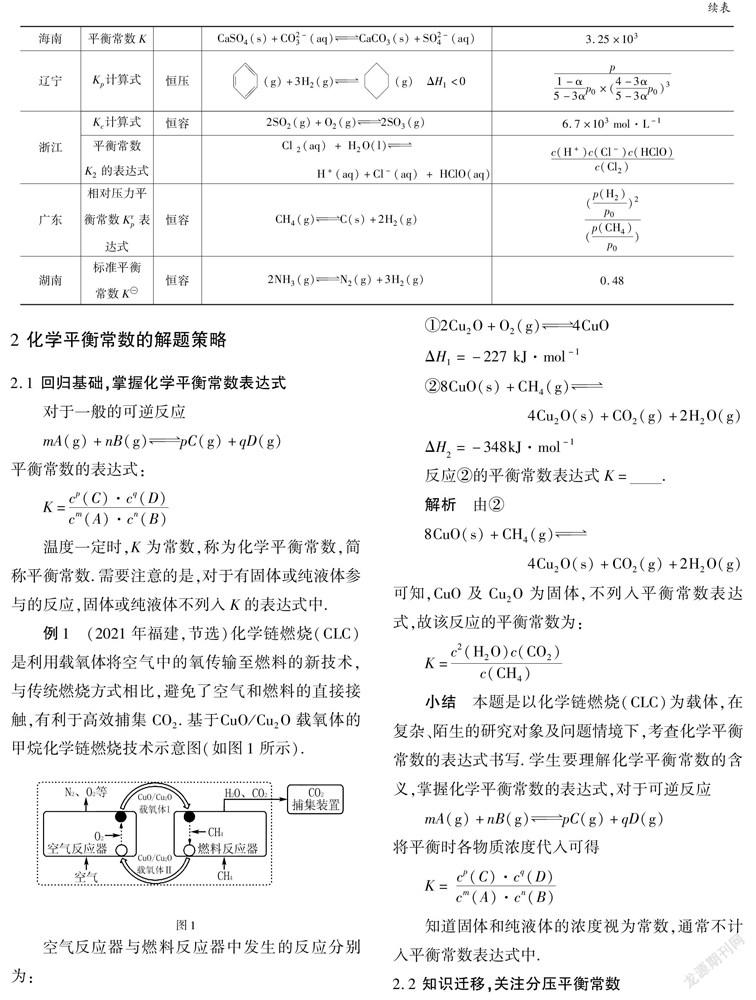
1 2021年高考化学平衡常数题统计
2021年高考有关化学平衡常数题的统计见表1.
2 化学平衡常数的解题策略
2.1 回归基础,掌握化学平衡常数表达式
对于一般的可逆反应
mA(g)+nB(g)pC(g)+qD(g)
平衡常数的表达式:
K=cp(C)·cq(D)cm(A)·cn(B)
温度一定时,K为常数,称为化学平衡常数,简称平衡常数.需要注意的是,对于有固体或纯液体参与的反应,固体或纯液体不列入K的表达式中.
例1(2021年福建,节选)化学链燃烧(CLC)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集CO2.基于CuO/Cu2O载氧体的甲烷化学链燃烧技术示意图(如图1所示).
空气反应器与燃料反应器中发生的反应分别为:
①2Cu2O+O2(g)4CuO
ΔH1=-227 kJ·mol-1
②8CuO(s)+CH4(g)4Cu2O(s)+CO2(g)+2H2O(g)
ΔH2=-348kJ·mol-1
反應②的平衡常数表达式K=.
解析由②
8CuO(s)+CH4(g)
4Cu2O(s)+CO2(g)+2H2O(g)
可知,CuO及Cu2O为固体,不列入平衡常数表达式,故该反应的平衡常数为:
K=c2(H2O)c(CO2)c(CH4)
小结本题是以化学链燃烧(CLC)为载体,在复杂、陌生的研究对象及问题情境下,考查化学平衡常数的表达式书写.学生要理解化学平衡常数的含义,掌握化学平衡常数的表达式,对于可逆反应
mA(g)+nB(g)pC(g)+qD(g)将平衡时各物质浓度代入可得
K= cp(C)·cq(D)cm(A)·cn(B)
知道固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中.
2.2 知识迁移,关注分压平衡常数
分压平衡常数是指在化学平衡体系中,对于有气体参与的反应,用各气体物质平衡时的分压替代平衡浓度计算得到的平衡常数.
以可逆反应
aA(g)+bB(g)cC(g)+dD(g)为例,分压平衡常数的表达式为Kp=pc(C)·pd(D)pa(A)·pb(B),其中p(X)表示X气体在平衡时的分压,p(X)=X物质的量分数(或体积分数)×总压强.
例2(2021年全国高考真题,节选)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳.回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)CO(g)+H2O(g)
ΔH1=+41 kJ·mol-1
②CO(g)+2H2(g)CH3OH(g)
ΔH2=-90 kJ·mol-1
(2)合成总反应在起始物n(H2)/n(CO2)=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图2所示.
①用各物质的平衡分压表示总反应的平衡常数,表达式Kp=;
解析先从所给信息中找出二氧化碳加氢制甲醇的总反应为
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
根据分压平衡常数的含义及表达式,利用各物质的平衡分压表示总反应的平衡常数:
Kp=p(H2O)·p(CH3OH)p3(H2)·p(CO2)
小结本题是以二氧化碳催化加氢制甲醇为载体,在复杂、陌生的研究对象及问题情境下,考查分压平衡常数的表达式书写,学生根据化学平衡常数的定义,将知识点迁移,用各气体物质平衡时的分压替代平衡浓度,即可计算得到分压平衡常数表达式,但需要注意的是本题涉及三个化学方程式,需要考生认真审题,按要求答题.
2.3 根据“三段式”计算浓度平衡常数
例3(2018年课标Ⅱ,27节选)CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义.CH4-CO2催化重整反应为:
CH4(g)+CO2(g)2CO(g)+2H2(g)
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为mol2·L-2.
解析利用“三段式”解答:
CH4(g)+CO2(g)2CO(g)+2H2(g)
开始/mol·L-110.500
转化/mol·L-10.250.250.50.5
平衡/mol·L-10.750.250.50.5
K=c2(H2)·c2(CO)c(CH4)·c(CO2)
=(0.5mol·L-1)2×(0.5mol·L-1)2(0.75mol·L-1)×(0.25mol·L-1)
=13 mol2·L-2
小结本题以CH4-CO2催化重整为载体,考查了浓度平衡常数,解题时第一步可先分析平衡常数定义表达式为K=c2(H2)·c2(CO)c(CH4)·c(CO2);第二步根据信息列出起始浓度、变化浓度及平衡时浓度;第三步将平衡时浓度代入平衡常数表达式进行计算.
2.4 根据“五段式”计算分压平衡常数
根据可逆反应
aA(g)+bB(g)cC(g)+dD(g)
可判断Kp=pc(C)·pd(D)pa(A)·pb(B),Kp计算充分体现了“科学探究与证据推理”的化学核心素养,其中的难点不是分压平衡常数的表达式书写,而是在复杂环境下,X气体的分压的计算:p(X)=X物质的量分数(或体积分数)×总压强.其中,根据分压定律,总压等于各气体分压之和,即
p(总)=p(A)+p(B)+p(C)+p(D) .恒容的体系中,根据理想气体状态方程,可判断气体的分压之比等于其物质的量之比.用“五段式”建立模型法解决分压平衡常数的计算步骤为:(1)根据题给信息,建立浓度三段式;
(2)判断体系中气体总物质的量,找出四段式;
(3)判断体系中总压强,确定各气体的分压,确定五段式.
例4(2021年湖北高考真题节选)丙烯是一种重要的化工原料,可以在催化剂作用下,由丙烷直接脱氢或氧化脱氢制备.
反应Ⅰ(直接脱氢):
C3H8(g)C3H6(g)+H2(g)
ΔH1=+125kJ·mol-1
反应Ⅱ(氧化脱氢):
C3H8(g)+12O2(g)C3H6(g)+H2O(g)
ΔH2=-118kJ·mol-1
(2)对于反应Ⅰ,总压恒定为100kPa,在密闭容器中通入C3H8和N2的混合气体(N2不参与反应),从平衡移动的角度判断,达到平衡后“通入N2”的作用是.在温度为T1时,C3H8的平衡转化率与通入气体中C3H8的物质的量分数的关系如图3所示,计算T1时反应Ⅰ的平衡常数Kp=kPa(以分压表示,分压=总压×物质的量分数,保留一位小数).
解析根据图3,C3H8的物质的量分数为0.4时,其平衡转化率为50%;假设混合气体为1mol,则起始时C3H8为0.4mol,N2为0.6mol,先运用三段式法计算:
C3H8H2(g)+C3H6(g)
开始量/mol0.400
变化量/mol0.20.20.2
平衡量/mol0.20.20.2
由于总压恒定为100kPa,平衡时C3H8为
0.2mol,C3H6为0.2mol,H2为0.2mol,N2为0.6mol,气体的总物质的量为0.2mol+0.2mol+0.2mol+0.6mol=1.2mol,此时可得出第四段式为气体的百分含量值,分析体系为恒压装置,可判断总压强恒定为100kPa,则可得出第五段式为各气体的分压,五段式总结如下:
C3H8(g)H2(g)+C3H6(g)
开始量/mol0.400
变化量/mol0.20.20.2
平衡量/mol0.20.20.2
百分含量/%131313
气体分压/kPa100610061006
即C3H8(g)、C3H6(g)、H2(g)的分压均为:
100kPa×0.2mol1.2mol=1006kPa
故T1时反应Ⅰ的平衡常数
Kp=1006kPa×1006kPa1006kPa=16.7kPa.
例5(2021年辽宁高考真题节选)苯催化加氢制备环己烷是化工生产中的重要工艺,一定条件下,发生如下反应:
Ⅰ.主反应:
(g)+3H2(g)(g)
ΔH1<0
Ⅱ.副反应:
(g)(g)
ΔH2>0
(6)恒压反应器中,按照n(H2)∶n(C6H6)=4∶1投料,发生Ⅰ、Ⅱ反应,总压为p0,平衡时苯的转化率为α,环己烷的分压为p,则反应Ⅰ的Kp=(列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
解析恒压反应器中,按照n(H2)∶n(C6H6)=4∶1投料,设投入的苯的物质的量为1mol,发生Ⅰ、Ⅱ反应总压为p0,平衡时苯的转化率为α,环己烷的分压为p,则:
C6H6+3H2C6H12
起始量/mol140
转化量/molα3αα
平衡量/mol1-α4-3αα
C6H12C5H9-CH3
起始量/molα0
转化量/molxx
平衡量/molα-xx
反应后平衡体系中总的物质的量为:1-α+4-3α+α-x+x=5-3α,反应总压为p0,故平衡時反应Ⅰ的五段式可表示为:
C6H6+3H2C6H12
起始量/mol140
变化量/molα3αα
平衡量/mol1-α4-3αα
百分含量1-α5-3α4-3α5-3αα5-3α
分压1-α5-3αp04-3α5-3αp0p
则反应Ⅰ的平衡常数:
Kp=p(C6H12)p(C6H6) p3(H2)=p1-α5-3αp0×(4-3α5-3αp0)3
小结“五段式”的计算关键分三步,一是根据题给信息,列出准确的“三段式”;二是分析所给条件是否有其他反应产生的气体或惰性气体,找出所有气体的总量,这关系着百分含量是否正确;三是判断体系平衡时总压强,恒压表示前后气体压强不变,可直接计算,如果是恒容,需要根据体系前后气体物质的量和压强是正比进行计算.
参考文献:[1]
中华人民共和国教育部.普通高中化学课程标准(2017年版)\[M\].北京:人民教育出版社,2017.
\[2\] 中华人民共和国教育部.普通高中课程标准实验教科书选择性必修1化学反应原理\[M\].北京:人民教育出版社,2020:31-32.
\[3\] 廖清泉.2020年高考试题中的热点—平衡常数\[J\].中学化学,2020(12):35-36.
\[4\] 吕旭东.化学平衡常数在高考试题中的考查视角及解题策略\[J\].高中数理化,2020(5):92-94.
[责任编辑:季春阳]
收稿日期:2022-02-05
作者简介:曹艳,从事高中化学教学研究.[FQ)]
