猕猴桃试管苗无菌扦插研究
2022-05-25安红旗张乃群
杨 迪,安红旗,张乃群
(1.南阳师范学院 生命科学与农业工程学院,河南 南阳 473061;2.河南伏牛山国家级自然保护区黄石庵管理局,河南 南阳 473000;3.河南科技大学 农学院(牡丹学院),河南 洛阳 471023)
猕猴桃是我国原生的多年生藤本果树[1],果实清香可口,含有丰富的膳食纤维、大量的维生素C、多种人体必需的矿质元素,享有“水果之王”的盛誉,具备较高的经济价值和食用价值[2].我国研究者对猕猴桃进行了深入研究,先后推出的优良猕猴桃品种多不胜数,如“华美二号”“徐香”“金桃”“杨氏金红50号”“天源红”等,对我国猕猴桃产业发展做出了卓越贡献.但是,猕猴桃雌雄异株[3],种子繁殖不利于良种基因保存,致使良种退化[4].现多采用嫁接手段来解决此问题,而嫁接会对植株造成创伤,增大感染溃疡病的风险.猕猴桃细菌性溃疡病是一种危害世界猕猴桃生产的毁灭性病害,目前尚未有有效的防治办法[5].
植物组织培养技术利用植株自身器官在无菌环境下进行无性培养,建立稳定且高效的再生体系,是克服猕猴桃良种退化的有效手段[6].同时有着可短周期、大量扩繁的特点[7],为猕猴桃种质保存、病害防治提供了新路径[8].目前,关于猕猴桃植物组织培养已有广泛的研究[9],过程基本都为通过外植体或愈伤组织诱导不定芽,经扩繁或壮苗,移入生根培养基培养根系,最后炼苗移栽.本研究主要集中在生根培养和炼苗移栽上,传统的组织培养在培养基内生根,培养基清洗麻烦,瓶内瓶外差异过大,对试管苗的移栽成活有一定影响,培养过程中水电耗量多.本研究用灭过菌的湿润细沙代替培养基,将试管苗扦插于细沙中,获得了很好的生根和移栽成活效果,减少了水电的使用量,为猕猴桃组织培养技术的优化及改进提供了技术支撑.
1 材料与方法
1.1 材料
试管苗取自南阳师范学院植物组织培养试验室,为“翠香”猕猴桃的实生苗.
1.2 方法
1.2.1 无菌扦插条件
扦插基质为细沙,在组培瓶内装细沙为瓶高的1/3,洒少量自来水使细沙湿润但不积水,拧紧组培瓶盖后用高压蒸汽灭菌锅对细沙灭菌,条件为121 ℃、0.1 MPa、20 min.组培室温度为(25±2)℃,光照为1500~2000 lx.
1.2.2 无菌扦插培养
选择茎长3~5 cm、带1个或多个腋芽的试管苗,在超净工作台上切下带腋芽茎段,去除顶芽,形态学下端蘸ABT生根粉溶液后扦插在灭过菌的细沙中进行培养.ABT 生根粉溶液的质量浓度为0.5 mg/mL,蘸液方法分别为以下两种:
(1)速蘸法.蘸液时间设6个处理,分别为5 s、10 s、15 s、20 s、25 s、30 s.
(2)浸泡法.蘸液时间设5个处理,分别为1 h、1.5 h、2h、2.5 h、3 h.
设置对照组为 CK,不蘸ABT生根粉溶液.
试验的每个处理设5个重复,每个重复3个试管苗.瓶内无菌培养时间为4周,观察记录4周内有无根系出现,出现根系的条数,腋芽的萌发情况,4周后取出无菌扦插苗记录生根情况.
1.2.3 无菌扦插苗的炼苗移栽
炼苗时间为4月下旬,室内常温约25 ℃,将无菌扦插苗移出组培室,在普通试验室炼苗.炼苗分为半开盖和全开盖,各3个重复,每个重复15个无菌扦插苗,时间为1周,炼苗结束后统计炼苗成活情况.选择炼苗成活的无菌扦插苗进行移栽,基质为腐殖土,观察30 d,记录苗的成活情况.
1.2.4 数据统计与分析
数据统计和作图采用Excel,数据的差异性和显著性分析采用SPSS 22.0.
生根率=生根茎段数÷接种总数×100%;平均总根长为5个重复总根长的平均数;平均根长=总根长÷生根条数;平均总生根数为5个重复总生根条数的平均数;平均生根数=总生根数÷接种总数;干枯率=干枯苗数÷炼苗总数×100%;成活率=成活苗数÷炼苗总数×100%.
2 结果与分析
2.1 瓶内无菌培养观察
速蘸法和浸泡法在 1 周内均可观察到不定根长出,浸泡法出现得更早,经过 4 周,可观察到有不定根长出的茎段数不断增加(图 1).
速蘸法20 s处理第1周就可观察到4个生根茎段,明显高于CK和其他处理,第2周数量不变,但第 3 周、第 4 周数量优势凸显,最终为11个,高出第二的10 s、15 s处理3个,高出最低的CK处理6个(图2).

图1 不定根的产生
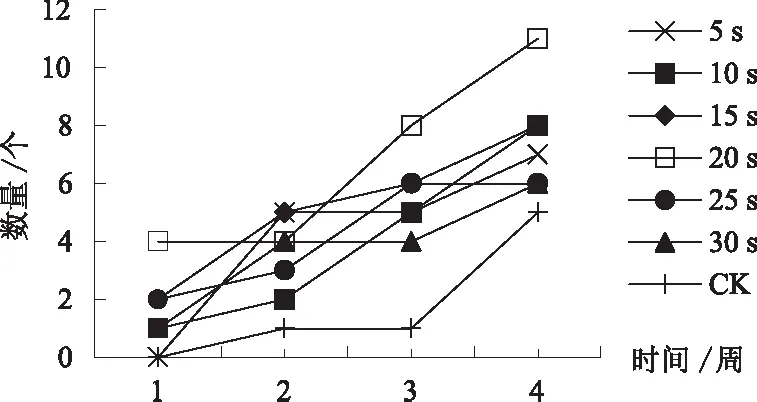
图2 速蘸法4周内可观察到生根现象的茎段数量变化
浸泡法在第4周时,1 h、2.5 h处理可观察到生根的茎段数最多,达11个,高出最低CK处理6个,在第1周时,1 h处理不能观察到根的出现,2.5 h处理却可以观察到2个,在后续培养中两者均超过其他处理(图3).
相比之下,速蘸法4周共观察到长出不定根的茎段数46个,浸泡法48个,浸泡法更多一点.
除了观察到根,腋芽的萌发也标志着茎段向苗的过渡,也是茎段成活的一种体现(图4).
速蘸法除了5 s和20 s处理最终腋芽萌发的茎段数为14个和11个,分别等于、小于CK处理外,其余处理都是15个.而浸泡法第4周时最高腋芽萌发的茎段数是1.5 h处理的6个,低于CK处理8个,小于所有的速蘸法处理.相比之下,速蘸法腋芽萌发的茎段数更多(表1),且浸泡法处理的茎段在经过4周培养后会出现部分茎段由嫩绿色变成嫩黄色,甚至干枯的现象,CK处理仅有一例,速蘸法无此现象.
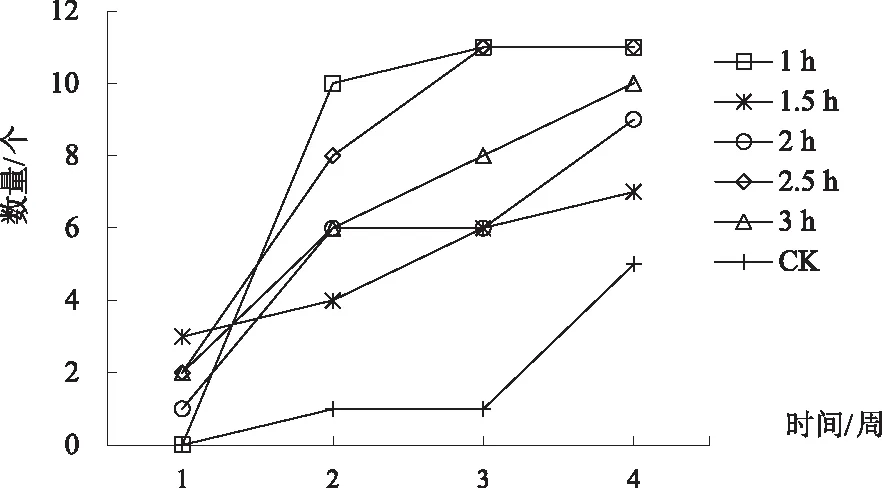
图3 浸泡法4周内可观察到生根现象的茎段数变化

图4 腋芽萌发
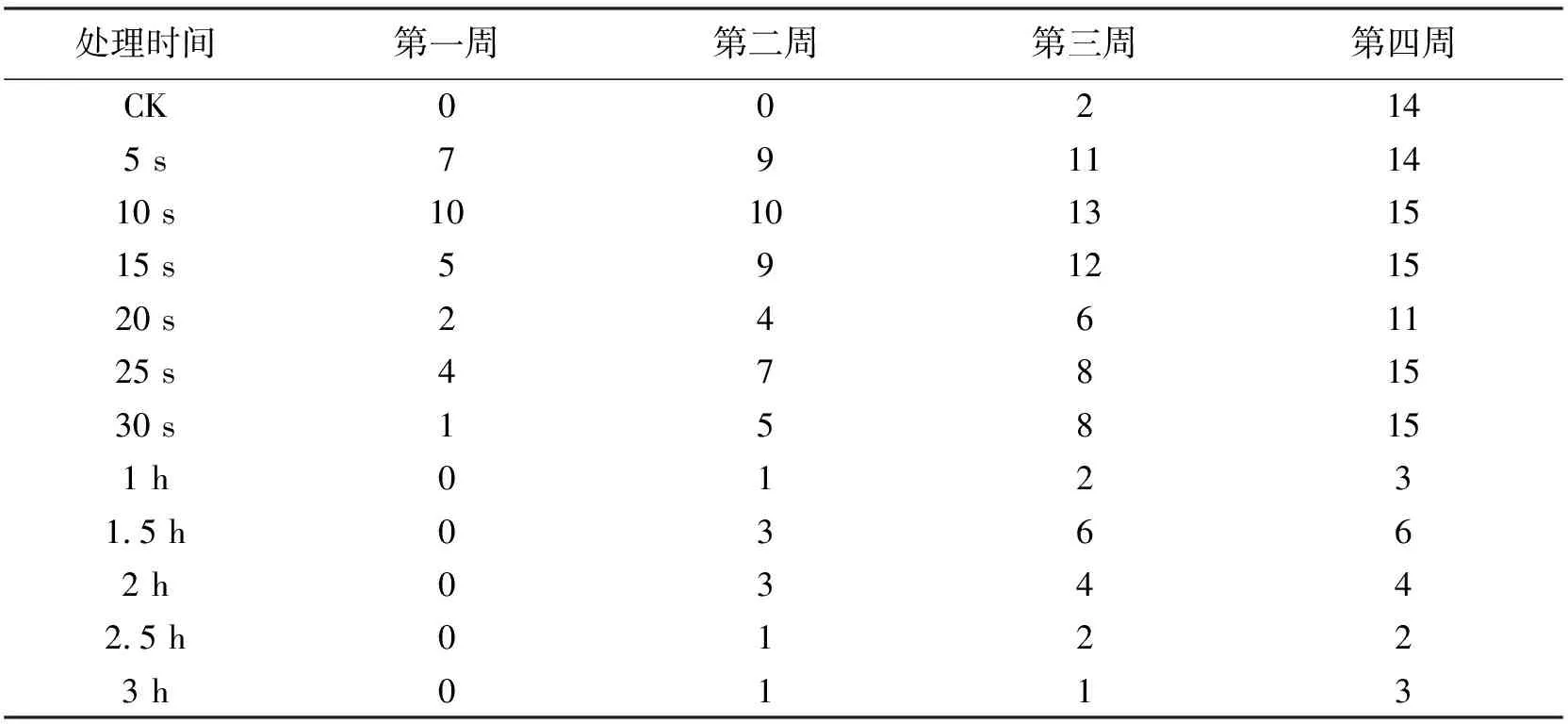
表1 1~4周腋芽萌发的茎段数
2.2 无菌扦插苗生根情况
经过4周的生长,通过外部的可见根和腋芽萌发可初步判断接种茎段的成活情况.在培养时间到后,取出茎段观察生根率、根长、生根数.
观察发现,一部分的茎段虽然腋芽萌发,但并无根产生或仅有极小的根产生(图5),生根的茎段数比仅从外部观察到的多.

图5 腋芽萌发但不生根的茎段
从生根率看,只有速蘸法10 s处理达到100%,20 s处理中15个茎段有14个生根,生根率为93.33%,浸泡法的2 h和3 h处理效果最差,生根率仅53.33%.整体上,CK处理的生根率为80%,浸泡法所有处理均小于CK,速蘸法所有处理除5 s的73.33%、15 s的80%和25 s的66.67%外,其余3个处理生根率均高于CK.从根长看,CK处理的平均总根长和平均根长最长,分别达6.30 cm和2.10 cm,其次是速蘸法10 s处理,平均总根长为5.45 cm,平均根长为1.81 cm,最短的是浸泡法3 h处理,平均总根长、平均根长分别为1.37 cm、0.45 cm.整体上,浸泡法处理的根长显著小于CK和速蘸法处理,CK和速蘸法处理无显著差异.从生根条数看,速蘸法的10 s处理平均总生根数和平均生根数最多,分别达21.80条和7.28条,分别多出CK处理13.80条和4.61条,两者有显著差异,速蘸法其他处理生根条数也均多于CK,5 s、10 s、15 s三者间无显著差异,但10 s显著多于20 s、25 s、30 s,且15 s时的结果波动过于剧烈,5 s时的生根条数较少.浸泡法处理的平均总生根数、平均生根数仅有1.5 h时的13.00 条、4.33 条,2.5 h的8.4 条、2.8 条多于CK,两者无显著差异,其他3个处理均少于CK.整体上,速蘸法的生根条数显著多于浸泡法,速蘸法的生根条数呈现出随时间的增加而先增后减的趋势,10 s处理时的生根条数最多(表2).
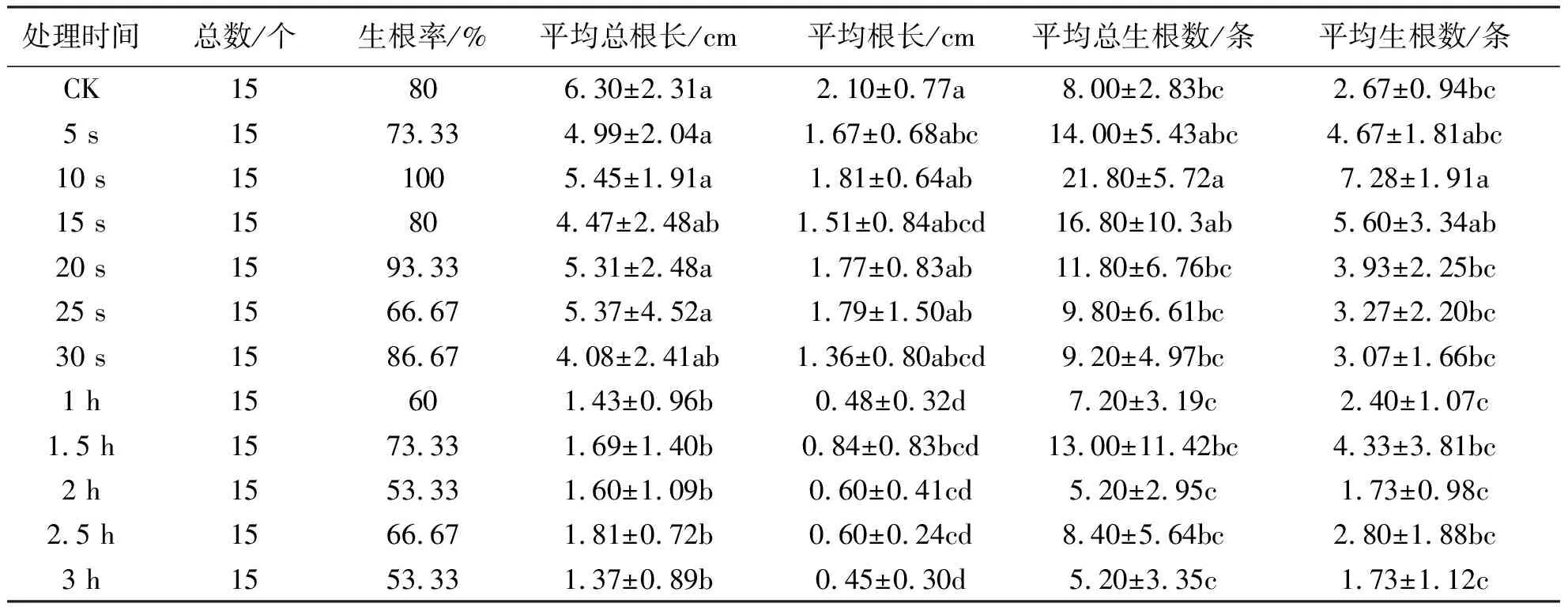
表2 生根情况
综上所述,速蘸法处理的茎段有生根率较高、生根条数多、根长适中的特点,以10 s处理效果最好(图6).CK处理的特点是生根率较高、生根条数少、根长长,且会出现部分苗只有很长的1条或2条根,取苗和移栽过程中易损伤脱落,不利于进一步培养研究.浸泡法处理的茎段各指标均较差,效果不好.结合上一节分析的速蘸法10 s处理15个苗在4周内均有腋芽萌发,因此,速蘸法10 s处理最适合用于“翠香”猕猴桃实生试管苗的无菌扦插处理.

图6 速蘸法10 s处理所得的苗
2.3 无菌扦插苗炼苗情况
炼苗过程中,细沙干燥时可适量加水润湿细沙,亦可采用喷雾使苗保持湿润(图7).

图7 半开盖和全开盖炼苗
半开盖炼苗的平均干枯率8.90%,平均成活率为91.11%,全开盖炼苗的平均干枯率为37.78%,平均成活率为62.22%,两种方法结果存在显著差异,可见半开盖炼苗的效果更好(表3).

表3 炼苗结果
2.4 移栽
移栽后经30 d的观察,成活率96.67%.
3 讨论
对比2.1和2.2部分的数据,两者所得结果有出入.在2.1中,浸泡法在瓶内培养阶段可观测到生根的茎段更多,而在2.2中,速蘸法的真实生根情况更好,这与2.1中腋芽萌发情况所得结论相似.究其原因,在瓶内培养观察过程中,有3种可见的不定根:a. 沿细沙表面生长;b. 在细沙内部生长;c. 在茎段上部生长.总的来说,观察到的以a、c不定根为主,b不定根在第3、4周时部分长根会伸展到瓶壁,可直接观察到.出现以上三种根可能有两方面原因:第一,在蘸生根粉溶液时茎段更高的部位接触生根粉溶液,导致不定根长出细沙表面,尤其是浸泡法,时间过于长,不利于管控.第二,将茎段插入细沙的深度、与细沙的间隙会有误差,较深、间隙小的茎段不定根生长在细沙内部,在最后将其取出移栽时才能看到,只有少部分长势特别好的才能在外部观察到,较浅、间隙大的茎段的根更易透过间隙观察或长出细沙.研究中也证明了腋芽萌发与茎段生根有一定的联系,可作为参考,但并不是腋芽萌发就一定代表根的产生.因为茎段本身具备营养物质,在原培养基中各茎段及腋芽的成熟度不一致,因而有的腋芽会不依赖根直接萌发.
传统的植物组织培养是利用生长素和细胞分裂素的作用来培养外植体[10],无菌扦插法所用到的生根粉也含有上述两类激素,对外植体的生根有促进作用,生根粉也是植物扦插的常用药品[11-13].在本研究中,浸泡法处理的部分苗出现枯黄现象,原因可能是材料取自幼嫩的试管苗,耐受力弱,浸泡久的茎段受激素影响大.而速蘸法时间短,受激素影响小,培养过程中,瓶子密闭可保存水分,自来水中含有大量的离子、细沙自身带有一定营养,可供给茎段生长,茎段自身也具备营养物质,结合生根粉中的激素共同促进不定根产生,取得了较好的生根效果.此外,本研究采用的炼苗移栽方法与传统组培一致,半开盖可减缓水分的流失,减少外界对苗的刺激,效果更好,移栽成活率也与传统组培不相上下[14-16].可见,无菌扦插法用于试管苗的生根培养是切实可行的.值得注意的是,本研究中CK组也有可圈可点的优势,为那些易扦插成活的植株不使用激素直接进行无菌扦插培养提供了可能.
猕猴桃的生根培养多采用MS/2培养基[17].配置培养基时,需要加去离子水,需要制水机制作,培养基加热需要耗电,培养基灭菌需要耗电,且1 L培养基最多分20个左右的培养瓶.培养结束后进行移栽需要先清理苗上的培养基,避免感染,洗净培养基比较困难,有的炼苗后培养基会缺水附着在根上加大清洗难度,因此也较耗水.本研究采用的无菌扦插法省略了制水步骤,加的自来水,省略了培养基加热固化等步骤,且1 L自来水可润湿远大于20瓶的细沙,在移栽时,直接取出苗便可移栽,不用清洗,细沙不会产生感染.试验结束,细沙取出后可直接还田或重复利用,不会污染环境.可见,无菌扦插法更加节省水电,更加环保.
