高温、高湿条件下模拟仓储小麦品质与微生物群落结构的变化
2022-05-25尚玉婷
尚玉婷,杨 薇,张 民
(1 天津农学院食品科学与生物工程学院 天津 300392 2 天津农学院基础科学学院 天津 300392)
小麦是温带国家的主要粮食作物[1],为人体提供必需氨基酸、矿物质、维生素以及有益的植物化学物质和膳食纤维成分等[2]。然而,由于小麦中富含淀粉、蛋白质、脂肪等营养物质,有助于微生物的生长,若存储不当,则会引起小麦发霉变质[3-4],造成严重经济损失,并产生真菌毒素危害人体健康[5-6]。小麦的霉变可能发生在收割、储存、运输、销售多个阶段,由于储存占整个周期比重最大,最易发生霉变。粮库内环境的温度、湿度是决定小麦霉变的关键因素[7-8]。全世界约有5%~7%的粮食每年因被霉菌侵染而不可食用[9]。控制霉菌生长是粮食仓储的主要任务。明晰小麦仓储过程中霉菌的变化规律及霉菌活动对小麦品质的影响,有利于对实际仓储小麦进行有针对性的预防,以减少小麦仓储损失,保护良好品质[10-11]。
为了研究北方粮库中经磷化铝环流熏蒸过的硬质白小麦储藏过程中霉变的影响因素,本试验通过分析天津市7~10月粮仓内储藏环境的变化,选取该段时间内温、湿度较高的储藏条件,对小麦进行模拟储藏。跟踪测定储藏期间小麦的各项理化指标,并用高通量测序技术探究模拟储藏期间小麦的微生物群落结构变化,探明小麦发生的品质变化。
1 材料和方法
1.1 材料
硬质白小麦,2020年产地为河北省,仓房位于天津市静海区(经纬度117.2E,39.13N),仓房类型为高大平房仓,入库前采用磷化铝环流熏蒸,2020年8月入库后测得小麦水分为10.85%,最高仓温36.3 ℃,最低仓温18.8 ℃,仓内湿度61.9%。
1.2 试剂
HiPure Soil DNA Kit 土壤DNA 基因组提取试剂盒,OMEGA 公司;AxyPrep DNA 凝胶回收试剂盒,AXYGEN 公司;PCR 所用试剂,大连宝生物公司。
1.3 仪器与设备
SPX-250B-Z 生化培养箱,上海博迅医疗生物仪器股份有限公司;CM-5 分光测色计,日本柯尼卡美能达有限公司;101-1AB 电热鼓风干燥箱,天津市泰斯特仪器有限公司;NM120-Analyst 核磁共振成像分析仪,上海纽迈电子科技有限公司;HERACLES Ⅱ快速电子气味分析仪,法国ALpha Mos 公司;立式高压蒸汽灭菌锅,上海申安医疗器械厂;SW-CJ-2 超净台,孚夏超净工作台;9700 型PCR 仪,美国ABI GeneAmpR公司;高通量测序仪,Illumina 公司;台式离心机,德国艾本德股份公司;凝胶成像系统,莫纳生物科技有限公司;EPS6000 电泳仪,Tanon。
1.4 方法及测定指标
1.4.1 方法 取样方法依据GB/T 5491-1985《粮食、油料检验扦样、分样法》[12]。取样后将样品放置于样品袋中,4 ℃备用。为避免每次取样存在分层误差以及杂菌污染,本试验将500 mL 三角瓶(空瓶)用棉绳将边长为20 cm 的8 层纱布系于瓶口,准备完毕后高压蒸汽灭菌,待冷却后在超净台中取150 g 小麦置于瓶中,放置于杀菌后的恒温恒湿培养箱中培养,取第0,20,40,60,80,100,120 天的小麦进行试验。
1.4.2 理化指标
1)色差 用色差仪测定样品色值,记录L*、a*、b*值的变化。L*值代表亮度,a*值代表红绿度,b*值代表黄蓝度。
2)水分 按照GB 5009.3-2016 《食品安全国家标准 食品中水分的测定》 第一法 直接干燥法[13]进行测定。
3)蛋白质 按照GB 5009.5-2016 《食品安全国家标准 食品中蛋白质的测定》 第一法 凯氏定氮法[14]进行测定。
4)脂肪 按照GB 5009.6-2016 《食品安全国家标准 食品中脂肪的测定》 第二法 酸水解法[15]进行测定。
5)淀粉 按照GB 5009.9-2016 《食品安全国家标准 食品中淀粉的测定》 第二法 酸水解法[16]进行测定。
6)脂肪酸值:按照GB 5009.168-2016《食品安全国家标准 食品中脂肪酸的测定》 第一法 内标法[17]进行测定。
7)小麦外部霉菌量:参照GB 4789.15-2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》第一法 霉菌和酵母平板计数法[18]测定。
1.4.3 基因组DNA 提取及PCR 过程 按照DNA提取试剂盒说明操作步骤,提取小麦总DNA,每个样本3 个重复,将同一样本的PCR 产物混合后用2%琼脂糖凝胶电泳检测完整性,使用AxyPrepDNA 凝胶回收试剂盒切胶回收PCR 产物,Tris_HCl 洗脱;2%琼脂糖电泳检测,合格样品保存待用。
以环境样本中微生物总DNA 为模板,真菌扩增区域为ITS1 区,引物为ITS1F、ITS2R[19],PCR 扩增条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退 火30 s,72 ℃延伸45 s,扩增32 个循环,72 ℃再延伸5 min,4 ℃保存。PCR 采用25 μL 反应体系:5×FastPfu Buffer (5 μL),2.5 mmol/L dNTPs(2.5 μL),上游引物1.0 μL,下游引物1.0 μL,FastPfu Polymerase(0.5 μL),BSA(0.25 μL),Template DNA(10 ng),ddH2O 补足至25 μL。
1.4.4 高通量测序 将纯化后的PCR 产物送至元莘生物公司,采用Illumina PE250 高通量测序平台进行文库构建和上机测序。Illumina PE250测序得到的PE reads 首先根据overlap 关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行操作分类单元 (Operational taxonomic units,OTU)聚类分析和物种分类学分析,基于OTU聚类分析结果,可以对OTU 进行多种多样性指数分析,以及对测序深度的检测。
1.5 数据处理
理化指标使用SPSS 26.0 软件分析比较,测试试验均重复3 次。使用Origin 2021 软件作图,使用Excel 软件做表。
Illumina PE250 测序得到的PE reads 首先根据overlap 关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行OTU 聚类分析和物种分类学分析,基于OTU 聚类分析结果,可以对OTU 进行多种多样性指数分析,以及对测序深度的检测;基于分类学信息,可以在各个分类水平上进行群落结构的统计分析。在上述分析的基础上,可以进行一系列群落结构和系统发育等深入的统计学和可视化分析。
2 结果与分析
2.1 营养成分分析
2.1.1 小麦籽粒与面粉色泽变化 小麦质量与颜色密不可分,然而感官评价中人眼会受到视觉偏好的影响[20],为了消除此影响,用色差仪记录小麦模拟储藏期间籽粒颜色及面粉颜色的变化,小麦籽粒黄色素是影响小麦面粉色泽的主要因素之一[21]。如图1~3 所示,在小麦模拟储藏过程中,在30 ℃,60%RH 条件下,L*值变化不明显,两种条件下小麦粒和小麦粉a*和b*色差变化不明显且趋势基本一致。在40 ℃,80%RH 条件下,小麦粒和小麦粉的L*值变化明显,呈下降趋势,其原因可能为此条件下微生物活跃,使得小麦表面滋生霉菌进一步导致颜色加深[22],小麦色差L*值变化间接反应出小麦品质变化。

图1 小麦色差L*值变化Fig.1 Wheat color difference L* value change
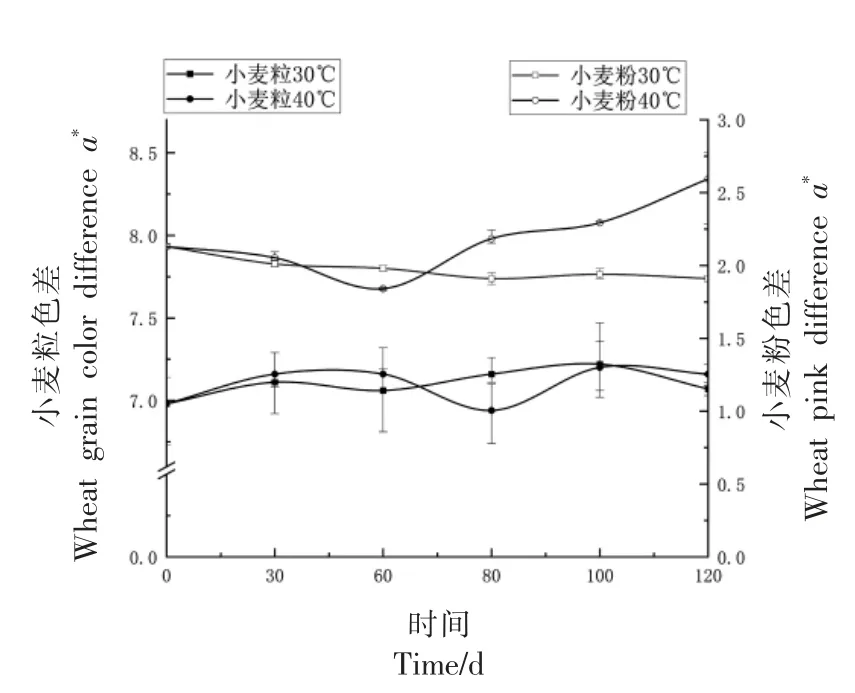
图2 小麦色差a*值变化Fig.2 Wheat color difference a* value change
2.1.2 水分变化
2.1.2.1 国标法检测 小麦的储存受温度和水分制约,温度和水分越高安全性越低,自然条件下小麦的安全储存水分含量应控制在8%~14%之间[23]。如图4所示,在0~120 d 储藏过程中,小麦籽粒中的水分含量逐渐升高。在30 ℃,60%RH 环境下储藏的小麦水分仍可以保持在安全水分以下,且未发现肉眼可见菌丝体。在40 ℃,80%RH 条件下,储藏的小麦在80 d 时水分含量为14.96%,超过安全水分,此时可在小麦表面发现明显的菌丝体。
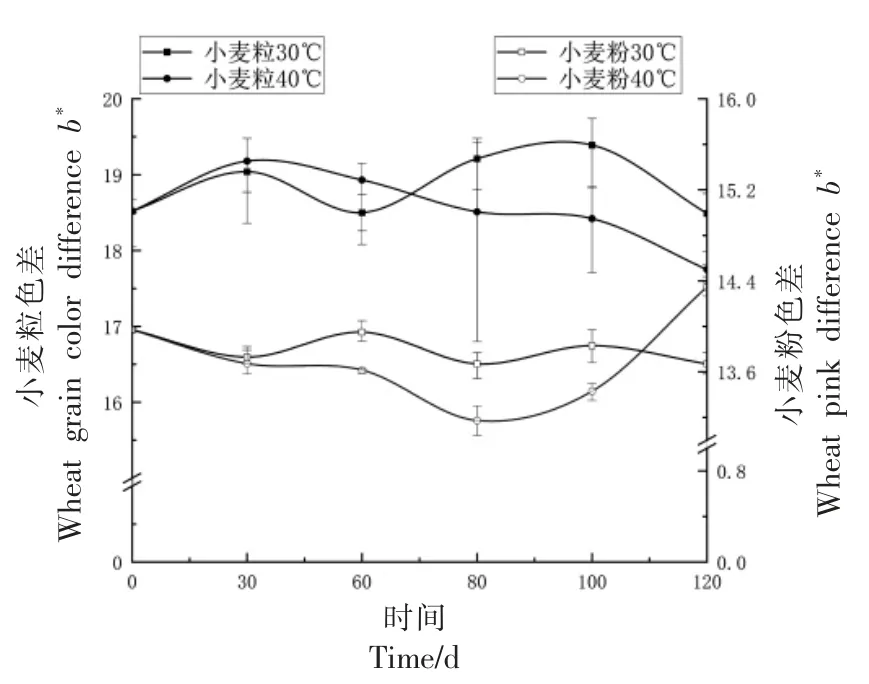
图3 小麦色差b*值变化Fig.3 Wheat color difference b* value change
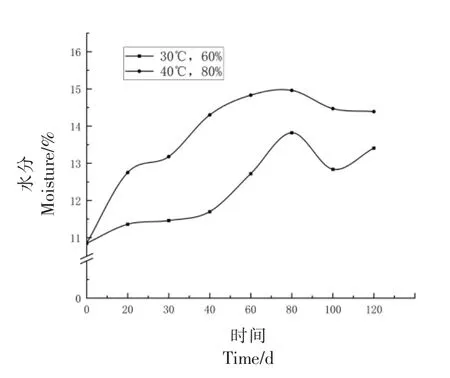
图4 小麦水分变化Fig.4 Wheat moisture changes
2.1.2.2 MRI 检测水分迁移变化 利用核磁共振成像分析仪的弛豫谱图分析小麦籽粒水分内部变化。通过分析得出,小麦在模拟储藏过程中存在3种状态的水,如图5从左至右分别为:T21(0.1~10 ms) 强结合水、T22(10~100 ms) 弱结合水、T23(10~1 000 ms)自由水。模拟仓储中,小麦中水分主要以强结合水(T21)的形式存在,流动性差,与非水组分如淀粉、蛋白质或其它大分子物质通过水-离子、水-偶极缔合作用紧密结合[24]。由图5可知,从第0 天开始,随着储藏时间延长,T21、T22弛豫时间变长,曲线开始向右移,在两种温度条件下,变化趋势基本一致,40 ℃、80%RH 条件下较30 ℃、60%RH 条件下峰顶点时间迁移更快。在40 ℃环境下,由图6b 可知,强结合水与弱结合水所占比例增加,表明水分和底物结合由紧密变稀疏[25]。
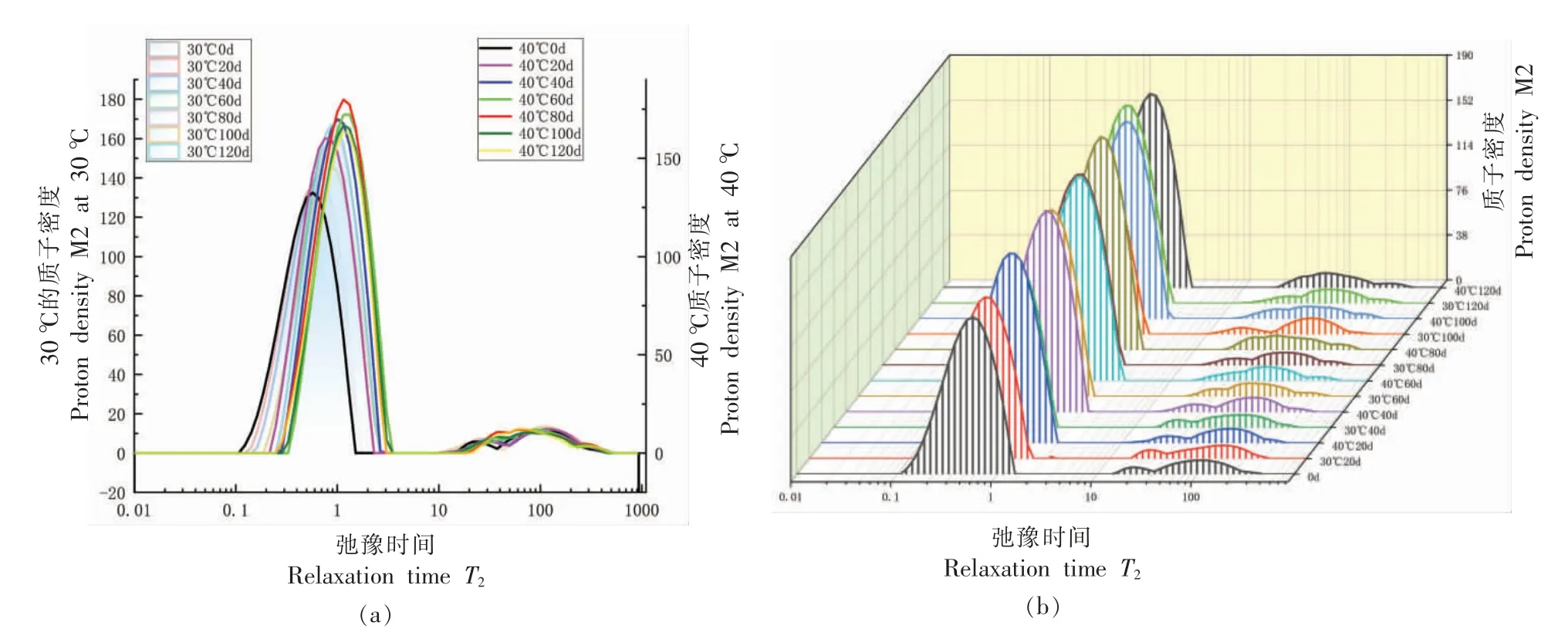
图5 小麦横向弛豫时间T2 平面图(a)T2 直观图(b)Fig.5 Wheat transverse relaxation time T2 plane diagram (a) T2 intuitive diagram (b)
由图6可知,强结合水的峰面积(A21)在两种条件下有缓慢增加的趋势。在30 ℃、60%RH 环境下弱结合水峰面积(A22)无变化,自由水峰面积由8%减少至6%;在40 ℃、80%RH 环境下弱结合水峰面积(A22)由占比2%增加至8%,自由水峰面积有减小趋势,由占比8%减小至1%,变化明显,说明可能此条件下流动性较大的自由水为环境中微生物提供了水分,结合出现可见菌丝体结果说明此条件不易于小麦储存。
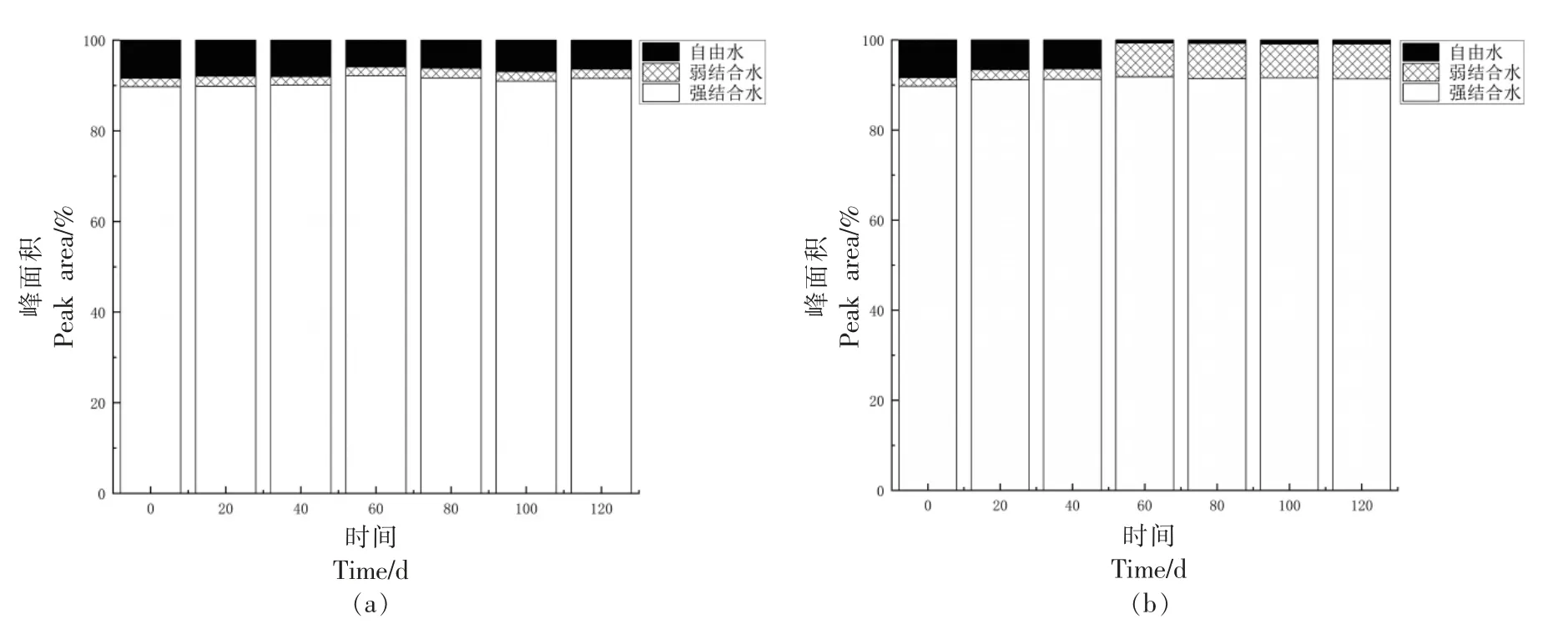
图6 3 种状态水的比例:30 ℃、60%RH 环境(a)和40 ℃、80%RH 环境(b)Fig.6 The proportion of water in the three states:30 ℃,60%RH (a) and 40 ℃,80%RH (b)
2.1.3 蛋白质变化 如图7所示,结果表明随着模拟仓储时间的延长,在0~30 d 时蛋白质含量在12.5%左右波动,而后呈上升趋势,在40 d 时达到15.2%,而后趋于平稳。这可能是由于新收获的小麦籽粒中含有大量低分子质量蛋白质,在高温、高湿条件下储藏,会促使其快速进入萌动期,导致小麦籽粒中醇溶性蛋白的肽链之间发生氧化反应形成二硫键,再次聚合成大分子谷蛋白,从而导致蛋白质含量增加[26]。
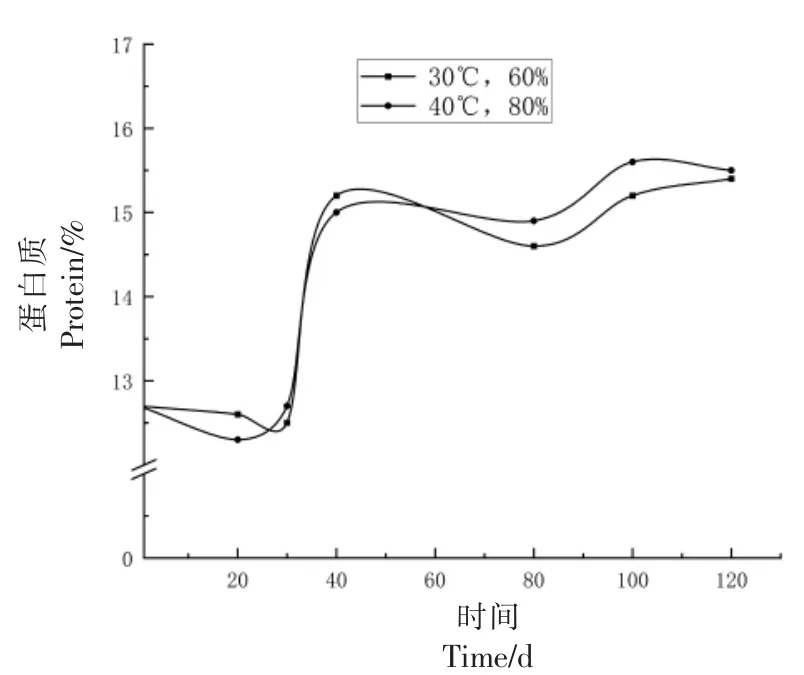
图7 小麦蛋白质变化Fig.7 Wheat protein changes
2.1.4 淀粉变化 淀粉是小麦中含量最高,也是最重要的碳水化合物,约占小麦质量的57%~67%。如图8所示,小麦在储藏过程中淀粉含量在67.1%~68.8%范围内波动,没有明显变化。
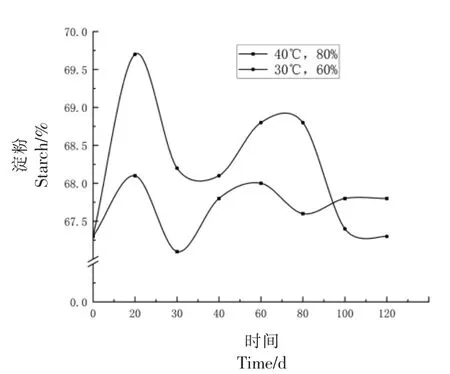
图8 小麦淀粉变化Fig.8 Wheat starch changes
2.1.5 脂肪变化 脂类是小麦重要营养物质之一,含量虽少,却是储藏过程中关键指标,脂肪氧化分解[27]会导致小麦产品品质劣变。如图9所示,刚收获的小麦籽粒中脂肪含量为1.8%,随着储藏时间延长,当储藏时间为40 d 时,呈明显下降趋势。且随着储藏时间延长,在40 ℃、80%RH 条件下,脂肪含量下降较快,80 d 时达到1.3%,下降了约28%。
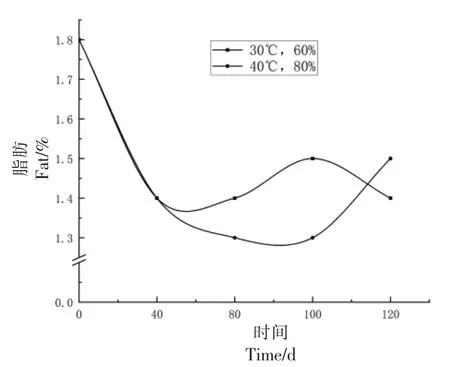
图9 小麦脂肪变化Fig.9 Wheat fat changes
2.1.6 脂肪酸的变化 小麦籽粒中含有一定量的脂肪酸[28],其中亚油酸为不饱和脂肪酸,其含量占总脂肪酸的60%[29-30],是小麦中重要的营养成分。如图10所示,刚收获的小麦总脂肪酸含量为1.95 mg/100 g,在储藏0~120 d 内总脂肪酸总体呈下降趋势。在40 ℃、80%RH 条件下,储藏120 d 时总脂肪酸为1.39 mg/100 g,与刚入库时相比降低了约29%。
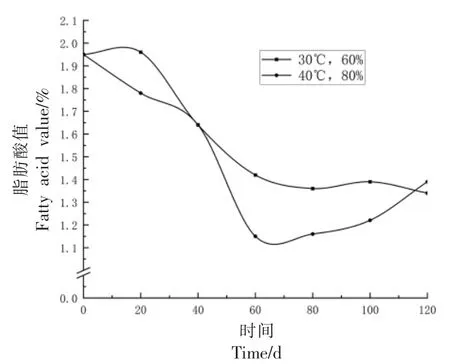
图10 小麦总脂肪酸变化Fig.10 Changes in total fatty acids in wheat
如图11所示,在所有样品中共检测到6 种主要脂肪酸,小麦脂肪酸中亚油酸含量最多且变化趋势与总脂肪酸趋势基本一致,在两种储藏条件下,小麦中亚油酸含量均呈下降趋势,由刚入库的1.16 mg/100 g 到储藏120 d 时30 ℃环境下0.804 mg/100 g,下降了约30%。在40 ℃、80%RH 条件下,小麦籽粒中的亚油酸含量下降更快,在第60天时下降至0.694 g/100 g,而在30 ℃、60%RH 条件下,亚油酸含量下降较为平缓,80 d 时降至0.81 mg/100 g。由此可见,高温、高湿环境下储藏小麦,可以加速其籽粒中亚油酸的氧化,降低小麦的营养价值。

图11 小麦各脂肪酸变化Fig.11 Changes of fatty acids in wheat
2.2 微生物群落结构与多样性分析
2.2.1 储藏过程中小麦α 多样性分析 表1为小麦模拟储藏过程中,各阶段样品的多样性指数。在30 ℃、60%RH 条件下,随着储藏时间的延长,Shannon 指数、Ace 指数、OTU 数目均逐渐增大,表明小麦中真菌多样性与丰富度逐渐增大。在40℃、80%RH 条件下,Shannon 指数、Ace 指数、OTU数目先增大后减小,表明小麦菌丝体增长速度较快,各种微生物迅速生长,储藏60 d 时,Shannon指数为0.02,小麦中真菌多样性大大降低,某种有害菌占比极高,菌丝体已显现。在40 ℃、80%RH条件下的小麦微生物群落变化程度远高于30 ℃、60%RH 条件下的小麦,结果表明,高温、高湿的储藏条件更易产生菌丝体。
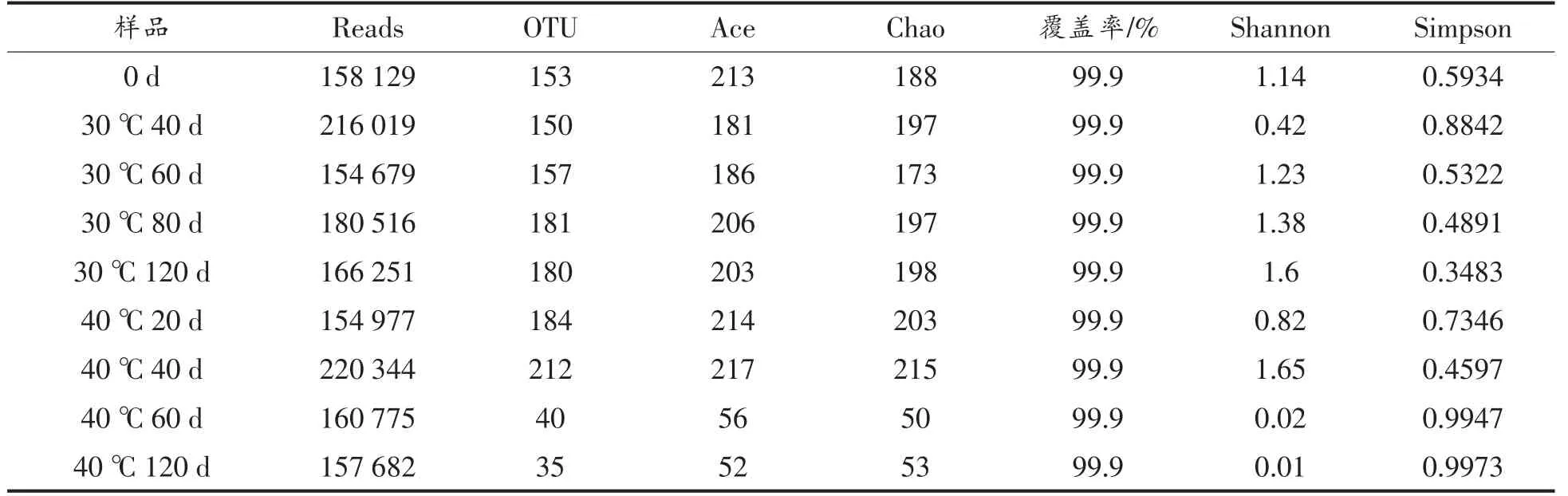
表1 真菌群落多样性指数统计Table 1 Statistics of fungal community diversity index
2.2.2 样品所含OTU 数目分析 图12为在30℃、60RH%及40 ℃、80RH%储藏条件下,不同储藏时间的真菌OTU 数目维恩图,在30 ℃、60RH%条件下,不同储藏时间共有OTU 87 个,原粮含有特有OTU 5 个,40 d 样品含有特有OTU 6 个、60 d样品含有特有OTU 11 个,80 d 样品含有特有OTU 15 个,120 d 样品含有特有OTU 19 个。随储藏时间延长,样品中特有OTU 数目逐渐增加,表示不断有新的微生物出现。在40 ℃、80RH%条件下,不同储藏时间共有OTU 23 个,原粮含有特有OTU 6 个,20 d 样品含有特有OTU 21 个,40 d 样品含有特有OTU 39 个,60 d 样品含有特有OUT 0 个,120 d 样品含有特有OTU 1 个。随储藏时间延长,样品中特有OTU 数目先迅速增加,后减少为0,表示群落变化十分迅速,60 d 后小麦中优势霉菌占比很大。

图12 小麦真菌群落维恩图:30 ℃、60RH%环境(a)和40 ℃、80RH%环境(b)Fig.12 Venn diagram of wheat fungus community:30 ℃,60RH% environment (a) and 40 ℃,80RH% environment (b)
2.2.3 贮藏期小麦真菌群落结构变化 为达到最佳视图效果,在众多检出微生物中,将丰度低于1%的部分合并在其它(Other)中表示(图13)。
图13为不同储藏时间小麦样品中真菌群落结构,链格孢属(Alternaria)为储藏过程中的优势菌属,随着储藏时间延长,其相对丰度呈逐渐下降的趋势。在30 ℃、60%RH 的样品中,储藏120 d时,曲霉属(Aspergillus)被检出,且相对丰度较高,表明在80~120 d 储藏阶段,小麦中有害菌属丰度升高。此时未发现肉眼可见菌丝体(图14a)。在40℃、80%RH 的样品中,储藏40 d 时,链格孢属(Alternaria)相对丰度最高,且优势明显;储藏60 d后,曲霉属(Aspergillus)的相对丰度达100%,表明在40~60 d 储藏阶段,小麦微生物群落变化迅速;储藏60 d 后,小麦中微生物均为曲霉属(Aspergillus),小麦上可明显观察到菌丝体(图14b)。

图13 小麦属水平群落组成:30 ℃、60RH%环境(a)和40 ℃、80RH%环境(b)Fig.13 Triticum horizontal community composition:30 ℃,60RH% environment (a) and 40 ℃,80RH% environment (b)

图14 小麦储藏120 d 后实况:30 ℃、60RH%环境(a)和40 ℃、80RH%环境(b)Fig.14 The actual condition of wheat after storage for 120 days:30 ℃,60RH% environment (a) and 40 ℃,80RH% environment (b)
2.2.4 储藏过程中小麦β 多样性分析 根据样品在PCA 图中的距离可判断样品间的相似度,如图15a 所示,图中A 组为原粮组,B 组为30 ℃存放的样品,C 组为40 ℃存放的样品。已产生菌丝体的样品(40 ℃,60 d;40 ℃,120 d)和有变霉趋势的样品(30 ℃,120 d)距离其它样品距离较远,得到明显区分。层级聚类图中树枝间的距离表示不同样本的距离,结果显示:所有样品可分为3 类,产生菌丝体的小麦(40 ℃,60 d;40 ℃,120 d)为一类,有变霉趋势的小麦(30 ℃,120 d)为一类,情况良好的样品(0 d;30 ℃,40 d;30 ℃,60 d;30 ℃,80 d;40 ℃,20 d;40 ℃,40 d)为一类。

图15 不同储藏时间小麦PCA 分析(a)与层级聚类分析(b)Fig.15 PCA analysis of wheat in different storage periods (a) and hierarchical cluster analysis (b)
2.2.5 小麦外部霉菌数量变化 对小麦表面霉菌数量进行监测,可以间接反应小麦在储藏过程中的品质变化。结果如表2所示,在30 ℃、60%RH条件下储藏120 d,小麦表面的霉菌数量整体波动不大,在40 ℃、80%RH 条件下储藏40 d 后,霉菌数量呈指数增加。由此可见,温度、湿度越高,小麦表面霉菌数量变化的速度越快。

表2 小麦霉菌计数结果Table 2 Wheat mold count results
3 结论
本文通过实验室模拟小麦在30 ℃、60%RH和40 ℃、80%RH 高温高湿条件下的仓储过程,监测小麦中水分、蛋白质、淀粉、脂肪等品质指标。结果表明,在30 ℃、60%RH 条件下,储藏120 d 内,小麦品质呈缓慢下降趋势。在40 ℃、80%RH 条件下储存的小麦,品质劣变比较明显,储藏60 d 后小麦表面出现明显的菌丝体。通过高通量测序技术发现,储藏前期小麦中优势菌属为链格孢属(Alternaria),当水分超过安全范围后,其相对丰度迅速下降,曲霉属(Aspergillus)逐渐成为优势菌属,相对丰度迅速上升。在40 ℃、80%RH 条件下,储藏60 d 的样品中检出微生物均为曲霉属(Aspergillus),小麦表面出现明显可见菌丝体。结果表明随着温度与相对湿度的上升,小麦曲霉属菌株迅速上升。
